高三化学专题复习《氧化还原反应》教案
- 格式:doc
- 大小:309.50 KB
- 文档页数:27

氧化复原反响高三化学第一轮复习教案考点突破1、氧化复原反响概念的理解和判断2、氧化性、复原性的强弱判断3、氧化复原反响的规律4、有关氧化复原反响的计算夯基固本一、氧化复原反响概念:有电子转移〔得失或偏移〕的反响特征:化合价的变化氧化复原反响中的各种关系:失电子,化合价升高,被氧化〔氧化反响〕氧化剂+复原剂复原产物+氧化产物得电子,化合价降低,被复原〔复原反响〕二、氧化剂和复原剂:1、常见氧化剂是指易得到电子的物质。
主要有:①、活泼的非金属单质〔如 O2、Cl2等〕②、含处于最高价态或较高价态元素的化合物〔如 HNO3、MnO2、HClO3等〕③、高价态的金属阳离子〔如Fe3+、Cu2+等〕2、常见复原剂是指易得到电子的物质。
主要有:①、金属单质〔如 Na、K 等〕②、某些非金属单质〔 C、H2等〕③、含处于较低价或最低价的化合物〔FeCl2、CO 等〕④、非金属阴离子〔 S2-、I-等〕三、电子转移的表示方法双线桥:步骤:标变价联双桥写升降注得失含义 : 双线桥表示元素化合价的变化过程,但不表示电子转移的方向。
考前须知 : 1、线桥应跨越等号2、线桥箭头和箭尾要对准同种元素3、电子用“e-〞表示 ,且得失电子的总数相等 .单线桥:直接标出电子转移的方向和数目注意: 1、单线桥不跨越等号;2、线桥箭头和箭尾分别表示得电子和失电子的元素。
典例分析得 e-,化合价降低Cl2 + H2O = HCl + HClO Cl 2 + H2O = HCl + HClO 失 e-,化合价升高得 2×5e-,化合价降低2KMnO 4 + 16HCl == 2KCl + 2MnCl 2 + 5Cl2↑ + 8H2O失 2×5e-,化合价升高2KMnO 4 + 16HCl == 2KCl + 2MnCl 2 + 5Cl2↑ + 8H2O反响练习1、氧化复原反响的实质是〔〕,判断是否是氧化复原反响的方法是〔〕A、元素的原子是否有电子转移B、同一元素的化合反响前后是否有变化C、是否有氧元素参加D、是否是化合反响或分解反响2、以下说法正确的选项是否正确①、阳离子只具有氧化性,阴离子只具有复原性。

高中化学氧化还原反应教案教学内容:氧化还原反应的基本概念和应用教学目标:1. 理解氧化还原反应的基本概念和特征;2. 掌握氧化还原反应的基本原理和化学方程式的写法;3. 熟悉氧化还原反应在日常生活和工业生产中的应用。
教学重点和难点:重点:氧化还原反应的基本概念和特征;难点:氧化还原反应的化学方程式的写法。
教学准备:1. 教师准备:教案、教学课件、实验器材、教学实验、教学资源等;2. 学生准备:预习相关知识,带有习题和问题。
教学步骤:一、导入(5分钟)教师引入氧化还原反应的概念,通过实例和图表培养学生对氧化还原反应的兴趣和好奇心。
二、理论讲解(15分钟)1. 讲解氧化还原反应的定义和特点;2. 分析氧化还原反应的过程和特征;3. 解释氧化和还原反应的化学方程式写法。
三、示范实验(20分钟)1. 教师进行氧化还原反应的实验演示;2. 学生观察实验现象,记录数据和观察结果;3. 学生独立设计并完成一个氧化还原反应的实验。
四、练习和讨论(15分钟)1. 学生根据示范实验和讲解内容,完成相关习题;2. 学生之间相互讨论和交流,澄清疑问。
五、总结(5分钟)教师总结本节课的重点内容,强调氧化还原反应的重要性和应用。
六、作业布置(5分钟)布置相关作业,巩固学习内容。
教学反思:本节课的教学内容涵盖了氧化还原反应的基本概念和应用,通过理论讲解和实验示范,帮助学生掌握了氧化还原反应的基本原理和化学方程式写法。
在今后的教学中,需要更加注重学生的实践能力和创新思维,在实验中提升学生的动手能力和实验设计能力。

高中化学中的氧化还原教案
目标:
1. 理解氧化还原反应的基本概念;
2. 能够根据物质的氧化态变化判断其是否参与氧化还原反应;
3. 能够编写和平衡氧化还原反应方程式。
教学过程:
一、导入
1. 引入氧化还原反应的概念,解释其在化学中的重要性;
2. 通过简单的例子介绍氧化还原反应中的氧化和还原过程。
二、讲解
1. 讲解氧化和还原的定义和特征;
2. 介绍氧化态的概念和计算方法;
3. 解释氧化还原反应的基本过程;
4. 举例说明氧化还原反应在日常生活和工业生产中的应用。
三、实验
1. 进行一些简单的氧化还原反应实验,观察氧化还原反应的现象;
2. 让学生根据实验结果判断反应中的氧化和还原物质;
3. 引导学生编写和平衡氧化还原反应方程式。
四、练习
1. 分发练习题,让学生在课堂上进行练习;
2. 查漏补缺,帮助学生解决遇到的问题。
五、总结
1. 回顾本堂课的重点内容,强调氧化还原反应的重要性;
2. 引导学生思考氧化还原反应在生活中的应用;
3. 鼓励学生继续学习,深入了解氧化还原反应的更多知识。
六、作业
1. 布置作业,要求学生总结本课内容,写一份氧化还原反应的实验报告;
2. 提醒学生加强对氧化还原反应的理解和掌握。

氧化—还原反应专题教案
【教学目标】
知识与技能
1.理解氧化和还原、氧化性和还原性、氧化剂和还原剂、氧化产物和还原产物等概念。
能判断氧化还原反应中物质的氧化性、还原性的强弱和电子转移方向和数目。
能应用氧化还原反应中电子得失规律解决一些化学问题。
2.能配平常见的氧化还原反应方程式(包括常规配平、缺项配平、离子方程式配平、简
单的有机反应配平等)。
3.掌握化合、分解、置换、复分解等四种基本化学反应类型,并能进行判断分析。
氧化还原反应是高考每年必考的内容,从考查试题类型来说可以是氧化还原概念的应用、
氧化还原方程式的配平和书写或有关氧化还原的化学计算等等。
近几年有深化加难的趋势。
过程与方法:
通过氧化还原方程式配平的学习,提高知识的综合迁移能力;
情感态度与价值观:
(1)通过一般氧化还原反应方程式、特殊的氧化还原反应方程式的配平,理解事物的一
般性和特殊性,加深具体情况具体分析的思想观念。
(2)通过一些配平技巧、配平的规律的学习,培养学生创造和发现化学学科的科学美、
规律美,从中提高学习化学的兴趣。
【重点和难点】
重点:使学生掌握用化合价升降法配平氧化还原反应方程式的原则和步骤。
难点:氧化还原反应方程式配平的技巧,熟练掌握氧化还原反应方程式配平。
教学中主要通过学生的练习来发现问题、让学生自己总结发现配平的规律,提高氧化还
原反应方程式配平的能力。
教学方法和过程
一、氧化—还原反应概念。
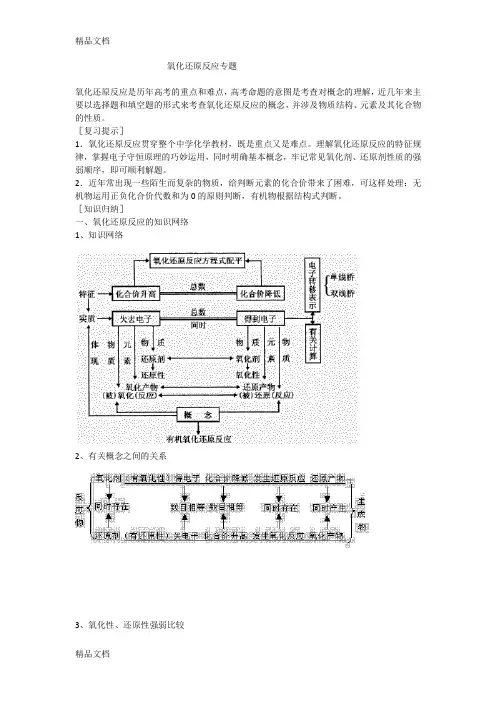
氧化还原反应专题氧化还原反应是历年高考的重点和难点,高考命题的意图是考查对概念的理解,近几年来主要以选择题和填空题的形式来考查氧化还原反应的概念,并涉及物质结构、元素及其化合物的性质。
[复习提示]1.氧化还原反应贯穿整个中学化学教材,既是重点又是难点。
理解氧化还原反应的特征规律,掌握电子守恒原理的巧妙运用,同时明确基本概念,牢记常见氧化剂、还原剂性质的强弱顺序,即可顺利解题。
2.近年常出现一些陌生而复杂的物质,给判断元素的化合价带来了困难,可这样处理:无机物运用正负化合价代数和为0的原则判断,有机物根据结构式判断。
[知识归纳]一、氧化还原反应的知识网络1、知识网络2、有关概念之间的关系3、氧化性、还原性强弱比较4、常见的氧化剂和还原剂强氧化剂:KMnO4,K2Cr2O7,浓H2SO4,HNO3,Ca(ClO)2,H2O2,Na2O2,Cl2,Br2,O2等。
强还原剂:活泼金属如Na,Mg,Al等,H2S,S2—,SO2,SO32—,H2SO3,I—,HI,Fe2+等。
二、氧化还原反应方程式的配平及计算1.氧化还原方程式的配平原则(1)电子得失守恒:反应中还原剂失去电子总数(化合价升高总值)与氧化剂得到的电子总数(化合价降低总值)相等。
(2)质量守恒:反应前后元素的种类相同,各元素的原子个数相等。
2.氧化还原方程式的配平步骤一标:标明反应前后化合价有变化的元素前后化合价。
二等:通过求最小公倍数使化合阶升与降总值相等。
三定:确定氧化剂与还原剂的化学计量数。
方法是:氧化剂(还原剂)化学计量数=四平:用观察法配平其他物质的化学计量数。
五查:检查质量与电荷是否分别守恒。
3.氧化还原反应的有关计算其原理是:氧化剂得到的电子总数等于还原剂失去的电子总数。
[例题分析]一、判断概念[例1] 已知化学方程式CaCO3十2HCN=CaCN2十CO↑十H2↑十CO2↑,在反应中()A.氢元素被氧化,碳元素被还原B.HCN既是氧化剂又是还原剂C.CaCN2是氧化产物.H2为还原产物D.CO为氧化产物,H为还原产物解析:本题考查氧化还原反应的有关概念。

氧化还原反应教案设计【教案设计】氧化还原反应一、教学目标本节课的教学目标是使学生了解氧化还原反应的基本概念,掌握氧化还原反应的反应类型和应用,培养学生的实验操作和观察能力,提高学生的科学实践能力。
二、教学内容1. 氧化还原反应的概念和基本特征2. 氧化还原反应的反应类型3. 氧化还原反应的应用4. 实验操作:观察氧化还原反应示例实验三、教学重点和难点1. 氧化还原反应的基本概念和特征2. 氧化还原反应的反应类型和应用四、教学过程引入:教师可以提出一个问题,如:“你们是否知道氧化还原反应是什么?”引导学生思考,然后给出概念:“氧化还原反应是指物质在化学反应过程中,原子或离子之间电子的转移导致物质氧化或还原的过程。
”引入本节课的教学内容。
详细讲解:1. 氧化还原反应的概念和基本特征a. 阐述氧化和还原的基本概念,并通过实际例子解释清楚。
b. 讲解氧化还原反应中电子转移的基本原理和特征。
c. 解释氧化还原反应中化学物质的氧化数变化。
2. 氧化还原反应的反应类型a. 教师介绍常见的氧化还原反应类型,如金属与非金属氧化反应、元素与化合物的反应、酸与碱的反应等。
b. 指导学生分析不同类型的氧化还原反应,了解其特点和需要注意的事项。
3. 氧化还原反应的应用a. 引导学生思考氧化还原反应在生活和工业中的应用,如腐蚀、电池、电解等。
b. 通过案例分析,让学生了解氧化还原反应的实际应用,并引导学生思考其在解决环境问题和能源问题中的潜力。
实验操作:介绍一个有关氧化还原反应的实验案例,并给学生展示实验操作过程。
鼓励学生积极参与实验操作,并观察反应现象、记录数据。
教师可以设计一些问题,引导学生分析实验结果和总结氧化还原反应的特点。
五、教学总结通过本节课的学习,学生对氧化还原反应的概念、特征、反应类型和应用有了初步的了解。
总结本节课的重要内容和关键点,并和学生一起回顾课堂的学习过程。
六、作业布置要求学生根据所学知识,选择一个氧化还原反应的应用案例,并撰写一篇作文,介绍该应用的原理、过程和意义。

《氧化还原反应》教案教学目标:通过本节课的学习,学生将能够:1. 理解氧化还原反应的概念和基本原理;2. 掌握氧化还原反应的常见实例和实验方法;3. 学会运用氧化还原反应的理论知识解决实际问题;4. 培养创新思维和实验能力。
教学重难点:1. 掌握氧化还原反应中的基本概念和原理;2. 理解氧化剂和还原剂的概念和特点;3. 掌握氧化还原反应的实验方法和实际应用。
教学方法:1. 理论讲解结合实例分析法;2. 实验演示及小组讨论法;3. 问答互动法。
教学过程:一、引入老师可以通过实验演示或生活中的实际例子引出氧化还原反应,在引入中提出本节课的学习目标,让学生明确学习重点和难点。
二、概念和原理讲解教师通过板书或PPT向学生阐述氧化还原反应的基本概念和原理,并注重基本概念的深入理解和记忆,如氧化剂和还原剂的定义及反应方式的表示等。
三、实验演示及小组讨论老师进行氧化还原反应的实验演示,让学生在实验中对反应过程进行观察和分析,并在小组内讨论反应机理和反应方式的特点。
四、问题解答及问答互动教师根据学生在学习过程中出现的疑难问题进行解答,并进行问答互动,刺激学生的思维和创新能力。
五、课堂练习老师可设计适合课堂练习的题目,帮助学生强化对氧化还原反应的理解和记忆,同时培养学生的解决问题的能力。
六、总结通过课后总结和复习,让学生归纳本节课所学的知识和技能,加深对氧化还原反应的理解和记忆。
教学反思:本节课教师主要采用了理论讲解结合实验演示、小组讨论及问答互动等多种教学方法,让学生通过实践感受和理论学习相结合的方式掌握氧化还原反应的概念、原理和实际应用。
同时,注重在教学过程中引导学生思考和提问,培养其创新思维和实验能力,提高学生的综合素质水平。

高中化学氧化还原备课教案教学内容:氧化还原反应教学目标:1. 了解氧化还原反应的含义及基本特征;2. 掌握氧化和还原的定义;3. 能够正确写出氧化还原反应的化学方程式;4. 能够运用氧化还原反应解决实际问题。
教学重点:1. 氧化还原反应的概念和基本特征;2. 氧化和还原的定义;3. 氧化还原反应的化学方程式及其平衡;4. 氧化还原反应的应用。
教学难点:1. 氧化还原反应的化学方程式的平衡;2. 氧化还原反应的应用解题。
教学准备:1. 实验器材:试管、试管夹、试剂瓶等;2. 教学资料:化学教材、化学实验手册等;3. 多媒体设备:投影仪、计算机等。
教学过程:一、导入(5分钟)1. 引导学生回顾化学反应的基本概念,引出氧化还原反应的概念;2. 提出问题:什么是氧化还原反应?氧化和还原在反应中如何体现?二、讲解(15分钟)1. 介绍氧化还原反应的定义:氧化是指物质失去电子,还原是指物质获得电子;2. 表示氧化还原反应的化学方程式:氧化剂+还原剂→氧化产物+还原产物;3. 指导学生如何判断氧化还原反应发生;三、实验操作(20分钟)1. 进行实验观察氧化还原反应,学生观察实验现象并记录;2. 学生根据实验结果写出化学方程式,进行讨论和解析;3. 教师指导学生掌握氧化还原反应的化学方程式写法。
四、巩固(10分钟)1. 带领学生回顾学过的知识点,强化理解;2. 学生进行练习,加深对氧化还原反应的理解。
五、作业布置(5分钟)1. 布置作业:完成相关习题,复习氧化还原反应的基本概念;2. 提醒学生预习下节课内容。
教学反思:通过本堂课的教学,学生对氧化还原反应的概念和特点有了初步了解,能够正确写出氧化还原反应的化学方程式,并能够运用所学知识解决实际问题。
下节课将继续深入讲解氧化还原反应的平衡及应用。

高中化学氧化还原章节教案
教学目标:了解氧化还原反应的概念,掌握氧化还原反应的基本规律,培养学生分析氧化
还原反应的能力。
教学重点和难点:掌握氧化还原反应的基本规律;能够分析氧化还原反应过程。
教学内容:
1. 氧化还原反应的概念和基本特征
2. 氧化还原反应中的氧化剂和还原剂
3. 氧化还原反应的电子转移理论
教学方法:讲授与实验相结合,引导学生发现问题,让学生进行探究式学习。
教学过程:
1. 导入:通过引入一个实际的氧化还原反应例子,引起学生对氧化还原反应的兴趣。
2. 学习氧化还原反应的概念和基本特征,让学生了解氧化还原反应是电子转移反应的一种,具有电子的失去和获得。
3. 学习氧化还原反应中的氧化剂和还原剂,并通过实验验证氧化剂和还原剂的交替作用。
4. 学习氧化还原反应的电子转移理论,帮助学生理解氧化还原反应的本质。
5. 实验操作:让学生进行一些简单的氧化还原反应实验,体验氧化还原反应的过程和特点。
6. 总结与拓展:总结本节课的重点内容,拓展相关知识,引导学生进一步学习。
教学评价:通过课堂讨论和实验操作,检查学生对氧化还原反应的理解程度,鼓励学生发
表自己的看法和观点。
作业布置:布置相关练习题,巩固学生对氧化还原反应的理解和掌握程度。
教学反思:根据学生的反馈和表现,及时调整教学方法和内容,提高教学效果。

高中化学《氧化还原反应》专题教案一、教学目标1、知识与技能目标(1)学生能够理解氧化还原反应的概念,能从化合价升降和电子转移的角度判断氧化还原反应。
(2)学生能够理解氧化剂和还原剂的概念,了解常见的氧化剂和还原剂。
(3)学生能够掌握氧化还原反应中电子转移的表示方法——双线桥法和单线桥法。
2、过程与方法目标(1)通过对氧化还原反应的分析,培养学生的逻辑思维能力和归纳总结能力。
(2)通过电子转移的表示方法的学习,培养学生的规范表达能力和微观分析能力。
3、情感态度与价值观目标(1)学生通过对氧化还原反应的学习,感受化学知识在生活和生产中的广泛应用,激发学习化学的兴趣。
(2)学生通过对氧化还原反应本质的探究,培养严谨的科学态度和勇于探索的精神。
二、教学重难点1、教学重点(1)氧化还原反应的概念及判断。
(2)氧化剂和还原剂的判断。
(3)氧化还原反应中电子转移的表示方法。
2、教学难点(1)从电子转移的角度理解氧化还原反应的本质。
(2)双线桥法和单线桥法的正确使用。
三、教学方法讲授法、讨论法、练习法四、教学过程1、导入新课(1)展示一些常见的化学反应,如铁与硫酸铜溶液的反应、氢气在氧气中燃烧等。
(2)提问学生这些反应有什么共同特点,引导学生思考化学反应的分类方法。
2、讲授新课(1)氧化还原反应的概念引导学生分析初中学习过的氧化反应和还原反应的概念。
以氢气还原氧化铜为例,从元素化合价的变化角度分析反应,得出氧化还原反应的概念:在反应过程中有元素化合价变化的化学反应叫做氧化还原反应。
强调氧化还原反应的特征是元素化合价的变化。
(2)氧化还原反应的判断给出一些化学反应方程式,让学生判断哪些是氧化还原反应,并说明判断依据。
通过练习,加深学生对氧化还原反应判断的理解。
(3)氧化还原反应的本质以钠与氯气的反应为例,分析化合价变化的原因是电子的得失。
以氢气与氯气的反应为例,分析化合价变化的原因是电子的偏移。
总结得出氧化还原反应的本质是电子的转移(得失或偏移)。

《氧化还原反应》复习课教学设计(一)指导思想与理论依据1.高考说明中的要求及要求层次氧化还原反应(层次Ⅱ);氧化剂和还原剂等概念(层次Ⅰ);重要的氧化剂和还原剂之间的常见反应(层次Ⅱ);判断反应中电子转移的方向和数目,配平反应方程式及有关计算(层次Ⅲ)。
2.建构主义理论:知识不是通过教师传授得到,而是学习者在一定的情境,借助其他人(包括教师和学习伙伴)的帮助,利用必要的学习资料,通过意义建构的方式而获得。
学生的学习是一个自.主构..建.的过程。
(二)教学背景分析氧化还原反应贯穿于高中化学教学过程的始末,高三学生站在已学习完全部高中化学知识的高度上,对氧化还原反应规律及应用层面上的一种深层次的全面整理、归纳、提升。
北京市高中示范校高三学生已经能够自主地观察实验现象、分析产物、书写方程式和离子方程式教师激发学生的学习兴趣,帮助学生形成学习动机;通过创设符合教学内容要求的情境和提示新旧知识之间联系的线索,帮助学生建构当前所学知识的意义。
提出适当的问题引起学生的思考和讨论,在讨论中设法把问题步步引向深入,加深学生对所学内容的理解,启发诱导学生自己去发现规律。
本节课以创设问题情境,搭建学习的台阶,提高学生的思维能力和培养科学方法为主线。
教学手段:演示实验、分组实验。
将学生分成八组,每组六人,组长负责制。
技术准备:演示实验让学生观察:84消毒液为什么不能和洁厕灵混合使用?具体如下:①试管里装2ml洛娃洁厕灵,用细线吊一张普通A4粉色纸湿纸条,用医用葡萄糖瓶塞密封。
②用5毫升医用注射器,抽取1ml龙安84消毒液。
(三)本课教学目标设计(四)教学过程与教学资源设计么不能和洁厕灵混合使用)得出反应原理(5分钟半开放) 管里装2ml洛娃洁厕灵,用细线吊一张普通A4粉色纸湿纸条,用医用葡萄糖瓶塞密封。
②5毫升医用注射器,抽取1ml龙安84消毒液。
演示实验,引导学生解决问题。
学生观察实验,观察后记录、描述实验现象、书写反应原理并交流,填写在学案上。
教学案例课题名称:Unit 4 Where’s my schoolbag?第一课时 Section A姓名:工作单位:学科年级:七年级教材版本:人教版一、教学内容分析(简要阐明课题来源、学习内容、这节课的价值和学习内容的重要性)本单元以议论物品地位(Things around the house)为话题,要求学生学会方位介词on, in, under等的用法。
题材颇具古代气息,贴近先生日常生活,内容丰富,词汇量大,经过描述物品地位、找寻物品、设置理想化居室等系列活动,让先生在听、说、读、写、做中学习言语知识,培养运用言语知识的能力,激发创新精神。
而本节课在这个单元中对于物品方位的初步认知和表达起侧重要的作用,次要经过问答方式教授先生如何表达单复数物品简单的方位。
二、教学目标(从知识与技能、过程与方法、情感态度与价值观三个维度对该课题估计要达到的教学目标做出一个全体描述)1.知识目标:A.掌握有关物品的新名词:table, bed, where, bookcase, sofa, chair, on, under等。
B.纯熟运用介词in, on, under。
C.纯熟运用where问句及其回答。
D.掌握名词单复数及人称代词they的用法。
2.能力目标:A.学会用英语讯问本人的和别人的物品的具体地位。
B.学会用英语精确描述物品的具体地位。
3.情感目标:A.培养先生划一摆放本人物品的生活习气。
B.经过小组对话、讨论等一系列的课堂活动,培养先生的合作精神。
三、学习者特点分析(阐明学习者在知识与技能、过程与方法、情感态度等三个方面的学习预备(学习起点),和先生的学习风格。
最好阐明教师是以何种方式进行学习者特点分析,比如说是经过平时的观察、了解;或是经过预测标题的编制运用等)先生经过三个预备单元和三个正式单元的学习,对于特殊疑问句的构成及回答方式都有了必然的了解,同时也具备了必然的学习能力和表达能力,可以经过自主学习与合作学习本人分析成绩、解决成绩。
氧化还原反应⑵.基本概念之间的关系: 氧化剂有氧化性化合价降低得电子被还原发生还原反应生成还原产物 还原剂有还原性化合价升高失电子被氧化发生氧化反应生成氧化产物2.基本规律⑴. 标电子转移的方向和数目(双线桥法、单线桥法)①单线桥法。
从被氧化(失电子,化合价升高)的元素指向被还原(得电子,化合价降低)的元素,标明电子数目,不需注明得失。
例:MnO 2+4HCl (浓)MnCl 2+Cl 2↑+2H 2O②双线桥法。
得失电子分开注明,从反应物指向生成物(同种元素)注明得失及电子数。
例:2e -MnO 2+4HCl (浓)MnCl 2+Cl 2↑+2H 2O注意两类特殊的化学反应。
①歧化反应,同种元素同价态在反应中部分原子化合价升高,部分原子化合价降低。
例:3Cl 2+6KOHKClO 3+5KCl+3H 2O②归中反应。
不同价态的同种元素的原子在反应中趋于中间价态,解此类题最好将该元素的不同价态用数轴标出,变化的区域只靠拢,不重叠。
例:KClO 32+ 6KCl ↑ +3H 2O⑵. 物质的氧化性强弱、还原性强弱的比较。
氧化性→得电子性,得到电子越容易→氧化性越强 还原性→失电子性,失去电子越容易→还原性越强由此,金属原子因其最外层电子数较少,通常都容易失去电子,表现出还原性,所以,一般来说,金属性也就是还原性;非金属原子因其最外层电子数较多,通常都容易得到电子,表现出氧化性,所以,一般来说,非金属性也就是氧化性。
1.根据金属活动性顺序来判断:一般来说,越活泼的金属,失电子氧化成金属阳离子越容易,其阳离子得电子还原成金属单质越难,氧化性越弱;反之,越不活泼的金属,失电子氧化成金属阳离子越难,其阳离子得电子还原成金属单质越容易,氧化性越强。
2.根据非金属活动性顺序来判断:一般来说,越活泼的非金属,得到电子还原成非金属阴离子越容易,其阴离子失电子氧化成单质越难,还原性越弱。
3.根据氧化还原反应发生的规律来判断: 氧化还原反应可用如下式子表示:得2e -失2e -—失得5e 得5e -规律:反应物中氧化剂的氧化性强于生成物中氧化产物的氧化性,反应物中还原剂的还原性强于生成物中还原产物的还原性。
高考化学氧化还原反应专题教案一、教学目标1. 理解氧化还原反应的概念和特征。
2. 掌握氧化还原反应的基本概念及判断方法。
3. 掌握氧化还原反应的配平方法。
4. 能够应用氧化还原反应解决实际问题。
二、教学内容1. 氧化还原反应的概念和特征氧化还原反应的定义氧化还原反应的特征2. 基本概念氧化还原反应中的氧化剂、还原剂、氧化产物、还原产物电子的转移电荷守恒3. 判断方法元素化合价的变化电子的转移方向4. 配平方法升降价法电子守恒法强制法5. 应用实例化学反应中氧化还原反应的应用实际问题中的氧化还原反应应用三、教学重点与难点1. 教学重点氧化还原反应的概念和特征氧化还原反应的基本概念及判断方法氧化还原反应的配平方法氧化还原反应在实际问题中的应用2. 教学难点氧化还原反应的配平方法氧化还原反应在实际问题中的应用四、教学方法1. 讲授法:讲解氧化还原反应的概念、特征、基本概念及判断方法。
2. 案例分析法:分析实际问题中的氧化还原反应。
3. 练习法:让学生通过练习掌握氧化还原反应的配平方法。
五、教学过程1. 引入:通过一个实际问题,引出氧化还原反应的概念。
2. 讲解:讲解氧化还原反应的概念、特征、基本概念及判断方法。
3. 案例分析:分析实际问题中的氧化还原反应。
4. 练习:让学生通过练习掌握氧化还原反应的配平方法。
5. 总结:对本节课的内容进行总结,强调重点和难点。
6. 作业布置:布置相关练习题,巩固所学知识。
六、教学评估1. 课堂问答:通过提问检查学生对氧化还原反应概念和特征的理解。
2. 练习题:布置相关的习题,检查学生对氧化还原反应基本概念及判断方法的掌握。
3. 配平练习:让学生尝试配平复杂的氧化还原反应,检查其配平能力。
4. 应用问题:让学生解决实际问题中的氧化还原反应,检查其应用能力。
七、教学反思在课程结束后,教师应反思教学过程中的优点和不足,如:1. 学生对氧化还原反应概念和特征的理解程度。
2. 学生对氧化还原反应基本概念及判断方法的掌握情况。
芯衣州星海市涌泉学校第二章化学物质及其变化第七课时氧化复原反响根本概念〖复习目的〗〔1〕理解氧化复原反响的根本概念,能对氧化剂、复原剂,氧化产物、复原产物,氧化性、复原性等概念作出准确地判断。
〔2〕理解氧化复原反响的本质是电子转移。
〔3〕掌握氧化复原反响的表示方法,特别是电子转移的表示方法。
〖教学重点〗氧化复原反响的根本概念、电子转移的表示方法〖教学难点〗电子转移的表示方法〖教学过程〗【知识精讲】1、氧化复原反响的概念〔1〕特征及判断根据:特征是反响前后元素化合价的升降;判断某反响是否属于氧化复原反响可根据反响前后化合价是否发生了变化这一特征。
〔2〕本质:在化学反响中有电子的转移〔得失或者者偏移〕〔3〕概念〔4〕过程〔5〕与四种根本类型的关系 2、电子转移的数目及方向 〔1〕有关电子转移数目的计算关键是明确反响中元素的化合价变化,找出氧化剂或者者复原剂的物质的量,以及1mol 氧化剂得电子的物质的量或者者者1mol 复原剂失电子的物质的量。
例如:1molCl2全部为-1,转移2mol 电子,变为+1和-1价,转移1mol 电子)) 1molFe 生成FeCl3,转移3mol 电子,生成FeS ,转移2mol 电子)) 〔2〕氧化复原反响中电子转移的表示方法①单线桥法用单线箭头从被氧化(失电子,化合价升高)的元素指向被复原(得电子,化合价降低)的元素,标明电子数目,不需注明得失。
ne -===氧化产物+复原产物本卷须知:①箭头必须由复原剂中失电子的元素指向氧化剂中得电子的元素②箭头方向表示电子转移的方向 ③在“桥〞上标明转移的是电子总数。
②双线桥法用双线箭头按被氧化和被复原的元素分别从反响物指向生成物(同种元素),并注明得失及电子数目。
本卷须知:①箭头必须由反响物指向生成物,且两端对准同种元素。
②箭头方向不代表电子转移方向,仅表示电子转移前后的变化。
③在“桥〞上标明电子的“得〞与“失〞,且得失电子总数应相等。
第六章氧还原反应一、教基本要求1、氧还原反应与原电池掌握氧值的概念,掌握离子 电子法配平;了解原电池、氧还原电对、半反应、电极反应、电池反应、电池符号(最简单的)等基本概念。
2、电极电势解双电层论;掌握标准电极电势的概念;熟悉标准氢电极、参比电极和甘汞电极;会用标准电极电势表。
3、影响电极电势的因素掌握能斯脱方程;掌握酸度、沉淀的生成、配合物的生成对电极电势的影响。
4、电极电势的应用会用电极电势判断氧剂(或还原剂)的相对强弱;会计算氧还原反应的平衡常;会判断氧还原反应进行的方向;会应用元素的标准电极电势图判断某一物质能否发生歧反应,并会计算相应电对的电极电势。
二、时分配三、教内容§61 氧还原反应与原电池611 基本概念参加反应的物质之间有电子的得失或偏移的一类反应称为氧还原反应。
例如:+ 2+=2+ + (电子的得失)H2(g)+2(g)=H(g)(电子的偏移)一、氧(值)1.氧 1970年纯粹和应用国际联合会(IUPA)确定氧是某元素的一个原子的荷电,该荷电是假定把每一键中的电子指定给电负性更大的原子而求得。
2.定氧值的几条规则如下(1)在单质中元素的氧为零;在单原子离子中元素的氧等于离子所带的电荷。
(2)在多原子分子中,所有原子的氧代和为零;在多原子离子中,所有元素的氧的代和等于该离子所带的电荷。
(3)含氢大多合物中氢的氧为+1,但在金属氢物中,氢的氧值为-1。
(4)氧在一般合物中的氧为-2;在过氧物中为-1;在超氧物(O2)中为-1/2;在臭氧物(O3)中为-1/3;在OF2中为+2,在O2F2中为+1。
(5)所有含氟物中氟的氧为-1;碱金属的氧为+1;碱土金属的氧为+2。
3.氧可以是正值,可以是负值, 也可以是分和零,从值上可以看出,氧值是合物中元素原子的形式电荷。
二、氧剂和还原剂在氧还原反应中,某元素原子失去电子,氧升高,即被氧;某元素的原子得到电子,氧降低,即被还原。
失去电子的物质是还原剂,得到电子的物质是氧剂。
1.了解氧化还原反应的本质是电子转移。
2.了解氧化剂、还原剂、氧化产物和还原产物等概念。
3.能够利用得失电子守恒进行有关氧化还原反应的计算。
4.了解常见的氧化剂和还原剂及常见的氧化还原反应。
一、氧化还原反应的基本概念及相互关系1.氧化还原反应的实质是电子的得失或电子对的偏移,特征是反应前后元素化合价的升降;判断某反应是否属于氧化还原反应可根据反应前后化合价是否发生了变化这一特征。
2.基本概念(1)氧化反应:失去电子(化合价升高)的反应。
(2)还原反应:得到电子(化合价降低)的反应。
(3)氧化剂(被还原):得到电子的物质(所含元素化合价降低的物质)。
(4)还原剂(被氧化):失去电子的物质(所含元素化合价升高的物质)。
(5)氧化产物:还原剂失电子后对应的产物(包含化合价升高的元素的产物)。
(6)还原产物:氧化剂得电子后对应的产物(包含化合价降低的元素的产物)。
3.氧化还原反应的表示方法(1)双线桥法箭头必须由反应物指向生成物,且两端对准同种元素。
箭头方向不代表电子转移方向,仅表示电子转移前后的变化。
在“桥”上标明电子的“得”与“失”,且得失电子总数应相等。
(2)单线桥法箭头必须由还原剂中失电子的元素指向氧化剂中得电子的元素。
箭头方向表示电子转移的方向。
在“桥”上标明转移的电子总数。
1.氧化还原反应与四种基本反应类型的关系(1)有单质参加的化合反应一定是氧化还原反应;(2)有单质生成的分解反应一定是氧化还原反应;(3)置换反应一定是氧化还原反应;(4)复分解反应一定不是氧化还原反应。
2.常见的氧化剂和还原剂重要的氧化剂一般有以下几类:(1)活泼的非金属单质,如Cl2、Br2、O2等。
(2)元素(如Mn等)处于高化合价时的氧化物,如MnO2等。
(3)元素(如S、N等)处于高化合价时的含氧酸,如浓H2SO4、HNO3等。
(4)元素(如Mn、Cl、Fe等)处于高化合价时的盐,如KMnO4、KClO3、FeCl3等。
氧化—还原反应专题教案【教学目标】知识与技能1.理解氧化和还原、氧化性和还原性、氧化剂和还原剂、氧化产物和还原产物等概念。
能判断氧化还原反应中物质的氧化性、还原性的强弱和电子转移方向和数目。
能应用氧化还原反应中电子得失规律解决一些化学问题。
2.能配平常见的氧化还原反应方程式(包括常规配平、缺项配平、离子方程式配平、简单的有机反应配平等)。
3.掌握化合、分解、置换、复分解等四种基本化学反应类型,并能进行判断分析。
氧化还原反应是高考每年必考的内容,从考查试题类型来说可以是氧化还原概念的应用、氧化还原方程式的配平和书写或有关氧化还原的化学计算等等。
近几年有深化加难的趋势。
过程与方法:通过氧化还原方程式配平的学习,提高知识的综合迁移能力;情感态度与价值观:(1)通过一般氧化还原反应方程式、特殊的氧化还原反应方程式的配平,理解事物的一般性和特殊性,加深具体情况具体分析的思想观念。
(2)通过一些配平技巧、配平的规律的学习,培养学生创造和发现化学学科的科学美、规律美,从中提高学习化学的兴趣。
【重点和难点】重点:使学生掌握用化合价升降法配平氧化还原反应方程式的原则和步骤。
难点:氧化还原反应方程式配平的技巧,熟练掌握氧化还原反应方程式配平。
教学中主要通过学生的练习来发现问题、让学生自己总结发现配平的规律,提高氧化还原反应方程式配平的能力。
教学方法和过程一、氧化—还原反应概念以K2Cr2O7与浓HCl为例分析K2Cr2O7 + HCl(浓)——KCl + Cr Cl3 + Cl2 + H2O问题1 判断上述反应是否氧化—还原反应?(复习氧化—还原反应概念)凡有元素化合价升降的化学反应就是氧化—还原反应(既是特征也是判断依据)。
【思考】在氧化—还原反应中被氧化元素化合价升高总数和被还原元素化合价降低总数有什么关系?(引出是氧化—还原反应的实质)【深化】凡是反应物中原子或离子有电子得失(或偏移)的反应就是氧化—还原反应。
问题2 什么是氧化剂、还原剂、氧化产物与还原产物、氧化性、还原性归纳氧化还原反应中的基本概念(1)氧化反应物质失去电子(化合价升高)的反应。
还原反应物质得到电子(化合价降低)的反应。
(2)所含元素化合价升高的反应物发生氧化反应(被氧化),是还原剂;所含元素化合价降低的反应物发生还原反应(被还原),是氧化剂。
(3)氧化性物质得电子的性质。
若某物质得电子能力强,则该物质氧化性较强;较难得电子的氧化剂,其氧化性较弱。
还原性物质失电子的性质。
若某物质失电子能力强,则该物质还原性较强;较难失电子的还原剂,其还原性较弱。
(4)氧化产物还原剂发生氧化反应后生成的物质。
还原产物氧化剂发生还原反应后生成的物质。
综合得出如下的氧化还原反应对立统一关系的两根推断线:记忆技巧实质判断依据元素变化反应物称为反应物性质失e —→升价—→被氧化—→还原剂—→还原性得e —→降价—→被还原—→氧化剂—→氧化性二、氧化—还原反应中电子得失情况的表示方法1.双线桥——表示电子得失的结果双线桥式要点:(1)两个箭号分别连接反应物中还原剂与氧化产物,反应物中氧化剂与还原产物(从反应物指向生成物);(2)箭号起、止所指为同一种元素;(3)标出得与失电子及总数(氧化剂得电子总数等于还原剂失电子总数)。
2.单线桥——表示电子转移情况单线桥式:6eOH Cl CrCl KCl HCl O Cr K 2237227322141+↑++=+要点:(1)单箭号(在反应物之间);(2)箭号起点为还原剂中被氧化(化合价升高或失电子)元素,终点为氧化剂中被还原(化合价降低或得电子)元素;(3)只标转移电子总数(最小公倍数n)e,不标得与失(氧化剂得电子总数等于还原剂失电子总数)。
【练习】学生讨论、分析、板演:说明:上述练习中的第(2)例(*号者)是一类特殊的氧化—还原反应,其特征是氧化—还原反应发生在同一物质中同一价态的同种元素之间。
这样的氧化—还原反应称为歧化反应。
三、氧化——还原反应方程式的配平1. 配平原则:氧化剂化合价降低总数与还原剂化合价升高总数相等,即得失电子守恒和质量守恒。
2. 配平的步骤:双线桥式标出化合价变化(或电子得失),双线桥式标出化合价变化(或电子得失),把自己多年教学笔记找出来对,引入自己的归纳:以一个分子为单位计,兼顾前后奇偶数,列变化、最小公倍数使升降(或电子得失)相等、配化学计量数:先参加氧化—还原反应的元素;再金属元素,非金属元素;最后氢元素、氧元素,必要时两边可添水配平。
3. 配平基本技能:①全变从左边配:氧化剂、还原剂中某元素化合价全变的,一般从左边反应物着手配平②自变从右边配:自身氧化——还原反应(包括分解、歧化)一般从右边着手配平(倒配法)例如:Cl2 + KOH ——KCl + KClO3 + H2O(右边变成Cl Cl15-+,变化为1、5互为化学计量数)Cu(NO3)2——CuO + NO2 + O2(右边NO、O2生成,价态变化为1、4,互为化学计量数)(NH4)2PtCl6——Pt + NH4Cl + HCl + N2(右边Pt ,N 2价态变化为4、6,互为化学计量数)③归中从左边配:归中反应(反歧化,化合型氧化——还原反应)一般从左边着手配平,例如:H 2S + SO 2 ——S + H 2O (左边:S SS 24-+•→,变化分别为2、4,互为化学计量数)KI + KIO 3 + H 2SO 4——I 2 + K 2SO 4 + H 2O(左边:I I I 152-+→、变化1、5,互为计量数) FeSO 4 + H 2SO 4 + O 2 →+Fe (SO )H O2432(左边Fe O 22+、变为1,4,互为化学计量)④部分变由两边配:一部分发生氧化——还原反应的物质化学计量数应为变与不变之和,例如:HCl + KMnO 4——KCl + MnCl 2 + Cl 2↑ + H 2O(HCl 化学计量数应为被氧化与未被氧化之和)Zn + HNO 3 ——Zn(NO 3)2 + NH 4NO 3 + H 2O(HNO 3化学计量应为被还原与未被还原的HNO 3之和)(5)检查等号两边各元素的原子总数是否相等,正负电荷总数是否相等。
注意的两个问题(1)在配平氧化还原反应方程时不仅要使方程式等号两边各元素的原子总数相等,而且正负电荷总数也要相等,例如:Fe Fe 2Fe 32+=++(错) 等号两边正负电荷总数不相等,应为Fe 2Fe 3Fe 32+=++Fe Cu Fe Cu 322++++=+(错) 同理应为2Fe C u 2Fe C u 322++++=+Fe Cl Fe 2Cl 223++-+=+(错)应为2Fe Cl 2Fe 2Cl 223++-+=+Fe 2I Fe I 322+-++=+(错)应为2Fe 2I 2Fe I 322+-++=+(2)检查一个氧化还原反应方程式是否写得正确,不仅要看等号两边各元素的原子个数及正负电荷总数是否相等,还要看氧化剂和还原剂的得失电子总数是否相等,例如①2KM nO 5H O 3H SO K SO 2M nSO 5O 8H O4222424422++=++↑+②2K M nO 7H O 3H SO K SO 2M nSO 6O 10H O4222424422++=++↑+③2K M nO 9H O 3H SO K SO 2M nSO 7O 12H O422424422++=++↑+上述三个化学方程式,从反应前后各元素的原子个数来看都已配平,但根据氧化剂和还原剂的得失电子总数相等的原则分析,则只有①的化学方程式正确,而②和③两个化学方程式都是错误的。
四、物质氧化性、还原性,常见的氧化剂、还原剂(一)物质的氧化性,还原性的相对强弱的判断1、从反应条件难易及反应剧烈程度来判断如(1)Cu 2H SO ()24+浓∆CuSO SO 2H O 422+↑+ (加热条件下反应) Cu 4H N O ()Cu(N O )2N O 2H O 33222+=+↑+浓(常温下剧烈反应)浓HNO 3氧化性>浓H 2SO 4氧化性(2)Cu 4H N O ()Cu(N O )2N O 2H O33222+=+↑+浓 (常温下剧烈反应) 3Cu 8H N O ()3Cu(N O )2N O 4H O3322+=+↑+稀(常温下反应慢)浓HNO 3氧化性 > 稀HNO 3注意:氧化性、还原性的强弱主要取决于它们得失电子的难易,不取决于它们得失电子的多少 HNO ()NO 5342++→浓得1eH NO ()NO532++→稀 得3e2、由元素在周期表中的位置判断:如元素处在元素周期表的左下方则还原性较强如元素处在元素周期表的右上方则氧化性较强3、通过金属活动性顺序判断金属原子失电子能力减弱,则还原性减弱,相应金属阳离子得电子能力增强,则氧化性增强应注意:2Fe C u 2Fe C u 322++++=+∴ 氧化性FeCu 32++>4、通过非金属活动性顺序判断非金属原子氧化性减弱SI Br Cl O F相应非金属离子还原性增强 ------22S I Br Cl O F5、通过实际氧化还原反应进行判断:6、通过元素的价态高低进行判断:具有最高价态元素的化合物一般可做氧化剂具有氧化性,如:含有S 6+的浓H 2SO 4含N 5+的HNO 3,含F e 3+的FeCl 3以及含有Mn 7+的KMnO 4等化合物都具有氧化性。
原因是这些最高价元素在氧化还原反应中,不能再失去电子(化合价再升高),而只能获得电子(化合价降低)发生还原反应。
具有最低价元素的化合物一般可做还原剂具有还原性。
如:含I 1-的HI 、含S 2-的H 2S 等化合物都具有还原性。
原因是这些最低价的元素在氧化还原反应中不能再结合电子(化合价再降低),而只能失去电子(化合价升高)发生氧化反应。
具有中间价态元素的物质既可以做氧化剂,又可做还原剂,例如:S 4+的H 2SO 3、含F e 2+的FeCl 2等物质既具有氧化性,又具有还原性。
原因是这些中间价态的元素在氧化还原反应里既可获得电子(化合价降低)发生还原反应,也可以失去电子(化合价升高)发生氧化反应。
(二)常用氧化剂、还原剂及其反应的主要产物1.常见的氧化剂在化学反应中易得电子被还原的物质。
(1)典型的非金属单质如:F 2、O 2、CI 2、Br 2、I 2、S ……(其氧化性强弱与非金属活动性基本一致)。
(2)有变价元素的高价态化合物如:47O Mn K +、35O I K +C 浓462SO +H 、35O N H +、24O +Mn 、24O N +……。
(3)金属阳离子如:Fe 3+、Cu 2+、(H +)…(在金属与酸、盐溶液的置换反应,如反应Fe +CuSO 4=FeSO 4+Cu 中,实质上是Cu 2+离子氧化Fe 原子,Cu 2+作氧化剂,Fe 是还原剂)。