人工固氮技术-合成氨
- 格式:doc
- 大小:726.50 KB
- 文档页数:15






课题2 人工固氮技术---合成氨教学目标1、了解合成氨对人类社会发展的重要意义。
2、通过实验学习合成氨反应原理,利用化学反应速率,化学平衡移动原理分析和讨论合成氨适宜反应条件。
3、结合合成氨的基本生产过程及合成氨工业发展,帮助学生理解实际生产中问题教学重点合成氨的反应原理、合成氨生产的适宜条件教学难点合成氨生产适宜条件教学用具 PPT课件课时安排 1课时教学过程【进行新课】[设立情景]神秘的魔鬼谷在新疆与青海交界处有一山谷,人称魔鬼谷。
每当人畜进入后,经常电闪雷鸣,狂风暴雨,把人畜击毙。
然而谷内却是牧草茂盛,四季常青。
请解释原因。
N 2 + O2==== 2NO2NO + O2 = 2NO23NO2 + H2O = 2HNO3+ NO“雷雨发庄稼”“春雨贵如油”等说法。
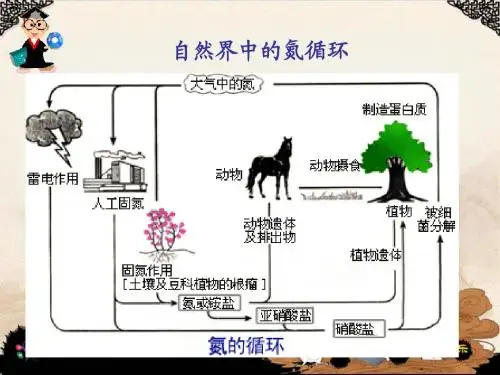
[过渡]空气中游离态氮气不能被庄稼吸收,转化为氮的化合物后才能被吸收。
将游离氮转化为化合态氮的方法叫氮的固定。
看一下氮的循环。
农作物每年从土壤中摄取大量含氮化合物,为了补偿土壤中减少的氮,必须施加氮肥。
必须人工固氮。
[导言]本课时谈一下人工固氮技术----合成氨[展示]胶片人工固氮技术----合成氨一、合成氨的反应原理•由氮气与氢气直接合成氨的化学原理为:方程式见胶片二、合成氨的基本生产过程1、制备合成氨的原料气,2、原料气的净化,3、氨的合成与分离 [展示]合成氨的实地照片三、合成氨工业的发展[阅读]教材总结.1、原料及原料气的净化2、催化剂的改进3、环境保护废气主要是硫化氢和二氧化碳等有害气体。
废液主要是含氰化物和氨的污水。
废渣主要来自造气阶段。
【课堂训练】【小结】工业合成氨:(1)原理:(2)条件:(3)生产过程:(4)三废处理:【布置作业】。

人工固氮技术—工业合成氨学案设计江西省新建二中阮名洁教学目标:【知识与技能】:1、掌握工业合成氨的化学反应原理2、通过工业合成氨的典例,建立工业产品合成的基本模型。
3、理解工业合成氨的最佳合成条件4、理解工业产品合成的四大基本原则“多”、“快”、“好”、“省”【教学重难点】:1、建立工业合成氨的流程模型(重点)2、根据反应速率和化学平衡两个角度找到工业合成氨的最佳合成条件(重点)3、归纳出工业产品合成的四大基本原则“多”、“快”、“好”、“省”(难点)【温故而知新】:1、影响化学反应速率的因素有温度、浓度、压强、催化剂。
以及它们分别是如何影响2、影响化学反应平衡的因素有温度、浓度、压强。
以及它们分别是如何影响3、转化率的概念,勒夏特列原理习题巩固一.选择题1.符合工业合成氨生产实际的是()A.V2O5做催化剂B.NH3循环使用C.N2和H2液化分离D.反应温度由催化剂决定2.下列有关工业生产叙述正确的是()A.合成氨工业中,将NH3及时液化分离有利于提高产率B.工业上通常使用电解法制备金属钠、镁、铝、铁等C.硫酸工业中,采用常压条件的原因是此条件下催化剂活性最高D.电解精炼铜时,将粗铜与电源的负极相连3.如图是工业合成氨的简单流程图,沿①路线回流的物质是()A.氮气和氢气B.催化剂C.NH3D.H2 4.下列有关工业生产叙述正确的是()A.工业上通常使用电解法制备金属钠、镁、铝等B.合成氨工业中,将NH3及时液化分离有利于加快反应速率C.硫酸工业中,采用常压条件的原因是此条件下催化剂活性最高D.电解精炼铜时,将粗铜与电源的负极相连5.关于工业生产的下列叙述中,不正确的是()A.工业生产硫酸时,使用热交换器可以充分利用反应中所放出的热量B.工业上合成氨没有采用更大的压强是从设备和动力要求方面考虑的C.工业上用离子交换膜法电解饱和食盐水制烧碱D.工业上采用电解(省电能30%)的AlCl3﹣KCl熔融体的方法制取金属铝一.填空题6.“低碳”既是时尚,也是环保要求.“低碳”在工业生产中意义重大,充分利用原材料,不排放或减少排放“三废”,不同工厂今后联合生产等都是很好的“低碳”生产方式.下面是几个工厂利用废气、废渣(液)联合生产化肥硫酸铵的工艺:请回答下列问题:(1)工艺操作②为:.(2)工业合成氨的化学方程式为:.(3)副产品的化学式为.该联合生产工艺中可以循环使用的物质是.(4)在实验室中检验合成氨厂排出的废气中是否含有氨气的方法是(5)写出生成“产品”的化学方程式:.7.NH3和HNO3是重要的工业产品,如图为合成氨以及氨氧化制硝酸的流程。

自我小测1.为了进一步提高合成氨的生产效率,科研中最具有开发价值的是()A.寻找N2的新来源B.研制低温下活性较大的催化剂C.研制500 ℃左右时活性较大的催化剂D.研制耐高温、高压的材料,用于建造氨合成塔2.合成氨时既要使合成氨的产率增大,又要使反应速率加快,可采取的办法是()①减压②加压③升温④降温⑤及时从平衡混合气中分离出NH3⑥补充N2或H2⑦加催化剂⑧减小N2或H2的量A.③④⑤⑦B.②④⑥C.②⑥D.②③⑥⑦3.关于氨的合成工业的下列说法正确的是()A.从合成塔出来的气体,其中氨气一般占15%,所以生产氨的工业的效率都很低B.由于NH3易液化,N2、H2可循环使用,所以总的说来氨的产率很高C.合成氨工业的反应温度控制在400~500 ℃,目的是使平衡向正反应方向进行D.合成氨工业采用10~30 MPa,是因该条件下催化剂的活性最好4.下列有关合成氨工业的叙述,可用勒夏特列原理来解释的是()A.使用铁触媒,使N2和H2混合气体有利于合成氨B.高压比常压条件更有利于合成氨的反应C.500 ℃左右比室温更有利于合成氨的反应D.合成氨时采用循环操作,可提高原料的利用率5.化工生产中,为加快反应速率应优先考虑的措施是()A.选用适宜的催化剂B.采用高压C.采用高温D.增大反应物浓度6.1913年德国化学家哈伯发明了以低成本制造大量氨的方法,从而大大满足了当时日益增长的人口对粮食的需求。
下列是哈伯法的流程图,其中为提高原料转化率而采取的措施是()A.①②③B.②④⑤C.①③⑤D.②③④7.氨催化氧化是硝酸工业的基础,在某催化剂作用下只发生主反应①和副反应②,有关物质产率与温度的关系如图。
4NH3(g)+5O2(g)4NO(g)+6H2O(g)ΔH1=-905 kJ·mol-1①4NH3(g)+3O2(g)2N2(g)+6H2O(g)ΔH2=-1 268 kJ·mol-1②下列说法中正确的是()A.工业上氨催化氧化生成NO时,温度应控制在780~840 ℃之间B.为了提高反应速率,工业上常采用物料n(O2)∶n(NH3)为1.7~2.0C.加压有利于NH3生成NO,不利于NH3生成N2D.N2(g)+O2ΔH=-181.5 kJ·mol-18.合成氨的流程示意图如下:回答下列问题:(1)工业合成氨的原料是氮气和氢气。


课题2 人工固氮技术-—合成氨1.了解工业合成氨的基本原理、基本生产过程以及合成氨工业的发展.2.了解工业获得合成氨的大量廉价原料气的方法,了解合成氨原料气循环利用的原理和重要意义。
3.了解工业合成氨与环境的关系。
德国化学家哈伯(1868—1934)一生从事化学研究,曾在1906年发明了氨的合成法,1908年又发明了合成氨的催化剂,为工业化生产奠定了基础.思考:如何利用空气中的氮气来合成氮肥呢?答案:氮气与氢气在高温、高压和催化剂条件下生成氨气,由氨气来合成氮肥.一、合成氨的反应原理1.反应的化学方程式工业合成氨反应的化学方程式________________________________________。
2.反应的特点(1)____________________反应;(2)____________________反应;(3)气体分子总数____________________的反应。
3.适宜化工生产条件的选择温度:____________;压强:______________;催化剂:____________________。
自主思考:①合成氨反应中催化剂的主要作用是什么?②合成氨方案的主要优点是什么?二、合成氨的基本生产过程主要包括三个步骤:________、________、________。
1.制备合成氨的原料气(1)制备氮气方法一:__________________________。
方法二:________________________________。
(2)制备氢气方法一:水蒸气与碳反应,化学方程式为__________________。
方法二:甲烷与水蒸气反应,化学方程式为______________________;____________________________.2.原料气的净化(1)除去H2S(用氨水)的化学方程式为______________________。
人工固氮技术——合成氨A组1.人工固氮的成功对人类社会的进步具有重大意义,下列过程属于人工固氮的是( )A.种植豆科植物,利用其根瘤菌将氮气转化为蛋白质B.闪电时氮气与氧气化合,生成的氮的化合物被植物吸收C.化工厂中在催化剂作用下使氮气与氢气化合成氨气D.以氨气为原料生产各种化肥解析:豆科植物的根瘤菌将氮气转变成植物蛋白属于生物固氮过程,A错误;闪电时氮气和氧气反应生成NO,是在自然条件下的氮的固定,B错误;在一定条件下反应生成N属于工业合成氨的过程,属于人工固氮方式,C正确;由N生产各种化肥,是氮的化合物之间的转化过程,不属于氮的固定过程,D 错误。
答案:C2.在合成氨时,可以提高H2转化率的措施是( )A.延长反应时间B.充入过量H2C.充入过量N2D.升高温度解析:A项不能提高转化率,B、D项反而会降低H2转化率;只有充入过量N2才能使平衡向正反应方向移动,提高H2转化率,故C正确。
答案:C3.合成氨工业中采用循环操作,主要是为了( )A.加快反应速率B.提高NH3的平衡浓度C.降低NH3的沸点D.提高N2和H2的利用率解析:合成氨工业采用循环操作,将N2、H2循环压缩到合成塔中,提高了N2、H2的利用率。
答案:D4.化工生产中,为加快反应速率应优先考虑的措施是( )A.选用适宜的催化剂B.采用高压C.采用高温D.增大反应物浓度解析:化工生产中应首先考虑的是生产成本,因此应先考虑使用催化剂,提高反应速率。
答案:A5.合成氨生产过程采取的措施与化学平衡移动原理无关的是( )A.选择适当的温度B.增大体系压强C.使用铁触媒作催化剂D.不断分离出氨解析:催化剂只能改变化学反应速率,对平衡移动无影响。
答案:C6.下列有关合成氨工业的说法中,正确的是( )A.从合成塔出来的混合气体中,氨气占15%,所以生产氨的工厂的效率都很低B.由于氨易液化,N2和H2在实际生产中循环使用,所以总体来说,氨的产率很高C.合成氨工业的反应温度控制在400~500 ℃,目的是使化学平衡向正反应方向移动D.我国合成氨厂采用的压强是10~30 MPa,因为该压强下铁触媒的活性最大解析:虽然从合成塔出来的混合气体中NH3只占15%,但由于原料气N2和H2循环使用和不断分离出液氨,所以生产NH3的效率还是很高的,因此A项错误;控制反应温度为400~500℃,主要是为了使催化剂活性最大,因此,C选项错误;增大压强有利于NH3的合成,但压强越大,需要的动力越大,对材料的强度和设备的制造要求越高,我国的合成氨厂一般采用1×107~3×107Pa,但这并不是因为该压强下铁触媒的活性最大,因此,D选项错误。
人工固氮技术-合成氨伟大的氮1、人类和氮:N2 NH4+或NO3-植物动物人类2、自然界中氮的循环:教材P93、氮的固定:定义:固定的方法:自然固氮、生物固氮(自然界中微量氮的化合物来源)、人工固氮.一.合成氨的原理1、分析氨的组成确定反应原理:原料:NH3(N2、H2)2、原理:实验室:NH4Cl +Ca(OH)2工业生产:N2 +H23、生产流程:造气净化干燥压缩合成冷却分离储存4、演示实验:教材P10二、条件的选择1、依据平衡移动原理:低温、高压2、依据化学反应速率:高温、高压、催化剂结论:400~5000C 10MPa~30Mpa 、催化剂(铁)三.合成氨的生产过程1:造气:N2 (气体,收集储存待用)N2 :空气液化升温O2(收集,待售)碳加热吸收CO2CO2和N2N2H2:C+H2O = CO +H2CO +H2O= CO2 + H2CH4 +2H2O =3H2 +COCH4 + 2H2O =CO2 + 4H22、净化干燥:⑴、目的:使催化氧化能顺利进行,防止催化剂中毒。
(H2S、CO 、CO2)⑵、净化过程:H2S + NH3.H2OCO + H2O(Fe2O3或CuO催化剂)CO2 + K2CO3⑶、精制:用醋酸、铜和氨水配成溶液吸收剩余微量的CO、CO2、O2、H2S 四、氨的分离极其目的1、氨在产品混合物中的含量15%2、如何提高原料的转化率?N2和H23、分离方法:氨在产品混合物液氨内衬沥青的钢制容器储存五、合成氨的发展前景1、原料及原料气净化技术发展探索寻找更为合适的制取氢气的原料,改经净化工艺和手段,降低各方面的生产成本。
2、催化剂的改进:铀磁铁矿铁钌(锇)(从催化剂的效率、催化剂的来源)3、环境保护(三废)⑴、废气:H2S:直接氧化法(选择氧化);循环法(浓缩溶剂吸收)。
CO2:用于生产尿素和碳酸铵等化肥。
CO:用于原料气氢气的生产。
⑵、废渣:煤煤渣生产建材重油:炭黑化工原料(如橡胶工业)⑶、废液:(CN- 、氨)CN-:生化、加压分解、氧化分解、化学沉淀、反吹回炉等方法。
【高中化学】高中化学知识点:合成氨(人工固氮)氮的固定:1.定义:氮的固定是指将游离态的氮转化为化合态氮的方法。
2.方法:氮的固定主要方法有:(1)人工合成氨:化学固氨法。
其条件要求高、成本高、转化率低、效率低。
(2)根瘤菌,生物固氨。
常温常压下进行。
成本低、转化率高、效率高。
3.工业应用:模拟生物的功能,把生物的功能原理用于化学工业生产,借以改善现有的并创造崭新的化学工艺过程。
二、合成氨的反应原理1.加热试管中的铁丝绒至红热后注入氢气和氨气的混合气体,可以看到湿润的PH试纸变蓝色2.用氢气和氨气合成氨的反应式是N2+3H22NH3,属放热反应。
3.工业上,采用以铁为主的催化剂,在400~500℃和10Mpa~30 Mpa的条件下合成氨。
(1)催化剂的主要作用:成千上万倍地加快化学反应速率,缩短达平衡的时间,提高日产量。
(2)合成氨的适宜条件:以铁为主的催化剂,在400~500℃和10Mpa~30 Mpa的条件(3)选择适宜生产条件的原则:有较高的反应速率和平衡转化率,能最大限度地提高利润。
(4)合成氨生产时,不采用尽可能高的压强,通常采用10MPa~30MPa 的压强,否则会增大设备的动力要求,增大成本。
(5)合成氨的反应为放热反应,降低温度促使平衡向有移动,有利于N2、H2转化为NH3;但降温必然减缓了反应速率,影响单位时间产率。
生产中将二者综合考虑,既要保证N2、H2的转化率,又要保证较快的反应速率,只能选择适中的温度400~500℃左右。
应注意该温度为催化剂活化温度,低于此温度,催化剂不起作用。
(6)催化剂是影响反应速率的几个因素中,对反应速率影响程度最大的。
催化剂的特点:①选择性:不同的反应选择不同的催化剂,如合成氨选择了铁触媒。
每种催化剂都是对特定的反应有催化作用,并非能改变任何化学反应的速率。
②灵敏性:催化剂中混入杂质,常常会失去催化作用,称催化剂“中毒”,因此反应气体进入反应器前必须净化。
考点七十六 人工固氮技术-合成氨聚焦与凝萃1.理解如何应用化学反应速率和化学平衡原理,选择合成氨的适宜条件; 2.了解合成氨生产的一般流程和反应原理、反应条件等。
解读与打通 常规考点 一、氮的固定1.定义:氮的固定是指将游离态的氮转化为化合态氮的方法。
2.方法:氨的固定主要方法有:(1)人工合成氨:化学固氨法。
其条件要求高、成本高、转化率低、效率低。
(2)根瘤菌,生物固氨。
常温常压下进行。
成本低、转化率高、效率高。
3.工业应用:模拟生物的功能,把生物的功能原理用于化学工业生产,借以改善现有的并制造崭新的化学工艺过程。
二、合成氨的反应原理 1.反应原理:N 2+3H 2催化剂 高温高压2NH 32.反应特点:合成氨反应是一个可逆、放热、气体分子总数削减的反应。
3.反应条件:工业上,合成氨的适宜条件为铁作催化剂、400~500 ℃、10~30 MPa 的压强。
三、合成氨的基本生产过程合成氨的基本生产过程主要包括三个步骤:造气(制备合成氨的原料气) 、净化(原料气净化处理)、合成(使原料气进行化学反应合成氨)。
1.原料气的制备 (1)氮气的制备:①物理方法:物理方法为将空气液化,蒸发分别出氧气。
②化学方法:将空气中的氧气与碳作用生成CO 2,再除去CO 2。
(2)氢气的制备:①碳与水蒸气的反应,用方程式表示为:C +H 2O=====高温 CO +H 2。
②水蒸气与碳氢化合物的反应,用方程式表示为:CH 4+H 2O=====高温 3H 2+CO ,CH 4+H 2O=4H 2+CO 2(催化剂、高温)。
2.原料气的净化(1)含义:原料气的净化是指除去原料中杂质的过程,目的是防止催化剂中毒。
(2)净化方法①H 2S 的除去,用方程式表示为:H 2S +NH 3·H 2O=NH 4HS +H 2O ;②CO 的除去,用方程式表示为:CO +H 2O=====△CO 2+H 2; ③CO 2的除去,用方程式表示为:K 2CO 3+CO 2+H 2O=2KHCO 3。
课题2人工固氮技术——合成氨课时过关·能力提升1为了进一步提高合成氨的生产效率,科研中最具有开发价值的是()A.寻找N2的新来源B.研制低温下活性较大的催化剂C.研制500 ℃左右时活性较大的催化剂D.研制耐高温、高压的材料,用于建造氨合成塔解析:根据平衡移动原理可知,低温有利于氨的合成。
答案:B21913年德国化学家哈伯发明了以低成本制造大量氨的方法,从而大大满足了当时日益增长的人口对粮食的需求。
下列是哈伯法的流程图,其中为提高原料转化率而采取的措施是()A.①②③B.②④⑤C.①③⑤D.②③④解析:合成氨反应为气体分子总数减小的放热反应,操作①是为了除去杂质,防止催化剂中毒;②增大压强,有利于该反应向右进行,能够提高原料转化率;③催化剂只能加快反应,不影响化学平衡,故不能提高原料转化率;④将产物NH3液化分离和⑤循环操作,均能使原料被更充分地利用,提高原料的转化率。
答案:B3合成氨工业上采用循环操作,主要是为了()A.加快反应速率B.提高NH3的平衡浓度C.降低NH3的沸点D.提高N2和H2的利用率解析:合成氨工业采用循环压缩,将N2、H2压缩到合成塔中,提高了N2、H2的利用率。
答案:D4合成氨生产过程采取的措施与化学平衡移动原理无关的是()A.选择适当的温度B.增大体系压强C.使用铁触媒作催化剂D.不断分离液氨解析:催化剂只能改变反应速率,对平衡移动无影响。
答案:C5下列有关合成氨工业的说法中,正确的是()A.从合成塔出来的混合气体中,氨气占15%,所以生产氨的工厂效率都很低B.由于氨易液化,N2和H2在实际生产中循环使用,所以总体来说,氨的产率很高C.合成氨工业的反应温度控制在500 ℃,目的是使化学平衡向正反应方向移动D.我国合成氨厂采用的压强是10~30 MPa,因为该压强下铁触媒的活性最大解析:虽然从合成塔出来的混合气体中NH3只占15%,但由于原料气N2和H2循环使用和不断分离出液氨,所以生产NH3的效率还是很高的,A项错误;控制反应温度为500 ℃,一是为了使反应速率不至于很低,二是为了使催化剂活性最大,C项错误;增大压强有利于NH3的合成,但压强越大,需要的动力越大,对材料的强度和设备的制造要求越高,我国的合成氨厂一般采用1×107~3×107 Pa,但这并不是因为该压强下铁触媒的活性最大,D项错误。
第一单元走进化学工业课题2 人工固氮技术——合成氨教学目标:知识与技能:1.掌握氮的固定的概念,了解工业合成氨对人类社会发展的意义。
2.利用化学反应速率和化学平衡理论解释合成氨中的相关问题。
3.了解合成氨的主要原理、原料、典型设备、流程和意义。
过程与方法:1.通过查阅资料了解工业合成氨的反应原理,并利用所学化学反应速率,化学平衡移动原理分析和讨论合成氨适宜反应条件。
2.结合合成氨的基本生产过程及合成氨工业发展,理解实际生产中问题。
情感态度与价值观:1.能够说出环境污染的主要方面及防止污染的一些措施,增强环境意识,作环境保护的宣传者、行动者。
2.树立合理利用自然资源、节约能源的观点,激发学习工业化学的兴趣,培养创新精神。
教材分析:本节教材的内容:本节教材是高中化学选修二第一章第二节《人工固氮技术—合成氨》的内容,合成氨工业对化学工业、国防工业和我国实现农业现代化具有重要意义,是重要的化学工业之一;同时,氨气、氢气合成氨反应也是一个学生熟悉的、典型的平衡体系。
本节主要通过合成氨的反应原理、原料气的制备和净化,主要生产过程及相应设备。
在化学工业中,需要化学与技术的结合,本节以此为研究对象有利于学生应用化学平衡理论和化学反应速率理论尝试综合选择化工生产的适宜条件,从而体会化学热力学理论和化学动力学理论对生产实践的指导作用。
本节教材的地位及作用:本节学生已在化学必修课中,学过NH3性质,有关氨的用途也已学过,通过“化学反应的快慢和限度”的学习,已经了解了化学反应速率的相关知识并建立了化学平衡的概念。
在本课题学习中,面对合成氨的实际生产问题,通过对合成氨最佳条件的探究,进一步理解化学反应速率和化学平衡移动原理是选择合成氨生产条件的主要依据,同时也提供给学生一条综合运用化学原理和其他生产因素分析和解决实际问题的途径,使他们已有的知识得到拓展和应用,并体会到化学理论对生产实践的指导作用。
教学重点:合成氨的反应原理、合成氨生产的适宜条件。
教学难点:合成氨生产适宜条件。
教学方法:讨论探究、多媒体。
课时安排:2课时教学设计流程图:教学过程:[教师活动] [课前学生活动]课前学生查阅资料,了解氮的固定,人工合成氨的重要用途,合成氨的原理,生产流程及相应的设备,做相应的板报和PPT。
角色扮演:教师:总导演学生:市场调查员—介绍氨用途学生(小组分工):氨厂厂长学生:硫酸厂总设计师—设计生产原理学生:第一阶段工程师—阐述氮气和氢气的制备;学生:第二阶段工程师—阐述氮气和氢气的净化;学生:第三阶段工程师—阐述氨合成的条件;学生:环境保护小组—阐述工业三废的处理;学生扮演:外聘博士—讲述氨合成塔使用原理。
[教师活动][课程引入ppt展示]在新疆与青海交界处有一山谷,人称魔鬼谷。
每当人畜进入后,经常电闪雷鸣,狂风暴雨,把人畜击毙。
然而谷内却是牧草茂盛,四季常青。
请同学们一起思考并解释原因。
[学生活动][学生归纳]N2 + O2= 2NO(放电)2NO + O2= 2NO23NO2 + H2O = 2HNO3 + NO空气中的氮转化为氮氧化物被植物吸收。
在人们生活中也经常有“雷雨发庄稼”“春雨贵如油”等说法。
[教师活动][过渡]大家都知道在地壳中氮的含量只有0.04%,而大气中氮气的体积分数为78%。
空中游离态氮气不能被庄稼吸收,必须将其转化为氮的化合物后才能被吸收。
将游离氮转化为化合态氮的方法叫氮的固定。
请大家根据课前的预习,氮的固定有哪些方法?[学生活动][学生归纳]主要的固氮反应有:生物固氮、自然固氮、化学固氮和人工模拟生物固氮。
[ppt展示]1、生物固氮:是一种主要的自然固氮反应,如植物在根瘤菌作用下直接吸收空气中的N2转化为氨等,进一步合成氮白质。
2、自然固氮:如闪电产生的巨大电压,其电火花足可以击破氮分子的叁键,促使其与氧气反应生成NO。
进而生成NO2和HNO3等。
3、化学固氮:合成氨反应;在放电条件下使氮气与氧气反应生成NO等;氮气与镁反应生成氮化镁。
4、人工模拟生物固氮:通过化学方法,制备出类似生物“固氮菌”的物质,使空气中的氮气在常温常压下与水及二氧化碳等反应,转化为氨态氮或铵态氮,进而实现人工合成大量的蛋白质等,最终实现工厂化生产蛋白质食品。
[信息技术支持]利用Powerpoint展示图片[教师活动][过渡]那么在化学上怎样才能有效利用廉价的自然资源来生产含氮化合物?其中合成氨是最有效且便于工业化的方法,这就涉及人工固氮技术—合成氨,为什么要合成氨呢?今天我们以角色扮演的形式来学习合成氨。
[学生活动] [投影]学生-角色市场调查员阐述氨的用途,利用板报展示氨的用途。
[设计意图]通过氨对化工生产的重要性,激发学生对合成氨生产的兴趣。
[信息技术支持]利用板报和Powerpoint展示图片[教师活动] [设疑]氨有那么多用途,工业上是如何生产的呢?请同学们根据查阅的资料小组归纳总结合成氨的制备原理及生产过程。
[教师活动] 氨的用途如此之多,建立合成氨厂不仅可以帮助到我们的生活还会带来利润,现在我想建立合成氨厂,首先知道如何才能得到合成氨?[设计意图]培养学生自学能力,归纳总结能力,个人与合作的能力。
[信息技术支持]网上查阅资料:合成氨[教师活动]教师要关注学生的活动状态,与他们共同解决可能存在的问题和困惑。
教师还可以提出以下思考问题引导学生学习活动(做成导学案学生课前及课堂使用):[创设情景]穿越历史:介绍合成氨的发展—从实验室到工业化生产?(以下问题做成导学案学生课前及课堂使用):1.根据氧化还原知识确定制备氨的反应原理是什么?2.根据反应原理确定哪些原料可以合成氨?3.如何净化气体中的杂质?4.如何根据影响速率和平衡移动的因素来确定合成氨的反应条件?5.如何合成氨和分离氨?6.如何保护环境?[学生活动][学生讨论归纳展示并板书]学生-总工程师代表团队讲述及板书:总工程师讲述及画报展示:1.穿越历史:合成氨的历史:1900年,法国化学家勒夏特列通过理论计算,认为氮气和氢气可以直接化合生成氨。
在实验验证过程中发生了爆炸,他并没有调查事故发生的原因,而是觉得这个实验有危险就放弃了。
后来查明实验失败的原因是他所用的混合气体中含有氧气。
稍后,德国物理化学家能斯特通过理论计算,竟然认为合成氨是不能进行的。
后来才发现,他在计算时误用一个热力学数据,以致得到错误的结论。
由于能斯特在物理化学领域的权威性,人工合成氨的研究陷入低潮。
德国化学家哈伯,哈伯没有盲从权威,而是依靠实验来检验,曾在1906年发明了氨的合成法,1908年又发明了合成氨的催化剂,为工业化生产奠定了基础。
而波施实现了合成氨的工业化。
2.确立用氢气和氨气合成氨的反应式是:N2+3H2催化剂高温高压2NH3,属放热反应。
板书:一、合成氨的反应原理:N2+3H2催化剂高温高压2NH3△H=-92.4KJ·mol-1[学生活动][总工程师归纳]根据硫酸的工业制备及我们查阅资料,合成氨的生产主要包括三个步骤:造气制备合成氨的气体原料净化原料气净化和处理合成与分离使原料进行化学反应合成氨并分离氨板书:二、合成氨的生产过程[教师活动][投影]合成氨的工艺流程:[信息技术支持]利用用Powerpoint展示资料[教师活动]下面请我们请不同阶段的工程师分别进行介绍工业合成氨的生产过程:[教师活动][设疑] [投影]第一阶段如何制备合成氨的原料气,工业合成氨时N2取自于什么物质?H2又来源于哪里?[学生活动]第一阶段工程师介绍(画报):1.氮气的制备:N2主要来源于空气(1)物理方法:将空气液化,蒸发分离出N2。
由于相对分子质量越大,分子间作用力越大,空气中所含气体的沸点N2<O2<CO2,因此,高压下将空气液化后,经减压蒸发,最先得到的是N2,然后还可以得到O2等。
此法是目前工业上制取N2和O2的主要方法。
(2)工业上所采用的化学方法:将空气中氧气与碳作用生成二氧化碳,用煤在空气中燃烧,除去O2,吸收CO2(如用氨水吸收制NH4HCO3)后,得到N2。
2.氢气的制备:主要来源于水和碳氢化合物,碳与水的作用或碳氢化合物与水的作用。
方法一:将水蒸气通过赤热的煤(或焦炭)层,使水蒸气与碳发生反应生成一氧化碳和氢气。
方法二:石油、天然气、焦炉气(炼焦厂副产的气体)、炼厂气(石油炼制厂副产的气体)等都含有大量的碳氢化合物,这些碳氢化合物在一定条件下,可以与氧气或水蒸气反应生成一氧化碳、二氧化碳和氢气。
[学生活动]试写出碳与水制氢气的化学方程式。
制取氢气的途径化学反应原理电解水制取氢气2H2O 2H2↑+O2↑由煤或焦炭制取氢气C+H2O H2+COCH4+H2O 3H2+CO 由天然气或重油制取氢气CH4+2H2O4H2+CO2板书:1.造气制备合成氨的气体原料[教师活动][设疑]合成氨原料的关键是什么?[学生活动]厂长团队:氮气可以从空气中获得,如何获得大量廉价的氢气,实现最大剩余价值?[学生活动][第一阶段工程师总结]原料制备路线的选择,应综合考虑资源、工艺、能耗、成本、环境等重要因素。
氮气主要来自于空气,主要是氢气,由电解水制氢气,电能消耗大,成本高,不适于制取大量的氢气,早期,主要以焦炭与水为原料生产水煤气以得到氢气,现在,已经可以使用各种不同的固态可燃物(煤和焦炭等)、液态可燃物(石油中提炼的石脑油和重油等)和气态可燃物(天然气、焦炉气等)作为制氢气的原料。
[设计意图]培养学生理论联系实际的能力,用实践检验理论。
[教师活动][设疑]在制取原料气的过程中往往会掺杂一些杂质,其中一些会使催化剂中毒,因此必须除去,这一过程就称为原料气的净化。
如何净化原料气?[设计意图]培养学生理论联系实际的能力,对工业的发展做出贡献。
[学生活动]第二阶段工程师介绍:原料气的净化处理(画报)(1)原料气净化的原因:除去某些杂质,防止使合成氨所用的催化剂中毒。
(2)用稀氨水吸收H2 S杂质:NH3·H2O+H2S=NH4HS+H2O(3)使CO变成CO2:CO+H2O=CO2+H2 (催化剂:Fe2O3和CuO)(4)用K2CO3吸收CO2:K2CO3+CO2+H2O=2KHCO3(5)最后,原料气还需进行精制处理,如用醋酸、铜和氨配制成的溶液来吸收CO、CO2、O2、H2S等少量有害气体。
[学生活动][第二阶段工程师总结]由于原料的不同,原料气的净化工艺和技术也不断改进。
板书:2.净化原料气净化和处理[设计意图]培养学生理论联系实际的能力,用实践检验理论。
[教师活动]净化后的原料气经过压缩机压缩至高压,进入氨合成塔合成和分离。
使氨气和氢气在高温高压和催化剂条件下合成氨,最后将合成后的混合气体液化分离出液态氨,并将剩余的氨气与氢气循环送回合成塔中进行反应。