水环境化学实验
- 格式:pdf
- 大小:969.68 KB
- 文档页数:25

养殖水环境化学水质调查报告一、调查目的(1)综合所学养殖水环境化学理论知识和实验分析技能,完成海水养殖区水质监测与评价。
(2)掌握渔业水域水质调查的基本程序。
二、调查内容与方法1、调查时间与地点地点:广东海洋大学西湖1号调查点经纬度:110.304512,21.157934时间:2023年12月30日上午9:00~10:002、调查项目与方法1现场测定项目1.1西湖水温测定1.1.1实验目的温度是水样的一个根底性指标,准确测量出水样的温度对养殖水体起着重要的作用。
1.1.2实验原理温度计液泡里的水银对温度变化很敏感,它会随着所接触温度的不同而伸缩。
1.1.3实验仪器和材料仪器:水银温度计、烧杯。
实验材料:西湖采集的水样。
1.1.4测定步骤挑选两个适合取水的位置,用烧杯从西湖内取出适量的水样,将温度计的液泡置于液面以下,待温度计的度数不再变化后,准确读出水样的温度并记录。
1.2西湖pH测定1.2.1实验目的水质中pH值的变化会影响藻类对氧气的摄入能力及动物对食物的摄取敏感度;会影响细胞膜转运物质的活性和速率,影响其正常代谢,进而对整个食物网产生影响。
1.2.2实验原理pH值是一个描述溶液酸碱性质的重要参数,用于评价溶液的酸碱程度,ph值越小,酸性越强;ph值越大,碱性越强;pH值为7时,为中性。
pH计是常用的测量pH值的仪器,它通过电极和在水溶液中的离子的作用产生电机势差,并将其显示为数字。
1.2.3实验仪器与试剂仪器:pH计、电极、烧杯、吸管、小勺。
试剂:氢氧化钠、盐酸、酸碱指示剂。
1.2.4测定步骤(1)测前准备1)将pH计接通电源并调节为标定状态。
2)取容量瓶并用纯净水冲洗干净。
3)用滴定管取一定数量的盐酸溶液并加入到容量瓶中,用同样的方法加入氢氧化钠溶液。
4)使用第三步配置的酸碱溶液,检验pH计是否正常工作。
(2)开始实验1)用烧杯从西湖中取水。
2)把PH计的电极插入容量瓶中的溶液内,并轻轻搅拌10秒。


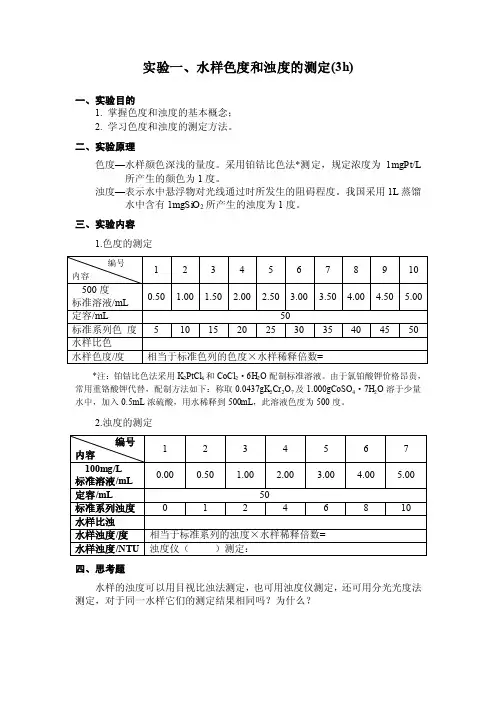
实验一、水样色度和浊度的测定(3h)一、实验目的1. 掌握色度和浊度的基本概念;2. 学习色度和浊度的测定方法。
二、实验原理色度—水样颜色深浅的量度。
采用铂钴比色法*测定,规定浓度为1mgPt/L 所产生的颜色为1度。
浊度—表示水中悬浮物对光线通过时所发生的阻碍程度。
我国采用1L蒸馏水中含有1mgSiO2所产生的浊度为1度。
三、实验内容1.色度的测定编号1 2 3 4 5 6 7 8 9 10 内容500度0.50 1.00 1.50 2.00 2.50 3.00 3.50 4.00 4.50 5.00 标准溶液/mL定容/mL 50标准系列色度 5 10 15 20 25 30 35 40 45 50 水样比色水样色度/度相当于标准色列的色度×水样稀释倍数=*注:铂钴比色法采用K2PtCl6和CoCl2·6H2O配制标准溶液。
由于氯铂酸钾价格昂贵,常用重铬酸钾代替,配制方法如下:称取0.0437gK2Cr2O7及1.000gCoSO4·7H2O溶于少量水中,加入0.5mL浓硫酸,用水稀释到500mL,此溶液色度为500度。
2.浊度的测定编号1 2 3 4 5 6 7内容100mg/L0.00 0.50 1.00 2.00 3.00 4.00 5.00 标准溶液/mL定容/mL 50标准系列浊度0 1 2 4 6 8 10水样比浊水样浊度/度相当于标准系列的浊度×水样稀释倍数=水样浊度/NTU 浊度仪()测定:四、思考题水样的浊度可以用目视比浊法测定,也可用浊度仪测定,还可用分光光度法测定,对于同一水样它们的测定结果相同吗?为什么?实验二、水样酸度和碱度的测定(3h)一、目的和要求1. 掌握酸度和碱度的基本概念;2. 学习酸度和碱度的测定方法。
二、实验原理酸度—指水中含有能与强碱发生中和作用的物质的总和。
①OH- + H+ = H2O (pHeq=7.0)②OH- + H2CO3 = HCO3- + H2O(pHeq=8.3)③OH-+ HCO3- = CO32- + H2O(pHeq=10.8)(甲基橙为指示剂—无机酸度①;酚酞为指示剂—CO2酸度①②)碱度—指水中含有能与强酸发生中和作用的物质的总和。

水中氨氮的测定实验报告
实验目的:
本实验旨在通过一系列的实验操作,测定水样中的氨氮含量,从而了解水体的污染程度,并为环境保护和水质监测提供数据支持。
实验原理:
水中氨氮的测定主要采用氨氮蒸馏-滴定法。
首先,将水样中的氨氮与碱性介质反应生成氨气,然后将氨气蒸馏出来,并与酸性介质中的硼酸络合物一起滴定,最后根据滴定所需的硼酸溶液体积,计算出水样中的氨氮含量。
实验步骤:
1. 取适量水样,加入适量氢氧化钠溶液和氧化剂,使水样碱化和氧化。
2. 将碱化和氧化后的水样倒入氨氮蒸馏瓶中,加入适量硼酸-硫酸溶液,并接上蒸馏装置。
3. 开始蒸馏,将蒸馏瓶中的氨气蒸馏出来,并通过冷凝管收集到滴定瓶中。
4. 在滴定瓶中加入酚酞指示剂,然后开始滴定,直至出现颜色变化。
5. 记录滴定所需的硼酸溶液体积V,计算水样中的氨氮含量。
实验数据:
根据实验结果,我们得到了水样中的氨氮含量为X mg/L。
实验结论:
通过本次实验,我们成功测定了水样中的氨氮含量,为后续的环境保护和水质监测提供了重要的数据支持。
同时,我们也意识到了水体污染对环境和人类健康造成的潜在威胁,因此应加强对水质的监测和保护工作。
实验注意事项:
1. 实验过程中要注意安全,避免接触到有毒有害物质。
2. 实验操作要准确无误,避免实验结果的偏差。
3. 实验后要及时清洗实验器材,保持实验环境的整洁。
总结:
本实验通过氨氮蒸馏-滴定法测定水中氨氮含量,为环境保护和水质监测提供了重要数据支持。
希望通过我们的努力,能够净化水体,保护环境,让人们能够饮用更加清洁、健康的水源。


环境化学实验测试一、引言环境化学实验测试是一种重要的手段,用于评估化学物质在自然环境中的行为和效应。
通过环境化学实验测试,可以了解化学物质对土壤、水体和大气等环境介质的影响,为环境污染的防治提供科学依据。
本文将介绍环境化学实验测试的一般步骤和常用方法,以及如何准确地进行实验测试。
二、实验测试步骤1. 实验设计在进行环境化学实验测试前,必须进行详细的实验设计。
实验设计应包括实验目的、方法、实验步骤和数据分析等内容。
在实验设计阶段,需要考虑到实验所需的样品数量、实验条件和实验时间等因素。
2. 样品采集样品采集是环境化学实验测试的关键环节之一。
根据实验的需要,需要选择适当的采样方法和采样点,保证采集到具有代表性的样品。
采集的样品应尽可能避免受到外界因素的干扰,确保实验结果的准确性。
3. 实验操作在进行环境化学实验测试时,需要按照实验设计的要求进行实验操作。
实验操作应遵循严格的操作规程,确保实验过程的安全和可靠性。
实验设备和试剂要经过严格的检查和校准,以减小误差的产生。
4. 数据处理实验结束后,需要对实验所得的数据进行处理和分析。
数据处理包括数据整理、统计和图表绘制等工作。
通过数据处理,可以得到实验结果的定量描述,为后续的结果解释和应用提供依据。
三、常用实验测试方法1. 水质分析水质分析是环境化学实验测试中常用的方法之一。
常用的水质分析方法包括pH值测定、溶解氧测定、化学需氧量(COD)测定和氨氮测定等。
这些方法可以对水体的污染程度进行评估,为水质改善提供参考。
2. 气体检测气体检测是环境化学实验测试中用于评估大气污染的重要方法。
常用的气体检测方法包括气体色谱法、质谱法和红外光谱法等。
这些方法可以测定大气中各种有害气体的浓度,从而评估大气污染的情况。
3. 土壤分析土壤分析是环境化学实验测试中用于评估土壤污染的常用方法。
常用的土壤分析方法包括有机质含量测定、重金属含量测定和土壤酶活性测定等。
这些方法可以确定土壤中污染物的含量和对土壤质量的影响程度。


污水中酸度和碱度的测定一、目的和要求(1)了解酸度和碱度的基本概念。
(2)掌握酸度和碱度的测定方法。
二、原理水中酸度和碱度均是衡量水质的重要指标,现将它们的定义和测定方法简述如下:1.酸度酸度是指水中含有能与强碱发生中和作用的物质的总量,主要来自水样中存在的强酸、弱酸和强酸弱碱盐等物质。
酸度采用氢氧化钠标准溶液滴定水样测得。
通常把用甲基橙作为指示剂滴定的酸度(pH 4.3)称为甲基橙酸度或强酸酸度;用酚酞作为指示剂滴定的酸度(pH 8.3)称为酚酞酸度或总酸度。
2.碱度碱度是指水中含有能与强酸发生中和作用的全部物质,主要来自水样中存在的碳酸盐、重碳酸盐及氢氧化物等。
碱度可用盐酸标准溶液进行滴定,其反应为2OH H H O -++→323CO H HCO -+-+→ 322HCO H H O CO -++→+↑用酚酞作为指示剂的滴定结果称为酚酞碱度,表示氢氧化物已经中和,32CO -全部转化为3HCO -。
以甲基橙作为指示剂的滴定结果称为甲基橙碱度或总碱度。
通过计算可以求出相应的碳酸盐、重碳酸盐和氢氧根离子的含量,但对废水、污水等由于其组分复杂,这种计算是没有实际意义的。
酸度和碱度单位常用mg L 表示,现在常以碳酸钙的mg L 表示。
此时l mg L 的酸度或碱度相当于50mg L 的碳酸钙。
三、实验步骤 1.酸度的测定I)酚酞酸度取25.0mL 水样于250mL 锥形瓶中,加2滴酚酞指示剂,以0.020mol L 氢氧化钠溶液滴定至溶液粉红色不退,准确读出消耗氢氧化钠溶液的毫升数(1V =18.5mL )。
2)甲基橙酸度取25.0mL 水样于250mL 锥形瓶中,加入2滴甲基橙,用氢氧化钠溶液滴定至溶液呈黄色,准确读出消耗氢氧化钠溶液的毫升数(2V =11.7mL )。
2.碱度的测定吸取10.0mL 水样于250mL 锥形瓶中,加入2滴酚酞指示剂,以0.0200mol L盐酸滴定至溶液粉红色刚退去,准确读出消耗盐酸溶液的毫升数(3V =24.8mL ),随后再加入2滴甲基橙指示剂,继续用盐酸滴定至溶液橙红色,准确读出消耗盐酸的毫升数(4V =4.8mL )。

水环境化学实验指导一、银量法测定水体中的氯度实验目的:1、学习和掌握水体中氯离子含量的测定方法2、滴定指示剂的作用原理原理:在中性或弱碱性条件下用AgNO3滴定海水水样,以荧光黄钠盐-淀粉吸附指示剂指示滴定终点,终点时溶液由黄绿色转变为浅玫瑰红,用相同的方法滴定氯度标准液(NaCI或标准海水),从而计算水体的氯度。
二、实验用品:AgNO3标准溶液、荧光黄—淀粉指示剂、氯度标准溶液、250ml三角锥瓶、棕色酸式滴定管等。
三、配制:AgNO3标准溶液:取4.92克AgNO3 固体溶解于100 ml dd H2O中,棕色瓶保存;荧光黄—淀粉指示剂:(1)取50 ml dd H2O, 溶解NaOH 块0.2 g, 从中取10 ml 该溶液,加0.1 g 荧光黄,搅拌溶解,并逐步加稀HNO3 进行中和,当pH值为7.0时,最终溶液到100 ml.(2)淀粉溶液(10%), 将250 ml ddH2O中,加入25 g 可溶性淀粉,搅拌,加水后煮沸,冷却后即可。
(3)取(1)溶液12.5 ml + 250 ml 溶液(2)氯度的标准溶液:NaCl 16.37 g 溶解于500 ml dd H2O中,定容至500 ml , 即此溶液氯度值19.375实验步骤:一、AgNO3标准溶液的标定1、取氯度的标准溶液10 ml 于烧杯中,加几滴荧光黄—淀粉指示剂2、将AgNO3标准溶液加入到酸式滴定管中3、对烧杯中的氯度标准溶液进行滴定,记录开始,终止时的刻度读数,二者的差值为Vn(单位ml);注意烧杯中的颜色变化由黄绿色变为玫瑰红,即可。
校准因子f = 19.375/ Vn二、水样的测定准确移取水样10.00mL于三角锥瓶中,按步骤一)操作,其消耗AgNO3标准溶液的体积记为Vw。
3. 结果计算按下式计算海水氯度值CI‰=Vw· f +k =Vs+k氯度标准溶液的氯度值(本次实验为19.375),k—计算氯度的校正值(Vs为17‰左右时,k=0.05)。

海南大学《养殖水环境化学》综合实验报告题目:“海院路边水塘”水质综合评价实验组员: X X X 指导教师: X X X 专业:水产养殖时间:二〇一四年五月二十日一.实验背景水是鱼虾的唯一生存场所,在缸、池养殖水生植物和水生动物需要相当的学问。
目前水族行业的水处理产品严重制约着水族爱好者和经营者对水质的管理,全球有90%以上的观赏鱼虾养殖爱好者只能采用生活用水水源。
自来水的溶解氧、温度、硬度和地表水的标准有很大差异,直接应用于养殖导致观赏鱼虾和水生植物的健康保障值很低,通常要在容器里将水放两天后使水溶解氧达到和接近地表水。
中国也和全球其它国家一样执行地表水质标准,自来水除了水指标中的溶解氧外大部分水质用于景观养殖是标准的.无论家庭鱼虾缸及景观养殖观赏主要需要考虑以下六个方面的水质指标问题。
1.硬度;硬度问题也是衡量水质的大问题,大家都知道在玻璃杯中倒满水后放到阳光下让水在常态下自然蒸发,会发现当水蒸发完时玻璃杯内壁会有碳酸钙等复合物,就是这些物资决定着水的硬度,水中的碳酸钙在常态下很水随水分子蒸发试验表明水的硬度超过1800mg/L时,碳钙等复合物有相当数量是不容于水了,水分子吸收已经饱和,多余的形成了其它复合物质或沉淀,水的硬度越大对热带鱼虾有相应的危害程度。
硬度在国家地表水标准没有明确要求,自来水的生活用水标准是每毫升小于800mg/L,养殖用水碳酸钙越低越好。
热带观赏鱼虾400mg/L以下最适宜家庭鱼虾缸养殖观赏2.PH值; PH值问题是水中是很重要的数据,在国家地表水水质标准中表示酸度和碱度单位,国家标准是在6-9的范围内水族箱养殖应该是6.5-8是最好,因为是中性的水,其实6-9范围内都适用决大部分鱼虾种类的要求。
有少部分的观赏鱼虾在繁殖期间对PH值存在生理习性问题,但只要水的PH值在6-9范围内对鱼虾和水生植物的健康并没有危害性。
水中的生命凡是能够通过几百万年进化生存到现在的物种是具有一定程度适应性,否则是很难生存到现在。
水环境化学实验指导一、银量法测定水体中的氯度实验目的:1、学习和掌握水体中氯离子含量的测定方法2、滴定指示剂的作用原理原理:在中性或弱碱性条件下用AgNO3滴定海水水样,以荧光黄钠盐-淀粉吸附指示剂指示滴定终点,终点时溶液由黄绿色转变为浅玫瑰红,用相同的方法滴定氯度标准液(NaCI或标准海水),从而计算水体的氯度。
二、实验用品:AgNO3标准溶液、荧光黄—淀粉指示剂、氯度标准溶液、250ml三角锥瓶、棕色酸式滴定管等。
三、配制:AgNO3标准溶液:取4.92克AgNO3 固体溶解于100 ml dd H2O中,棕色瓶保存;荧光黄—淀粉指示剂:(1)取50 ml dd H2O, 溶解NaOH 块0.2 g, 从中取10 ml 该溶液,加0.1 g 荧光黄,搅拌溶解,并逐步加稀HNO3 进行中和,当pH值为7.0时,最终溶液到100 ml.(2)淀粉溶液(10%), 将250 ml ddH2O中,加入25 g 可溶性淀粉,搅拌,加水后煮沸,冷却后即可。
(3)取(1)溶液12.5 ml + 250 ml 溶液(2)氯度的标准溶液:NaCl 16.37 g 溶解于500 ml dd H2O中,定容至500 ml , 即此溶液氯度值19.375实验步骤:一、AgNO3标准溶液的标定1、取氯度的标准溶液10 ml 于烧杯中,加几滴荧光黄—淀粉指示剂2、将AgNO3标准溶液加入到酸式滴定管中3、对烧杯中的氯度标准溶液进行滴定,记录开始,终止时的刻度读数,二者的差值为Vn(单位ml);注意烧杯中的颜色变化由黄绿色变为玫瑰红,即可。
校准因子f = 19.375/ Vn二、水样的测定准确移取水样10.00mL于三角锥瓶中,按步骤一)操作,其消耗AgNO3标准溶液的体积记为Vw。
3. 结果计算按下式计算海水氯度值CI‰=Vw· f +k =Vs+k氯度标准溶液的氯度值(本次实验为19.375),k—计算氯度的校正值(Vs为17‰左右时,k=0.05)。
实验一、酸碱标准容液的配制及标定废水酸度的测定一、目的1. 掌握酸、碱标准溶液的配制与标定方法。
2. 掌握滴定操作.3. 了解酸度的基本概念;掌握水样酸度的测定方法二、原理用直接法配标准溶液的物质,需符合①纯度达到一定要求;②组成与化学式符合;③稳定等三个条件。
市售的盐酸,氢氧化钠不能满足上述要求,因此采用间接法配制盐酸,氢氧化钠标准溶液,然后用基准物进行标定。
NaOH溶液可用邻苯二甲酸氢钾标定,由于邻苯二甲酸的Ka=2.9x 10-6,化学计量点附近的pH突跃与酚酞的变色范围重合,故可用酚酞为指示剂,HCl溶液可用碳酸钠标定,用甲基橙做指示剂.标定了碱或酸的浓度后,另一溶液的浓度也可根据酸与碱溶液滴定的体积比计算得出。
在水中,由于溶质的解离或水解(无机酸类,硫酸亚铁和硫酸铝等)而产生的氢离子,与碱标准溶液作用至一定pH值所消耗的量,定为酸度。
酸度数值的大小,随所用指示剂指示终点pH值的不同而异。
滴定终点的pH值有两种规定,即8.3和3.7。
用氢氧化钠溶液滴定到pH8.3(以酚酞作指示剂)的酸度,称为“酚酞酸度。
又称总酸度,它包括强酸和弱酸。
用氢氧化钠溶液滴定到pH3.7(以甲基橙为指示剂)的酸度,称为“甲基橙酸度”,代表一些较强的酸。
三、仪器1. 称量瓶2. 250 ml锥形瓶3. 50ml滴定管四、试剂1. 无二氧化碳水:pH不低于6.0的蒸馏水,如蒸馏水的pH较低,应蒸沸15分钟,加盖后冷却至室温。
2. 酚酞指示剂:称取0.5克酚酞,溶于50毫升95%乙醇中,再加入50毫升水。
3. 甲基橙指示剂:称取0.05克甲基橙,溶于100毫升水中。
4. 无水碳酸钠:优级纯5. 邻苯二甲酸氢钾:优级纯。
五、步骤1.0.1mol/L盐酸及0.1mol/L氢氧化钠溶液的配制0.1mol/L盐酸溶液的配制:用清洁量筒量取纯浓盐酸(比重1.19)4.3毫升,倒入清洁的试剂瓶中,用蒸馏水稀释至500毫升,以玻塞塞住瓶口,充分摇匀,贴上标签。
第十章污染物的毒性与毒性实验第一节毒性作用与毒性试验一毒性作用的一些基本概念1.毒物与毒性毒物:在一定条件下,较小浓度或剂量就能引起生物体功能性或器质性损伤的化学物质,或剂量虽微,但积累到一定量,就能干扰或破坏生物机体正常生理功能,引起暂时或永久性的病理变化,甚至危及生命的化学物质。
毒性:毒物对生物引起损害的能力称为毒物的毒性。
一种化合物的毒性,与它进入生物体的数量(剂量)、方式和接触时间有关。
2. 毒物浓度(剂量)与毒性效应效应:毒物作用于生物体引起生物个体发生的生物学变化。
反应:毒物作用于生物群体后产生某种效应的生物个体数量在生物群体中所占的比率。
3. 有效浓度(剂量)与致死浓度(剂量)(1)致死浓度(LC lethal concentration)绝对致死浓度(LC100):在一定时间内引起所观察生物个体全部死亡的水中化合物的最低浓度。
半致死浓度(LC50)致死浓度需要明确时限24h LC50(2) 耐受限度(TL tolerance limit)以存活比率为观察指标。
可用于毒物和非毒物(如温度)。
TLm 中间耐受限度:50%个体存活,50%个体死亡。
用于毒物时TLm =LC50.96 h TL10 = 96 h LC90(3)有效浓度(EC efficient concentration)当毒性试验不以试验生物的死亡作为反应指标,而是以通过测定或观察生物对毒物的某种特定效应,如动物失去平衡、畸形、酶活为指标,以EC反映毒物对试验生物的毒性。
24h EC10 : 引起10%的试验生物产生某一特定效应的毒物浓度;或使受试生物群体的某效应指标的平均值发生10%差异。
48h EC10IC50(半数抑制浓度): 特指能引起50%受试生物某种效应被抑制的毒物浓度。
(4)最大允许毒物浓度(MATC)与安全浓度(SC)MATC(maximum allowable toxicant concentration): 最大允许的对受试生物没有明显影响的毒物浓度。
环境化学实验知识点总结一、环境化学实验的基本知识点1. 环境化学基本概念环境化学是研究环境中的化学现象及其影响的科学。
它主要包括环境中的化学物质的组成、性质、分布和迁移转化规律。
环境化学实验是研究环境化学问题的重要手段。
2. 环境化学实验的基本原理环境化学实验主要涉及到物质的性质、化学反应过程和环境污染物的检测和分析。
在实验中,应遵循化学反应原理、仪器分析原理和环境监测原理,保证实验的准确性和可靠性。
3. 环境化学实验的基本内容环境化学实验的基本内容包括化学物质的性质、化学反应过程、环境污染物的检测和分析等。
具体实验内容包括:氧化还原反应实验、酸碱中和反应实验、离子交换实验、环境污染物检测实验等。
4. 环境化学实验的基本技术环境化学实验所需的基本技术包括:化学实验技术、仪器分析技术、环境监测技术等。
在实验中,应熟练掌握各种实验技术,保证实验的顺利进行。
二、环境化学实验的常用技术1. 化学实验技术化学实验技术是进行环境化学实验的基本技术。
包括:物质的称量、溶液的调配、化学反应的进行、沉淀的制备、溶液的过滤、溶液的蒸发等。
在实验中,应严格按照实验操作规程进行,确保实验的准确性和可靠性。
2. 仪器分析技术仪器分析技术是进行环境化学实验的重要技术之一。
包括:色谱分析技术、质谱分析技术、光谱分析技术等。
在实验中,应适用合适的仪器进行分析,保证实验结果的准确性和可靠性。
3. 环境监测技术环境监测技术是进行环境化学实验的重要技术之一。
包括:空气质量监测技术、水质监测技术、土壤监测技术等。
在实验中,应熟练掌握各种监测技术,确保环境监测数据的准确性和可靠性。
三、环境化学实验的应用1. 环境监测环境化学实验在环境监测中起着重要作用。
通过实验可以对环境中的化学物质进行检测和分析,了解环境中的污染物质的分布和浓度,为环境保护工作提供重要依据。
2. 环境治理环境化学实验在环境治理中也起着重要作用。
通过实验可以对环境中的污染物质进行定量分析,为制定环境治理措施提供科学依据,指导环境污染物的减排和治理工作。
《水质化学需氧量的测定重铬酸盐法》(HJ 828—2017)的实验室方法验证1. 引言1.1 研究背景水质化学需氧量(COD)是一种用于衡量水体有机和无机污染物总量的重要指标。
COD值的高低直接影响水体的水质状况,对于环境保护和饮用水安全具有重要意义。
测定COD值的方法有很多种,其中重铬酸盐法是较为常用的一种方法之一。
重铬酸盐法是利用重铬酸钠(K2Cr2O7)氧化有机物,然后通过化学计量确定被氧化的有机物量的方法。
这种方法具有操作简便、精度高的特点,被广泛应用于水质检测领域。
在实验室中,准确测定水样中的COD值对于监测水质污染和评估环境风险至关重要。
本实验旨在验证《水质化学需氧量的测定重铬酸盐法》(HJ 828—2017)这一标准的准确性和可靠性,以确保水质监测工作的准确性和实用性。
通过此次实验,我们将对该方法进行实验验证和分析,为实际水质检测工作提供参考依据。
1.2 研究目的本次实验的研究目的是验证《水质化学需氧量的测定重铬酸盐法》(HJ 828—2017)这一实验室方法的准确性和可靠性。
需氧量作为衡量水体中有机污染物含量的重要指标,对于环境监测和水质评价具有重要意义。
本实验旨在通过对水样中有机物氧耗量的测定,验证该实验方法在实际应用中的稳定性和精确度,为今后的水质监测工作提供科学依据和参考。
通过本次实验的研究,可以进一步了解该实验方法的适用范围和具体操作步骤,为未来的实验操作和数据解读提供支持。
通过比较实验结果与标准值的偏差情况,评估该方法的准确性和可靠性,为其在实际水质监测中的应用提供科学依据。
通过本次实验的研究,可以为水质监测工作提供参考和建议,为保护水环境和维护人类健康作出贡献。
2. 正文2.1 实验设计实验设计是本次实验的重要部分,可以确保实验过程的顺利进行及数据的准确性。
在本实验中,我们将根据《水质化学需氧量的测定重铬酸盐法》(HJ 828—2017)的要求设计实验流程。
我们需要准备好所有实验所需的材料和仪器,确保实验过程中不会出现缺乏材料或设备的情况。