2020年高考人教版化学一轮专项突破18 压强平衡常数Kp的计算方法
- 格式:ppt
- 大小:1.24 MB
- 文档页数:18
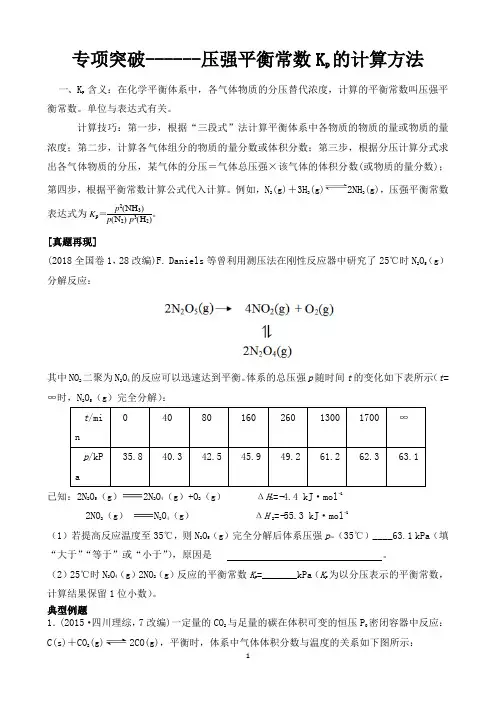
专项突破------压强平衡常数K p 的计算方法一、K p 含义:在化学平衡体系中,各气体物质的分压替代浓度,计算的平衡常数叫压强平衡常数。
单位与表达式有关。
计算技巧:第一步,根据“三段式”法计算平衡体系中各物质的物质的量或物质的量浓度;第二步,计算各气体组分的物质的量分数或体积分数;第三步,根据分压计算分式求出各气体物质的分压,某气体的分压=气体总压强×该气体的体积分数(或物质的量分数);第四步,根据平衡常数计算公式代入计算。
例如,N 2(g)+3H 2(g)2NH 3(g),压强平衡常数表达式为K p=p 2(NH 3)p (N 2)·p 3(H 2)。
[真题再现](2018全国卷1,28改编)F. Daniels 等曾利用测压法在刚性反应器中研究了25℃时N 2O 5(g )分解反应:其中NO 2二聚为N 2O 4的反应可以迅速达到平衡。
体系的总压强p 随时间t 的变化如下表所示(t =∞时,N 2O 5(g )完全分解):已知:2N 2O 5(g )2N 2O 4(g )+O 2(g ) ΔH 1=−4.4 kJ ·mol −1 2NO 2(g )N 2O 4(g ) ΔH 2=−55.3 kJ ·mol −1(1)若提高反应温度至35℃,则N 2O 5(g )完全分解后体系压强p ∞(35℃)____63.1 kPa (填“大于”“等于”或“小于”),原因是 。
(2)25℃时N 2O 4(g )2NO 2(g )反应的平衡常数K p =_______kPa (K p 为以分压表示的平衡常数,计算结果保留1位小数)。
典型例题1.(2015·四川理综,7改编)一定量的CO 2与足量的碳在体积可变的恒压P 0密闭容器中反应:C(s)+CO 2(g)2CO(g),平衡时,体系中气体体积分数与温度的关系如下图所示:已知:气体分压(p分)=气体总压(p总)×体积分数。

化学气压平衡常数计算公式化学气压平衡常数是描述气相和液相之间达到平衡时的压力关系的重要物理量。
在化学反应中,气相和液相之间的平衡常数可以帮助我们了解反应的进行程度以及平衡时的压力情况。
在本文中,我们将探讨化学气压平衡常数的计算公式以及其在化学反应中的应用。
化学气压平衡常数通常用Kp表示,其计算公式可以表示为:Kp = (pA)^m (pB)^n。
其中,pA和pB分别代表反应物A和B的分压,m和n分别代表反应物A和B的摩尔数。
在这个公式中,Kp的值可以用来描述气相和液相之间的平衡状态。
当Kp大于1时,表示产物的分压较大,反应向产物方向进行;当Kp小于1时,表示反应物的分压较大,反应向反应物方向进行;当Kp等于1时,表示反应物和产物的分压相等,反应处于平衡状态。
在实际应用中,我们可以通过实验数据来计算Kp的值。
首先,我们需要确定反应物和产物的摩尔数以及其分压。
然后,根据上述的计算公式,我们可以得到Kp的值。
通过比较Kp与1的大小关系,我们可以判断反应的进行程度以及平衡时的压力情况。
除了通过实验数据来计算Kp的值外,我们还可以通过热力学数据来计算Kp。
根据热力学原理,我们可以利用反应物和产物的标准生成焓以及反应物和产物的摩尔数来计算Kp的值。
这种方法可以帮助我们在没有实验数据的情况下,预测反应的进行程度以及平衡时的压力情况。
化学气压平衡常数的计算公式在化学反应中具有重要的应用价值。
通过计算Kp的值,我们可以了解反应的进行程度以及平衡时的压力情况,从而指导实际生产过程中的操作。
此外,化学气压平衡常数的计算公式也为化学反应的研究提供了重要的理论基础,有助于深入理解反应机理以及平衡原理。
在实际应用中,化学气压平衡常数的计算公式也可以帮助我们优化反应条件,提高反应的产率和选择性。
通过调整反应物和产物的摩尔数以及温度和压力等条件,我们可以控制反应的进行程度,从而实现对产物的精确控制。
这对于化工生产过程中的产品质量和产量具有重要的意义。
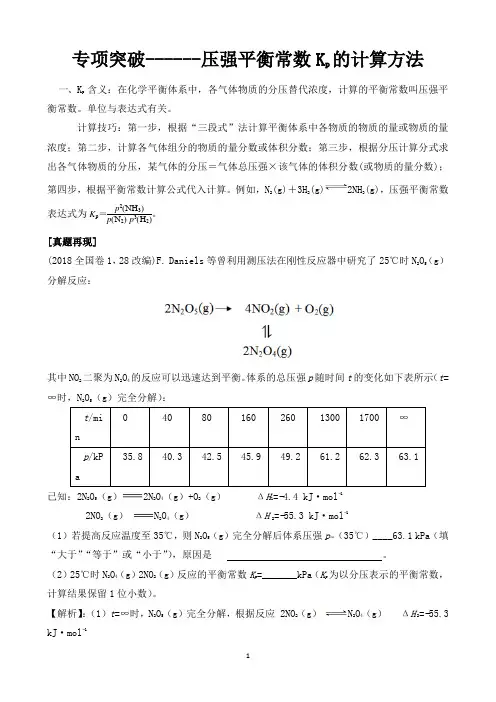
专项突破------压强平衡常数K p 的计算方法一、K p 含义:在化学平衡体系中,各气体物质的分压替代浓度,计算的平衡常数叫压强平衡常数。
单位与表达式有关。
计算技巧:第一步,根据“三段式”法计算平衡体系中各物质的物质的量或物质的量浓度;第二步,计算各气体组分的物质的量分数或体积分数;第三步,根据分压计算分式求出各气体物质的分压,某气体的分压=气体总压强×该气体的体积分数(或物质的量分数);第四步,根据平衡常数计算公式代入计算。
例如,N 2(g)+3H 2(g)2NH 3(g),压强平衡常数表达式为K p=p 2(NH 3)p (N 2)·p 3(H 2)。
[真题再现](2018全国卷1,28改编)F. Daniels 等曾利用测压法在刚性反应器中研究了25℃时N 2O 5(g )分解反应:其中NO 2二聚为N 2O 4的反应可以迅速达到平衡。
体系的总压强p 随时间t 的变化如下表所示(t =∞时,N 2O 5(g )完全分解):已知:2N 2O 5(g )2N 2O 4(g )+O 2(g ) ΔH 1=−4.4 kJ ·mol −1 2NO 2(g )N 2O 4(g ) ΔH 2=−55.3 kJ ·mol −1(1)若提高反应温度至35℃,则N 2O 5(g )完全分解后体系压强p ∞(35℃)____63.1 kPa (填“大于”“等于”或“小于”),原因是 。
(2)25℃时N 2O 4(g )2NO 2(g )反应的平衡常数K p =_______kPa (K p 为以分压表示的平衡常数,计算结果保留1位小数)。
【解析】:(1)t =∞时,N 2O 5(g )完全分解,根据反应 2NO 2(g ) N 2O 4(g ) ΔH 2=−55.3kJ ·mol −1升高温度,平衡逆向移动,气体的物质的量增多,在刚性(恒容)容器中气体的压强增大。

反应得平衡常数kp
平衡常数 K_p 是用来描述化学反应在平衡状态下反应物和生成
物浓度之间的关系的一个数值。
它可以通过反应物和生成物的浓度
来计算,公式为 K_p = ([C]^c [D]^d) / ([A]^a [B]^b),其中[A]、[B]、[C]、[D] 分别表示反应物 A、B 和生成物 C、D 的浓度,a、b、c、d 分别表示它们的摩尔系数。
K_p 的数值越大,表示反应在平衡时生成物浓度较高;反之,
数值越小,表示反应在平衡时反应物浓度较高。
当 K_p = 1 时,表
示反应物和生成物的浓度相等。
K_p 的数值还可以告诉我们反应的
趋势,如果 K_p > 1,则反应向生成物的方向进行;如果 K_p < 1,则反应向反应物的方向进行。
需要注意的是,K_p 的数值与反应的速率无关,它只与反应在
平衡状态下的浓度有关。
K_p 的值受到温度的影响,随着温度的变化,K_p 的数值也会发生变化。
根据 Le Chatelier 原理,温度升
高会使 K_p 值变大,反应向生成物的方向进行;温度降低则会使
K_p 值变小,反应向反应物的方向进行。
除了 K_p,还有 K_c、K_w 等常数用来描述不同类型的化学反
应。
K_c 是在气相反应中用来描述反应物和生成物浓度之间的关系的常数;K_w 是用来描述水的自离解反应(水的离子化)的常数。
总结来说,平衡常数 K_p 是一个重要的化学概念,通过它我们可以了解反应在平衡状态下反应物和生成物的浓度关系,以及反应的趋势。
它是根据反应物和生成物的浓度计算得出的,并受到温度的影响。

平衡常数kp与分压的关系
平衡常数Kp是描述气相和溶液中物质浓度之间平衡的关系的一
个参数。
它可以用来描述气体在溶液中的溶解度,也可以用来描述
气相反应的平衡情况。
Kp与分压的关系可以通过气相反应的平衡式
来解释。
对于一个简单的气相反应aA + bB ⇌ cC + dD,其平衡常数Kp
可以表示为Kp = (PC)^c (PD)^d / (PA)^a (PB)^b,其中PA、PB、PC和PD分别表示反应物A、B和生成物C、D的分压。
从这个公式可以看出,Kp与分压之间存在着直接的关系。
当Kp
大于1时,表示生成物的分压较大,反应偏向生成物的一侧;当Kp
小于1时,表示反应物的分压较大,反应偏向反应物的一侧;当Kp
等于1时,表示反应物和生成物的分压相等,反应处于平衡状态。
另外,Kp与分压的关系还可以通过Le Chatelier原理来解释。
根据Le Chatelier原理,当对一个处于平衡状态的系统施加压力时,系统会偏向减小压力的方向。
因此,当增加某一物质的分压时,系
统会偏向减少该物质的分压的方向,以达到新的平衡状态,从而保
持Kp不变。
总之,Kp与分压之间存在着密切的关系,通过平衡常数Kp可以揭示气相反应的平衡情况,以及分压对反应平衡的影响。
这种关系对于理解气相反应的平衡性质和工业生产中的气相反应过程具有重要意义。

平衡常数kp的公式平衡常数Kp是化学反应平衡研究中一个最重要的参数,它描述了反应的变化方向和变化速率。
其计算方式包括Le Chatelier-Braun 模型,Hess定律、Gibbs-Duhem方程和Gibbs-Helmholtz方程。
Le Chatelier-Braun模型的Kp可以用以下公式来表示:Kp =iSi/ΠPi,其中,Πi表示i涉及的反应过程,ΠSi表示反应式最终状态下物质浓度的乘积,ΠPi表示反应式初始状态下物质浓度的乘积。
Hess定律Kp可以用以下公式表示:Kp = exp(-ΔG/RT),其中,ΔG表示反应过程的标准反应焓变,R表示气体常数,T表示热力学温度。
Gibbs-Duhem方程Kp可以用以下公式表示:Kp = exp(-ΔG/RT+ΔV/RT),其中,ΔV表示标准反应体积变化。
Gibbs-Helmholtz方程Kp可以用以下公式表示:Kp = exp(-ΔG/RTΔS/R),其中,ΔS表示标准反应熵变。
在计算Kp时,需要注意反应中温度、压强和物质浓度的影响。
物质浓度是计算Kp值的最重要因素之一,需要严格准备试验以获得准确的浓度数据。
此外,还需要测定反应过程的温度和压强,以确定Kp的准确性。
Kp的计算不仅受到温度、压强和物质浓度的影响,还受到溶剂的影响。
溶剂的质量浓度和类型会影响Kp的大小,因此,在计算Kp 值时必须精确选择溶剂。
Kp计算的结果可以通过实验测量获得。
一般来说,Kp计算结果与实验测量结果有一定的差异。
这是由于反应受到环境条件影响,导致实验测量中反应状态与理论计算状态有微小差别。
由于Kp描述了反应的变化方向和变化速率,因此,平衡常数Kp 的计算是化学反应中至关重要的参数,在实验室设计、工业生产等各个领域都可以看到它的身影。
此外,Kp的计算还可以用于研究反应的可逆性,从而判断该反应的活化能和反应热。
以上就是关于平衡常数Kp的公式的相关介绍,希望通过本文的介绍,能够让读者对平衡常数Kp有更深入的理解。

化学平衡常数Kp化学平衡常数Kp是化学反应在气相中的平衡常数。
它描述了反应物和生成物的浓度之间的关系,决定了反应的方向和程度。
Kp的大小可以告诉我们反应的平衡位置,从而预测化学反应的结果。
在本文中,我们将详细讨论Kp的计算和应用,并解释如何利用Kp确定反应方向。
首先,化学平衡常数Kp定义为化学反应中反应物和生成物的分压之间的比值,每个物质的分压用大写字母表示:Kp = (P生成物A)^m * (P生成物B)^n / (P反应物C)^x * (P反应物D)^y其中,生成物A和B的系数为m和n,反应物C和D的系数为x和y。
化学平衡常数Kp是一个纯量,没有单位。
要计算Kp,首先需要知道化学反应的平衡方程式。
平衡方程式告诉我们反应物和生成物之间的摩尔比例。
然后,根据反应物和生成物的分压,可以计算Kp的值。
Kp的值越大,说明反应离平衡位置越近;反之,Kp的值越小,说明反应离平衡位置越远。
Kp的值对于确定反应方向非常重要。
如果Kp大于1,意味着反应物浓度相对较高,有利于生成物的形成,反应是正向的;如果Kp小于1,意味着反应物浓度相对较低,有利于反应物的形成,反应是逆向的。
化学平衡常数Kp还可以用于计算反应物和生成物的浓度。
根据Kp的定义,可以重排方程式:Kp = (P生成物A)^m * (P生成物B)^n / (P反应物C)^x * (P反应物D)^y可以得到:(P生成物A)^m * (P生成物B)^n = Kp * (P反应物C)^x * (P反应物D)^y通过分别计算反应物和生成物的分压,可以用上述公式计算出它们的浓度。
另外,当反应体系发生温度或压力变化时,Kp的值也会发生变化。
根据Le Chatelier原理,增加温度会使反应向反应物方向移动,降低温度会使反应向生成物方向移动。
而增加压力会使反应向生成物方向移动,降低压力会使反应向反应物方向移动。
因此,改变温度或压力可以改变Kp的值,从而改变反应的平衡位置。


在气相反应的化学平衡中,常见考查方式是用浓度c、物质的量n和浓度平衡常数K c等进行计算,但近几年高考化学逐渐延伸到用气体总压p、分压p(B)和压力平衡常数K p等进行计算,在高考复习时不能忽视。
下面我们一起来了解一下压力平衡常数K p及其相关计算方法。
一、气体的分压p(B)1.混合气体中的气体B的分压:p(B)=p·x(B)式中x(B)为气体B的体积分数或物质的量分数,p为混合气体在相同温度下的总压强。
2.分压定律:混合气体的总压等于相同温度下各组分气体的分压之和。
p(A) +p(B)+p(C)+p(D) +···=p3.气体的分压之比等于其物质的量之比:4.某气体的分压p(B)与总压之比等于其物质的量分数:二、压力平衡常数K p1.压力平衡常数K p一定温度下,气相反应:m A(g) + n B(g) e C(g) + f D(g)达平衡时,气态生成物分压幂之积与气态反应物分压幂之积的比值为一个常数,称为该反应的压力平衡常数,用符号K p 表示,K p的表达式如下:单位:,K p只受温度影响。
2.压力平衡常数K p与总压p、气体体积分数x的关系一定温度下,刚性密闭容器中发生气相反应:m A(g) + n B(g)e C (g) + f D(g)达到平衡时,令A、B、C、D的分压分别为p(A)、p(B)、p(C)、p(D),A、B、C、D的体积分数为x(A)、x(B)、x(C)、x(D),体系总压p=p(A)+p(B)+p(C)+p(D)。
m+n=e+f时,,3.浓度平衡常数K c与压力平衡常数K p的关系根据理想气体状态方程PV=nRT,可推知:三、计算模式——三段式一定温度下,向刚性密闭容器中充入A、B两种气体,发生气相反应:m A(g) + n B(g)e C(g) + f D(g)令A、B起始分压分别为p(A)、p(B),达到平衡后A气体分压的减小值为m x。

化学平衡常数kp公式化学平衡常数KP公式是描述气态反应体系的一个关键公式,也是化学反应研究中非常重要的一环。
它描述了反应的前后浓度及压力之间的关系,同时也反映了气态反应体系中各种反应物和产物的相对数量。
概述KP公式的全称是气相反应体系的平衡常数,它通常被表示为KP。
它用于描述气态反应体系中各种反应物和产物之间浓度及压力的关系,即反应系数和平衡系数的比。
KP 值可以通过测定反应物和产物的压力或浓度来确定。
KP值越大,说明产物相对于反应物的浓度更高,反应越偏向产物一侧。
当KP值等于1时,反应物与产物的浓度相等,此时反应处于平衡状态。
如果KP值小于1,反应趋于向反应物方向转化,如果KP值大于1,反应趋向于向产物方向转化。
公式KP公式可用下列等式表示:KP = (pA)^a x (pB)^b / (pC)^c x (pD)^d式中,a,b,c,d分别表示反应物和产物的摩尔系数,pA、pB、pC、pD分别表示反应物和产物在平衡时的分压,KP表示平衡常数。
还可以将KP用浓度来表示:KP = [C ]c x [D]d / [A]a x [B]b式中,[A],[B],[C],[D] 分别表示反应物和产物的摩尔浓度,a,b,c,d分别表示反应物和产物的摩尔系数,KP表示平衡常数。
相互作用KP值可以解释反应经过的方向,它可以通过下列这个方程式来确定化学反应的平衡:产品 / 反应物 = (pC / pA)^c x (pD / pB)^d / (pA / pC)^a x (pB / pD)^b公式的右边为KP值,左边的表达式通过计算比值,并由各种化学式所表示的系数来描述反应的前后状态。
应用实例为了更好地理解KP公式的应用,我们举个例子,假设有下列气态化学方程式:N2 + 3H2 ↔ 2NH3想象这个方程仅仅是一种理论反应,该方式表示氮气(N2)和氢气(H2)如何合成氨气(NH3)。
在反应开始时,只有N2和 H2反应。
当反应达到平衡状态时,即产品和反应物的比率已经没有变化。

化学平衡常数压强表达式
在化学平衡中,对于气体反应物和产物,可以使用分压来表示化学平衡常数。
对于一般的气体反应:
aA(g) + bB(g) ⇌ cC(g) + dD(g)
其化学平衡常数Kp可以表示为:
Kp = (P_C^c × P_D^d) / (P_A^a × P_B^b)
其中,P_A、P_B、P_C和P_D分别表示A、B、C和D的分压。
对于纯气体反应,即反应物和产物都是气体,化学平衡常数Kp就等于反应的总压强P的某个幂次:
Kp = P^(Δn)
其中,Δn = (c+d)-(a+b),表示气体分子总数的变化量。
对于固体或液体参与的反应,由于固体和液体的分压恒定,因此它们的分压项可以省略。
通过压强表达式,我们可以计算出在特定条件下反应的化学平衡常数,从而判断反应的平衡方向和程度。
化学反应的平衡常数与Kp值化学反应是指在化学反应物(反应物)之间发生的转化过程,产生新的化学物质(生成物)。
在化学反应中,反应物与生成物之间的摩尔比例关系可以用平衡常数(K)来描述。
平衡常数是一个无单位的数值,表示了在给定温度下反应物与生成物的浓度之比。
Kp值则是一个特殊情况下的平衡常数,用于描述气体反应体系中气体分压的比值。
一、平衡常数(K)1. 平衡常数的定义平衡常数是指当一个反应系统达到平衡时,反应物浓度和生成物浓度之间的比例关系。
对于以下一般反应方程式:aA + bB ↔ cC + dD其中,A、B、C、D分别代表相应的化学物质,a、b、c、d为它们的摩尔系数。
平衡常数(K)可通过以下公式计算:K = [C]^c[D]^d / [A]^a[B]^b方括号内的字母表示相应物质的浓度。
2. K的大小和反应的趋势a) 当K > 1时,表示生成物浓度较高,反应向生成物方向偏移。
b) 当K < 1时,表示反应物浓度较高,反应向反应物方向偏移。
c) 当K = 1时,表示反应物和生成物浓度处于相对平衡状态。
3. 影响K值的因素a) 温度:温度的改变会显著影响反应的平衡常数。
根据Le Chatelier 原理,提高温度会使平衡常数K减小(反向偏移),降低温度会使K 增加(正向偏移)。
b) 压力/浓度:在涉及气体的反应体系中,改变压强会影响到平衡常数。
提高压力(增加压强)会导致平衡常数K减小(反向偏移),降低压力会使K增加(正向偏移)。
c) 物质的浓度:改变反应物和生成物的初始浓度会导致平衡常数发生变化,但不会改变K值的大小。
相对平衡常数K而言,物质浓度的变化只会使反应达到平衡所需的时间发生变化。
二、Kp值Kp值是平衡常数的一种特殊情况,用于描述气体反应体系中气体分压之间的比值关系。
在包含气体物质的反应中,平衡常数K可以根据以下公式转化为Kp:Kp = pC^c pD^d / pA^a pB^b其中,pA、pB、pC、pD分别代表相应气体的分压。
压强平衡常数的计算公式压强平衡常数是化学平衡常数中的一种常数,在化学反应中起到非常重要的作用。
下面我们将详细介绍压强平衡常数的定义、计算公式以及如何利用它来研究化学反应。
1. 压强平衡常数的定义压强平衡常数可以简单地理解为,化学反应在不同压力下达到平衡时反应物和生成物的浓度比值的常数。
即在达到平衡的状态下,各组分的摩尔分数比等于Kp,其带有的物理意义是气体分压之比,这就是Kp。
2. 计算压强平衡常数的公式在计算压强平衡常数时,需要根据化学反应式写出平衡常数表达式,该式需要包括反应物和生成物压力之比,并根据各组分的物质量平衡关系,用化学式表示各组分的浓度。
压强平衡常数的公式如下:Kp = (pX)^m*(pY)^n/(pA)^l其中,pX、pY和pA分别代表反应物X、Y和生成物A的分压,m、n和l分别代表反应物X、Y和生成物A在化学平衡中的摩尔数。
3. 利用压强平衡常数研究化学反应利用压强平衡常数可以进行一些重要的研究,例如:(1)利用Kp可以计算反应的平衡常数。
当化学反应达到平衡时,压强平衡常数Kp是该反应的平衡常数之一。
(2)利用Kp可以计算反应物和生成物在不同温度下的浓度比。
当Kp已知时,可以通过Kp公式,计算出反应物和生成物在不同温度下的浓度比。
(3)利用Kp可以计算产率。
在实际反应过程中,产物的产率受到一些因素的影响,例如温度、反应速率等。
通过计算压强平衡常数和浓度比,可以计算出理论上可能的产物产率。
总之,压强平衡常数是化学反应中重要的物理量之一。
在研究化学反应方面,利用压强平衡常数可以对反应物和生成物的相互作用进行深入了解,并对反应的平衡性质进行研究。
化学平衡常数的计算公式化学平衡是指在化学反应过程中,反应物转化成产物的速度与产物转化成反应物的速度相等的状态。
平衡常数(K)是用来描述平衡状态下反应物和产物浓度之间的关系的数值。
计算化学平衡常数的公式取决于反应方程式的形式。
一、当反应是简单的惰性气体或溶液中的理想溶液之间的平衡时,计算平衡常数的公式如下:对于气体反应:aA(g) + bB(g) ⇄ cC(g) + dD(g)平衡常数公式为:Kp = (Pc^c * Pd^d) / (Pa^a * Pb^b)其中,P表示气体分压。
对于溶液中反应:aA(aq) + bB(aq) ⇄ cC(aq) + dD(aq)平衡常数公式为:Kc = ([C]^c * [D]^d) / ([A]^a * [B]^b)其中,[ ]表示溶液中物质的浓度。
二、当反应是气体反应中涉及到分压不明显的固体或液体时,可以使用摩尔浓度来计算平衡常数。
平衡常数的计算公式如下:对于气体反应:aA(g) + bB(g) ⇄ cC(g) + dD(g)平衡常数公式为:Kc = ( [C]^c * [D]^d ) / ( [A]^a * [B]^b * (RT)^(c+d-a-b) )其中,R是气体常数,T是温度,[ ]表示物质的摩尔浓度。
三、当反应涉及到溶质的活性系数时,需要引入活度来计算平衡常数。
平衡常数的计算公式如下:对于溶液中反应:aA(aq) + bB(aq) ⇄ cC(aq) + dD(aq)平衡常数公式为:Kc = ( aC * aD ) / ( aA * aB )其中,a表示溶质的活度。
四、当反应涉及到非均相平衡时,可以使用活度或者逸度来计算平衡常数。
平衡常数的计算公式如下:对于非均相反应:aA(s) + bB(s) ⇄ cC(s) + dD(g)平衡常数公式为:K = ( aC * aD ) / ( aA * aB * γC^c * γD^d )其中,γ表示非电离物质的逸度。
压强平衡常数K p的计算方法The Standardization Office was revised on the afternoon of December 13, 2020专项突破------压强平衡常数K p 的计算方法一、K p 含义:在化学平衡体系中,各气体物质的分压替代浓度,计算的平衡常数叫压强平衡常数。
单位与表达式有关。
计算技巧:第一步,根据“三段式”法计算平衡体系中各物质的物质的量或物质的量浓度;第二步,计算各气体组分的物质的量分数或体积分数;第三步,根据分压计算分式求出各气体物质的分压,某气体的分压=气体总压强×该气体的体积分数(或物质的量分数);第四步,根据平衡常数计算公式代入计算。
例如,N 2(g)+3H 2(g)2NH 3(g),压强平衡常数表达式为K p=p2(NH 3)p (N 2)·p 3(H 2)。
[真题再现](2018全国卷1,28改编)F. Daniels 等曾利用测压法在刚性反应器中研究了25℃时N 2O 5(g )分解反应:其中NO 2二聚为N 2O 4的反应可以迅速达到平衡。
体系的总压强p 随时间t 的变化如下表所示(t =∞时,N 2O 5(g )完全分解):已知:2N 2O 5(g )2N 2O 4(g )+O 2(g ) ΔH 1=− kJ ·mol −1 2NO 2(g )N 2O 4(g ) ΔH 2=− kJ ·mol −1(1)若提高反应温度至35℃,则N 2O 5(g )完全分解后体系压强p ∞(35℃) kPa (填“大于”“等于”或“小于”),原因是 。
(2)25℃时N 2O 4(g )2NO 2(g )反应的平衡常数K p =_______kPa (K p 为以分压表示的平衡常数,计算结果保留1位小数)。
典型例题1.(2015·四川理综,7改编)一定量的CO 2与足量的碳在体积可变的恒压P 0密闭容器中反应:C(s)+CO 2(g)2CO(g),平衡时,体系中气体体积分数与温度的关系如下图所示:已知:气体分压(p分)=气体总压(p总)×体积分数。