高中化学 2.3化学平衡常数及计算 新人教版选修4
- 格式:ppt
- 大小:499.00 KB
- 文档页数:5

课时 2.4 化学平衡常数及化学平衡计算【学习目标】1、掌握化学平衡常数的书写及化学平衡常数的应用2、掌握化学平衡中三段式计算的方法 【主干知识梳理】一、化学平衡常数1、定义:在一定温度下,当一个可逆反应达到平衡时,生成物浓度幂之积与反应物浓度幂之积的比值是一个常数。
这个常数就是该反应的化学平衡常数(简称平衡常数),用K 表示2、表达式:对于可逆反应:m A(g)+n B(g)p C(g)+q D(g))()()()(B c A c D c C c K n m q p ••= (固体和纯液体的浓度视为常数,通常不计入平衡常数表达式中) 3、化学平衡常数表示的意义(1)平衡常数数值的大小可以反映可逆反应进行的程度大小,K 值越大,反应进行越完全,反应物转化率越高,反之则越低(2)一般当K >105时,该反应进行得基本完全4、使用化学平衡常数应注意的问题(1)化学平衡常数只与温度有关,与反应物或生成物的浓度无关,与压强无关(2)反应物或生成物中有固体和纯液体存在时,由于其浓度可看做常数“1”而不代入公式CaCO 3(s)CaO(s)+CO 2(g) K== CO 2(g)+H 2(g) CO(g)+H 2O(l) K==(3)化学平衡常数是指某一具体反应的平衡常数。
若反应方向改变,则平衡常数改变。
若方程式中各物质的系数等倍扩大或缩小,尽管是同一个反应,平衡常数也会改变N 2+3H 22NH 3 K 1== 2NH 3N 2+3H 2 K 2== 21N 2+23H 2NH 3 K 3==5、化学平衡常数的应用(1)判断、比较可逆反应进行的程度:一般来说,一定温度下的一个具体的可逆反应:K 值 正反应进行的程度 平衡时生成物浓度 平衡时反应物浓度反应物转化率 越大 越大 越大 越小 越高越小 越小 越小 越大 越低(2) (3)判断正在进行的可逆反应是否达到平衡或反应进行的方向:对于可逆反应:mA(g)+nB(g)pC(g)+qD(g),在一定温度的任意时刻,反应物的浓度和生成物的浓度有如下关系:)()()()(B c A c D c C c Q n m q p c ••=,Q C 叫该反应的浓度商 ⎩⎪⎨⎪⎧Q c <K :反应向正反应方向进行,v 正>v 逆Q c =K :反应处于化学平衡状态,v 正=v 逆Q c >K :反应向逆反应方向进行,v 正<v 逆【练习1】1、判断正误(正确的打“√”,错误的打“×”)(1)平衡常数表达式中,可以是物质的任一浓度 ( )(2)催化剂能改变化学反应速率,也能改变化学平衡常数 ( )(3)化学平衡常数发生变化,化学平衡不一定发生移动 ( )(4)化学平衡发生移动,化学平衡常数不一定发生变化 ( )2、已知下列反应在某温度下的平衡常数:H 2(g)+S(s)H 2S(g) K 1 S(s)+O 2(g)SO 2(g) K 2则在该温度下反应H 2(g)+SO 2(g)O 2(g)+H 2S(g)的平衡常数为( )A .K 1+K 2B .K 1-K 2C .K 1×K 2D .K 1/K 23、在25 ℃时,密闭容器中X 、Y 、Z 三种气体的初始浓度和平衡浓度如下表,下列说法错误的是( )物质 X Y Z初始浓度/mol·L -1 0.1 0.2 0平衡浓度/mol·L -1 0.05 0.05 0.1A .反应达到平衡时,X 的转化率为50%B .反应可表示为X +3Y 2Z ,其平衡常数为1 600C .增大压强使平衡向生成Z 的方向移动,平衡常数增大D .改变温度可以改变此反应的平衡常数4、汽车尾气里含有的NO 气体是由内燃机燃烧时产生的高温引起氮气和氧气反应所致:N 2(g)+O 2(g)2NO(g) ΔH >0,已知该反应在2 404 ℃时,平衡常数K =6.4×10-3。


2-2-1化学平衡常数知识与技能:1.理解化学平衡常数的含义。
2.能利用化学平衡常数进行简单的计算。
过程与方法:1.通过化学平衡常数的计算教学,培养学生的计算能力。
2•通过对数据分析,培养学生分析、处理数据的能力,提高学生逻辑归纳能力。
情感、态度与价值观:通过对实验数据的分析,培养学生严谨求实、积极实践的科学作风。
JL:化学平衡常数表达式的书写、化学平衡常数的含义。
化学平衡常数的应用[攵习提问]什么叫化学平衡?化学平衡的特征有哪些?M[回答]化学平衡是是指在一定条件下的可逆反应里,正反应和逆反应的速率相等,反应体系中所有参加反应的物质的质量(溶液中表现为浓度)可以保持恒定的状态。
化学平衡的特征:(1)反应物和所有产物均处于同一反应体系屮,反应条件(温度、压强)保持不变。
(2)达到平衡时反应混合物屮各组分的浓度保持不变;由于化学平衡状态时反应仍在进行,故其是一种动态平衡。
达到平衡时正反应速率等于逆反应速率。
[过渡]尽管就这么几句话,但真正在学习中能否准确把握和处理好关于化学平衡的问题,还需大家对该概念及相关特征进行深入的理解。
化学平衡状态的特征,不仅包括上边大家冋答的那些,还有其他方面的特征,这就是今天咱们学习和讨论的主题一一化学平衡常数。
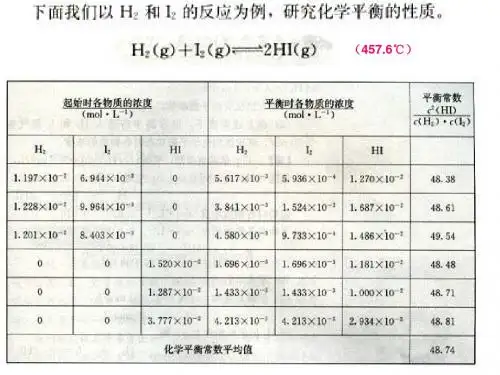
[板书]三、化学平衡常数[引导]请同学们阅读教材P28标题三下面的内容以及浓度关系数据表,分析并验算表中所给的数据,最后可以得到什么结论?[探究活动]阅读教材和P29表2—1,对表中数据进行观察并归纳。
[总结]一定温度下:_ c(HI )2^=C(H2)C(I2)[小结]在一定温度下,可逆反应无论是从正反应开始,还是从逆反应开始,又无论反应物起始浓度为多少,最后都能达到化学平衡。
这时生成物的浓度幕之积与反应物浓度幕之积的比是一个常数,这个常数叫做该反应的化学平衡常数,简称平衡常数,用符号K表示。
[板书]1.定义:在一定温度下,可逆反应达到平衡时,生成物的浓度幕之积与反应物浓度幕之积的比是一个常数,这个常数叫做该反应的化学平衡常数,简称平衡常数,用符号K表示。




