饱和蒸汽压力和温度的关系
- 格式:doc
- 大小:54.50 KB
- 文档页数:1

饱和蒸气压饱和蒸气压是一种与液体蒸发速率有关的物理性质。
它在很多领域都有着重要的应用,尤其在化学、物理和环境科学方面。
本文将详细介绍饱和蒸气压的概念、特性、测量方法以及应用领域。
旨在为读者提供对饱和蒸气压有深入了解的机会。
首先,我们来介绍一下饱和蒸气压的概念。
饱和蒸气压是指在一定温度下,液体和气体之间达到平衡时,液体表面上的蒸发速率与气体中的凝结速率相等时所对应的气体压强。
简单来说,就是液体蒸发时所产生的气体对环境施加的压力。
这个压力是与温度有关的,随着温度的升高,饱和蒸气压也会增加。
那么,饱和蒸气压与温度之间有何特性呢?首先,随着温度的升高,饱和蒸气压会逐渐增加,表现为一个正相关的关系。
这是因为随着温度升高,液体内部的分子运动增加,蒸发速率也相应增大,从而使液体表面上的蒸发分子数量增多,最终导致饱和蒸气压的增加。
其次,不同物质的饱和蒸气压与温度的关系不尽相同。
不同物质对应的饱和蒸气压-温度曲线呈现出不同的形状,有些物质的曲线比较陡峭,而有些物质的曲线则比较平缓。
测量饱和蒸气压的方法也有多种。
常用的方法是利用压力-温度关系来测量。
通过将液体置于封闭容器中,在不同的温度下测量容器内部的压力变化,就可以得到饱和蒸气压与温度的关系。
这种方法简单实用,适用于大部分液体的饱和蒸气压测量。
饱和蒸气压在很多领域都有着广泛的应用。
首先,在化学领域,饱和蒸气压是气相反应与液相反应之间的平衡条件之一。
通过控制饱和蒸气压,可以调节反应速率和平衡位置,进而实现对反应的控制。
其次,在物理领域,饱和蒸气压是气体溶解度的重要指标。
通过控制饱和蒸气压,可以实现气体的溶解度调节,这在溶液制备和分离过程中具有重要意义。
另外,在环境科学领域,饱和蒸气压也是水汽在大气中的重要参数之一。
了解饱和蒸气压可以帮助我们预测大气湿度,进而控制大气环境中的水分含量。
饱和蒸气压是一个在化学、物理和环境科学中应用广泛的概念。
它与温度密切相关,随着温度升高而增加。

饱和蒸汽压力与温度的关系
饱和蒸汽压力与温度的关系可以用饱和蒸汽表或蒸汽压力-温度关系图来表示。
在常见的水蒸汽条件下,饱和蒸汽压力随着温度的升高而增加。
这个关系可以用以下公式近似描述:P = exp(A-B/T),其中P为饱和蒸汽压力(单位为kPa或bar),T为绝对温度(单位为K),A和B是常数,通常用实验数据拟合得到。
例如,在常压条件下,水的饱和蒸汽压力随着温度的升高而增加,其关系如下表所示:
温度(℃)饱和蒸汽压力(kPa)。
0 0.611。
10 1.229。
20 2.338。
30 4.243。
40 7.376。
50 12.336。
60 19.933。
70 31.245。
80 47.321。
90 69.951。
100 101.325。
因此,可以看出饱和蒸汽压力与温度的关系是正相关的。

蒸汽热值与压力温度的关系
蒸汽热值与压力温度的关系可以通过热力学的理论来解释。
根据热力学原理,蒸汽的热值与其温度和压力之间存在一定的关系。
一般来说,蒸汽的热值(也称为焓值)随着温度的升高而增加,同时随着压力的升高而增加。
这是因为温度和压力的升高都会增加蒸汽分子的动能,从而使其具有更高的热值。
具体来说,在常见的工程实践中,蒸汽热值通常用焓值表示,单位为焦耳/千克(J/kg)或千焦/千克(kJ/kg)。
在常见的压力范围内,蒸汽的热值与温度和压力之间的关系可以通过蒸汽表或蒸汽表格来查找。
例如,对于饱和蒸汽(即液态和气态同时存在的状态),其热值与压力和温度之间存在一一对应的关系。
通过查找蒸汽表格,可以得到在给定压力下的饱和蒸汽的温度和热值。
同样地,在给定温度下的饱和蒸汽的压力和热值也可以通过蒸汽表格得到。
蒸汽热值与压力温度之间存在一定的关系,可以通过热力学理论和蒸汽表格来描述和计算。

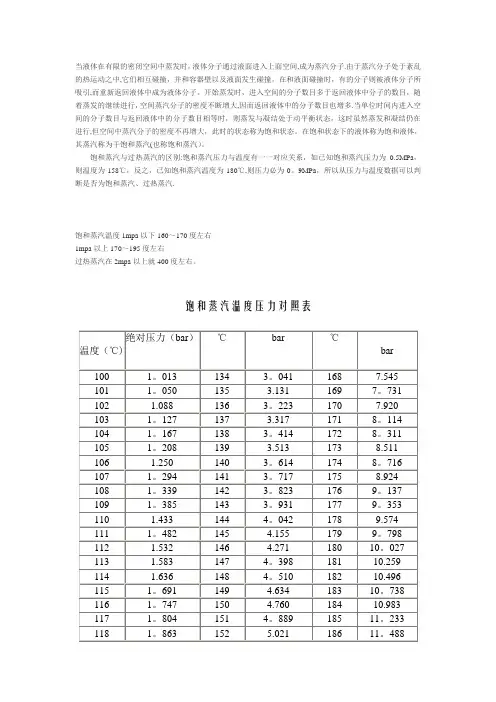
当液体在有限的密闭空间中蒸发时,液体分子通过液面进入上面空间,成为蒸汽分子.由于蒸汽分子处于紊乱的热运动之中,它们相互碰撞,并和容器壁以及液面发生碰撞,在和液面碰撞时,有的分子则被液体分子所吸引,而重新返回液体中成为液体分子。
开始蒸发时,进入空间的分子数目多于返回液体中分子的数目,随着蒸发的继续进行,空间蒸汽分子的密度不断增大,因而返回液体中的分子数目也增多.当单位时间内进入空间的分子数目与返回液体中的分子数目相等时,则蒸发与凝结处于动平衡状态,这时虽然蒸发和凝结仍在进行,但空间中蒸汽分子的密度不再增大,此时的状态称为饱和状态。
在饱和状态下的液体称为饱和液体,其蒸汽称为干饱和蒸汽(也称饱和蒸汽)。
饱和蒸汽与过热蒸汽的区别:饱和蒸汽压力与温度有一一对应关系,如已知饱和蒸汽压力为0.5MPa,则温度为158℃,反之,已知饱和蒸汽温度为180℃,则压力必为0。
9MPa,所以从压力与温度数据可以判断是否为饱和蒸汽、过热蒸汽.饱和蒸汽温度1mpa以下160~170度左右1mpa以上170~195度左右过热蒸汽在2mpa以上就400度左右。
饱和蒸汽温度压力对照表压力MPa 温度℃压力MPa温度℃压力MPa温度℃压力MPa温度℃0。
000 99。
5 0。
180 131.0 0.000 99。
5 -0.072 65。
0 0.005 101.0 0.185 131。
5 —0。
002 99.0 -0.074 64。
0 0.010 102.0 0.190 132.0 -0。
004 98。
5 -0.076 63.0 0。
015 103.5 0。
195 132.5 -0。
006 97.5 -0。
078 62.0 0。
020 104。
5 0.200 133.5 —0。
008 97.0 —0。
08 60.0 0。
025 105。
5 0。
210 134。
5 —0.010 96.5 —0。
081 59.0 0.030 107。
0 0.220 135.5 —0。
![饱和蒸汽压和温度的计算关系式[最新]](https://uimg.taocdn.com/45d46d836aec0975f46527d3240c844769eaa0fc.webp)
在表1中给出了采用Antoine公式计算不同物质在不同温度下蒸气压的常数A、B、C。
其公式如下lgP=A-B/(t+C) (1)0式中:P—物质的蒸气压,毫米汞柱;1mm汞柱=133.3Pa,一个标准大气压约760mm汞柱t—温度,℃。
公式(1)适用于大多数化合物;而对于另外一些只需常数B与C值的物质,则可采用(2)公式进行计算0lgP=-52.23B/T+C (2)0式中:P—物质的蒸气压,毫米汞柱;0这是所有单位的换算:1兆帕(MPa)=145磅/英寸2(psi)=10.2千克/厘米2(kg/cm2)=10巴(bar)=9.8大气压(atm)1磅/英寸2(psi)=0.006895兆帕(MPa)=0.0703千克/厘米2(kg/cm2)=0.0689巴(bar)=0.068大气压(atm)1巴(bar)=0.1兆帕(MPa)=14.503磅/英寸2(psi)=1.0197千克/厘米2(kg/cm2)=0.987大气压(atm) 1大气压(atm)=0.101325兆帕(MPa)=14.696磅/英寸2(psi)=1.0333千克/厘米2(kg/cm2)=1.0133巴(bar)0名称分子式范围(℃) A B C 0银 Ag 1650~1950 公式(2) 250 8.76 0氯化银 AgCl 1255~1442 公式(2) 185.5 8.179 0三氯化铝 AlCl3 70~190 公式(2) 115 16.24 0氧化铝 Al2O3 1840~2200 公式(2) 540 14.22 0砷 As 440~815 公式(2) 133 10.800 0砷 As 800~860 公式(2) 47.1 6.692 0三氧化二砷 As2O3 100~310 公式(2) 111.35 12.127 0三氧化二砷 As2O3 315~490 公式(2) 52.12 6.513 0氩 Ar -207.62~-189.19 公式(2) 7.8145 7.5741 0金 Au 2315~2500 公式(2) 385 9.853 0三氯化硼 BCl3 …… 6.18811 756.89 214.0 0钡 Ba 930~1130 公式(2) 350 15.765 0铋 Bi 1210~1420 公式(2) 200 8.876 0溴 Br2 …… 6.83298 113.0 228.0 0碳 C 3880~4430 公式(2) 540 9.596 0二氧化碳 CO2 …… 9.64177 1284.07 268.432 0二硫化碳 CS2 -10~+160 6.85145 1122.50 236.46 0一氧化碳 CO -210~-160 6.24020 230.274 260.0 0四氯化碳 CCl4 …… 6.93390 1242.43 230.0 0钙 Ca 500~700 公式(2) 195 9.697 0钙 960~1100 公式(2) 370 16.240 0镉 Cd 150~320.9 公式(2) 109 8.564 0镉 500~840 公式(2) 99.9 7.897 0氯 Cl2 …… 6.86773 821.107 240 0二氧化氯 ClO2 -59~+11 公式(2) 27.26 7.893 0钴 Co 2374 公式(2) 309 7.571 0铯 Cs 200~230 公式(2) 73.4 6.949 0铜 Cu 2100~2310 公式(2) 468 12.344 0氯化亚铜 Cu2Cl2 878~1369 公式(2) 80.70 5.454 0铁 Fe 2220~2450 公式(2) 309 7.482 0氯化亚铁 FeCl2 700~930 公式(2) 135.2 8.33 0氢 H2 -259.2~-248 5.92088 71.615 276.337 0氟化氢 HF -55~+105 8.38036 1952.55 335.52 0氯化氢 HCl -127~-60 7.06145 710.584 255.0 0溴化氢 HBr -120~-87 8.4622 1112.4 270 0溴化氢 -120~-60 6.88059 732.68 250 0碘化氢 HI -97~-51 公式(2) 24.16 8.259 0碘化氢 -50~-34 公式(2) 21.58 7.630 0氰化氢 HCN -85~-40 7.80196 1425.0 265.0 0氰化氢 -40~+70 7.29761 1206.79 247.532 0过氧化氢 H2O2 10~90 公式(2) 48.53 8.853 0水② H2O 0~60 8.10765 1750.286 235.0 0水③ 60~150 7.96681 1668.21 228.0 0硒化氢 H2Se 66~-26 公式(2) 20.21 7.431 0硫化氢 H2S -110~83 公式(2) 20.69 7.880 0碲化氢 H2Te -46~0 公式(2) 22.76 7.260 0氦 He …… 16.1313 282.126 290 0汞 Hg 100~200 7.46905 1771.898 244.831 0汞 200~300 7.7324 3003.68 262.482 0汞 300~400 7.69059 2958.841 258.460 0汞 400~800 7.7531 3068.195 273.438 0氯化汞 HgCl2 60~130 公式(2) 85.03 10.888 0氯化汞 130~270 公式(2) 78.85 10.094 0氯化汞 HgCl2 275~309 公式(2) 61.02 8.409 0氯化亚汞 Hg2Cl2 … 8.52151 3110.96 168.0 0碘 I2 … 7.26304 1697.87 204.0 0钾 K 260~760 公式(2) 84.9 7.183 0氟化钾 KF 1278~1500 公式(2) 207.5 9.000 0氯化钾 KCl 690~1105 公式(2) 174.5 8.3526 0氯化钾 1116~1418 公式(2) 169.7 8.130 0溴化钾 KBr 906~1063 公式(2) 168.1 8.2470 0溴化钾 1095~1375 公式(2) 163.8 7.936 0碘化钾 KI 843~1028 公式(2) 157.6 8.0957 0碘化钾 1063~1333 公式(2) 155.7 7.949 0氢氧化钾 KOH 1170~1327 公式(2) 136 7.330 0氪 Kr -188.7~-169 公式(2) 10.065 7.1770 0氟化锂 LiF 1398~1666 公式(2) 218.4 8.753 0镁 Mg 900~1070 公式(2) 260 12.993 0锰 Mn 1510~1900 公式(2) 267 9.300 0钼 Mo 1800~2240 公式(2) 680 10.844 0氮 N2 -210~-180 6.86606 308.365 273.2 0一氧化氮 NO -200~161 公式(2) 16.423 10.084 0一氧化氮 -163.7~148 公式(2) 13.04 8.440 0三氧化二氮 N2O3 -25~0 公式(2) 39.4 10.30 0四氧化二氮 N2O4 -100~-40 公式(2) 55.16 13.40 0四氧化二氮 -40~-10 公式(2) 45.44 11.214 0五氧化二氮 N2O5 -30~+30 公式(2) 57.18 12.647 0氯化亚硝酰 NOCl -61.5~-5.4 公式(2) 25.5 7.870 0肼 N2H4 -10~+39 8.26230 1881.6 238.0 0肼 39~250 7.77306 1620.0 218.0 0钠 Na 180~883 公式(2) 103.3 7.553 0氯化钠 NaF 1562~1701 公式(2) 218.2 8.640 0氯化钠 NaCl 976~1155 公式(2) 180.3 8.3297 0氯化钠 1562~1430 公式(2) 185.8 8.548 0溴化钠 NaBr 1138~1394 公式(2) 161.6 4.948 0碘化钠 NaI 1063~1307 公式(2) 165.1 8.371 0氰化钠 NaCN 800~1360 公式(2) 155.52 7.472 0氢氧化钠 NaOH 1010~1402 公式(2) 132 7.030 0氖 Ne …… 7.57352 183.34 285.0 0镍 Ni 2360 公式(2) 309 7.600 0四羰基镍 Ni(CO) 4 2~40 公式(2) 29.8 7.780 0氧 O2 -210~-160 6.98983 370.757 273.2 0臭氧 O3 …… 6.72602 566.95 260.0 0磷(白磷) P 20~44.1 公式(2) 63.123 9.6511 0磷(紫磷) P 380~590 公式(2) 108.51 11.0842 0磷化氢 PH3 …… 6.70101 643.72 256.0 0铅 Pb 525~1325 公式(2) 188.5 7.827 0氯化铅 PbCl2 500~950 公式(2) 141.9 8.961 0铂 Pt 1425~1765 公式(2) 486 7.786 0铷 Rb 250~370 公式(2) 76 6.976 0氡 Rn …… 6.6964 717.986 250 0硫 S …… 6.69535 2285.37 155.0 0二氧化硫 SO2 …… 7.32776 1022.80 240.0 0三氧化硫 SO3 24~48 公式(2) 43.45 10.022 0锑 Sb 1070~1325 公式(2) 189 9.051 0三氯化锑 SbCl3 170~253 公式(2) 49.44 8.090 0硒 Se …… 6.96158 3256.55 110.0 0二氧化硒 SeO2 …… 6.57781 1879.81 179.0 0硅 Si 1200~1320 公式(2) 170 5.950 0四氯化硅 SiCl4 -70~+5 公式(2) 30.1 7.644 0甲硅烷 SiH4 -160~112 公式(2) 12.69 6.996 0二氧化硅 SiO2 1860~2230 公式(2) 506 13.43 0锡 Sn 1950~2270 公式(2) 328 9.643 0四氯化锡 SnCl4 -52~-38 公式(2) 46.74 9.824 0锶 Sr 940~1140 公式(2) 360 16.056 0铊 Tl 950~1200 公式(2) 120 6.140 0钨 W 2230~2770 公式(2) 897 9.920 0氙 Ke …… 6.6788 573.480 260 0锌 Zn 250~419.4 公式(2) 133 9.200 0甲烷 XH4 固体③ 7.69540 532.20 275.00 0甲烷液体 6.61184 339.93 266.00 0氯甲烷 CH3Cl -47~-10 公式(2) 21.988 7.481 0三氯甲烷 CHCl3 -30~+150 6.90328 1163.03 227.4 0二苯基甲烷 C13H12 217~283 公式(2) 52.36 7.967 0氯溴甲烷 CH2ClBr -10~+155 6.92776 1165.59 220.0 0硝基甲烷 CH3O2N 47~100 公式(2) 39.914 8.033 0乙烷 C2HS …… 6.80266 656.40 256.00 0氯乙烷 C2H5Cl 65~+70 6.80270 949.62 230 0溴乙烷 C2H5Br -50~+130 6.89285 1083.8 231.7 0均二氯乙烷 C2H4Cl2 …… 7.18431 1358.46 232.2 0均二溴乙烷 C2H4Br2 …… 7.06245 1469.70 220.1 0环氧乙烷 C2H4O -70~+100 7.40783 1181.31 250.60 0偏二氯乙烷 C2H2Cl2 0~30 公式(2) 31.706 7.909 01,1,2一三氯乙烷 C2H3Cl3 …… 6.85189 1262.57 205.17 0丙烷 C3H8 …… 6.82973 813.20 248.00 0正氯丙烷 C3H7Cl 0~50 公式(2) 28.894 7.593 0环氧丙烷(1,2) C3H6O -35~+130 7.06492 1113.6 232 0正丁烷 C4H10 …… 6.83029 945.90 240.00 0异丁烷 C4H10 …… 6.74808 882.80 240.00 0正戊烷 C5H12 …… 6.85221 1064.63 232.000 0异戊烷 C5H12 …… 6.78967 1020.012 233.097 0环戊烷 C5H10 …… 6.88676 1124.162 231.361 0正己烷 C6H14 …… 6.87776 1171.530 224.366 0环已烷④ C6H12 -50~200 6.84498 1203.526 222.863 0正庚烷 C7H16 …… 6.90240 1268.115 216.900 0正辛烷 C8H18 -20~+40 7.37200 1587.81 230.07 0正辛烷 20~200 6.92374 1355.126 209.517 0异辛烷(2-甲基庚烷) C8H18 …… 6.91735 1337.468 213.963 0正壬烷 C9H20 -10~+60 7.26430 1607.12 217.54 0正壬烷 60~230 6.93513 1428.811 201.619 0正癸烷 C10H22 10~80 7.31509 1705.60 212.59 0正癸烷 70~260 6.95367 1501.268 194.480 0正十一烷 C11H24 15~100 7.3685 1803.90 208.32 0正十一烷 100~310 6.97674 1566.65 187.48 0正十二烷 C12H26 5~120 7.35518 1867.55 202.59 0正十二烷 115~320 6.98059 1625.928 180.311 0正十三烷 C13H28 15~132 7.5360 2016.19 203.02 0正十三烷 132~330 6.9887 1677.43 172.90 0正十四烷 C14H30 15~145 7.6133 2133.75 200.8 0正十四烷 145~340 6.9957 1725.46 165.75 0正十五烷 C15H32 15~160 7.6991 2242.42 198.72 0正十五烷 160~350 7.0017 1768.42 158.49 0正十六烷 C16H34 …… 7.03044 1831.317 154.528 0正十七烷 C17H36 20~190 7.8369 2440.20 194.59 0正十七烷 190~320 7.0115 1847.12 145.52 0正十八烷 C18H38 20~200 7.9117 2542.00 193.4 0正十八烷 200~350 7.0156 1883.73 139.46 0正十九烷 C19H40 20~40 8.7262 3041.10 207.30 0正十九烷 160~410 7.0192 1916.96 131.66 0正二十烷 C20H42 25~223 8.7603 3113.0 204.07 0正二十烷 223~420 7.0225 1948.7 127.8 0乙烯 C2H4 …… 6.74756 585.00 255.00 0氯乙烯 C2H3 Cl -11~+50 6.49712 783.4 230.0 01,1,2一三氯乙烯 C2HCl3 …… 7.02808 1315.04 230.0 0苯乙烯 C8H8 …… 6.92409 1420.0 206 0丙烯 C3H6 …… 6.81960 785.0 247.00 0丁稀-1 C4H8 …… 6.84290 926.10 240.00 0顺-2-丁烯 C4H8 …… 6.86926 960.100 237.00 0反-2-丁稀 C4H8 …… 6.86952 960.80 240.00 02-甲基丙烯-1 C4H8 …… 6.84134 923.200 240.00 01,2一丁二烯 C4H6 -60~+80 7.1619 1121.0 251.00 01,3一丁二烯 C4H6 -80~+65 6.85941 935.531 239.554 02-甲基丁二稀-1,3 C5H8 -50~+95 6.90334 1080.966 234.668 0乙炔 C2H2 -140~-82 公式(2) 21.914 8.933 0甲醇 CH4O -20~+140 7.87863 1473.11 230.0 0苯甲醇 C7H8O 20~113 7.81844 1950.3 194.36 0苯甲醇 113~300 6.95916 1461.64 153.0 0乙醇 C2H6O …… 8.04494 1554.3 222.65 0正丙醇 C3H8O …… 7.99733 1569.70 209.5 0异丙醇 C3H8O 0~113 6.66040 813.055 132.93 0正丁醇 C4H10 75~117.5 公式(2) 46.774 9.1362 0特丁醇 C4H10 …… 8.13596 1582.4 218.9 0乙二醇 C2H6O2 25~112 8.2621 2197.0 212.0 0乙二醇 112~340 7.8808 1957.0 193.8 0乙醛 C2H4 O -75~-45 7.3839 1216.8 250 0乙醛 -45~+70 6.81089 992.0 230 0丙酮 C3H6O …… 7.02447 1161.0 224 0二乙基酮 C5H10O …… 6.85791 1216.3 204 0甲乙酮 C4H3O …… 6.97421 1209.6 216 0甲酸 CH2O2 …… 6.94459 1295.26 218.0 0苯甲酸 C7H6O2 60~110 公式(2) 63.82 9.033 0乙酸 C2H4O2 0~36 7.80307 1651.2 225 0乙酸 36~170 7.18807 1416.7 211 0丙酸 C3H6O2 0~60 7.71553 1690 210 0丙酸 60~185 7.35027 1497.775 194.12 0正丁酸 C4H8O2 0~82 7.85941 1800.7 200 0正丁酸 82~210 7.38423 1542.6 179 0月硅酸 C12H24O2 164~205 公式(2) 74.386 9.768 0十四烷酸 C14H28O2 190~224 公式(2) 75.783 9.541 0乙酐 C4H6O3 100~140 公式(2) 45.585 8.688 0顺丁烯二酸酐 C4H2O3 60~160 公式(2) 46.34 7.825 0邻苯二甲酸酐 C3H4O3 160~285 公式(2) 54.92 8.022 0酷酸乙醋 C4H8 O2 -20~+150 7.09808 1238.71 217.0 0甲酸乙酯 C3H6O2 -30~+235 7.11700 1176.6 223.4 0醋酸甲酯 C3H6O2 …… 7.20211 1232.83 228.0 0苯甲酸甲酯 C8H8O2 25~100 7.4312 1871.5 213.9 0苯甲酸甲酯 100~260 7.07832 1656.25 95.23 0甲酸甲酯 C2H4O2 …… 7.13623 1111.0 229.2 0水杨酸甲酯 C8H8O3 175~215 公式(2) 48.67 8.008 0氨基甲酸乙酯 C3H7O2N …… 7.42164 1758.21 205.0 0甲醚 C2H6O …… 6.73669 791.184 230.0 0苯甲醚 C7H8O …… 6.98926 1453.6 200 0二苯醚 C12H10O 25~147⑤ 7.4531 2115.2 206.8 0二苯醚 147~325 7.09894 1871.92 185.84 0甲乙醚 C3H8O 0~25 公式(2) 26.262 7.769 0乙醚 C4H10O …… 6.78574 994.195 210.2 0甲胺 CH5N -93~-45 6.91831 883.054 223.122 0甲胺 -45~+50 6.91205 838.116 224.267 0二甲胺 C2H7N -80~-30 7.42061 1085.7 233.0 0二甲胺 -30~+65 7.18553 1008.4 227.353 0三甲胺 C3H9N -90~-40 7.01174 1014.2 243.1 0三甲胺 -60~+850 6.81628 937.49 235.35 0乙胺 C2H7N -70~-20 7.09137 1019.7 225.0 0乙胺 -20~+90 7.05413 987.31 220.0 0二乙胺 C4H11N -30~+100 6.83188 1057.2 212.0 0三乙胺 C6H15N 0~130 6.8264 1161.4 205.0 0苯胺 C6H7N …… 7.24179 1675.3 200 0二甲替甲酰胺 C3H7ON 15~60 7.3438 1624.7 216.2 0二甲替酰胺 60~350 6.99608 1437.84 199.83 0二苯胺 C12H11N 278~284 公式(2) 57.35 8.008 0间硝基苯胺 C6H6O2N2 190~260 公式(2) 77.345 9.5595 0邻硝基苯胺 C6H5O2N2 150~260 公式(2) 63.881 8.8684 0对硝基苯胺 C6H6O2N2 190~260 公式(2) 77.345 9.5595 0苯酚 C6H6O …… 7.13617 1518.1 175.0 0邻甲酚 C7H8O …… 6.97943 1479.4 170.0 0间甲酚 C7H8O …… 7.62336 1907.24 201.0 0对甲酚 C7H8O …… 7.00592 1493.0 160.0 0α-萘酚 C10H8O …… 7.28421 2077.56 184.0 0β-萘酚 C10H8O …… 7.34714 2135.00 183.0 0苯⑥ C6H6 …… 6.90565 1211.033 220.790 0氯苯 C6H5Cl 0~42 7.10690 1500.0 224.0 0氯苯 42~230 6.94594 1413.12 216.0 0邻二氯苯 C6H4Cl2 …… 6.92400 1538.3 200 0乙苯 C8H10 …… 6.95719 1424.255 213.206 0氟苯 C6H5F -40~+180 6.93667 1736.35 220.0 0硝基苯 C6H6O2N 112~209 公式(2) 48.955 8.192 0甲苯 C7H8 …… 6.95464 1341.800 219.482 0邻硝基甲苯 C7H7O2N 50~225 公式(2) 48.114 7.9728 0间硝基甲苯 C7H7O2N 55~235 公式(2) 50.128 8.0655 0对硝基甲苯 C7H7O2N 80~240 公式(2) 49.95 7.9815 0三硝基甲苯 C7H5O6N3 …… 3.8673 1259.406 160 0邻二甲苯 C8H10 …… 6.99891 1474.679 213.686 0间二甲苯 C8H10 7.00908 1462.266 215.105 0对二甲苯 C8H10 6.99052 1453.430 215.307 0乙酰苯 C8H8O 30~100 公式(2) 55.117 9.1352 0乙腈 C2H3N …… 7.11988 1314.4 230 0丙烯腈 C3H3N -20~+140 7.03855 1232.53 222.47 0氰 C2N2 -72~-28 公式(2) 32.437 9.6539 0氰 C2N2 -36~-6 公式(2) 23.75 7.808 0萘 C10H8 …… 6.84577 1606.529 187.227 0α-甲基綦 C11H10 …… 7.06899 1852.674 197.716 0β-甲基萘 C11H10 …… 7.06850 1840.268 198.395 0蓖 C14H10 100~160 公式(2) 72 8.91 0蓖 223~342 公式(2) 59.219 7.910 0蓖醌 C14H3O2 224~286 公式(2) 110.05 12.305 0蓖醌 285~370 公式(2) 63.985 8.002 0樟脑 C10H16O 0~18 公式(2) 53.559 8.799 0咔唑 C12H9N 244~352 公式(2) 64.715 8.280 0芴 C13H10 161~300 公式(2) 56.615 8.059 0呋喃 C4H4O -35~+90 6.97533 1010.851 227.740 0吗啉 C4H9ON 0~44 7.71813 1745.8 235.0 0吗啉 44~170 7.16030 1447.70 210.0 0菲 C14H10 203~347 公式(2) 57.247 7.771 0喹啉 C9H7N 180~240 公式(2) 49.72 7.969 0噻吩 C4H4S -10~180 6.95926 1246.038 221.354 0草酸 C2H2O4 55~105 公式(2) 90.5026 12.2229 0光气 COCl2 -68~+68 6.84297 941.25 230 0氨⑥ NH3 -83~+60 7.55466 1002.711 247.885 0氯化铵 NH4Cl 100~400 公式(2) 83.486 10.0164 0氰化铵 NH4CN 7~17 公式(2) 41.481 9.978 0。

水的饱和蒸汽压与温度的关系公式水的饱和蒸汽压与温度是一个经典的物理现象,它们之间存在着密切的关系。
了解这种关系对于我们理解水的蒸发和液态水与蒸汽之间的平衡至关重要。
本文将详细介绍水的饱和蒸汽压与温度之间的关系,并为读者提供一些实用的指导意义。
首先,我们来了解一下什么是饱和蒸汽压。
饱和蒸汽压是指在一定温度下,液体表面附近蒸汽和液体之间达到平衡时的蒸汽压力。
简单来说,当水的饱和蒸汽压等于外部空气中的压力时,水就会开始蒸发。
因此,饱和蒸汽压是决定液体蒸发速率的重要因素之一。
那么,水的饱和蒸汽压与温度之间存在什么样的关系呢?据研究发现,水的饱和蒸汽压随着温度的升高而增加。
这符合常识,因为我们经常可以观察到,在夏天或温度较高的日子里,水的蒸发速率会比较快。
具体来说,水的饱和蒸汽压与温度之间的关系可以由麦克斯韦-博尔兹曼分布律来描述。
该律指出,气体分子的速度与温度呈正相关。
在水的蒸气中,水分子也以一定速度运动,当温度升高时,水分子的平均动能增加,进而引起了更多水分子逃逸成为蒸汽。
因此,水的饱和蒸汽压会随着温度的升高而增加。
为了更好地描述水的饱和蒸汽压与温度之间的关系,科学家发现了一个经验公式,即麦克斯韦方程。
它可以用于计算不同温度下水的饱和蒸汽压。
麦克斯韦方程如下所示:ln(P) = A - B/(T+C)其中,P表示水的饱和蒸汽压(单位为帕斯卡),T表示温度(单位为摄氏度),A、B和C是常数。
这个方程可以用来预测不同温度下水的饱和蒸汽压,从而提供了实际应用的指导意义。
了解水的饱和蒸汽压与温度之间的关系对于许多领域都具有重要意义。
例如,在工业生产中,了解水的蒸发速率有助于控制和优化生产过程,提高生产效率。
在气象学中,了解水的饱和蒸汽压与温度之间的关系有助于预测天气变化,尤其是降水的形式和强度。
总之,水的饱和蒸汽压与温度之间存在着密切的关系,它由麦克斯韦方程描述,并遵循麦克斯韦-博尔兹曼分布律。
通过了解和应用这种关系,我们可以更好地理解和控制水的蒸发过程,从而在各个领域中取得更好的研究和应用效果。
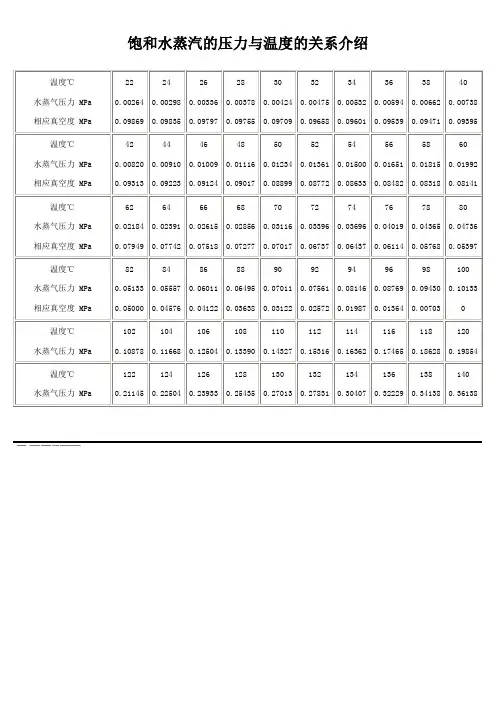
饱和水蒸汽的压力与温度的关系介绍温度℃水蒸气压力 MPa 相应真空度 MPa220.002640.09869240.002980.09835260.003360.09797280.003780.09755300.004240.09709320.004750.09658340.005320.09601360.005940.09539380.006620.09471400.007380.09395温度℃水蒸气压力 MPa 相应真空度 MPa420.008200.09313440.009100.09223460.010090.09124480.011160.09017500.012340.08899520.013610.08772540.015000.08633560.016510.08482580.018150.08318600.019920.08141温度℃水蒸气压力 MPa 相应真空度 MPa620.021840.07949640.023910.07742660.026150.07518680.028560.07277700.031160.07017720.033960.06737740.036960.06437760.040190.06114780.043650.05768800.047360.05397温度℃水蒸气压力 MPa 相应真空度 MPa820.051330.05000840.055570.04576860.060110.04122880.064950.03638900.070110.03122920.075610.02572940.081460.01987960.087690.01364980.094300.007031000.10133温度℃水蒸气压力 MPa1020.108781040.116681060.125041080.133901100.143271120.153161140.163621160.174651180.186281200.19854温度℃水蒸气压力 MPa1220.211451240.225041260.239331280.254351300.270131320.278311340.304071360.322291380.341381400.36138真空计算常用公式1、玻义尔定律体积V,压强P,P·V=常数(一定质量的气体,当温度不变时,气体的压强与气体的体积成反比。

实验报告评分13系07级第二大组实验室力一楼日期2010-03-23姓名钟伟PB07013076实验题目:饱和蒸汽压力和温度关系实验实验目的:通过观察饱和蒸汽压力和温度变化的关系,加深对饱和状态的理解,从而建立液体温度达到对应液面压力的饱和温度时,沸腾便会发生的基本概念。
通过对实验数据的整理,掌握饱和蒸汽p-t关系图表的编制方法,观察小容积的泡态沸腾现象。
实验原理:考察水在定压下加热时水的状态的变化过程。
随着热量的加入,水的温度不断升高。
当温度上升到某温度值t时水开始沸腾。
此沸腾温度称为该压力下的饱和温度。
同样,此时的压力称为饱和压力。
继续加热,水中不断产生水蒸汽,随着加热过程的进行,水蒸汽不断增加,直至全部变为蒸汽,而达到干饱和蒸汽状态。
对干饱和蒸汽继续加热,由蒸汽的温度由饱和温度逐渐升高。
水在汽化过程中,呈现出五种状态,即未饱和水、饱和水、湿饱和蒸汽、干饱和蒸汽、过热蒸汽。
在汽化阶段,处于汽液两相平衡共存的状态,它的特点是定温定压,即一定的压力对应着一定的饱和温度,或一定的温度对应着一定的饱和压力。
实验步骤:熟悉实验装置的工作原理、性能和使用方法。
1.将调压器指针置于零位,然后接通电源。
2.将电接点压力表的上限压力指针拨到稍高于最高试验压力(如:0.7MPa)的位置。
3.将调压器输出电压调至170V,待蒸汽压力升至接近于第一个待测定的压力值时,将电压降至20-50V左右(参考值)。
由于热惯性,压力将会继续上升,待工况稳定(压力和温度基本保持不变)时,记录下蒸汽的压力和温度。
重复上述实验,在0~0.6Pa(表压)范围内,取5个压力值,顺序分别进行测试。
实验点应尽可能分布均匀。
4.实验完毕后,将调压器指针旋回零位,并断开电源。
记录实验环境的温度和大气压力B。
注意事项:本装置允许使用压力为0.8MPa(表压),不可超压操作。
实验处理:数据记录绘制p - t 关系曲线,并将实验结果在p - t坐标系中标出如下:将实验点绘制在双对数坐标中,实验曲线将基本呈一直线,所以饱和水蒸汽压力和温度的关系可近似整理成下列经验公式:082234.0.282234.0t==pe.p注意事项:1、电接点压力表的上限压力指针须拨到稍高于最高试验压力;2、调压器的输出加热电压不宜过高过低,150~200V为宜。

水的饱和蒸汽压与温度对应表一、水的饱和蒸汽压与温度的关系蒸汽压是一定外界条件下,液体中的液态分子会蒸发为气态分子,同时气态分子也会撞击液面回归液态。
这是单组分系统发生的两相变化,一定时间后,即可达到平衡。
平衡时,气态分子含量达到最大值,这些气态分子对液体产生的压强称为蒸气压。
水的表面就有水蒸气压,当水的蒸气压达到水面上的气体总压的时候,水就沸腾。
我们通常看到水烧开,就是在100 摄氏度时水的蒸气压等于一个大气压。
蒸气压随温度变化而变化,温度越高,蒸气压越大,当然还和液体种类有关。
一定的温度下,与同种物质的液态(或固态)处于平衡状态的蒸气所产生的压强叫饱和蒸气压,它随温度升高而增加。
如:放在杯子里的水,会因不断蒸发变得愈来愈少。
如果把纯水放在一个密闭的容器里,并抽走上方的空气。
当水不断蒸发时,水面上方气相的压力,即水的蒸气所具有的压力就不断增加。
但是,当温度一定时,气相压力最终将稳定在一个固定的数值上,这时的气相压力称为水在该温度下的饱和蒸气压力。
当气相压力的数值达到饱和蒸气压力的数值时,液相的水分子仍然不断地气化,气相的水分子也不断地冷凝成液体,只是由于水的气化速度等于水蒸气的冷凝速度,液体量才没有减少,气体量也没有增加,液体和气体达到平衡状态。
所以,液态纯物质蒸气所具有的压力为其饱和蒸气压力时,气液两相即达到了相平衡。
饱和蒸气压是物质的一个重要性质,它的大小取决于物质的本性和温度。
饱和蒸气压越大,表示该物质越容易挥发。
、水的饱和蒸汽压与温度对应表水的饱和蒸汽压与温度对应表三、水的饱和蒸汽压与温度的换算公式当10C≤ T≤168 C时,采用安托尼方程计算:lgP=7.07406- (1657.46∕(T+227.02))式中:P――水在T温度时的饱和蒸汽压,kPa;T――水的温度,C四、水的饱和蒸汽压曲线SjC⅛出T畴ae。

水的饱和蒸汽压与温度对应表第一篇:水的饱和蒸汽压随温度变化规律水的饱和蒸汽压是指在特定温度下,水和其蒸气同时存在时,水蒸气所施加的压力即为饱和蒸汽压,它是气液相平衡时的一个基本参数。
以下是水的饱和蒸汽压与温度对应表:温度(℃)饱和蒸汽压(kPa)0 0.6115 0.87210 1.22815 1.70520 2.33825 3.16930 4.24735 5.62440 7.35845 9.51450 12.1755 15.4160 19.3665 24.1270 29.875 36.5680 44.5385 53.8790 64.7495 77.26100 101.3从表中可以看出,随着温度的升高,水的饱和蒸汽压也随之增大。
这是因为在高温下,水分子吸收能量后动能增加,从而逃离水面而成为水蒸气,随着水蒸气分子的增加,造成水蒸气的压强也增大。
同时,在高温下,水分子之间的距离增加,相互之间的作用力减小,水的表面张力也越来越小,从而使水分子逃逸成为气态分子的概率增大,也进一步增加了饱和蒸汽压。
然而,水的饱和蒸汽压是与温度密切相关的,随着温度的升高,水的饱和蒸汽压不仅逐渐增加,而且增加的速度也不一样。
根据饱和蒸汽压与温度的关系,可以得出一个重要的结论:当水温升高1℃时,饱和蒸汽压约增加4%。
这个结论对于许多领域,如改善生产条件、计算蒸汽歧管的性能等都具有一定的参考价值。
除了温度,水的饱和蒸汽压还受空气压力的影响。
在大气压力为标准大气压的情况下,即101.3kPa,以上表格所示的饱和蒸汽压即为绝对饱和蒸汽压。
而在低于标准大气压的情况下,水的饱和蒸汽压也相应减小,反之亦然。
在工业生产和实际应用中,应根据需要计算适当的饱和蒸汽压,并根据实际情况进行相应的调整。
总之,水的饱和蒸汽压是与温度密切相关的,随着温度升高,饱和蒸汽压也随之增大。
掌握这一规律对于实际生产和应用具有重要的意义,可以有效地提高生产效率和质量。
下的水蒸气压力。
饱和水蒸气压力数值与饱和温度相关,当温度上升时,对应的饱和水蒸气压力随之上升。
饱和水蒸气压力基本信息
定义
饱和水蒸气压力,又称饱和蒸汽压,指密闭条件下水的气相与液相达到平衡即饱和状态下的水蒸气压力。
该压力数值与对应的温度有关。
原理
当液体在有限的密闭空间中蒸发时,液体分子通过液面进入上面空间,成为蒸汽分子。
由于蒸汽分子处于紊乱的热运动之中,它们相互碰撞,并和容器壁以及液面发生碰撞,在和液面碰撞时,有的分子则被液体分子所吸引,而重新返回液体中成为液体分子。
开始蒸发时,进入空间的分子数目多于返回液体中分子的数目,随着蒸发的继续进行,空间蒸汽分子的密度不断增大,因而返回液体中的分子数目也增多。
当单位时间内进入空间的分子数目与返回液体中的分子数目相等时,则蒸发与凝结处于动平衡状态,这时虽然蒸发和凝结仍在进行,但空间中蒸汽分子的密度不再增大,此时的状态称为饱和状态。
在饱和状态下的液体称为饱和液体,其对应的蒸汽是饱和蒸汽。
饱和水蒸气压力与温度的关系
下的水蒸气压力。
饱和水蒸气压力数值与饱和温度相关,当温度上升时,对应的饱和水蒸气压力随之上升。
蒸汽压力与温度对照表
注:加热室温度差=壳层压力(真空度)相应温度-加热室料液温度。
过热度=蒸汽温度-饱和蒸汽压力相应温度。
饱和蒸汽温度与压力对照表
按1MPa=1000kPa=10.2kgf/cm2(公斤/平方厘米),对照饱和蒸汽压力(MPa表示)与蒸汽温度的标准表,可以计算得到饱和蒸汽压力(kgf/cm2表示)与蒸汽温度之间的关系,如下所示:
饱和蒸汽的温度与压力之间一一对应,二者之间只有一个独立变量。
理想的饱和蒸汽状态,指的是温度、压力及蒸汽密度三者存在一一对应的关系,知道其中一个,其他二个值就是定数。
存在这种关系的蒸汽就是饱和蒸汽,并存在饱和蒸汽压力与温度对照表。
标准的饱和蒸汽压力与蒸汽温度对照表是根据国际单位制进行编制的,即压力单位为MPa,温度单位为℃。
扩展资料
饱和蒸汽压的测量方法可以分为两类:
1.动态法。
指在不同外界压力下,测定液体的沸点,又称沸点法。
这种方法只在测量常压附近的饱和蒸汽压时测量精度较好。
2.静态法。
指在不同温度下,直接测量液体饱和蒸汽压,即在恒温条件下测量饱和压力。
静态法测量相对简单,更具普遍性,通常的做法就是将待测物质充人密闭容器,并使其处于气液两相共存状态,然后放人恒温槽中,通过调节恒温槽温度来测量不同温度下的饱和蒸汽压数据。
水的饱和蒸汽压与温度对应表一、水的饱和蒸汽压与温度的关系蒸汽压是一定外界条件下,液体中的液态分子会蒸发为气态分子,同时气态分子也会撞击液面回归液态。
这是单组分系统发生的两相变化,一定时间后,即可达到平衡。
平衡时,气态分子含量达到最大值,这些气态分子对液体产生的压强称为蒸气压。
水的表面就有水蒸气压,当水的蒸气压达到水面上的气体总压的时候,水就沸腾。
我们通常看到水烧开,就是在100摄氏度时水的蒸气压等于一个大气压。
蒸气压随温度变化而变化,温度越高,蒸气压越大,当然还和液体种类有关。
一定的温度下,与同种物质的液态(或固态)处于平衡状态的蒸气所产生的压强叫饱和蒸气压,它随温度升高而增加。
如:放在杯子里的水,会因不断蒸发变得愈来愈少。
如果把纯水放在一个密闭的容器里,并抽走上方的空气。
当水不断蒸发时,水面上方气相的压力,即水的蒸气所具有的压力就不断增加。
但是,当温度一定时,气相压力最终将稳定在一个固定的数值上,这时的气相压力称为水在该温度下的饱和蒸气压力。
当气相压力的数值达到饱和蒸气压力的数值时,液相的水分子仍然不断地气化,气相的水分子也不断地冷凝成液体,只是由于水的气化速度等于水蒸气的冷凝速度,液体量才没有减少,气体量也没有增加,液体和气体达到平衡状态。
所以,液态纯物质蒸气所具有的压力为其饱和蒸气压力时,气液两相即达到了相平衡。
饱和蒸气压是物质的一个重要性质,它的大小取决于物质的本性和温度。
饱和蒸气压越大,表示该物质越容易挥发。
二、水的饱和蒸汽压与温度对应表水的饱和蒸汽压与温度对应表118 186.23 243 3524.7 368 20533 119 192.28 244 3586.3 369 20780 120 198.48 245 3648.8 370 21030 121 204.85 246 3712.1 371 21286 122 211.38 247 3776.2 372 21539 123 218.09 248 3841.2 373 21803 124 224.96 249 3907.0 - - 三、水的饱和蒸汽压与温度的换算公式当10℃≤T≤168℃时,采用安托尼方程计算:lgP=7.07406-(1657.46/(T+227.02))式中:P——水在T温度时的饱和蒸汽压,kPa;T——水的温度,℃四、水的饱和蒸汽压曲线。
水的饱和蒸汽压与温度公式水的饱和蒸汽压与温度之间的关系,可真是个有趣的话题!想象一下,咱们在厨房煮水,水慢慢加热,刚开始还没什么特别的,随着温度的上升,水蒸气开始冒头,那种热腾腾的气息扑面而来,简直让人想起了锅里的小汤圆,咕噜咕噜的声音像在唱歌。
说到饱和蒸汽压,其实就是在这个过程中,水分子们开始变得活跃起来,它们不再安分守己,而是奋力向上,试图逃离水面,直奔空中而去。
随着温度的提高,这些小家伙们越发兴奋,频繁地撞击着锅盖,造成的压力也就越来越大,这就是咱们所说的饱和蒸汽压。
你知道吗?这个压强可是跟温度息息相关的。
水的温度越高,蒸汽压就越大,简直像是开了火的茶壶,热气腾腾地冒着白烟。
换句话说,在高温下,水分子变得活跃得多,跟小孩子放开了手脚似的,追逐嬉戏。
每当温度升高一度,水分子的运动速度就会加快,想象一下,像是在马路上飞驰的汽车,嗖的一声就过去了。
这样的变化真是太神奇了。
水的饱和蒸汽压公式,就是科学家们为了描述这种关系而设立的规则,听起来复杂,其实就是揭示了一个简单的真理:热了就会变得更有劲。
大家都知道,水的状态可不止液态,冰、蒸汽也都是水的一部分。
这种变化就像是人心似的,温度低的时候,它们像是沉静的老者,乖乖待在水里。
可一旦温度上升,哦,那可真是热情洋溢,跃跃欲试,仿佛要去参加一场盛大的派对。
你瞧,那些水分子像是舞动的舞者,在温暖的环境中展现它们的优雅与灵动。
它们不断地聚集、碰撞,最终形成蒸汽。
这种状态变化,就像是人生中那些充满期待的时刻,让人心跳加速,充满了无限的可能性。
再说说水的沸腾,这可是饱和蒸汽压的高兴时刻。
你可以想象一下,锅里水开了,那股气势,真是震撼!水分子们在那儿欢快地舞蹈,像是在庆祝什么。
此时此刻,水的蒸汽压已经达到了一个极致,足以让水面开始沸腾,气泡从底部冒出,像是小朋友们玩泡泡,乐此不疲。
每当看到这一幕,心中总会感到一种莫名的愉悦,仿佛连空气都变得更加清新。
这样的时刻,让人不禁感慨,科学和生活是多么紧密相连,就像一对亲密无间的好朋友。
按1MPa=1000kPa=10.2kgf/cm2(公斤bai/平方厘米),对照饱和蒸汽压力(MPa表示du)与蒸汽温zhi度的标准表,可以计算dao得到饱和蒸汽压力(kgf/cm2表示)与蒸汽温度之间的关系,如下所示:
饱和蒸汽的温度与压力之间一一对应,二者之间只有一个独立变量。
理想的饱和蒸汽状态,指的是温度、压力及蒸汽密度三者存在一
一对应的关系,知道其中一个,其他二个值就是定数。
存在这种关系的蒸汽就是饱和蒸汽,并存在饱和蒸汽压力与温度对照表。
标准的饱和蒸汽压力与蒸汽温度对照表是根据国际单位制进行编制的,即压力单位为MPa,温度单位为℃。
扩展资料
饱和蒸汽压的测量方法可以分为两类:
1.动态法。
指在不同外界压力下,测定液体的沸点,又称沸点法。
这种方法只在测量常压附近的饱和蒸汽压时测量精度较好。
2.静态法。
指在不同温度下,直接测量液体饱和蒸汽压,即在恒温条件下测量饱和压力。
静态法测量相对简单,更具普遍性,通常的做法就是将待测物质充人密闭容器,并使其处于气液两相共存状态,然后放人恒温槽中,通过调节恒温槽温度来测量不同温度下的饱和蒸汽压数据。
常压下饱和蒸汽的温度
常压下饱和蒸汽的温度是指在常压下,水在加热过程中达到饱和状态时所对应的温度。
在常压下,水的沸点为100℃,当水被加热到100℃时,水开始沸腾,产生水蒸气。
此时,水蒸气的温度与水的温度相同,都是100℃,这就是常压下饱和蒸汽的温度。
饱和蒸汽是指在一定温度和压力下,水蒸气与液态水达到平衡状态的状态。
在常压下,当水被加热到100℃时,水开始沸腾,产生水蒸气,此时水蒸气的温度与水的温度相同,都是100℃,这就是常压下饱和蒸汽的温度。
饱和蒸汽的温度与压力有关,当压力增加时,饱和蒸汽的温度也会随之增加。
例如,在高海拔地区,由于大气压力较低,水的沸点也会随之降低,因此在这些地区,水的沸点会低于100℃,饱和蒸汽的温度也会相应降低。
饱和蒸汽在工业生产和日常生活中都有广泛的应用。
例如,在发电厂中,蒸汽驱动涡轮机发电;在化工生产中,蒸汽可以用于加热反应釜和蒸馏塔;在食品加工中,蒸汽可以用于杀菌和烘干等工艺。
常压下饱和蒸汽的温度是100℃,这是由于水在常压下的沸点为100℃所决定的。
饱和蒸汽在工业生产和日常生活中都有广泛的应用,是一种非常重要的物质。