铜及其化合物方程式书写
- 格式:doc
- 大小:481.50 KB
- 文档页数:2



第三章金属及其化合物1、钠及其重要化合物1.钠与氧气反应4Na + O 22Na2O(白色固体)2Na + O 2Na2O2(淡黄色固体)2.钠与氯气反应2Na + Cl 22NaCl(产生白烟)3.钠与硫反应2Na + S Na2S4.钠与水反应2Na + 2H2O2NaOH + H2↑2Na + 2H2O2Na++2OH-+ H2↑5.钠与盐酸反应2Na + 2HCl2NaCl + H2↑2Na + 2H+2Na+ + H2↑6.钠与硫酸铜溶液的反应2Na+CuSO4+2H2O Cu(OH)2↓+H2↑+Na2SO4 2Na+Cu2++2H2O Cu(OH)2↓+H2↑+2Na+7.钠与氯化铁溶液的反应6Na+2FeCl3+6H2O2Fe(OH)3↓+3H2↑+6NaCl 6Na+2Fe3++6H2O2Fe(OH)3↓+3H2↑+6Na+ 8.钠与熔融的四氯化钛的反应4Na+TiCl44NaCl+Ti9.过氧化钠溶于水中2Na2O2 + 2H2O4NaOH + O2↑2Na2O2 + 2H2O4Na+ + 4OH-+O2↑10.过氧化钠与CO2的反应2Na2O2 + 2CO 22Na2CO3+ O2↑11.过氧化钠与盐酸的反应2Na2O2 + 4HCl4NaCl+2H2O+ O2↑2Na2O2 + 4H+4Na++2H2O+ O2↑12.碳酸氢钠溶液中加入氢氧化钠溶液NaHCO3 + NaOH Na2CO3+ H2OHCO3-+ OH-CO32-+ H2O13.碳酸氢钠溶液中加入稀盐酸NaHCO3 + HCl NaCl+ CO2↑+ H2OHCO3-+ H+ CO2↑+ H2O14.碳酸钠溶液中滴入少量稀盐酸Na2CO3 + HCl NaHCO3 + NaClCO32-+ H+ HCO3-15.盐酸中滴加少量碳酸钠溶液Na2CO3 +2 HCl2NaCl + CO2↑+ H2OCO32-+ 2H+ CO2↑+H2O16.饱和碳酸钠溶液中通入足量二氧化碳气体Na2CO3 + CO2 + H2O2NaHCO3CO32-+ CO2 + H2O2HCO3-17.石灰水中加入Na2CO3溶液Ca(OH)2 + Na2CO3CaCO3↓+ 2NaOHCa2++ CO32-CaCO3↓18.石灰水中加入少量碳酸氢钠溶液NaHCO3 + Ca(OH)2CaCO3↓+NaOH + H2O HCO3-+ OH-+Ca2+CaCO3↓+ H2O19.石灰水中加入过量碳酸氢钠溶液2NaHCO3 + Ca(OH)2 CaCO3↓+ Na2CO3+ 2H2O 2HCO3-+ 2OH-+ Ca2+ CaCO3↓+ CO32-+ 2H2O 20.碳酸氢钠固体受热分解2NaHCO3Na2CO3+ CO2↑+ H2O21.碳酸钠溶液与氯化钡溶液的混合Na2CO3+BaCl2BaCO3↓+2NaClBa2++ CO32-BaCO3↓工业制钠(电解熔融的氯化钠)2NaCl(熔融) 2Na+Cl2↑2、铝及其化合物的转化关系22.铝与氧气的反应4Al+3O22Al2O323.铝与氯气的反应2Al+3Cl2AlCl324.铝与硫的反应2Al+3S Al2S325.铝与稀硫酸反应2Al + 3H2SO4 2Al2(SO4)3 + 3H2↑2Al + 6H+2Al 3++ 3H2↑26.铝与氢氧化钠溶液反应2Al + 2NaOH + 2H2O2NaAlO2 + 3H2↑2Al + 2OH-+ 2H2O 2 AlO2-+ 3H2↑27.氧化铝与稀盐酸反应Al2O3 + 6HCl2AlCl3 + 3H2OAl2O3 + 6H+2Al 3+ + 3H2O28.氧化铝与氢氧化钠溶液反应Al2O3 + 2NaOH2NaAlO2 + 2H2OAl2O3 + 2OH-AlO2-+ 2H2O29.氢氧化铝与稀硝酸反应Al(OH)3 + 3HNO3Al(NO3)3 + 3H2OAl(OH)3 + 3H+Al 3+ + 3H2O30.氢氧化铝与氢氧化钾溶液反应Al(OH)3 + KOH KAlO2 + 2H2OAl(OH)3 + OH-AlO2-+ 2H2O31.氯化铝溶液中加入少量氢氧化钠溶液AlCl3 + 3NaOH Al(OH)3↓+ 3NaClAl 3++3OH-Al(OH)3↓32.硝酸铝溶液中加入过量氢氧化钠溶液Al(NO3)3 + 4NaOH NaAlO2+ 3NaCl Al 3+ + 4OH-AlO2-+ 2H2O33.氯化铝溶液中滴加烧碱溶液至过量AlCl3 + 3NaOH Al(OH)3↓+3NaClAl(OH)3 + NaOH NaAlO2 + 2H2O总反应:AlCl3 + 4NaOH NaAlO2 + 2H2O + 3NaCl 离子方程式:Al3+ + 4OH-AlO2-+ 2H2O34.偏铝酸钠溶液中通入少量二氧化碳气体2NaAlO2 + CO2 + 3H2O2Al(OH)3↓+Na2CO32AlO2-+ CO2 + 3H2O2Al(OH)3↓+CO32-35.偏铝酸钠溶液中通入过量二氧化碳气体NaAlO2 + CO2 + 2H2O Al(OH)3↓+NaHCO3AlO2-+ CO2 + 2H2O Al(OH)3↓+HCO3-36.偏铝酸钠溶液中滴加少量稀盐酸NaAlO2 +HCl + H2O Al(OH)3↓+ NaClAlO2-+H+ + H2O Al(OH)3↓37.偏铝酸钠溶液中加入过量稀盐酸NaAlO2 + 4HCl AlCl3 + NaCl + 2H2OAlO2-+ 4H+Al 3+ + 2H2O38.偏铝酸钠溶液中加入硫酸铝溶液Al2(SO4)3+6NaAlO2+12H2O8Al(OH)3↓+3Na2SO4Al 3+ + 3AlO2-+ 6H2O4Al(OH)3↓39.氯化铝溶液中加入过量的氨水AlCl3 + 3NH3·H2O Al(OH)3↓+ 3NH4ClAl 3+ + 3NH3·H2O Al(OH)3↓+ 3NH43+40.偏铝酸钠溶液中滴加稀盐酸至过量NaAlO2+HCl+H2O NaCl+Al(OH)3↓Al(OH)3 + 3HCl AlCl3 + 3H2O总反应:NaAlO2+ 4HCl AlCl3 + NaCl + 2H2O离子方程式:AlO2-+ 4H+Al 3+ + 2H2O41.铝与氧化铁(镁带引发)(铝热反应)2Al + Fe 2O3 Al2O3+2 Fe明矾溶液中加氢氧化钡溶液至SO42-恰好完全沉淀KAl(SO4)2+2Ba(OH)22BaSO4↓+KAlO2+2H2OAl 3++2SO42-+2Ba2++4OH-2BaSO4↓+AlO2-+2H2O高温氢氧化铝加热分解2Al(OH)3Al2O3+3H2O工业制铝2Al2O3 (熔融)4Al+3O2↑3、铁及其化合物的转化关系42.沸水中滴入饱和氯化铁溶液制氢氧化铁胶体FeCl3 +3H2O Fe(OH)3(胶体) + 3HClFe3+ + 3H2O Fe(OH)3(胶体) + 3H+43.铁与稀硫酸反应Fe + H2SO4 FeSO4 + H2↑Fe + 2H+ Fe2+ + H2↑44.铁与氯化铁溶液反应Fe + 2FeCl3 3FeCl2Fe + 2Fe3+ 3Fe2+45.铁与水蒸气的反应3Fe+4H2O(g)Fe3O4+4H246.铁与氯气的反应2Fe+3Cl22FeCl3(棕褐色烟)47.氧化亚铁与稀盐酸的反应FeO+ 2HCl FeCl2+H2OFeO+ 2H+Fe2++H2O48.铁红与稀盐酸的反应Fe2O3 + 6HCl 2FeCl3+3H2OFe2O3 + 6H+ 2Fe3++3H2O49.磁性氧化铁与稀盐酸反应Fe3O4 + 8HCl 2FeCl3+FeCl2+4H2OFe3O4 + 8H+ 2Fe3++Fe2++4H2O50.硫酸亚铁溶液中加入氢氧化钠溶液FeSO4 + 2NaOH Fe(OH)2↓+ Na2SO4Fe2+ + 2OH-Fe(OH)2↓51.硫酸铁溶液中加入氢氧化钠溶液Fe2(SO4)3 + 6NaOH 2Fe(OH)3↓+ 3Na2SO4Fe3+ + 3OH-Fe(OH)3↓52.氯化铁溶液中滴入硫氰化钾溶液FeCl3 + 3KSCN Fe(SCN)3 + 3KClFe3+ + 3SCN-Fe(SCN)353.氢氧化亚铁与盐酸反应Fe(OH)2 + 2HCl FeCl2+2H2OFe(OH)2 + 2H+ Fe2++2H2O54.氢氧化铁与盐酸反应Fe(OH)3 + 3HCl FeCl3+3H2OFe(OH)3 + 3H+ Fe3++3H2O55.氯化铁溶液与Cu反应2FeCl3 + Cu 2FeCl2+CuCl22Fe3+ + Cu 2Fe2++Cu2+56.氯化亚铁溶液中通入氯气2FeCl2 + Cl2 2FeCl32Fe2+ + Cl22Fe3++2Cl-57.溴化亚铁溶液中通入少量氯气6FeBr2 +3Cl2 4FeBr3 +2FeCl32Fe2+ + Cl2 2Fe3++2Cl-58.溴化亚铁溶液中通入过量氯气2FeBr2 + 3Cl2 2FeCl3 +2Br22Fe2+ + 4Br-+3Cl2 2Fe3++2Br2+6Cl-59.四氧化三铁与稀硝酸反应3Fe3O4 + 28HNO39Fe(NO3)3 + 14H2O + NO↑离子反应式:3Fe3O4 + 28H+ + NO3-9Fe3+ + 14H2O + NO↑60.氯化铁与碘化钾反应2FeCl3 +2KI 2FeCl2+I2+2KCl2Fe3+ + 2I-2Fe2++I261.氯化铁溶液里通入SO2气体2FeCl3 + SO2+2H2O2FeCl2+H2SO4+2HCl2Fe3+ + SO2+2H2O2Fe2++SO42-+4H+高温62.铁与硫的反应Fe+S FeS63.铁在氧气中燃烧3Fe+2O2Fe3O464.氢氧化亚铁被空气中氧气氧化4Fe(OH)2+O2+2H2O4Fe(OH)365.氯化亚铁与过氧化氢溶液的反应2FeCl2 +H2O2+2HCl2FeCl3+2H2O2Fe2++H2O2+2H+2Fe3++2H2O66.硫酸亚铁与酸性高锰酸钾溶液的反应10FeSO4+2KMnO4+8H2SO4K2SO4+2MnSO4+5Fe2(SO4)3+8H2O5Fe2++MnO4-+8H+5Fe3++Mn2++ 4H2O 67.氢氧化铁加热分解2Fe(OH)3Fe2O3+3H2O4、镁及其化合物68.2Mg+O22MgO69.3Mg+N2Mg3N270.2Mg+CO22MgO+C71.Mg+H2SO4MgSO4+H2↑72.Mg+H2O Mg(OH)2+H2↑73.Mg3N2+6H2O3Mg(OH)2+2NH3↑74.MgCl2(熔融) Mg+Cl2↑5、铜及其化合物75.Cu在硫蒸气中燃烧2Cu+S Cu 2S76.Cu在氯气中燃烧Cu+Cl2CuCl2 (产生棕黄色烟)77.铜在空气中生成铜绿2Cu+O2+CO2+H2O===Cu2(OH)2CO378.Cu和浓HNO3的反应Cu+4HNO3(浓)===Cu(NO3)2+2NO2↑+2H2OCu+4H++2NO-3===Cu2++2NO2↑+2H2O 79.Cu和稀HNO3的反应3Cu+8 HNO3(稀)===3Cu(NO3)2+2NO↑+4H2O3Cu+8H++2NO-3===3Cu2++2NO↑+4H2O 80.Cu和浓H2SO4的反应Cu+2H2SO4(浓)CuSO4+SO2↑+2H2OCu+2H2SO4(浓)Cu2++SO2-4+SO2↑+2H2O 81.胆矾受热分解CuSO4·5H2O CuSO4+5H2O↑82.氢氧化铜受热分解Cu(OH)2CuO+H2O。

无机方程式默写2 铁、铜及其化合物1.铁及其化合物(1)写出下列反应的方程式①Fe高温下和水蒸气的反应②Fe在氧化中燃烧③Fe与硫反应④Fe2O3和CO的反应⑤Fe(OH)2长时间露置于空气中⑥FeCO3在空气氧化为Fe(OH)3⑦FeCO3在空气中加热生成Fe2O3⑧Fe(OH)3加热分解(2) 写出下列反应的离子方程式①Fe和少量稀HNO3的反应②Fe和过量稀HNO3的反应③H2O2在酸性条件下氧化Fe2+④高锰酸钾在酸性条件下氧化H2O2⑤高锰酸钾在酸性条件下氧化Fe2+⑥K2Cr2O7在酸性条件下氧化Fe2+⑦NaClO在酸性条件下氧化Fe2+⑧稀硝酸氧化Fe2+⑨FeCl3溶液和Fe的反应⑩FeCl3溶液和少量Zn的反应⑪FeCl3溶液和Cu的反应⑫FeCl3溶液和KI在酸性条件下反应⑬FeCl3溶液中通入SO2⑭FeCl3溶液中通入H2S⑮FeCl3与KSCN的反应⑯FeO和HCl的反应⑰FeO和稀HNO3的反应⑱Fe(OH)3和HI的反应⑲FeBr2溶液和少量Cl2的反应FeBr2溶液和Cl2等物质的量的反应FeBr2溶液和过量Cl2的反应⑳Fe2+与HCO3-反应生成碳酸亚铁和CO2○21Fe3+与HCO3-反应2.铜及其化合物(1)写出下列反应的方程式:①Cu在硫蒸气中燃烧②Cu(OH)2加热分解③铜在空气中生成铜绿【Cu2(OH)2CO3】④Cu2(OH)2CO3加热分解⑤ZnCO3·2Zn(OH)2·H2O加热分解(2) 写出下列反应的离子方程式①Cu和浓HNO3的反应②Cu和稀HNO3的反应③H2O2在酸性条件下氧化Cu④Cu2+与I-反应⑤Cu2(OH)2CO3与酸反应。

2020-2021高考化学复习《铜及其化合物推断题》专项综合练习含答案解析一、铜及其化合物1.由两种元素组成的矿物A,测定A的组成流程如下:请回答:(1)②反应中除了产生D外,还有一种气体生成,请写出该气体的电子式____________(2)写出①的化学方程式:_______________________________________________________(3)写出③的离子方程式:____________________________________________________(4)检验E溶液中含有Fe2+ 的方法是:_____________________________【答案】 Cu2S + 2O22CuO + SO2 SO2+2Fe3++2H2O=2Fe2++ SO42-+4H+取少量溶液E于试管中,加入铁氰化钾溶液,若生成蓝色沉淀,说明含有Fe2+【解析】【分析】由黑色固体B与一氧化碳共热反应生成红色固体单质D可知,黑色固体B为氧化铜,单质D为铜,则A中含有铜元素;由无色气体C与过量氯化铁溶液反应生成E溶液,E溶液与过量氯化钡溶液反应生成白色沉淀可知,C为二氧化硫,E为硫酸、氯化亚铁、盐酸和氯化铁的混合液,白色沉淀F为硫酸钡,则A中含有硫元素;4.66g硫酸钡的物质的量为0.02mol,由硫原子守恒可知,A中含有硫原子的物质的量为0.02mol,3.20gA中含有的铜原子的物质的量为3.20g0.02mol32g/mol64g/mol-⨯=0.04mol,则A中n(Cu):n(S)=0.04mol:0.02mol=2:1,A的化学式为Cu2S。
【详解】(1)②反应为氧化铜与一氧化碳共热反应生成铜和二氧化碳,二氧化碳为共价化合物,电子式为,故答案为:;(2)反应①为硫化亚铜与氧气在高温下发生氧化还原反应生成氧化铜和二氧化硫,反应的化学方程式为Cu2S + 2O22CuO + SO2,故答案为:Cu2S + 2O22CuO + SO2;(3)反应③为氯化铁溶液与二氧化硫发生氧化还原反应生成硫酸、盐酸和氯化亚铁,反应的离子方程式为SO2+2Fe3++2H2O=2Fe2++ SO42-+4H+,故答案为:SO2+2Fe3++2H2O=2Fe2++ SO42-+4H+;(4)E为硫酸、氯化亚铁、盐酸和氯化铁的混合液,因溶液中含有的氯离子能与酸性高锰酸钾溶液发生氧化还原反应,使酸性高锰酸钾溶液褪色,会干扰亚铁离子检验,所以检验亚铁离子应选用铁氰化钾溶液,具体操作为取少量溶液E于试管中,加入铁氰化钾溶液,若生成蓝色沉淀,说明含有Fe2+,故答案为:取少量溶液E于试管中,加入铁氰化钾溶液,若生成蓝色沉淀,说明含有Fe2+。

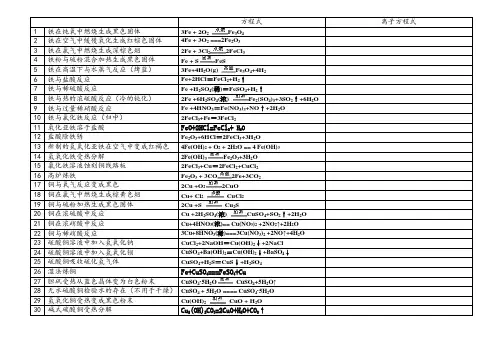
方程式离子方程式1 铁在纯氧中燃烧生成黑色固体3Fe + 2O2Fe3O42 铁在空气中缓慢氧化生成红棕色固体4Fe + 3O2===2Fe2O33 铁在氯气中燃烧生成深棕色烟2Fe + 3Cl22FeCl34 铁粉与硫粉混合加热生成黑色固体Fe +S FeS5 铁在高温下与水蒸气反应(烤蓝)3Fe+4H2O(g)Fe3O4+4H26 铁与盐酸反应Fe+2HCl=FeCl2+H2↑7 铁与稀硫酸反应Fe +H2SO4(稀)=FeSO4+H2↑8 铁与热的浓硫酸反应(冷的钝化)2Fe +6H2SO4(浓)Fe2(SO4)3+3SO2↑+6H2O9 铁与过量稀硝酸反应Fe +4HNO3=Fe(NO3)3+NO↑+2H2O10 铁与氯化铁反应(归中)2FeCl3+Fe=3FeCl211 氧化亚铁溶于盐酸FeO+2HCl=FeCl2+ H2O12 盐酸除铁锈Fe2O3+6HCl=2FeCl3+3H2O13 新制的氢氧化亚铁在空气中变成红褐色4Fe(OH)2 + O2 + 2H2O == 4 Fe(OH)314 氢氧化铁受热分解2Fe(OH)3Fe2O3+3H2O15 氯化铁溶液蚀刻铜线路板2FeCl3+Cu=2FeCl2+CuCl216 高炉炼铁Fe2O3 +3CO2Fe+3CO217 铜与氧气反应变成黑色2Cu +O22CuO18 铜在氯气中燃烧生成棕黄色烟Cu+ Cl2CuCl219 铜与硫粉加热生成黑色固体2Cu +S Cu2S20 铜在浓硫酸中反应Cu +2H2SO4(浓)CuSO4+SO2↑+2H2O21 铜在浓硝酸中反应Cu+4HNO3(浓)== Cu(NO3)2 +2NO2↑+2H2O22 铜与稀硝酸反应3Cu+8HNO3(稀)===3Cu(NO3)2 +2NO↑+4H2O23 硫酸铜溶液中加入氢氧化钠CuCl2+2NaOH=Cu(OH)2↓+2NaCl24 硫酸铜溶液中加入氢氧化钡CuSO4+Ba(OH)2=Cu(OH)2↓+BaSO4↓25 硫酸铜吸收硫化氢气体CuSO4+H2S=CuS↓+H2SO426 湿法炼铜Fe+CuSO4===FeSO4+Cu27 胆矾受热从蓝色晶体变为白色粉末CuSO4·5H2O CuSO4+5H2O↑28 无水硫酸铜检验水的存在(不用于干燥)CuSO4 + 5H2O ==== CuSO4·5H2O29 氢氧化铜受热变成黑色粉末Cu(OH)2CuO + H2O30 碱式碳酸铜受热分解Cu2(OH)2CO3=2CuO+H2O+CO2↑。

高三化学一轮复习——铜及其化合物知识梳理1.铜(1)物理性质:紫红色固体,具有良好的延展性、导热性和导电性。
(2)化学性质①常温下,铜在干燥的空气中性质稳定,但在潮湿的空气里则会被锈蚀,在其表面逐渐形成一层绿色的铜锈。
有关化学方程式:2Cu +O 2+CO 2+H 2O===Cu 2(OH)2CO 3。
②铜丝与硫蒸气反应的方程式:2Cu +S=====△Cu 2S③与氧化性酸反应:a .与浓硫酸共热的化学方程式:Cu +2H 2SO 4(浓)=====△CuSO 4+SO 2↑+2H 2O b .与稀硝酸反应的离子方程式:3Cu +8H ++2NO -3===3Cu 2++2NO ↑+4H 2O c .与浓硝酸反应的离子方程式:Cu +4H ++2NO -3===Cu 2++2NO 2↑+2H 2O 。
④与盐溶液反应与FeCl 3溶液反应的离子方程式2Fe 3++Cu===2Fe 2++Cu 2+。
2.铜的重要化合物(1)氧化物①CuO :黑色难溶于水的固体,与酸(H +)反应,可以用H 2、CO 、Al 还原出Cu 。
②Cu 2O :a.砖红色难溶于水的固体。
b.与酸反应(H+)为Cu2O+2H+===Cu+Cu2++H2O。
c.Cu2O遇到HNO3发生氧化反应生成Cu2+。
(2)氢氧化铜——蓝色难溶物,是一种弱碱。
(3)铜盐①Cu2(OH)2CO3:名称为碱式碳酸铜,是铜绿、孔雀石的主要成分。
△②CuSO4:白色粉末,可由蓝色的硫酸铜晶体受热分解得到,化学方程式为CuSO4·5H2O=====CuSO4+5H2O。
③铜盐的毒性:铜盐溶液有毒,主要是因为铜离子能与蛋白质作用,使蛋白质变性失活,利用这一性质用胆矾、熟石灰、水配成波尔多液,杀灭植物的病毒。
[名师点拨]涉铜警示点1.铜为变价金属,与Cl2反应生成CuCl2,与S反应生成Cu2S。
2.Cu与稀H2SO4不反应,但在通入O2的条件下,Cu可在稀H2SO4中逐渐溶解:2Cu+O2+2H2SO4===2CuSO4+2H2O。

第三章金属及其化合物化学方程式(四)铜及其化合物1、铜分别与O2、Cl2、S、I2反应化学反应方程式:2Cu+O22CuO(黑色固体)Cu+Cl2CuCl2(棕黄色烟)2Cu+S Cu2S(黑色固体) 2Cu+I22CuI2、铜和浓硫酸反应化学方程式:Cu +2H2SO4(浓)CuSO4+SO2↑+2H2O3.铜和浓硝酸反应化学方程式:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O;离子方程式:Cu+4H++2NO3-=Cu2++2NO2↑+2H2O4.铜和稀硝酸反应化学方程式:3Cu+8HNO3(稀)=3Cu(NO3)2+2N O↑+4H2O;离子方程式: 3Cu+8H++2NO3-= 3Cu2++2N O↑+4H2O5、铜与硝酸银溶液反应化学方程式:Cu+2AgNO3===Cu(NO3)2+2Ag离子方程式:Cu+2Ag+===Cu2++2Ag6、氯化铁溶液腐蚀印刷电路板化学方程式:Cu+2FeCl3=CuCl2+2FeCl2离子方程式:Cu+2Fe3+=Cu2++2Fe2+7、铜在空气中生锈化学方程式:2Cu+O2+H2O+CO2=Cu2(OH)2CO3。
8、Cu2(OH)2CO3(碱式碳酸铜、铜绿、孔雀石)受热分解化学方程式:Cu2(OH)2CO32CuO + H2O+ CO2↑9、碱式碳酸铜溶于盐酸化学方程式:Cu2(OH)2CO3+4HCl= 2Cu Cl2+3H2O+ CO2↑10、Cu2O在非氧化性酸中,不稳定,发生歧化反应化学方程式:Cu2O+H2SO4=CuSO4+Cu+H2O离子方程式:Cu2O+2H+=Cu2++Cu+H2O11、Cu2O溶于稀硝酸化学方程式: 3Cu2O+14HNO3(稀)=6Cu(NO3)2+2NO↑+7H2O 离子方程式:3Cu2O+14H++2NO3-=6Cu2++2NO↑+7H2O12、Cu2S溶于稀硝酸化学方程式:3Cu2S +16HNO3(稀)=6Cu(NO3)2+3S+4NO↑+8H2O离子方程式:3Cu2S +16H++4NO3-=6Cu2++3S+4NO↑+8H2O13、CuS溶于稀硝酸化学方程式:3CuS + 8HNO3(稀)= 3S+3Cu(NO3)2+2NO↑+4H2O)离子方程式:3CuS +8H++2NO3- =3Cu2++3S +2NO↑+4H2O14、氧化铜氧化氨气化学方程式:3CuO+2NH33Cu+N2+3H2O15、氧化铜受热10000C以上分解化学方程式:4CuO 2Cu2O +O2↑16、SO2通入氯化铜溶液中反应离子方程式:2Cu2++2Cl-+SO2+2H2O=2CuCl↓+4H++SO42-17、将铜粉加入氯化铜溶液中反应离子方程式:Cu2++2Cl-+Cu= CuCl↓18、将KI溶液加入到氯化铜溶液中反应离子方程式:2Cu2++4l-= 2Cul↓+ l219、氢氧化铜溶于强酸离子方程式:Cu(OH)2+2H+=Cu2++2H2O20、氢氧化铜溶于氨水离子方程式:Cu(OH)2+4NH3·H2O=[Cu(NH3)4]2++ 2OH-+4H2O21、氢氧化铜受热分解化学方程式:Cu(OH)2 CuO+ H2O。


精心整理铜银锌及其化合物的化学方程式和离子方程式一、铜1、铜在氯气中燃烧:Cu+Cl2CuCl22、铜和氧气加热:2Cu+O22CuO3、铜与硫共热:2Cu+S Cu2S4445673Cu(NO+Cu832FeCl+2Fe1Cu2233、一氧化碳与氧化铜共热:CuO +CO Cu+CO24、碳粉与氧化铜共热:2CuO +C2Cu+CO2↑5、氧化铜与硫酸反应:CuO+H2SO4CuSO4+H2OCuO+2H+Cu2++H2O6、氧化铜与氯化铁溶液反应:3CuO+2FeCl3+3H2O2Fe(OH)3+3CuCl23CuO +2Fe 3++3H 2O2Fe(OH)3+3Cu 2+三、氢氧化铜1、氢氧化铜溶于稀硫酸:Cu(OH)2+H 2SO 4CuSO 4+2H 2OCu(OH)2+2H +Cu 2++2H 2O2、氢氧化铜与氯化铁溶液反应:3Cu(OH)2+2FeCl 32Fe(OH)3+3CuCl 23Cu(OH)2+2Fe 3+2Fe(OH)3+3Cu 2+31CuCl 2CuS CuS 33CuCO -CuCO 4Cu(OH)OCu(OH)5632247、硫酸铜溶液和偏铝酸钠溶液混合:CuSO 4+2NaAlO 2+4H 2O Cu(OH)2↓+2Al(OH)3↓+Na 2SO 4Cu 2++2AlO 2-+4H 2OCu(OH)2↓+2Al(OH)3↓8、硫酸铜溶液中加入锌:Zn +CuSO 4ZnSO 4+CuZn +Cu 2+Zn 2++Cu9、铁和硫酸铜溶液反应:Fe +CuSO 4FeSO 4+Cu10、加热硫酸铜晶体:CuSO 4·5H 2OCuSO 4+5H 2O11、水蒸气通过无水硫酸铜:CuSO 4+5H 2O CuSO 4·5H 2O五、银1、银与浓硝酸反应:Ag +2HNO 3AgNO 3+NO 2↑+H 2OAg +2H ++NO 3-Ag ++NO 2↑+H 2O21AgCl 2NaBrAgBr -AgBr 3KIAgI -AgI 4Ag 5AgOH6、向硝酸银溶液加入氢氧化钠溶液:AgNO 3+NaOHAgOH ↓+NaNO 3Ag ++OH -AgOH ↓7、硝酸银溶液中加入少量氨水:AgNO 3+NH 3·H 2OAgOH ↓+NH 4NO 3 Ag ++NH 3·H 2OAgOH ↓+NH 4+8、硝酸银溶液加入过量氨水:AgNO 3+2NH 3·H 2O Ag(NH 3)2NO 3+2H 2OAg ++2NH 3·H 2OAg(NH 3)2++2H 2O9、铜与硝酸银溶液反应:Cu +2AgNO 3Cu(NO 3)2+2Ag10、硝酸银见光分解:2AgNO32Ag +2NO 2↑+O 2↑七、锌1、锌在氯气在燃烧:Zn +Cl 2ZnCl 22、锌与氧气共热:2Zn +O 22ZnO3、锌与硫共热:Zn +SZnS4567+Zn 84ZnSO +Zn 9103Zn +2Fe3+3Zn 2++2Fe八、氧化锌1、氢气通过灼热的氧化锌:ZnO +H 2Zn +H 2O2、铝与氧化锌高温反应:3ZnO +2Al 3Zn +Al 2O 33、一氧化碳与氧化锌高温反应:ZnO +CO Zn +CO 24、碳粉与氧化锌高温反应:2ZnO +C 2Zn +CO 2↑5、氧化锌与硫酸反应:ZnO +H 2SO 4ZnSO 4+H 2O见光或受热ZnO +2H +Zn 2++H 2O6、氧化锌与氯化铁溶液反应:3ZnO +2FeCl 3+3H 2O2Fe(OH)3+3ZnCl 23ZnO +2Fe 3++3H 2O2Fe(OH)3+3Zn 2+九、氢氧化锌1、氢氧化锌溶于稀硫酸:Zn(OH)2+H 2SO 4ZnSO 4+2H 2OZn(OH)2+2H +Zn 2++2H 2O22Fe(OH)3ZnO 12ZnCl 2SZnS -ZnS 33ZnCO 4Zn(OH)Zn(OH)526、硫酸锌溶液中加入氨水:ZnSO 4+2NH 3·H 2OZn(OH)2↓+(NH 4)2SO 4Zn 2++2NH 3·H 2OZn(OH)2↓+2NH 4+7、硫酸锌溶液和偏铝酸钠溶液混合:ZnSO 4+2NaAlO 2+4H 2O Zn(OH)2↓+2Al(OH)3↓+Na 2SO 4Zn 2++2AlO 2-+4H 2OZn(OH)2↓+2Al(OH)3↓8、硫酸锌溶液中加入镁:Mg +ZnSO 4MgSO 4+ZnMg+Zn2+Mg2++Zn。
系列三 副族金属 专题3 铜及其化合物1.“铜”的颜色与溶解性 物质 颜色 状态及溶解性物质 颜色 状态及溶解性 Cu紫红色、金属光泽固态,难溶于非氧化性酸,易溶于强氧化性酸 CuSO 4白色粉末,易溶于水,水溶液呈蓝色CuO 黑色 粉末,可溶于酸溶液CuSO 4·5H 2O 蓝色 晶体Cu 2O砖红色固体,难溶于水,可溶于酸溶液(生成Cu 和Cu 2+)Cu 2(OH)2CO 3 绿色粉末,难溶于水,可溶于酸溶液CuCl ,CuI 白色 粉末,难溶于水Cu(OH)2蓝色难溶于水,可溶于酸溶液CuS黑色粉末,难溶于水及非氧化性强酸[Cu(NH 3)4]2+深蓝色 络合离子,溶于水2.铜被锈蚀(1)与O 2的反应:在空气中或O 2中加热表面变黑:CuO 2O Cu 22∆+,利用此反应可除去混在H 2、CO 中的少量O 2。
(2)与O 2、CO 2、H 2O 的作用:铜在干燥的空气中比较稳定,在水中也几乎不反应,在含有二氧化碳的潮湿空气中铜可生成铜绿,322222CO )OH (Cu O H CO O Cu 2=+++,铜绿可防止金属进一步腐蚀。
铜绿可以溶解于稀硫酸Cu 2(OH)2CO 3+4H +===2Cu 2++CO 2↑+3H 2O 。
3.铜的溶解(1)和强氧化性体系反应 铜和硝酸反应:Cu+4HNO 3(浓)Cu(NO 3)2+2NO 2↑+2H 2O ,3Cu+8HNO 3(稀)3Cu(NO 3)2+2NO↑+4H 2O铜和浓硫酸反应:Cu+2H 2SO 4(浓)CuSO 4 + SO 2↑ + 2H 2O 。
反应后试管内的现象为:铜片逐渐溶解,产生无色刺激性气味的气体,溶液变为灰白色,如何检测反应后的产物:溶液加入水中变蓝证明有硫酸铜,气体通入到品红溶液中褪色,加热后恢复红色证明是二氧化硫。
工业上用FeCl 3溶液做“腐蚀液”,腐蚀多余的铜箔,制作印刷电路板,其反应原理是(离子方程式):Cu+2FeCl 3 CuCl 2+2FeCl 2 (2)铜和稀硫酸反应①电解法:阳极:Cu-2e -=Cu 2+,阴极(石墨):2H ++2e -=H 2↑ ②外加氧化剂法:向体系中充入氧气:2Cu+4HCl+O 22CuCl 2+2H 2O向体系中加入KNO 3:3Cu + 8H + + 2NO3-= 3Cu 2+ + 2NO ↑ + 4H 2O 向体系中加入H 2O 2:Cu+H 2SO 4+H 2O 2=CuSO 4+2H 2O 向体系加入芬顿试剂:2Fe 2++2H ++H 2O 22Fe 3++2H 2O ,2Fe 3++CuCu 2++2Fe 2+。
铜及其化合物的化学方程式
一、铜的化学性质
根据铜在金属活动性顺序表中的位置,它应属于不活泼的金属,因此它置换出酸或水中的氢。
1、铜与非金属的反应
与氧气反应:
与氯气反应
与硫反应(产物为硫化亚铜)
3、与酸的反应
铜与非氧化性酸(如盐酸、稀硫酸等)不反应。
铜与强氧化性酸(如浓硫酸、浓、稀硝酸等)能反应,但不生成氢气。
与浓硫酸反应
与浓硝酸反应
与稀硝酸反应的离子方程式
4、与盐溶液的反应
与硝酸银溶液反应的离子方程式、
与氯化铁溶液反应离子方程式
二、铜的冶炼
湿法炼铜(铁和硫酸铜反应)
电解精炼铜是如何除去Ag、Au、Fe、Zn等杂质的?
电解精炼铜时,阳极材料:阴极材料:电解质溶液:
电极反应(主要电极反应式):
阳极
阴极
三、铜的重要化合物
1、CuO CuO为黑色而Cu2O为红色。
一氧化碳还原氧化铜
2、Cu(OH)2 蓝色沉淀
氢氧化铜生成的离子方程式
氢氧化铜受热分解
2、CuSO4及CuSO4·5H2O
硫酸铜晶体(CuSO4·5H2O)俗名或。
CuSO4·5H2O受热分解的化学方程式为:
五、铜及其化合物的转化关系:。