第10章 P区元素(一)
- 格式:ppt
- 大小:963.00 KB
- 文档页数:93


p区非金属元素(一)(卤素、氧、硫)(3学时)
卤素是无机元素,它的原子结构由海德兰(Heldelberg)系统中的17种元素构成,
这些元素包括氟(F)、氯(Cl)、溴(Br)、碘(I)和氙(Xe)。
在常温常压下,它
们分别以气体、液体和固体的形式存在。
除了碘外,卤素之间互相极其易溶,但已知性质
又有很大的不同。
由于卤素具有高的电负性,它们能够通过组装到多种特定的构型中形成电离软下化合物,如盐和硫酸盐。
因此,它们不仅可以提供对多种非金属元素的易溶性,还可以提供其
他种类的化学反应。
卤素最初发现于18月,由爱因斯坦(Einstein)等人发现,被称为“阿里斯王子”(Prince Albert)。
在20世纪开始以来,卤素则被广泛应用于农业、工业和放射性元素
提取等领域,包括催化芳烃反应、用合成药物等。
此外,卤素还有重要的作用,特别是当与其他物质(如氧、硫等元素)结合时,能够
丰富和改善空气质量。
例如,氯可以与水混合形成消毒剂,用于净化水;溴可以与水混合
形成净化剂,可用于净化工厂污水、污泥等;硫也可以改善空气质量,用于降低空气污染。
由于其许多特性,卤素对当今社会至关重要,它给改善生活质量和保护环境带来巨大
的贡献。
因此,在未来,卤素将继续被广泛应用于许多领域,并将一直是人类发展的重要
元素。

p区元素实验报告P区元素实验报告引言:P区元素是指位于元素周期表第15组的元素,包括氮(N)、磷(P)、砷(As)、锑(Sb)和铋(Bi)。
这些元素在化学和生物学领域中具有重要的应用价值。
本实验旨在通过实际操作,探索P区元素的性质和特点。
实验一:氮的制备和性质氮是地球大气中含量最丰富的元素之一,它在自然界中以氮气(N2)的形式存在。
实验中,我们采用了氨水和氯化铵的反应制备氮气。
首先,在装有氨水的烧瓶中加入适量的氯化铵固体,然后用酸将氯化铵分解生成氨气(NH3),最后通过加热和冷却的过程将氨气转化为氮气。
实验结果表明,氮气是一种无色、无味、无毒的气体,具有较低的反应性。
实验二:磷的制备和性质磷是一种非金属元素,它以白色或黄色固体的形式存在。
实验中,我们采用了磷酸钠和硫酸的反应制备磷酸氢二钠。
首先,在烧杯中加入适量的磷酸钠固体,然后缓慢加入硫酸,搅拌使反应进行。
实验结果表明,磷酸氢二钠是一种无色结晶体,具有较强的酸性。
实验三:砷的制备和性质砷是一种具有金属和非金属特性的元素,它以灰色固体的形式存在。
实验中,我们采用了砷酸钠和硫酸的反应制备砷酸氢钠。
首先,在烧杯中加入适量的砷酸钠固体,然后缓慢加入硫酸,搅拌使反应进行。
实验结果表明,砷酸氢钠是一种无色结晶体,具有毒性。
实验四:锑的制备和性质锑是一种具有金属和非金属特性的元素,它以灰色固体的形式存在。
实验中,我们采用了锑酸钠和硫酸的反应制备锑酸氢钠。
首先,在烧杯中加入适量的锑酸钠固体,然后缓慢加入硫酸,搅拌使反应进行。
实验结果表明,锑酸氢钠是一种无色结晶体,具有较强的酸性。
实验五:铋的制备和性质铋是一种具有金属特性的元素,它以银白色固体的形式存在。
实验中,我们采用了铋酸钠和硫酸的反应制备铋酸氢钠。
首先,在烧杯中加入适量的铋酸钠固体,然后缓慢加入硫酸,搅拌使反应进行。
实验结果表明,铋酸氢钠是一种无色结晶体,具有较强的酸性。
结论:通过本次实验,我们对P区元素的制备和性质有了更深入的了解。
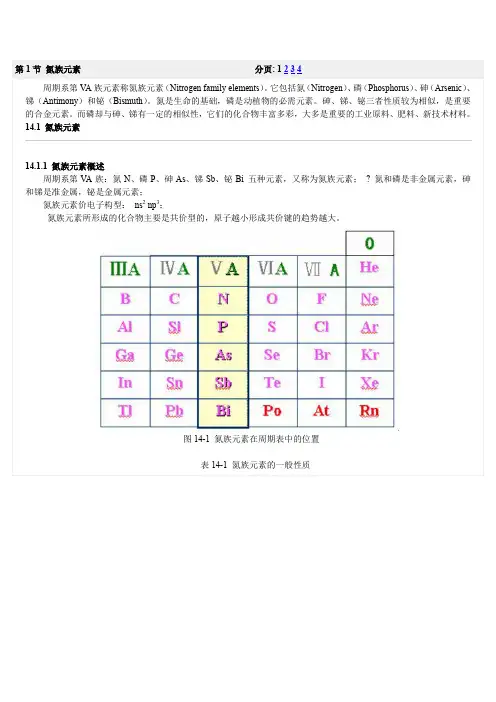
14.1.2 氮族元素的单质?????图14-2 氮族元素的单质1.存在氮族元素中除磷在地壳中含量较多外,其它各元素含量均较少。
氮主要以单质存在于大气中,天然存在的氮的无机化合物较少。
磷较容易氧化,在自然界中不存在单质。
它主要以磷酸盐的形式分布在地壳中。
? 砷、锑和铋主要以硫化物矿的形式存在,如雄黄:As4 S4。
雌黄(As2S3 )辉锑矿(Sb2S3 ) 雄黄(As4S4)图14-3 氮族元素的存在2. 性质除氮气外,其它氮族元素的单质都比较活泼。
化学性质列于上表中。
表14-2 氮族元素的化学性质3. N2N2分子的分子轨道表达式为:N2[(σ1s)2(σ1s*)2(σ2s)2(σ2s*)2(π2py,π2pz)4(σ2px)2]氮气是无色、无臭、无味的气体。
沸点为-195.8°C。
微溶于水。
强的N≡N键(944kJ/mol),常温下化学性质极不活泼,故N2常常作为惰性气体使用。
4. 磷的同素异形体图14-4 白磷和红磷(1)白磷的结构白磷的结构由P4分子通过分子间力堆积起来,每个磷原子通过其px,py和pz轨道分别和另外3个磷原子形成3个σ键,键角∠PPP为60°,分子内部具有张力,其结构不稳定。
图14-5 白磷的结构白磷的性质白磷P4是透明的、柔软的蜡状固体,化学性质活泼,空气中自燃,溶于非极性溶剂。
图14-6 白磷在空气中自燃白磷的制备将磷酸钙、砂子和焦炭混合在电炉中加热到约1500?C,可得到白磷。
2Ca3(PO4)2(s) + 6SiO2(s) + 10C(s) P4(g) + 6CaSiO3(l) + 10CO(g)(2)红磷将白磷隔绝空气加热到400℃时可得到红磷。
红磷的结构较复杂。
一种观点认为:P4分子中的一个P—P键断裂后相互连接起来形成长链结构。
所以红磷较稳定,400℃以上燃烧,不溶于有机溶剂。
图14-7 红磷的可能结构(3)黑磷黑磷具有与石墨类似的层状结构,但与石墨不同的是,黑磷每一层内的磷原子并不都在同一平面上,而是相互连接成网状结构。

13.1 复习笔记一、p区元素概述1.p区元素包括了除氢以外的所有非金属元素和部分金属元素。
与s区元素相似,p区元素的原子半径在同一族中自上而下逐渐增大,它们获得电子的能力逐渐减弱,元素的非金属性也逐渐减弱,金属性逐渐增强。
除第ⅦA族和稀有气体外,p区各族元素都由明显的非金属元素过渡到明显的金属元素。
2.p区元素特征(1)各族元素性质由上到下呈现二次周期性①第二周期元素具有反常性(只有2s,2p轨道);第二周期元素单键键能小于第三周期元素单键键能。
②第四周期元素表现出异样性(d区插入),例如:溴酸、高溴酸氧化性分别比其他卤酸(HClO3,HIO3)、高卤酸(HClO4,H5IO6)强。
③最后三个元素性质缓慢地递变(d区、f区插入)。
(2)多种氧化值①p区元素的价电子构型为n s2n p1-6,具有多种氧化态。
例如:氯的氧化值有+1,+3,+5,+7,-1,0等。
②惰性电子对效应:同族元素从上到下,低氧化值化合物比高氧化值化合物变得更稳定。
(3)电负性大,形成共价化合物。
二、硼族元素1.硼族元素概述硼族元素包括B,Al,Ga,In,Tl五种元素,其价电子构型为n s2n p1,因此他们一般形成氧化值为+3的化合物。
随着原子序数的增加,形成低氧化值+1化合物的趋势逐渐增强。
硼的原子半径较小,电负性较大,所以硼的化合物都是共价型的,在水溶液中也不存在B3+。
在硼族元素化合物中形成共价键的趋势自上而下依次减弱。
(1)缺电子元素硼族元素原子的价电子轨道数为4,而其价电子只有3个,这种价电子数小于价键轨道数的原子称为缺电子元素。
它们所形成的化合物有些为缺电子化合物。
缺电子化合物的特点:易形成配位化合物HBF4;易形成双聚物Al2Cl6。
(2)硼族元素的一般性质①B是非金属单质,Al、Ga、In、Tl是金属单质;②B,Al,Ga的氧化态是+3,In的氧化态是是+1和+3,Tl的氧化态是+1;③B的最大配位数是4,Al、Ga、In、Tl 的最大配位数是6。

实验 P 区非金属元素(一)(卤素、氧、硫)一、实验目的1、学习氯气、次氯酸盐、氯酸盐的制备方法。
掌握次氯酸盐、氯酸盐强氧化性的区别。
了解氯、溴、氯酸钾的安全操作。
2、掌握H2O2 的某些重要性质。
3、掌握不同氧化态硫的化合物的主要性质。
4、掌握气体发生的方法和仪器的安装。
二、实验用品仪器:铁架台、石棉网、蒸馏烧瓶、分液漏斗、烧杯、大试管、滴管、试管、表面皿、 离心机、酒精灯、锥形瓶、温度计。
固体药品:二氧化锰、过二硫酸钾。
液体药品:HCl(浓、6mol/L、2mol/L)、H2SO4(浓、3mol/L、1mol/L)、HNO3(浓)、 NaOH(2mol/L)、 KOH(30%)、KI(0.2mol/L)、KBr(0.2mol/L)、 K2Cr2O7(0.5mol/L)、 KMnO4(0.2mol/L) 、 Na2S(0.2mol/L) 、 Na2S2O3(0.2mol/L) 、 Na2SO3(0.5mol/L) 、 CuSO4(0.2mol/L)、 MnSO4(0.2mol/L、 0.002mol/L)、 Pb(NO3)2(0.2mol/L)、 AgNO3(0.2mol/L)、 H2O2(3%)、氯水、溴水、碘水、CCl4、乙醚、品红、硫代乙酰胺(0.1mol/L)。
材料:玻璃管、橡皮管、棉花、冰、pH试纸、滤纸。
三、实验内容:(一)氯酸钾和次氯酸钠的制备分液漏斗装有30mL浓盐酸; A管装15mL30%的KOH, 蒸馏烧瓶内装15g二氧化锰,并置入70~80℃的热水浴中; B管装有15mL2mol/LNaOH, 置入冰水浴中; C管装15mL 水;D装2mol/LNaOH溶液(目的吸收多余的氯气),并在瓶口覆盖用硫代硫酸钠溶液 浸过的棉花(目的除氯气)。
MnO2 + 4HCl(浓) === MnCl2 + Cl2↑+2H2O3Cl2 + 6KOH(热) === 5KCl + KClO3 +3H2OCl2 + 2NaOH === NaCl + NaClO +H2OCl2 + H2O === HCl + HClO注意:(1)装置的气密性;(2)滴盐酸要缓慢而均匀;(3)A 管溶液由黄变无色 时,停止加热氯气发生装置,反应停止往蒸馏烧瓶中加入大量水;(4)冷却 A管溶液, 析出氯酸钾晶体,倾析法倾去溶液,晶体置入表面皿,滤纸吸干;(5)注意观察各管 实验现象,做好记录;(6)注意通风。




p区元素讲课教案第10章 p 区元素【10-1】完成下列反应⽅程式:(1)KBr+KBrO 3+H 2SO 4(2)AsF 5+H 2O (3)OCl 2+H 2O(4)Cl2通⼊热的碱液(5)Br2加⼊冰⽔冷却的碱液解:(1)5KBr+KBrO 3+3H 2SO 4 = 3Br 2+3K 2SO 4+3H 2O(2)AsF 5+4H 2O = H 2AsO 4 +5HF (3)OCl 2+H2O = 2 HClO(4)3Cl 2 + 6NaOH(热) = NaClO 3 + 5 NaCl+ 3H 2O (1)Br 2 + 2NaOH(冰⽔) = NaBr + NaBrO+H 2O【10-2】⽤表9-1和表10-1有关数据⽐较F2和Cl2分别与Na(s)反应时,何者放出的能量更多?并指出造成此结果的原因(NaF 和NaCl 的晶格能分别为915kJ/mol 和778kJ/mol )。
解:.前者放出的能量多(11402(NaCl),556)(--?-=??-=?mol kJ rH mol kJ NaF rH ),因为氟的原⼦半径⼩,当⽣成离⼦化合物时晶格能⼤。
计算过程如下:【10-3】Br 2能从I - 溶液中取代出I ,但I 2⼜能从KBrO 3溶液中取代出Br 2,这两种实验事实有⽆⽭盾?为什么?解:不⽭盾。
因为φ?(Br 2/Br -)>φ? (I 2/I -),所以Br 2+2I- 2Br -+I 2能进⾏,说明氧化性Br 2>I 2;⼜因为φ? (Br /Br 2)>φ? (I/I 2),所以2Br +I 2 Br 2+2I能进⾏,说明氧化性Br>I,或还原性I 2>Br 2。
【10-4】将Cl 2不断地通⼊KI 溶液中,为什么开始时溶液呈黄⾊,继⽽有棕⾊沉淀产⽣,最后⼜变成⽆⾊溶液?解:黄⾊为I 3-, 棕褐⾊沉淀为I 2, ⽆⾊为IO 3-。
有关反应为:2I - + Cl 2 === 2Cl - + I 2I 2 + I - === I 3-I 2 + 5Cl 2 + 6H 2O === 2IO 3- + 10Cl - + 12H +【10-5】写出下列制备过程中的反应⽅程式:(1)由NaBr 制备HBr (2)由KI 制备KIO 3 (3)由I 2和P 制备HI (4)由Cl 2和CaCO 3制备漂⽩粉解:电解(2) KI + 3H 2O === KIO 3 + 3H 2↑(4) CaCO 3===CaO+CO 2↑ CaO + H 2O===Ca(OH)2 2Cl 2 + 2Ca(OH)2===CaCl 2 + Ca(ClO)2 + 2H 2O ⾼温5. (1) NaBr + H 3PO 4=== NaH 2PO 4 + HBr (3) 2I 2 + 3P + 6H 2O === 2H 3PO 4 + 6H 2O电解(2) KI + 3H 2O === KIO 3 + 3H 2↑(4) CaCO 3===CaO+CO 2↑ CaO + H 2O===Ca(OH)2 2Cl 2 + 2Ca(OH)2===CaCl 2 + Ca(ClO)2 + 2H 2O ⾼温5. (1) NaBr + H 3PO 4=== NaH 2PO 4 + HBr (3) 2I 2 + 3P + 6H 2O === 2H 3PO 4 + 6H 2O【10-6】⽐较下列性质的⼤⼩(1)键能:F —F 和Cl —Cl (2)电⼦亲合能:F 和Cl (3)酸性:HI 和HCl (4)热稳定性:HI 和HCl (5)⽔中溶解度:MgF 2和MgCl 2 (6)氧化性:HClO 和HClO 4解:(1)F —FHCl ;(4)HIHClO 4 【10-7】在淀粉碘化钾溶液中加⼊少量NaClO 时,得到蓝⾊溶液A ;继续加⼊过量NaClO 时,得到⽆⾊溶液B 。
