高考第一轮复习——电解原理及应用(学案含答案)
- 格式:doc
- 大小:102.07 KB
- 文档页数:6

专题23 电解池及其应用1.用“四室电渗析法”制备H3PO2的工作原理如图所示(已知:H3PO2是一种具有强还原性的一元弱酸;阳膜和阴膜分别只允许阳离子、阴离子通过),则下列说法不正确...的是( )A.阳极电极反应式为:2H2O-4e-===O2↑+4H+B.工作过程中H+由阳极室向产品室移动C.撤去阳极室与产品室之间的阳膜a,导致H3PO2的产率下降D.通电一段时间后,阴极室中NaOH溶液的浓度一定不变2.如图所示,其中甲池的总反应式为2CH3OH+3O2+4KOH===2K2CO3+6H2O。
下列说法正确的是()A.1min内甲池消耗1mol O2转移的电子是乙池Ag电极转移电子数的4倍B.甲池通入CH3OH的电极反应式为CH3OH-6e-+2H2O===CO32-+8H+C.反应一段时间后,向乙池中加入一定量Cu(OH)2固体能使CuSO4溶液恢复到原浓度D.甲池中消耗280mL(标准状况下)O2,此时丙池中理论上最多产生1.45g固体3.电解法制取Na2FeO4的总反应为Fe+2H2O+2OH-FeO42-+3H2↑,工作原理如图所示。
已知:Na2FeO4只在强碱性条件下稳定,易被H2还原。
下列叙述正确的是( )A.铁电极上发生还原反应,生成FeO42-B.通电一段时间后,阳极区pH下降C.通电后Na+向右移动,阴极区Na+浓度增大D.当电路中通过1 mol电子时,阴极区有11.2 L H2生成4.二甲醚(CH3OCH3)直接燃料电池具有启动快、效率高等优点,用二甲醚燃料电池电解甲基肼(CH3—NH—NH2)制氢的装置如图所示,其中X、Y、M、N均为惰性电极。
下列说法正确的是A.M极的电极反应式为CH3—NH—NH2+12OH−−10e−CO32-+N2+9H2OB.若忽略水的消耗与生成,甲中电解质溶液的pH减小,乙中电解质溶液的pH 增大C.乙中的交换膜是阴离子交换膜,OH−透过交换膜向N极移动D.理论上,当生成6.72 L H2时,消耗CH3OCH3的质量为2.3 g5.空间实验室“天宫一号”的供电系统中有再生氢氧燃料电池(RFC),RFC是一种将水电解技术与氢氧燃料电池技术相结合的可充电电池。
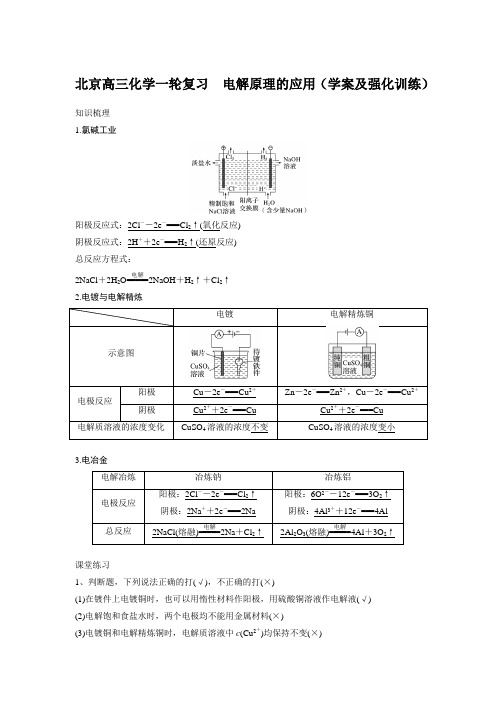
北京高三化学一轮复习 电解原理的应用(学案及强化训练)知识梳理 1.氯碱工业阳极反应式:2Cl --2e -===Cl 2↑(氧化反应) 阴极反应式:2H ++2e -===H 2↑(还原反应) 总反应方程式:2NaCl +2H 2O=====电解2NaOH +H 2↑+Cl 2↑ 2.电镀与电解精炼Cu -2e -===Cu 2+Zn -2e -===Zn 2+,Cu -2e -===Cu 2+3.电冶金课堂练习1、判断题,下列说法正确的打(√),不正确的打(×)(1)在镀件上电镀铜时,也可以用惰性材料作阳极,用硫酸铜溶液作电解液(√) (2)电解饱和食盐水时,两个电极均不能用金属材料(×)(3)电镀铜和电解精炼铜时,电解质溶液中c (Cu 2+)均保持不变(×)(4)电解冶炼镁、铝通常电解MgCl2和Al2O3,也可以电解MgO和AlCl3(×)(5)电解精炼时,阳极泥可以作为提炼贵重金属的原料(√)(6)用Zn作阳极,Fe作阴极,ZnCl2作电解质溶液,由于放电顺序H+>Zn2+,不可能在铁上镀锌(×)强化训练1.金属镍有广泛的用途,粗镍中含有Fe、Zn、Cu、Pt等杂质,可用电解法制得高纯度的镍。
下列叙述中正确的是(已知:氧化性Fe2+<Ni2+<Cu2+)()A.阳极发生还原反应,其电极反应式为Ni2++2e-===NiB.电解过程中,阳极质量的减少量与阴极质量的增加量相等C.电解后,溶液中存在的阳离子只有Fe2+和Zn2+D.电解后,电解槽底部的阳极泥中有Cu和Pt答案 D2.利用如图所示装置模拟电解原理在工业生产中的应用。
下列说法正确的是()A.氯碱工业中,X电极上的反应式是4OH--4e-===2H2O+O2↑B.电解精炼铜时,Z溶液中的Cu2+浓度不变C.在铁片上镀铜时,Y是纯铜D.制取金属镁时,Z是熔融的氯化镁答案 D3用电解氧化法可以在铝制品表面形成致密、耐腐蚀的氧化膜,电解质溶液一般为H2SO4-H2C2O4混合溶液。

第三课时电解原理及其应用【课时目标】1、电解原理、装置、构造。
2、电极的判断、电极反应、电极方程式的书写3、电解原理的应用:铜的电解精练、电镀、氯碱工业等4、离子的放电顺序、电解的有关计算教学环节复习提问:1、铅蓄电池的电极反应式2、氢氧燃料电池的电极反应式①硫酸做电解液②氢氧化钾做电解质授课:一、知识梳理(一)电解原理1、电解定义。
电解池是把电能转化为化学能的装置,装置特点:借助于电流引起氧化还原反应的装置。
2、从装置名称、能量转化、电极名称、电极反应、溶液中的离子移方向、电子流向对原电池与电解池进行对比,从而理解电解的原理。
更清晰的认识原电池与电解池的特点。
3、电极产物的判断:阳极放电顺序:S2->I->Br->Cl->OH->含氧酸根阳离子放电顺序:Ag+>Hg2+>Fe3+>Cu2+>H+>Pb2+>Sn2+>Fe2+>Zn2+>H+>Al3+>Mg2+>Na +>Ca2+>K+。
处理有关电解池两极产物的问题,一定要先看电极是活性电极还是惰性电极。
活性电极在阳极放电,电极溶解生成相应的金属离子,此时阴离子在阳极不放电。
对于惰性电极,则只需比较溶液中定向移动到两极的阴阳离子的放电顺序即可。
学生根据放电顺序书写电极反应方程式。
并有阴阳极的产物判断恢复到原状态需要加入的物质,判断溶液PH值的变化。
(二)电解的应用1、氯碱工业①阴阳极电极反应式及总反应式的书写②阴阳极的产物及检验方法③了解离子交换膜的作用④食盐的精制2、电解精炼,阳极材料是——粗铜,阴极材料是——精铜,电解质溶液是CuSO4溶液(或Cu(NO3)2溶液)。
粗铜中的杂质去向,3、电镀(1)形成条件:①电解时镀层金属作阳极;②镀件作阴极;③含镀层金属离子的电解质溶液作电镀液;④用直流电源。
(2)特征:①阳极本身放电被氧化;②宏观上看无新物质生成;③电解液的总量、浓度、pH均不变。

考点五十五电解池及电解原理聚焦与凝萃1.理解电解原理,会推断电解池、电极产物、电极四周溶液pH值及整个溶液pH值的变化;2.正确书写电极反应式。
解读与打通常规考点一、电解池:把电能转变成化学能的装置叫做电解池。
二、电解原理以电解氯化铜溶液为例,装置如下图。
原理分析: CuCl2是强电解质且易溶于水,在水溶液中电离生成Cu2+和Cl-:CuCl2=Cu2++2Cl-。
通电前后溶液里离子移动示意图通电前,Cu2+和Cl-在水里自由地移动着(如图Ⅰ所示);通电后,这些自由移动着的离子,在电场的作用下,改做定向移动。
依据异性相吸的原理,带负电的氯离子向阳极移动,带正电的铜离子向阴极移动(如图Ⅱ所示)。
在阳极,氯离子失去电子而被氧化成氯原子,并两两结合成氯分子,从阳极放出。
在阴极,铜离子获得电子而还原成铜原子,就掩盖在阴极上。
他们的反应可分别表示如下:阳极:2Cl--2e-=Cl2↑ (氧化反应)阴极:Cu2++2e-=Cu (还原反应)电解CuCl2溶液的化学反应方程式为:CuCl 2电解Cu+Cl2↑三、电解池构成:1.电极且分别与电源的正、负极相连:(1)阴极:与电源的负极相连,在阴极上发生还原反应;(2)阳极:与电源的正极相连,在阳极上发生氧化反应。
2.电解质溶液或熔融电解质3.闭合回路4.直流电源隐性考点1.放电挨次(1)阴极放电挨次(即氧化性挨次)Ag+>Hg2+>Fe3+>Cu2+>(H+)>Pb2+>Sn2+>Fe2+>Zn2+>Al3+>Mg2+>Na+>Ca2+>K+(2)阳极放电挨次(即还原性挨次)金属单质(除Pt、Au外)>S2->I->Br->Cl->OH->含氧酸根>F-用石墨、金、铂等还原性很弱的材料制作的电极又叫做惰性电极,理由是它们在一般的通电条件下不发生化学反应。


《电解原理及运用》李仕才(考试时间:45分钟满分:100分)一、单项选择题:本题包括10小题,每小题5分,共50分。
1. 若某池(电解池或原电池)的总反应离子方程式是Cu+2H+===Cu2++H2↑,关于此池的有关说法正确的是A.该池只能是电解池,且金属铜为该电解池的阳极B.该池只能是原电池,且电解质溶液为硝酸C.该池可能是原电池,也可能是电解池D.该池只能是电解池,电解质溶液可以是硫酸铜答案A解析:铜与H+不反应,因而不可能是原电池,只能是电解池。
在该电解池中,铜失去电子被氧化,因而铜作电解池的阳极,A正确,B、C错误;D 选项中若电解质溶液是硫酸铜溶液,则相当于电镀铜,与题给离子方程式不符,故D错误。
2.某溶液中含有Cu2+、Fe2+、Al3+、Cl-、NO-3,且浓度均为0.1 mol/L,用石墨作电极进行电解时,肯定得不到的产物是( )A.Cl2B.AlC.Cu D.H2答案B解析:阴极上Al3+、Fe2+的放电能力弱于H+,而Cu2+的放电能力比水电离出的H+的放电能力强,阳极上Cl-放电能力强于OH-。
3.埋在地下的钢管常用如图所示的方法加以爱护,使其免受腐蚀。
关于此方法,以下说法正确的是( )A.金属棒X的材料可能为铜 B.金属棒X的材料可能为钠C.钢管四周土壤的pH可能会上升 D.这类方法属于外加电流的阴极爱护法答案C解析:金属棒X的材料若为铜,则易腐蚀钢管,A项错误;钠为活泼金属,易发生反应,B项错误;钢管吸氧发生还原反应,产生OH-,四周土壤的pH可能会上升,C项正确;该安装没有外接电源,不属于外加电流的阴极爱护法,D项错误。
4.用石墨作电极电解CuSO4溶液。
通电一段时间后CuSO4未充分电解,欲使电解液恢复到起始形状,应向溶液中加入适量的( )A.CuSO4B.H2OC.CuO D.CuSO4·5H2O答案C解析:本题考查了电解规律和电解质溶液的复原。
用石墨作电极电解硫酸铜溶液,阳极反应式为:4OH--4e-===O2↑+2H2O,阴极反应式为:Cu2++2e-===Cu,即阳极冒出氧气,阴极析出铜,通电一段时间后要想使电解液恢复原状,应加入氧化铜固体。
2020届高三化学一轮复习精品教学案+分层练习电化学原理电解原理及其应用【考纲要求】1. 判定某装置是否是电解池。
2. 明白得电解原理、书写电解池工作时的电极反应式。
把握电解前后溶液浓度和pH的变化。
3. 了解铜的电解精炼和电镀装置及原理。
4. 了解氯碱工业的反应原理。
5. 把握有关电解的运算。
教与学方案【自学反馈】一.电解1.定义。
2.电极判定:阳极相连,发生反应。
阴极相连,发生反应。
3.电解时电极产物的判定(1)阳极产物判定第一看电极材料,爽朗金属做电极那么金属失电子被氧化。
假如是惰性电极那么是溶液中易失电子的阴离子失电子被氧化。
(2)阴极产物判定依照阳离子放电顺序进行判定,氧化性强的阳离子第一在阴极得电子被还原。
二.电解原理的应用1.电解饱和食盐水制取氯气和烧碱(氯碱工业)阳极电极反应式:。
阴极电极反应式:。
总反应式:。
2.电解硫酸铜溶液阳极电极反应式:。
阴极电极反应式:。
总反应式:。
3.电镀镀件必须作极. 镀层金属必须作极.电解质溶液中必须含有金属离子。
【例题解析】1.用两支惰性电极插入500mlAgNO3溶液中,通电电解当电解溶液pH从此.6.0变为3.0时,(设电解时阴极没有氢气析出,且电解液在电解前后体积变化能够忽略),电极上应析出银的质量是( )A. 27mgB. 54mgC.108mgD.216mg解题思路:。
易错点:。
2.用惰性电极电解以下溶液,电解一断时刻后,阴极质量增加,电解液的pH下降的是( )A.CuSO4B.AgNO3C.BaCl2D.H2SO4解题思路:。
易错点:。
【考题再现】1.电解CuCl2和NaCl的混合溶液,阴极和阳极上分不析出的物质是( )A.H2和Cl2B.Cu 和Cl2C. H2和O2D. Cu和O2思维方法:。
展望高考:2.用惰性电极实现电解,以下讲法正确的选项是( )A.电解稀硫酸溶液,实质上是电解水,故溶液pH不变B.电解稀氢氧化钠溶液,要消耗OH-,故溶液pH减小C.电解硫酸钠溶液,在阴极上和阳极上析出产物的物质的量之比为1∶2D.电解氯化铜溶液,在阴极上和阳极上析出产物的物质的量之比为1∶1思维方法:。
第二十一讲电解原理及其运用一、要点精讲1.电解O电解池的装置。
构成条件是:2.电解反应及规律⑴阳极:①活性材料作电极时,阳极材料(金属)本身失电子被氧化成阳离子进入溶液,阴离子不容易在电极上放电;②惰性电极(Pt、Au、石墨、钛等)作电极时;溶液中阴离子的放电顺序主要是:OH\ C「、Br\ S2-;⑵阴极:无论是惰性电极还是活性电极都不参与电极反应,发生反应的是溶液中的阳离子,阳离子在阴极上放电顺序主要和金属活泼性相反;⑶电解质溶液用惰性电极电解的规律小结:3.电解原理的应用:电镀(以镀铜为例)、电解精炼(以电解精炼铜为例)、氯碱工业。
4.二、典型例题【例1】用惰性电极实现电解,下列说法正确的是 A. 电解稀硫酸溶液,实质上是电解水,故溶液pH 不变 B. 电解稀氢氧化钠溶液,要消耗OHL 故溶液pH 减小C. 电解硫酸钠溶液,在阴极上和阳极上析出产物的物质的量之比为1 : 2D. 电解氯化铜溶液,在阴极上和阳极上析出产物的物质的吊:之比为1 : 1 【例2]如图所示,通电后,A 极上析出Ag,对该装 置的有关叙述中正确的是 A. P 是电源的正极B. F 极上发生的反应为4OH 一一4e 一 = 2玦0+。
2£C. 电解时,甲、乙、丙三池中,除了 E 、F 两极外, 其他电极均参加了反应D. 通电后,甲池溶液的pH 减小,而乙、丙两池溶 液的pH 不变【例3]如下图所示,若电解5min 时铜电极质量 增加2.16 g,试回答:(1)电源电极X 名称为 o ⑵变化:A B,C o(3)通电5min 时,B 中共收集224mL 气体(标况), 溶液体积为200mL 。
(设电解前后无体积变化)则 通电前CuSO 4溶液的物质的量浓度为 0⑷若A 中KC1溶液的体积也是200mL,电解后, 溶液的pH 是 (设前后体积无变化)。
【例41电解原理在化学工业中有广泛应用。
右 图表示一•个电解池,装有电解液a ; X 、Y 是两块电极板,通过导线与宜流 电源相连。
第2课时电解原理的应用[预习案]1.电解饱和食盐水(1)电极反应:阳极: ( 反应)阴极: ( 反应)(2)总反应方程式:离子方程式:(3)应用:氯碱工业制烧碱、氯气和氢气。
2.电镀和电解精炼铜3.电冶金利用电解熔融盐的方法来冶炼活泼金属Na、Ca、Mg、Al等。
[探究案]命题点1 电解原理在工业中的应用题组一电解原理的“常规”应用1.利用如图所示装置,当X、Y选用不同材料时,可将电解原理广泛应用于工业生产。
下列说法中正确的是( )A.氯碱工业中,X、Y均为石墨,X附近能得到氢氧化钠B.铜的精炼中,X是纯铜,Y是粗铜,Z是CuSO4C.电镀工业中,X是待镀金属,Y是镀层金属D.外加电流的阴极保护法中,Y是待保护金属题组二电解原理的“不寻常”应用(一)处理废水2.某工厂采用电解法处理含铬废水,耐酸电解槽用铁板作阴、阳极,槽中盛放含铬废水,原理示意图如下,下列说法不正确的是( )A.A为电源正极B.阳极区溶液中发生的氧化还原反应为Cr2O2-7+6Fe2++14H+===2Cr3++6Fe3++7H2OC.阴极区附近溶液pH降低D.若不考虑气体的溶解,当收集到H2 13.44 L(标准状况)时,有0.1 mol Cr2O2-7被还原(二)制备物质3.电解尿素[CO(NH2)2]的碱性溶液制氢气的装置示意图如下:电解池中隔膜仅阻止气体通过,阴阳两极均为惰性电极。
(1)A极为________,电极反应式为________________________________________。
(2)B极为________,电极反应式为________________________________________。
(三)处理废气4.用NaOH溶液吸收烟气中的SO2,将所得的Na2SO3溶液进行电解,可循环再生NaOH,同时得到H2SO4,其原理如下图所示。
(电极材料为石墨)(1)图中a极要连接电源的(填“正”或“负”)________极,C口流出的物质是________。
电解池的工作原理及应用(时间:45分钟满分:100分)一、选择题(本题包括10小题,每小题6分,共60分,每小题只有一个选项符合题目要求)1.分析右图装置,下列说法错误的是( )A.虚线框中接直流电源,铁可能会被腐蚀B.虚线框中接灵敏电流计或接直流电源,锌都是负极C.虚线框中接灵敏电流计,该装置可将化学能转化为电能D.若电解质溶液为硫酸锌溶液并接上直流电源,该装置可用于铁皮上镀锌答案B解析若虚线框中接直流电源,且铁连接电源正极,此时铁作阳极,则会加快铁的腐蚀,A项正确;若虚线框中接直流电源,此时为电解池,锌是阳极或阴极,若虚线框中接灵敏电流计,锌是负极,B项错误;虚线框中接灵敏电流计,此时为原电池,可将化学能转化为电能,C项正确;若电解质溶液为硫酸锌溶液并接上直流电源,且铁电极连接电源负极,该装置可用于铁皮上镀锌,D项正确。
2.下列关于电化学知识的说法正确的是( )A.用石墨电极电解饱和食盐水,在阳极得到氯气,阴极得到金属钠B.电解精炼铜时,阳极减少的质量不一定等于阴极增加的质量C.用石墨电极电解FeCl3、CuCl2的混合溶液,在阴极上依次析出Al、Fe、CuD.用石墨电极电解CuSO4溶液一段时间后(Cu2+未反应完),加入适量Cu(OH)2可以使溶液恢复至原状态答案B解析用石墨电极电解饱和食盐水,阴极产生氢气,A错误;电解精炼铜时,阳极除铜放电外,比铜活泼的金属如Zn、Fe也放电,但阴极上只有Cu2+放电,B正确;根据金属活动性顺序可知,阴极上离子的放电顺序是Fe3+>Cu2+>H+>Fe2+>Al3+,不会析出铁和铝,C错误;电解CuSO4溶液,阴极析出Cu,阳极生成氧气,欲使溶液恢复至原状态应加入CuO,D错误。
3.用惰性电极电解下列物质的溶液,一段时间后(溶液过量),再加入一定质量的另一种物质(括号内),溶液能与原来溶液完全一样的是( )A.CuCl2(CuSO4)B.NaOH(NaOH)C.NaCl(HCl)D.CuSO4[Cu(OH)2]答案C解析电解CuCl2溶液时,阴、阳两极放电的离子分别是Cu2+和Cl-,所以要恢复原状需加入CuCl2,A项错;电解NaOH溶液相当于电解水,要恢复原状需加水,B项错;电解NaCl溶液时,阴、阳两极放电的离子分别是H+、Cl-,故需加HCl才能恢复原状,C项正确;电解CuSO4溶液时,阴、阳两极的产物分别是Cu、O2,要恢复原状需加CuO或CuCO3,D项错。
一. 教学内容:电解原理及应用二. 教学目标理解电解原理,掌握电极反应式的书写及电解原理的应用三. 教学重点、难点电解原理[教学过程]一、电解原理:电解是电流通过电解质溶液而在阴、阳两极发生氧化还原反应的过程;电解池是将电能转化为化学能的装置;构成条件为:必须连接有直流电源,要有电极(阴、阳极),以及电解质溶液或熔融电解质。
在电解过程中与电源正极相连的极称为阳极,在阳极上发生氧化反应;与电源负极相连的极称为阴极,在阴极上发生还原反应;电解质溶液中的阴离子移向阳极,阳离子移向阴极。
说明:1、电解质溶液的导电过程实质上就是其电解过程。
在电解池中电子流向:电子由电源的负极→电解池的阴极,再由电解质溶液→电解池的阳极→电源正极。
溶液中离子的移动方向:溶液中阳离子向阴极移动,阴离子向阳极移动。
3、电解池与原电池的判断:有外加电源的装置一定是电解池,无外加电源的装置一定是原电池, 多池组合时, 一般是含有活泼金属的池为原电池,其余都是在原电池带动下工作的电解池;若最活泼的电极相同时,则两极间活泼性差别较大的是原电池,其余为电解池。
4、电解池的反应原理:放电:阳离子得到电子或阴离子失去电子。
离子放电的顺序取决于离子的本性,也与离子浓度和电极材料有关。
(1)阳极产物的判断先看电极,若是活泼电极(金属活动顺序表Ag以前,包含Ag),电极放电,溶液中的阴离子不放电;若是惰性电极(如铂、石墨等),则看溶液中阴离子的失电子能力。
在惰性电极上,阴离子放电顺序为:(2)阴极产物的判断:直接根据阳离子放电顺序进行判断,阳离子放电顺序为:注意:高价含氧酸根离子一般不放电5、分析电解问题的基本思路:通电前:电解质溶液中含有哪些阴、阳离子(包括水电离出的H+和OH-)。
通电时:阴离子移向阳极,阳离子移向阴极,结合放电顺序分析谁优先放电。
写电极反应式,并结合题目要求分析电解结果,如两极现象、水的电离平衡移动、离子浓度的变化、pH变化等。
二、电解原理的应用:1、电解精炼铜原理:①粗铜的溶解与纯铜的生成:阳极(粗铜):Cu-2e-=Cu2+阴极(纯铜):Cu2++2e-=Cu②比铜活泼的金属:Zn、Fe、Ni只溶解,不析出;③比铜不活泼的金属:Au、Pt不溶解,而以单质沉积形成阳极泥;④电解质溶液中CuSO4的浓度基本不变;2、电镀:镀件作阴极,镀层金属作阳极,含镀层金属离子的电解质配成电镀液;电镀铜的原理:阳极(镀层金属):Cu-2e-=Cu2+阴极(镀件):Cu2++2e-=Cu电镀液浓度不变;3、氯碱工业:电解饱和食盐水制氢氧化钠和氯气:电极反应及总反应:阳极反应:2Cl--2e-=Cl2↑(氧化反应)阴极反应:2H++2e-=H2↑(还原反应)总反应离子方程式:2Cl-+2H2O=2OH-+H2↑+Cl2↑总反应:阴极区阳极区4、电冶金:通过电解熔融的氯化钠制取金属钠,电解熔融的氧化铝冰晶石的混合物制取金属铝:制取金属钠:阳极反应:2Cl--2e-=Cl2↑阴极反应:2Na++2e-=2NaO-12e-=3O2↑制取金属铝:阳极反应:6 2阴极反应:4Al3++12e-=4Al说明:2、氯碱工业:离子交换膜法制烧碱(1):阳离子交换膜的作用:将电解槽隔成阴极室和阳极室,它只允许阳离子(Na+)通过,而阻止阴离子(Cl-、OH-)和气体通过。
可防止H2、Cl2混合爆炸,也可防止Cl2与NaOH反应。
(2):食盐的精制:①粗盐的成份:泥沙、Ca2+、Mg2+、Fe3+、SO42-杂质,会与碱性物质反应产生沉淀,损坏离子交换膜;②杂质的除去过程:(3)、在精制食盐时,所加除杂试剂均为过量,因此,所加试剂的顺序必须是碳酸钠在氯化钡后面加入,以除去过量的Ba2+。
3、电冶金主要用于冶炼活泼性很强的金属。
在电解熔融的氧化铝时,加入冰晶石的目的是为了降低氧化铝的熔点,使氧化铝能够在较低的温度下熔化,而不能用电解无水氯化铝的方法冶炼金属铝。
因为氯化铝为共价化合物,熔融状态时不导电。
【典型例题】例1. 1L0.1mol/LAgNO3溶液在以Ag作阳极,Fe作阴极的电解槽中电解,当阴极增重2.16g 时。
下列判断(设电解按理论进行,溶液不蒸发)正确的是:A. 溶液的浓度变为0.08mol/LB. 阳极上产生112mLO2(标准状况)C. 转移的电子数是1.204×1022个D. 反应中有0.01mol的Ag被氧化解析:本题所给的信息是:Ag作阳极,AgNO3溶液作电解液符合电镀的条件,是一种电镀装置。
则电极反应式为:阳极:Ag-e-=Ag+,阴极:Ag++e-=Ag,阳极减少的银的质量等于阴极析出的银的质量,电解质溶液的浓度保持不变。
由于在阴极析出2.16gAg即为0.02mol,则阳极减少0.02mol的Ag,转移的电子数为0.02N A,即为1.204×1022个。
综上所述,本题的答案为C答案:C例2. 在500gCuSO4溶液中,一极为铁,一极为含杂质锌均匀的粗铜;通电一段时间后切断电源,取出电极,此时铁极析出7.04g铜,电解质溶液增重0.02g,求粗铜中含锌的质量分数。
解析:电解精炼时电极反应为:阳极(粗铜):Cu-2e-=Cu2+,Zn-2e-=Zn2+阴极(铁):Cu2++2e-=CuCu2+~Zn2+△m1mol 1mol 1gx x 0.02g∴Zn溶解为0.02mol×65g·mol-1=1.3g溶液中Cu2+析出0.02mol×64g·mol-1=1.28g锌的质量分数为:答案:粗铜中锌的质量分数为18.4%例3. 500 mL KNO3和Cu(NO3)2的混合溶液中c(NO3-)=6mol·L-1,用石墨作电极电解此溶液,当通电一段时间后,两极均收集到22.4 L气体(标准状况),下列说法正确的是(假设电解前后溶液的体积不变)A. 原混合溶液中c(K+)为2 mol·L-1B. 上述电解过程中共转移4 mol电子C.电解得到的Cu的物质的量为0.5molD. 电解后溶液中c(H+)为2 mol·L-1解析:本题的信息是用惰性电极电解KNO3和Cu(NO3)2混合溶液,电解后阴、阳两极分别产生22.4L气体,即1mol气体。
溶液中的阳离子有:Cu2+、H+;阴离子有OH-、NO3-。
根据阴、阳离子的放电顺序可得:阳极:4OH――4e-=2H2O+O2↑;阴极:Cu2++2e-=Cu、2H++2e-=H2↑4mol 1mol 2mol 1mol 2mol 1mol 则原溶液中含有Cu2+1mol,转移的电子数为4mol,电解后溶液中增加的H+的物质的量为2mol,即c(H+)=2mol/0.5L=4mol/L。
再根据溶液中阳离子所带正电荷总数等于阴离子所带负电荷总数,可得K+的物质的量为1mol,其浓度为2mol/L。
综上所述,本题的答案为AB答案:AB例4. 以铁为阳极、铜为阴极,对足量的NaOH溶液进行电解,一段时间后得到2molFe (OH)3沉淀,此时消耗水的物质的量共为A. 2molB. 3molC. 4molD. 5mol解析:本题的信息为:铁为阳极、铜为阴极,电解NaOH溶液,得到2molFe(OH)3。
则根据信息,写出电极反应:阳极:Fe-2e-=Fe2+,阴极:2H++2e-=H2↑总的电极反应为:Fe+2H2O=Fe(OH)2↓+H2↑,而Fe(OH)2在空气中易被氧化,反应方程式为:4 Fe(OH)2+2H2O+O2=4Fe(OH)3,则根据相互之间量的关系可得,每生成2molFe(OH)3沉淀,所消耗水的物质的量为5mol。
答案:D例5. 某硝酸盐晶体的化学式是M(NO3)x·n H2O,相对分子质量为242,将1.21g该晶体溶于水配制成100mL溶液,用惰性电极进行电解,当有0.01mol电子转移时,溶液中金属离子全部析出,此时阴极增重0.32g。
求:(1)金属M的相对原子质量及x、n的值。
(2)电解后溶液的pH(假设电解前后溶液的体积不变)。
解析:本题的信息为:用惰性电极电解1.21gM(NO3)x·n H2O的溶液,当有0.01mol 电子转移时,溶液中金属离子全部析出,此时阴极增重0.32g。
则电极反应式为:阳极:4OH――4e-=2H2O+O2↑;阴极:M X++xe-=M4 4 x 10.01mol 0.01mol 0.01mol 1.21/242=0.32/M解得x=2,M=64g/mol,溶液中c(H+)=0.01mol/0.1L=0.1mol/L,pH=1再根据相对分子质量之间的关系可得:n=3答案:M的相对原子质量及x、n的值分别为:64、2、3,电解后溶液的PH为1例6. 工业上用MnO2为原料制取KMnO4,主要生产过程分为两步进行:第一步将MnO2和KOH粉碎,混匀,在空气中加热至熔化,并连续搅拌,制取K2MnO4;第二步将K2MnO4的浓溶液用惰性电极进行电解,在阳极上得到KMnO4,在阴极上得到KOH。
(1)制取K2MnO4的反应方程式是,连续搅拌的目的是_______________________。
(2)电解K2MnO4的浓溶液时,两极发生的电极反应式:阴极是__________________,阳极是__________________ ;电解的总反应方程式是。
解析:本题的信息为:工业上以MnO2为原料制取KMnO4。
MnO2和KOH粉碎,混匀,在空气中加热至熔化,制取K2MnO4,说明是与空气中的氧气发生氧化还原反应,其中O原子得到电子,而MnO2转变为K2MnO4,反应方程式为:2MnO2+4KOH+O2=2 K2MnO4+2H2O;而连续搅拌的目的则是为了让反应物充分接触,使反应顺利进行。
用惰性电极电解K2MnO4的浓溶液,在阳极上得到KMnO4,说明阳极是MnO42―放电发生氧化反应;阴极是H+放电,产生H2,从而使溶液的pH升高,生成KOH。
具体的电极反应式为:阴极:2H++2e-=H2↑;阳极:MnO42――e-=MnO4-总反应式:2K2MnO4+2H2O=2KMnO4+2KOH+H2↑答案:(1)2MnO2+4KOH+O2=2 K2MnO4+2H2O;让反应物充分接触,使反应顺利进行(2)阴极:2H++2e-=H2↑;阳极:MnO42――e-=MnO4-总反应式:2K2MnO4+2H2O=2KMnO4+2KOH+H2↑。