医疗器械生产主流程图
- 格式:doc
- 大小:108.50 KB
- 文档页数:10
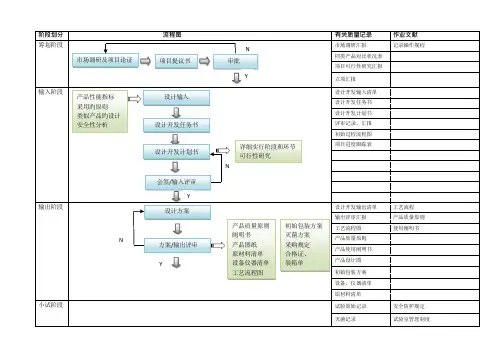

医疗器械生产工艺流程图在医疗器械行业,生产工艺流程对于产品的品质和安全性至关重要。
本文将介绍医疗器械生产的常见工艺流程,并配以流程图展示。
1. 设计和开发首先,医疗器械的生产需要经过设计和开发阶段。
设计阶段包括从市场调研中获取用户需求,制定产品规格书,设计方案,进行样机试验等。
开发阶段则包括根据设计方案,进行工程设计,开发工具、模具等。
2. 采购原材料医疗器械的原材料通常是一些特殊的材料,如聚氨酯、硅胶、石墨烯等。
生产商需要根据设计要求选择合适的原材料,并进行采购。
原材料的入库应该建立一套完善的管理制度,确保原材料能够符合产品质量要求。
3. 原材料处理和制备原材料采购之后需要进行处理和制备,以便后续的生产环节能够进行。
这个阶段的主要任务是将材料分解成粒子、纤维或液态,以便于后续工艺的进行。
4. 器械生产器械生产包括了许多工艺流程,常见的包括注塑、喷涂、成型、射出、组装等。
4.1 注塑注塑是将热塑性塑料粉末或颗粒加热到塑化状态后,将其注入模具中进行制品成型的加工方法。
这个过程中需要控制好温度、压力、注塑速度等参数,以确保产品的质量。
4.2 喷涂喷涂工艺主要是针对表面涂层进行的,常见的喷涂材料包括了塑料、橡胶、金属等。
喷涂的必要性主要是涂层能起到保护、美化以及改善工件表面性能等作用。
4.3 成型成型工艺是通过热压、热处理等方式将材料压制成所需的形状和大小。
该过程能够提高产品的物理力学性能、耐腐蚀性和密封性等。
4.4 射出射出工艺主要是针对塑料件和硅橡胶件的成型处理。
射出机根据生产的要求,将热塑性塑料或热固性塑料等物料打入模具中,通过模具压实成型。
4.5 组装产品的组装阶段需要对各个零部件进行合理的组合。
这个过程中需要严格按照产品装配图、装配规范进行组装,以保证产品的质量。
5. 检测和包装当产品完成生产之后,需要进行检测,以确保其符合产品技术要求和质量标准。
这个过程需要依靠先进的检测设备和专业的技术人员,对产品进行各项检测,包括外观检测、尺寸检测、物理性能检测等。
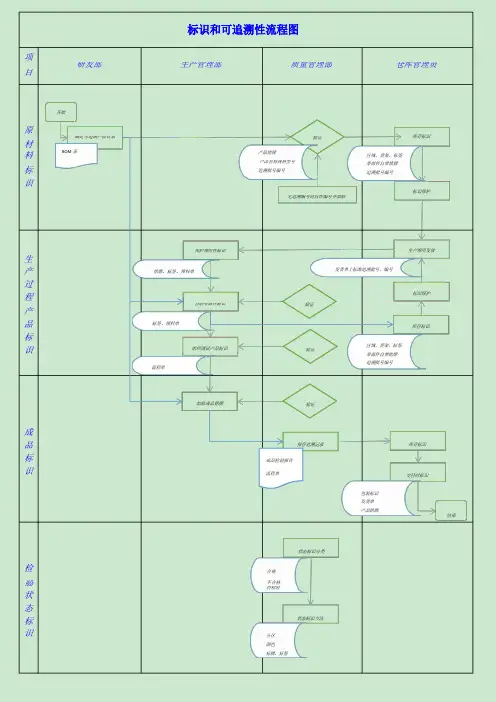
标识和可追溯性流程图项研发部生产管理部质量管理部仓库管理员目开始原确定可追溯产品目录验证材料BOM表产品铭牌产品名称规格型号标追溯批号编号识区域、货架、标签零部件自带铭牌追溯批号编号库存标识标识保护无追溯编号时自作编号并加贴保护领用件标识生产铭牌、标签、领料单过程自制零部件标识产品标签、领料单标识组织调试产品标识流程单发货单上标准追溯批号、编号验证区域、货架、标签验证零部件自带铭牌追溯批号编号生产领用发放标识保护库存标识加贴成品铭牌验证成品标成品检验报告识流程单保存追溯记录库存标识交付时标识包装标识发货单产品铭牌结束状态标识分类检合格验不合格待检验状态标识分区颜色标牌、标签状态标识方法不合格品处理流程图各部门质量管理部总经理开始采购品不合格标识隔离问题分类半成品不合格一般不合格严重不合格成品不合格经理决策共同评审总经理组织各部门退回不合格检验记录评审记录流程单返工/返修退货让步接收报废返工返修单检验反馈问题责任部门报废否合格是入库纠正预防措施流程图记录回收存档完成采购流程图总经理采购主管质量管理部财务主管开始组织生产计划会议参考生产计划参考库存否制定采购计划否审批用款采购计划审批是是开始采购合格供方选择开发新供应商合格供方名录供应商选择签订合同流程图A 类质量协议合同通知供应商供货收货检验流程图验收记录是入库合格入库单否是供应商管理不合格处置流程图审批否按评审表处置定期评价供方业绩评定表质量统计表结束供应商选择流程图否是采购主管质量管理部总经理开始开发/更换供应商收集供应商基本资料供方调查表必要时实地考察否审批是物资分类ABC样品检验检验记录合格否是审批列为合格供应商合格供方名录正常供货结束取消供应商管理评审流程图是是总经理管理者代表质量管理部各部门开始制定管理评审计划管理评审计划否批准审核是三个工作日完成发放计划资料准备部门体系运行报告对体系运行报告内容进行讨论并作出结论主持会议汇总评价企业体系运行报告收集管理评审输入资料整理会议资料会议记录体系运行报告内容:1.内外审核结果;2.顾客反馈投诉;否批准审核是管理评审报告报告编制发放报告3.自查报告;4.产品监视测量;5.纠正预防措施;6.以往管评追踪;7.过程监视测量;8.体系变更;9.法律法规变更;10.改进建议;11.方针目标适宜性;12.目标统计;13.资源配置。

标题:医疗器械产品开发流程图(参考)一、引言医疗器械产品开发是一个复杂而严谨的过程,涉及到市场调研、设计开发、临床试验、注册审批等多个环节。
为了更好地指导医疗器械企业进行产品开发,本文将详细介绍医疗器械产品开发流程,以供参考。
二、市场调研1.1 市场需求分析在医疗器械产品开发初期,企业应对市场需求进行充分调研,了解目标市场的规模、竞争格局、用户需求等信息。
通过市场需求分析,企业可以确定产品开发的定位、功能和性能指标。
1.2 技术可行性分析在市场需求分析的基础上,企业还需对产品所需技术进行可行性分析,评估现有技术是否能满足产品开发的需求。
若现有技术无法满足需求,企业需进行技术研发或寻求外部技术支持。
三、设计开发2.1 概念设计根据市场需求和技术可行性分析,企业可进行产品概念设计,明确产品的基本功能、性能指标、外观设计等。
概念设计阶段需充分考虑用户体验,确保产品设计的合理性。
2.2 详细设计在概念设计的基础上,企业需进行详细设计,包括结构设计、电路设计、软件设计等。
详细设计阶段应注重产品的可制造性、可维护性和安全性。
2.3 原型制作与测试完成详细设计后,企业应制作产品原型,并进行功能测试、性能测试、可靠性测试等。
通过测试验证,确保产品设计满足预定要求。
四、临床试验3.1 试验方案设计根据产品特点,企业需制定临床试验方案,明确试验目的、试验方法、评价指标等。
试验方案应具有科学性、合理性和可操作性。
3.2 试验实施在临床试验方案获批后,企业应按照方案开展临床试验。
试验过程中,企业需密切关注试验进度,确保试验数据的真实性、准确性和完整性。
3.3 数据分析临床试验结束后,企业应对试验数据进行统计分析,评估产品安全性和有效性。
若试验结果符合预期,企业可进行产品注册申请。
五、注册审批4.1 准备注册资料企业需根据国家相关规定,准备产品注册申请所需资料,包括产品技术要求、临床试验报告、生产质量管理体系文件等。
4.2 提交注册申请企业向国家药品监督管理局提交产品注册申请,并按照要求缴纳注册费用。
