中考化学专题题库∶化学推断题的综合题及答案
- 格式:doc
- 大小:210.00 KB
- 文档页数:11

中考化学化学推断题综合题汇编含答案一、初中化学推断题1.图中所涉及到的物质均为常见的化合物,图中“—”表示相互反应,“→”表示转化关系,部分反应物、生成物、反应条件已略去。
其中A、B常温下均为液态,且组成元素相同,F是大理石的主要成分,Y为氧化物,Z是紫红色固体,L为蓝色絮状沉淀。
回答下列问题:(1)写出A物质的化学式___________。
(2)反应①—⑥涉及的基本反应类型有__________种。
(3)写出反应④的化学方程式__________________________________。
(4)写出N物质的一种用途_______________________________________。
【答案】H2O2 3 Ca(OH)2+Na2CO3=CaCO3↓+2NaOH 除锈【解析】【分析】A、B常温下均为液态,且组成元素相同,A与X反应后生成B与C,所以A为过氧化氢,B为水,C为氧气。
X为二氧化锰;Z是紫红色固体,则Z为铜,E为氧化铜;F是大理石的主要成分,所以F是碳酸钙;Y为氧化物,能与B(水)反应生成D,D与M反应生成碳酸钙,所以Y为氧化钙,D为氢氧化钙,则M为碳酸钠,G为氢氧化钠;L为蓝色絮状沉淀,则L为氢氧化铜沉淀;G(氢氧化钠)与H反应生成氢氧化铜沉淀,则H为硫酸铜,N为硫酸。
【详解】(1)由分析可知,A为过氧化氢,其化学式为H2O2,故填H2O2。
(2)反应①是过氧化氢反解生成水和氧气,属于分解反应,反应②是氧化钙与水反应生成氢氧化钙,属于化合反应,反应③是铜和氧气反应生成氧化铜,属于化合反应,反应④是氢氧化钙与碳酸钠反应生成碳酸钙沉淀和氢氧化钠,属于复分解反应,反应⑤是氧化铜与硫酸反应生成硫酸铜和水,属于复分解反应,反应⑥是氢氧化钠与硫酸铜反应生成氢氧化铜沉淀和硫酸钠,属于复分解反应,涉及的基本反应类型有分解反应、化合反应和复分解反应,共3种,故填3。
(3)反应④是氢氧化钙与碳酸钠反应生成碳酸钙沉淀和氢氧化钠,故反应的化学方程式写为:Ca(OH)2+Na2CO3=CaCO3↓+2NaOH。

中考化学推断题50题专题训练(含答案)一、中考化学推断题1.在下面关系图中,A 、B 、C 、D 是初中化学中常见的单质,甲、乙分别是酒精燃烧时一定会产生的两种物质,丁是常用建筑材料的主要成分,G 为无色有刺激性气味的气体,能使紫色石蕊变蓝,J 是赤铁矿的主要成分。
(1)写出化学式:甲是_____,丁是_____,G 是_____;(2)写出A 与B 反应的化学方程式:_____;(3)写出E→F 的化学方程式:_____。
【答案】H 2O CaCO 3 NH 3 2222H +O 2H O 点燃 22CaO+H O Ca(OH)═ 【解析】【分析】丁是常用建筑材料的主要成分,所以丁是碳酸钙;G 为无色有刺激性气味的气体,能使紫色石蕊变蓝,所以G 是氨气;J 是赤铁矿的主要成分,所以J 是氧化铁;甲、乙分别是酒精燃烧时一定会产生的两种物质,甲可能是水,乙可能是二氧化碳;丙是碳酸;碳酸和F 反应生成碳酸钙,则F 可能是氢氧化钙;E 和水生成氢氧化钙,E 是氧化钙;碳酸钙在高温的条件下生成氧化钙和二氧化硫,所以乙是二氧化碳;A 、B 、C 都是单质,A 和B 点燃生成水,B 和C 点燃生成二氧化碳,所以A 是氢气;B 是氧气;C 是碳;二氧化碳和碳反应生成H ,H 是一氧化碳;一氧化碳和氧化铁反应生成铁和二氧化碳,D 是单质,D 是铁,把以上各物质代入框图进行验证,符合要求。
【详解】(1)根据分析可知,甲是水,化学式是H 2O ,丁是碳酸钙,化学式是CaCO 3,G 是氨气,化学式是 NH 3;(2)氢气和氧气在点燃的条件下生成水,化学方程式为:2222H +O 2H O 点燃; (3)氧化钙和水反应生成氢氧化钙,化学方程式为:22CaO+H O Ca(OH)═。
2.如图 A ﹣F 都是初中化学常见的物质.图中的反应条件已略去.已知 A 常温下为液体,F 是一种难溶性 的蓝色固体.(资料:难溶性碱受热易分解为两种氧化物,反应中各元素化合价不变).请回答下列问题.(1)A 的名称是_____;F 的化学式为_____.(2)反应①的现象为_____;(3)写出另一个 F 能发生的反应方程式_____,该反应属于_____反应(填基本反应类型).【答案】(1)A 水F Cu (OH )2(2)黑色固体变为红色,且有水珠出现(3)Cu (OH )2+H 2SO 4====CuSO 4+2H 2O 复分解反应【解析】试题分析:难溶性碱受热易分解为两种氧化物,反应中各元素化合价不变,且A 是一种液体,说明F 是氢氧化铜,而A 是分解后得到的水,同时E 是氧化铜,水电解生成氧气和氢气,氢气能够和氧化铜反应得到水和铜单质,说明C是氢气,而B是氧气,二者反应得到水。

一、中考初中化学推断题 1.有一包白色固体,可能含氯化钠、碳酸钠、硫酸钠、氢氧化钠、氢氧化钡中的一种或几种。某兴趣小组为探究其成分做了以下实验: 实验一:探究固体的组成
(1)向固体样品中加入过量稀硝酸,产生的气体是_______。 (2)生成白色滤渣甲反应的化学方程式为_______。 (3)原固体中一定不含有的物质是_____。 实验二:进一步探究固体中是否含氯化钠
得出结论:原固体中一定含NaCl。 (4)试剂X是__________。 (5)滤液C中除含Fe(NO3)3外,一定还含有的溶质是______。 【答案】CO2 Ba(NO3)2+MgSO4=BaSO4↓+Mg(NO3)2 Na2SO4 Ba(NO3)2 HNO3、NaNO3、Mg(NO3)2、Ba(NO3)2 【解析】 【详解】 实验一 根据白色固体中加过量的稀硝酸,有无色气体生成可知,原固体中一定有碳酸钠;根据向无色无色溶液加过量硫酸镁有白色滤渣生成可知,原固体中一定有氢氧化钡,一定没有硫酸钠。 (1)根据题干所提供的信息可知,向固体样品中加入过量稀硝酸,产生的气体是二氧化碳; (2)通过以上分析可知原固体中含有氢氧化钡,氢氧化钡和稀硝酸反应生成硝酸钡,所以白色滤渣甲是硝酸钡和硫酸镁反应生成的硫酸钡,化学方程式为:Ba(NO3)
2+MgSO4=BaSO4↓+Mg(NO3)2; (3)在原白色固体中加入过量稀硝酸得到无色溶液,通过以上推断可知原固体中含有氢氧化钡,所以一定不含硫酸钠; 实验二 (4)滤液A中含有硫酸镁,硫酸根离子和银离子结合生成微溶于水的硫酸银,会干扰氯离子的检验,所以要向滤液A中加入过量的硝酸钡溶液除去硫酸根离子;向滤液B中滴加硝酸银溶液有白色沉淀生成说明原固体中含有氯化钠; (5)固体样品中加入的是过量稀硝酸,滤液C中一定有硝酸;碳酸钠和稀硝酸反应生成硝酸钠,所以滤液C中一定硝酸钠;无色滤液中加入硝酸铁,整个过程中没有和其他物质反应,所以滤液C中一定有硝酸铁;硫酸镁和过量的硝酸钡反应生成硝酸镁所以滤液C中一定含有硝酸镁和过量的硝酸钡。

中考化学化学推断题综合题汇编及答案一、初中化学推断题1.图中所涉及到的物质均为常见的化合物,图中“—”表示相互反应,“→”表示转化关系,部分反应物、生成物、反应条件已略去。
其中A、B常温下均为液态,且组成元素相同,F是大理石的主要成分,Y为氧化物,Z是紫红色固体,L为蓝色絮状沉淀。
回答下列问题:(1)写出A物质的化学式___________。
(2)反应①—⑥涉及的基本反应类型有__________种。
(3)写出反应④的化学方程式__________________________________。
(4)写出N物质的一种用途_______________________________________。
【答案】H2O2 3 Ca(OH)2+Na2CO3=CaCO3↓+2NaOH 除锈【解析】【分析】A、B常温下均为液态,且组成元素相同,A与X反应后生成B与C,所以A为过氧化氢,B为水,C为氧气。
X为二氧化锰;Z是紫红色固体,则Z为铜,E为氧化铜;F是大理石的主要成分,所以F是碳酸钙;Y为氧化物,能与B(水)反应生成D,D与M反应生成碳酸钙,所以Y为氧化钙,D为氢氧化钙,则M为碳酸钠,G为氢氧化钠;L为蓝色絮状沉淀,则L为氢氧化铜沉淀;G(氢氧化钠)与H反应生成氢氧化铜沉淀,则H为硫酸铜,N为硫酸。
【详解】(1)由分析可知,A为过氧化氢,其化学式为H2O2,故填H2O2。
(2)反应①是过氧化氢反解生成水和氧气,属于分解反应,反应②是氧化钙与水反应生成氢氧化钙,属于化合反应,反应③是铜和氧气反应生成氧化铜,属于化合反应,反应④是氢氧化钙与碳酸钠反应生成碳酸钙沉淀和氢氧化钠,属于复分解反应,反应⑤是氧化铜与硫酸反应生成硫酸铜和水,属于复分解反应,反应⑥是氢氧化钠与硫酸铜反应生成氢氧化铜沉淀和硫酸钠,属于复分解反应,涉及的基本反应类型有分解反应、化合反应和复分解反应,共3种,故填3。
(3)反应④是氢氧化钙与碳酸钠反应生成碳酸钙沉淀和氢氧化钠,故反应的化学方程式写为:Ca(OH)2+Na2CO3=CaCO3↓+2NaOH。

中考化学推断题80题专题训练(含答案)一、中考化学推断题1.A、B、C、D、E、F、G分别是一氧化碳、二氧化碳、氧化铜、稀硫酸、氢氧化钡溶液、碳酸钠溶液、氯化钡溶液中的一种.B的相对分子质量为44,它们之间有如图所示的关系,图中相连的两个方框表示相应物质间能发生反应.回答下列问题:(1)B、E分别为_____、_____.(2)A与D反应的实验现象为_____.(3)F与G反应的化学方程式为_____.【答案】二氧化碳稀硫酸产生白色沉淀 CuO+COΔCu+CO2【解析】【分析】A、B、C、D、E、F、G分别是一氧化碳、二氧化碳、氧化铜、稀硫酸、氢氧化钡溶液、碳酸钠溶液、氯化钡溶液中的一种,B的相对分子质量为44,所以B是二氧化碳,二氧化碳会与氢氧化钡反应,所以C是氢氧化钡,氢氧化钡会与稀硫酸、碳酸钠反应,D如果是碳酸钠,碳酸钠除了会与氢氧化钡、稀硫酸反应,不会与气体物质反应,所以A是氯化钡,E是稀硫酸,稀硫酸会与氧化铜反应,所以F是氧化铜,G是一氧化碳,经过验证,推导正确。
【详解】(1)所以B是二氧化碳,E是稀硫酸;(2)A与D的反应是稀硫酸和氢氧化钡反应生成硫酸钡沉淀和水,所以实验现象为:产生白色沉淀;(3)F与G的反应是一氧化碳和氧化铜在加热的条件下生成铜和二氧化碳,化学方程式为:CuO+COΔCu+CO2.故答案为:(1)二氧化碳,稀硫酸;(2)产生白色沉淀;(3)CuO+COΔCu+CO2.2.如图A、B、C、D、甲、乙、丙、丁都是我们已学过的物质.(图中“﹣”表示两端的物质能发生化学反应;“→”表示物质间存在转化关系,部分反应物、生成物及反应条件已略去.)甲、乙、丙、丁均是氧化物,且乙是黑色固体.A、B是单质,D是补钙剂,且D和C的组成元素中有两种是相同的.(1)C的化学式是_____,D的化学式是_____.(2)若A为紫红色固体,写出乙→丁的化学反应方程式_____反应的基本反应类型为_____.(3)若A的年产量位于世界第一.写出乙+甲的化学反应方程式_____.【答案】Ca(OH)2 CaCO3 H2+CuO ΔCu+H2O 置换反应 Fe3O4+4CO高温3Fe+4CO2【解析】【分析】根据“D是补钙剂”,推测D为碳酸钙,根据“D和C的组成元素中有两种是相同的”,则推测C可能为氢氧化钙,根据“甲、乙、丙、丁均是氧化物,且乙是黑色固体,A、B是单质”,结合图框,根据丙与C反应生成D和丁,则推测丙为二氧化碳,丁为水;根据甲、乙反应生成丙和A;乙、B反应生成A和丁,则推测甲、乙分别为一氧化碳和氧化铜,A、B分别为铜、氢气,代入检验,符合题意。

中考化学推断题50题专题训练(含答案)一、中考化学推断题1.粗盐中含有MgCl2、CaCl2等杂质,工业提纯粗盐的工艺流程如图所示:(1)Ca(OH) 2俗称_____,步骤①反应的化学方程式为_____。
(2)步骤③操作a的名称是_____。
(3)若步骤①和步骤②的顺序颠倒,则最后所得的精盐水中还含有_____。
【答案】熟石灰或消石灰 MgCl2+Ca(OH)2=Mg(OH)2↓+CaCl2;过滤 CaCl2(或氯化钙)【解析】【分析】粗盐水里面含有氯化镁和氯化钙,加入过量的氢氧化钙溶液,会生成氢氧化镁白色沉淀,加入过量的碳酸钠溶液,生成碳酸钙沉淀,滤液中含有氯化钙。
【详解】(1)氢氧化钙的俗名为熟石灰或消石灰;步骤①加入过量的氢氧化钙溶液,氯化镁与氢氧化钙反应生成氢氧化镁沉淀和氯化钙,反应的化学方程式为:MgCl2+Ca(OH)2=Mg(OH)2↓+CaCl2。
(2)过滤是分离固体和液体的操作,步骤③操作a后得到沉淀和滤液,故为过滤。
(3)根据Ca(OH)2可除去MgCl2,Na2CO3可除去CaCl2.如果步骤①和步骤②的顺序颠倒,步骤②先反应溶液中就有过量的碳酸钠,然后完成步骤①,这时过量的氢氧化钙把上步中多余的碳酸钠除去,同时生成氢氧化钠,另外氢氧化钙与氯化镁反应还生成氯化钙,最后步骤④中加入适量的盐酸,反应掉生成的氢氧化钠,但不与生成的氯化钙反应,所以最后所得的精盐水中还含有CaCl2,故答案为:CaCl2。
【点睛】除杂的原则:除去杂质,不能引入新的杂质。
2.A~F是初中化学常见物质,A、B、C、D和CaCO3均含有同一种元素,其中B常用于改良酸性土壤,胃液中含有F。
它们之间的转化关系如图所示,“→”表示相互转化,请回答:(1)B的化学式是______,F的化学式是______。
(2)在物质的分类中,A属于______(填“酸”、“碱”、“盐”或“氧化物”)。
(3)图中反应B→D属于基本反应类型中的______反应.(4)写出下列反应的化学方程式:D→C:_______________________。

中考化学推断题专题练习(带答案)一、中考化学推断题1.已知某固体混合物A中含有CuSO4、FeCl3、NaNO3、BaCl2、CaCO3五种物质中的两种或多种,按下述步骤进行实验探究,观察实验现象,并加以分析推理。
(假设过程中所有发生的反应都恰好完全反应)Ⅰ.取一定质量的该固体混合物A放入一洁净烧杯中,向其中加入适量NaOH溶液,搅拌,待烧杯中物质充分反应后,过滤,得红褐色沉淀B和滤液CⅡ.另取一定质量的该固体混合物A放入另一洁净烧杯中,向其中加入适量H2SO4溶液,搅拌,待烧杯中物质充分反应后,过滤,得白色沉淀D和滤液EⅢ.将所得溶液C和溶液E充分混合,再向混合后的溶液中加入适量AgNO3溶液,待充分反应后,过滤,得白色沉淀F和滤液GⅣ.根据上述实验过程和发生的现象做出相应的推理,填写以下空白:(1)在混合物A里,上述五种物质中肯定不存在的物质是(写化学式)_____。
(2)在固体混合物A里,上述五种物质中肯定存在的物质是(写化学式)_____。
(3)写出步骤Ⅲ中生成白色沉淀F的1个化学方程式:_____。
(4)在滤液G中肯定存在的阴离子是_____。
【答案】CuSO4、CaCO3 FeCl3、BaCl2 NaCl+AgNO3=AgCl↓+NaNO3或HC1+AgNO3=AgC1↓+HNO3 NO3﹣【解析】【分析】碳酸钙难溶于水,硫酸铜在溶液中显蓝色,硫酸铜和氢氧化钠会生成蓝色沉淀,氯化铁和氢氧化钠会生成红褐色沉淀氢氧化铁,氯化钡和硫酸反应会生成白色的硫酸钡沉淀,氯离子和银离子会生成白色的氯化银沉淀。
【详解】Ⅰ、取一定质量的该固体混合物A放入一洁净烧杯中,向其中加入适量NaOH溶液,搅拌,待烧杯中物质充分反应后,过滤,得红褐色沉淀B和滤液C,所以混合物中含有氯化铁,一定不含硫酸铜和碳酸钙,氯化铁和氢氧化钠反应生成氢氧化铁沉淀和氯化钠,所以B是氢氧化铁,C中含有氯化钠;Ⅱ、另取一定质量的该固体混合物A放入另一洁净烧杯中,向其中加入适量H2SO4溶液,搅拌,待烧杯中物质充分反应后,过滤,得白色沉淀D和滤液E,硫酸和氯化钡会生成硫酸钡沉淀和盐酸,所以D是硫酸钡沉淀,E是盐酸,Ⅲ、将所得溶液C和溶液E充分混合,再向混合后的溶液中加入适量AgNO3溶液,待充分反应后,过滤,得白色沉淀F和滤液G,盐酸和硝酸银反应生成氯化银沉淀和硝酸,氯化钠和硝酸银反应生成氯化银沉淀和硝酸钠,所以F是氯化银,G中含有硝酸和硝酸钠,所以:(1)通过推导可知,在混合物A里,上述五种物质中肯定不存在的物质是CuSO4、CaCO3,得出此结论的理由是:Ⅰ中只有红褐色沉淀;(2)通过推导可知,在固体混合物A里,上述五种物质中肯定存在的物质是:FeCl3、BaCl2;(3)步骤Ⅲ中生成白色沉淀F的反应是氯化钠或稀盐酸和硝酸银反应生成氯化银沉淀和硝酸钠或硝酸,化学方程式为:NaCl+AgNO3=AgCl↓+NaNO3或HCl+AgNO3=AgC1↓+HNO3;(4)通过推导可知,滤液C应为:NaCl、BaCl2;滤液E应为:FeCl3、HCl;混合后应为四者混合物,这四种物质均可与硝酸银反应,反应后会生成NaNO3、Ba(NO3)2、Fe(NO3)3、HNO3,所以含有的金属阳离子共有3种,该滤液中肯定存在的酸根阴离子是:NO3-。

中考化学推断题80题专题训练(含答案)一、中考化学推断题1.有一包固体,可能是Cu(NO3)2、K2SO4、KCl、K2CO3、KOH中的一种或几种组成。
为了探究该固体的组成,某化学小组设计并开展以下实验:已知,步骤I中固体全部消失,溶液呈蓝色,无气泡产生,步骤II、III中均可观察到有白色沉淀生成。
请回答下列问题:(1)经推论,原固体中一定不含K2CO3,理由是___________________(2)原固体中一定含有的物质是________________。
(3)步骤II中产生白色沉淀的化学方程式是_______________。
(4)步骤III所得蓝色滤液中一定含有的阳离子是____________。
【答案】向固体中加入过量的稀盐酸时,无气泡产生Cu(NO3)2、K2SO4 Ba(NO3)2+ K2SO4=BaSO4↓+2KNO3 Cu2+、K+、H+【解析】本题是推断题。
首先分析题中所给物质的性质和两两之间的反应,然后依据题中的现象判断各物质的存在性,最后进行验证即可。
解题时注意加入试剂的量对反应后溶液成分的影响。
(1)碳酸钾与盐酸反应生成氯化钾、水和二氧化碳。
原固体中一定不含K2CO3,理由是向固体中加入过量的稀盐酸时,无气泡产生;(2)固体加过量稀盐酸,固体完全溶解且溶液呈蓝色,说明固体中一定有硝酸铜,硝酸铜与氢氧化钾能发生反应不能共存,则说明一定不存在氢氧化钾,根据题(1)的分析固体中一定不含K2CO3,在步骤Ⅰ得到的蓝色溶液中加入硝酸钡溶液有白色沉淀生成,硫酸钾与硝酸钡反应生成硫酸钡沉淀和硝酸钾,说明固体中一定有硫酸钾,在步骤Ⅱ得到的蓝色溶液中加入硝酸银溶液产生白色沉淀,含氯离子的溶液与硝酸银反应生成氯化银的沉淀,由于在步骤Ⅰ中加入了盐酸,不能说明固体中一定有氯化钾,所以原固体中一定含有的物质是Cu(NO3)2、K2SO4;(3)步骤II中产生白色沉淀的反应是硫酸钾与硝酸钡反应生成硫酸钡沉淀和硝酸钾,化学方程式是Ba(NO3)2+ K2SO4=BaSO4↓+2KNO3;(4)根据题(2)中的分析可知,步骤III所得蓝色滤液中一定含有的阳离子是 Cu2+、K+、H+。

中考化学化学推断题综合题汇编含答案一、初中化学推断题1.A、B、C、D、E是初中化学中常见的物质,其转化关系如图所示,请依据转化关系图,写出符合要求的一组答案。
(1)若反应①为置换反应,且A为单质,则C为____,反应③的化学方程式为______________。
(2)若反应①为中和反应,反应②无明显变化,反应③有沉淀生成,A能使紫色石蕊试液变红,则A的名称是_____,E的化学式为______。
【答案】H2O(或CO2) 2Cu+O22CuO 稀盐酸 NaOH【解析】根据A、B、C、D、E是初中化学常见的物质,反应①为置换反应,且A为单质,单质和氧化物反应生成单质和氧化物,所以A可以是氢气,B是氧化铜,氢气和氧化铜加热生成铜和水,所以C是水,D是铜;反应反应①为中和反应,②无明显变化,反应③有沉淀生成,A能使紫色石蕊试液变红,所以A是酸,B是碱,A可以是盐酸,B可以是氢氧化镁,C是水,D是氯化镁,E是氢氧化钠,然后进行验证即可。
A、B、C、D、E是初中化学常见的物质,(1)反应①为置换反应,且A为单质,单质和氧化物反应生成单质和氧化物,所以A可以是氢气,B是氧化铜,氢气和氧化铜加热生成铜和水,所以C是水,D是铜经过验证,推导正确,所以C是H2O,反应③是铜和氧气在加热的条件下生成氧化铜,化学方程式为:2Cu+O22CuO ;(2)反应反应①为中和反应,②无明显变化,反应③有沉淀生成,A能使紫色石蕊试液变红,所以A是酸,B是碱,A可以是盐酸,B可以是氢氧化镁,C是水,D是氯化镁,E是氢氧化钠,氢氧化镁和盐酸反应生成氯化镁和水,盐酸和氢氧化钠会生成水,氯化镁和氢氧化钠会生成氢氧化镁,推导正确,所以A是稀盐酸,B是Mg(OH)2,E是NaOH。
点睛:在解此类题时,首先将题中有特征的物质推出,然后结合推出的物质和题中的转化关系推导剩余的物质,最后将推出的各种物质代入转化关系中进行验证即可。
2.下图表示某些物质间的转化关系,甲、乙是常见气体,丙是常见金属,C的水溶液呈蓝色,D是大理石的主要成分。
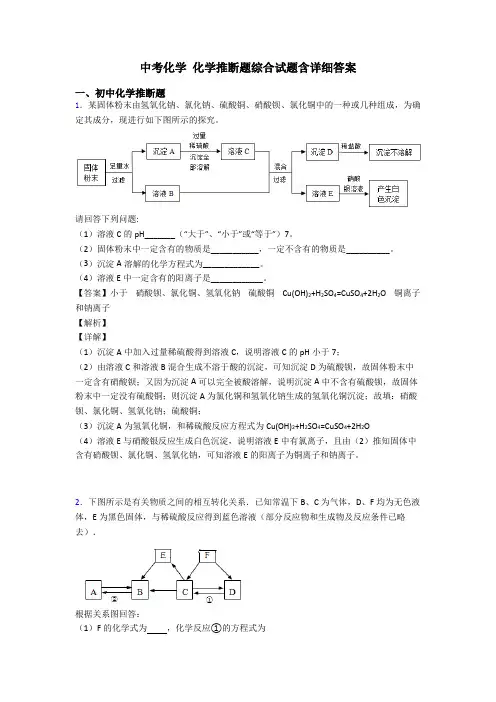
中考化学化学推断题综合试题含详细答案一、初中化学推断题1.某固体粉末由氢氧化钠、氯化钠、硫酸铜、硝酸钡、氯化铜中的一种或几种组成,为确定其成分,现进行如下图所示的探究。
请回答下列问题:(1)溶液C的pH_______(“大于”、“小于”或“等于”)7。
(2)固体粉末中一定含有的物质是___________,一定不含有的物质是__________。
(3)沉淀A溶解的化学方程式为_____________。
(4)溶液E中一定含有的阳离子是____________。
【答案】小于硝酸钡、氯化铜、氢氧化钠硫酸铜 Cu(OH)2+H2SO4=CuSO4+2H2O 铜离子和钠离子【解析】【详解】(1)沉淀A中加入过量稀硫酸得到溶液C,说明溶液C的pH小于7;(2)由溶液C和溶液B混合生成不溶于酸的沉淀,可知沉淀D为硫酸钡,故固体粉末中一定含有硝酸钡;又因为沉淀A可以完全被酸溶解,说明沉淀A中不含有硫酸钡,故固体粉末中一定没有硫酸铜;则沉淀A为氯化铜和氢氧化钠生成的氢氧化铜沉淀;故填:硝酸钡、氯化铜、氢氧化钠;硫酸铜;(3)沉淀A为氢氧化铜,和稀硫酸反应方程式为Cu(OH)2+H2SO4=CuSO4+2H2O(4)溶液E与硝酸银反应生成白色沉淀,说明溶液E中有氯离子,且由(2)推知固体中含有硝酸钡、氯化铜、氢氧化钠,可知溶液E的阳离子为铜离子和钠离子。
2.下图所示是有关物质之间的相互转化关系.已知常温下B、C为气体,D、F均为无色液体,E为黑色固体,与稀硫酸反应得到蓝色溶液(部分反应物和生成物及反应条件已略去).根据关系图回答:(1)F的化学式为,化学反应①的方程式为(2)若A为一种盐,则A可能是,若A为一种氧化物,则反应②的方程式是:。
【答案】(1)H2O22H2O2H2↑ +O2↑(2) Na2CO3或CaCO3 CO2+C2CO【解析】试题分析:根据题中的叙述可知,E为氧化铜,F为过氧化氢、D为水、C为氧气;故(1)F的化学式为H2O2,化学反应①的方程式为2H2O2H2↑ +O2↑;(2)若A为一种盐,则A可能是碳酸盐,故Na2CO3或CaCO3若A为一种氧化物,则反应②的方程式是:CO2+C2CO。
中考化学专项训练:化学推断题综合训练题附答案一、化学推断题1.已知A~G是初中化学常见的物质,A、B、C、E、F属于不同类别的物质,G溶液呈黄色,A与C反应产生白色沉淀(微溶物不列为沉淀),它们相互间发生反应或转化的关系如图所示(“﹣”表示两种物质间能发生反应,“→”表示两种物质间的转化关系,部分反应物、生成物和反应条件已经略去).(1)A、F的化学式分别为_____,_____;(2)B与E反应的化学方程式为_____,其反应的基本反应类型为_____;G→D的化学方程式为_____;(3)A→D反应的实验现象为_____.2.图中A、B、C、D、E是初中化学常见的五种不同类别的物质. E是导致溫室效应的一种气体,图中“﹣”表示相连物质能发生化学反应,“→”表示两种物质间的转化关系(部分反应物、生成物及反应条件省略).(1)写出物质E的一种用途;(2)物质C与E反应的化学方程式是;(3)写出图中一个属于中和反应的化学方程式。
(4)A与B反应的微观实质是。
3.A~E为初中化学常见物质,他们之间有如图所示的转化和反应关系(“→”表示某一种物质经一步反应可转化为另一种物质,“一”表示相连两种物质能发生化学反应,部分反应物、生成物及反应条件已略去).(1)若C、D是组成元素相同的气体,且A和X反应的现象是固体由红色逐渐变成黑色,则A为____,B为____,D与E发生的化学反应_____(填“是”或“不是”)置换反应.(2)若A、B、C、D、E均含有一种相同的元素,且A、B、C、D是不同类别的物质,A和X反应的现象是有刺激性气味的气体生成,则D为_____,写出A﹣B反应的化学方程式_______________________________。
4.某校实验室有一无色澄清溶液,其中除了硝酸钠以外,可能还含有氢氧化钠、碳酸钠、硫酸钠、硝酸钡中的一种或几种。
实验活动一“探究该废液的组成。
去一定量的无色溶液,进行如下图所示实验。
中考二轮复习化学推断题专题练习(带答案)一、中考化学推断题1.下图表示某些物质间的转化关系,甲、乙是常见气体,丙是常见金属,C的水溶液呈蓝色,D是大理石的主要成分。
按要求回答下列问题:(1)写化学式:甲_____________H___________。
(2)写出反应①、②的化学方程式:①_________________②_______________。
(3)农业上常用B和C混合配制农药X,X的俗称为__________________________。
(4)A和甲反应生成醋酸和水,反应中A和甲的质量比为__________(最简比)。
【答案】H2 CaO Ca(OH)2+CO2=CaCO3↓+H2O 2Cu+2H2SO4+O2Δ2CuSO4+2H2O或(2Cu+O2Δ2CuO CuO+H2SO4=CuSO4+H2O)波尔多液 11:1【解析】【分析】C的溶液是蓝色溶液,故C是硫酸铜,则丙是铜,B和C能制成农药,故B是氢氧化钙,E 通电能生成常见气体甲和乙,故甲是氢气,乙是氧气,E 是水,D是大理石的主要成分,故D是碳酸钙,碳酸钙高温分解生成氧化钙和二氧化碳,故A是二氧化碳,H 是氧化钙,据此分析解答。
【详解】(1)由分析知,甲是氢气,化学式为H2;H是氧化钙,化学式为CaO;(2)①是二氧化碳与氢氧化钙反应生成碳酸钙和水,反应方程式为Ca(OH)2+CO2=CaCO3↓+H2O;反应②是硫酸和铜和氧气反应生成硫酸铜和水,反应方程式为2Cu+2H2SO4+O2 Δ2CuSO4+2H2O(或2Cu+O2Δ2CuO CuO+H2SO4=CuSO4+H2O);(3)硫酸铜和氢氧化钙配制得的溶液称为波尔多液;(4)二氧化碳与氢气反应生成醋酸和水,反应方程式为4H2+2CO2=2H2O+C2H4O2,故反应中A和甲的质量比为88:8=11:1。
2.A~F均为初中化学常见的物质,它们之间的关系如图所示(部分物质已经略去)已知A是目前世界上年产量最高的金属;B是A的最高价金属氧化物,D是胃酸的主要成分;C 中金属元素的质量分数为40%,其水溶液呈蓝色,常用来配制农药波尔多液;E属于碱;F 属于盐。
中考化学推断题50题专题训练(含答案)一、中考化学推断题1.A、B、C、D、E、F是初中化学常见的六种物质,已知A俗称生石灰,C是最常用的溶剂,C与F元素组成相同。
其相互反应情况如图所示(“→”表示一种物质能一步转化为另一种物质)。
(1)A的化学式为_____。
(2)写出D的一种用途_____。
(3)A生成B的化学方程式为_____。
【答案】CaO 做建筑材料 CaO+H2O=Ca(OH)2【解析】【分析】根据A~F均为初中化学常见的物质,A俗称生石灰,所以A是CaO,C是最常用的溶剂,所以C是H2O,C与F元素组成相同,F会转化成C,所以F是H2O2,过氧化氢分解生成水和氧气,所以E是O2,氧气和水可以互相转化,D会转化成水、氧化钙,所以D是CaCO3,氧化钙会转化成的B会转化成水,所以B是Ca(OH)2,经过验证,推导正确。
【详解】(1)根据推断A是CaO;(2)D是CaCO3,它的一种用途是:做建筑材料;(3)A生成B的反应是氧化钙和水反应生成氢氧化钙,反应的化学方程式为:CaO+H2O=Ca(OH)2。
【点睛】在解此类题时,首先将题中有特征的物质推出,然后结合推出的物质和题中的转化关系推导剩余的物质,最后将推出的各种物质代入转化关系中进行验证即可。
2.某白色固体混合物可能含有Na2CO3、KOH、MgCl2、CaCl2中的一种或几种。
为了确定该混合物的成份,宇琛同学进行了如下实验:(1)在固体样品中加入足量水搅拌后的操作Ⅰ是_____,该操作必须用到的玻璃仪器有玻璃棒、烧杯和_____,其中玻璃棒的作用是_____;(2)往白色沉淀B中加入足量稀盐酸,沉淀全部溶解且无气泡产生,则反应的化学方程式为_____;(3)取无色溶液A少量于试管中,通入CO2,得到无色溶液C和白色沉淀D,该步骤发生的化学反应方程式为_____;(4)原白色固体中含有的物质是_____。
【答案】过滤漏斗引流 Mg(OH)2+2HCl=MgCl2+2H2O 2KOH+CO2=K2CO3+H2O,K2CO3+CaCl2=CaCO3↓+2KCl(或Ca(OH)2+CO2=CaCO3↓+H2O) KOH、MgCl2、CaCl2【解析】【分析】根据实验可知:加入足量的水,溶解之后,得到白色沉淀B和无色滤液A,可以推测白色沉淀是两物质反应产生的不溶于水的物质,可能是氢氧化镁或者是碳酸钙;向白色沉淀B 中加入足量的稀盐酸,固体溶解得到无色溶液E,若无其他明显的现象,说明该白色沉淀B 为氢氧化镁;将无色溶液A分别取样滴入酚酞,溶液变红,说明溶液呈碱性,可能是氢氧化钾或者是碳酸钠使得酚酞变红,另取样通入二氧化碳,得到白色沉淀D和无色溶液C;可知该白色沉淀D为碳酸钙;因此溶液中存在CaCl2,可得无色溶液A中没有Na2CO3;经过综合分析可得:白色固体混合物含有KOH、MgCl2、CaCl2;而没有Na2CO3;代入验证可得推导正确。
一、中考初中化学推断题1.A~J是初中化学常见的物质,A是一种含有四种元素的盐,可用作治疗胃酸过多,其反应原理:A和B反应生成C、D和E三种物质,通过光合作用D和E反应生成F和G,煤气主要成分H在F中燃烧生成E,I和D反应只生成J,J常用于改良酸性土壤。
(1)G的化学式为____,G中质量分数最大的元素是_________。
(2)A的俗称是____;A和B反应的化学方程式为___,基本反应类型是_____。
(3)I的用途是______(答1点即可);H在F中燃烧的化学方程式为___。
(4)改良后土壤浸出液的酸碱度可用_____测定。
【答案】C6H12O6 O 小苏打 NaHCO3+HCl=NaCl+H2O+CO2↑复分解反应干燥剂2CO+O2点燃2CO2 pH试纸【解析】【分析】根据A~是初中化学常见的物质,A是一种含有四种元素的盐,可用作治疗胃酸过多,所以A是碳酸氢钠,其反应原理:A和B反应生成C、D和E三种物质,B是盐酸,通过光合作用D和E反应生成F和G,煤气主要成分H在F中燃烧生成E,所以H是一氧化碳,E是二氧化碳,F是氧气,I和D反应只生成J,所以I是氧化钙,D是水,常用于改良酸性土壤,所以是J氢氧化钙,水和二氧化碳光合作用生成葡萄糖和氧气,所以G是葡萄糖,然后将推出的物质进行验证即可。
【详解】(1)由分析可知:G是葡萄糖,其化学式为:C6H12O6,G中质量分数最大的元素是:碳;故填:C6H12O6;碳(2)A的俗称是小苏打,A和B的反应是碳酸氢钠和盐酸反应生成氯化钠、水和二氧化碳,化学方程式为:NaHCO3+HCl=NaCl+H2O+CO2↑,基本反应类型是复分解反应;故填:小苏打;NaHCO3+HCl=NaCl+H2O+CO2↑;复分解反应(3)I的用途是干燥剂;H在F中燃烧的反应是一氧化碳和氧气在点燃的条件下生成二氧化碳,化学方程式为:2CO+O2点燃2CO2;故填:干燥剂;2CO+O2点燃2CO2(4)改良后土壤浸出液的酸碱度可用pH试纸测定。
中考化学推断题80题专题训练(含答案)一、中考化学推断题1.现有五瓶失去标签的溶液 A、B、C、D、E,它们分别是氢氧化钠、氯化钠、硫酸铜、氯化钡、稀硫酸中的一种,某同学不用其它试剂,用如下实验加以鉴别。
第一步:通过观察发现 E 溶液呈蓝色,其它溶液均为无色。
第二步:取少量 A、B、C、D 溶液,分别滴加 E 溶液,现象为:A 溶液中出现白色沉淀,B 溶液中出现蓝色沉淀,C 和 D 溶液均无明显现象。
第三步:取第二步中产生的蓝色沉淀,滴加 C 溶液后沉淀消失。
则:(1)A 溶液中溶质的化学式是_________。
(2)写出B和E反应的化学方程式:_________,其基本反应类型是_________。
【答案】BaCl2 CuSO4+2NaOH=Cu(OH)2↓+Na2SO4复分解反应【解析】【分析】E溶液为蓝色,则E是硫酸铜;硫酸铜与A混合产生白色沉淀,则A是氯化钡;硫酸铜与B混合产生蓝色沉淀,则B是氢氧化钠;氢氧化铜沉淀能溶于硫酸,加入C,沉淀消失,则C是硫酸,故D是氯化钠。
【详解】(1)A是氯化钡,故填:BaCl2;(2)B是氢氧化钠,E是硫酸铜,氢氧化钠能与硫酸铜反应生成氢氧化铜沉淀和硫酸钠,故填:CuSO4+2NaOH=Cu(OH)2↓+Na2SO4.两种化合物相互交换成分生成另外两种化合物,基本反应类型为复分解反应。
2.高纯碳酸钙广泛应用于电子、医药等领域。
某化工厂利用优质石灰石(含少量SiO2等不溶于水和稀盐酸的杂质)为原料得到高纯CaCO3.其工艺流程如图:(1)该流程图中出现的氧化物有二氧化碳和_____(填名称)。
(2)实验室进行操作I的名称是_____,进行该操作时需要的玻璃仪器有烧杯、漏斗、_____。
(3)请完成“转化”步骤中发生反应的化学方程式:CaCl2+_____NH3+CO2+_____═CaCO3↓+2NH4Cl(4)该工艺的副产品NH4Cl的用途有_____(写出一种即可)。
中考化学化学推断题综合题附详细答案一、初中化学推断题1.如图是常见酸、碱、盐之间的相互转化关系。
(1)写出图中相应物质的化学式。
酸______,碱______。
(2)写出图中反应②和④的化学方程式。
②________________________________________________________;④________________________________________________________。
(3)总结化学反应的规律是我们学习化学的方法之一。
请根据上图总结出酸、碱、盐相互反应的规律。
(写两点)_____________________________________________;____________________________________________。
【答案】24H SO 2Ba(OH) 2244BaCl H SO BaSO +=↓2HCl +232Na CO +Ba(OH)3BaCO ↓+2NaOH (答案不唯一,合理即可) 酸和碱反应生成盐和水 酸和盐反应生成新酸和新盐(其他答案合理均可)【解析】【分析】根据酸碱盐之间发生复分解反应的规律进行分析。
【详解】(1)根据酸和碱反应生成盐和水判断,生成硫酸钡需要硫酸和氢氧化钡反应,故酸是硫酸24H SO ,碱是氢氧化钡2Ba(OH);(2)硫酸和盐反应会生成硫酸钡,从复分解反应的原理,只要是可溶性的钡盐就可以如硫酸和氯化钡或者硝酸钡等可溶性钡盐反应生成硫酸钡沉淀和盐酸或者硝酸;(3)氢氧化钡和盐反应生成碳酸钡,从复分解反应的原理可以知道,盐只要是可溶性的碳酸盐就可以如氢氧化钡和碳酸钠反应生成碳酸钡沉淀和氢氧化钠;可溶性碳酸盐和可溶性钡盐可以生成碳酸钡。
②和④的化学方程式为2244BaCl H SO BaSO +=↓2HCl + (4). 232Na CO +Ba(OH)=3BaCO ↓+2NaOH(4)复分解反应是两种化合物交换成分生成两种化合物。
中考化学专题题库∶化学推断题的综合题及答案 一、初中化学推断题 1.在一次化学课堂活动中,老师设计了如图所示的游戏,要求五位同学分别佩戴下列铭牌:铝、氧气、二氧化碳、硫酸铜、氢氧化钠,以最快的速度找到自己的位置(图中“一”表示相的两位置代表的“同学”能发生化学反应,“→”表示两位置代表的“同学存在转化关系)。其中A的溶液显蓝色,D的固体可用于人工降雨。请回答下列问题:
(1)D的化学式为______。 (2)写出C的一种用途:______。 (3)A-E反应的化学方程式为______。 (4)下列四位佩戴铭牌的同学为候选人员按游戏规则,只有一人能从原五位同学中找到替代对象完成游戏,这位同学佩戴的铭牌是______(填序号)。 ① 银 ② 一氧化碳 ③ 盐酸 ④ 氯化钠
【答案】CO2 供给呼吸 CuSO4+2NaOH=Cu(OH)2↓+Na2SO4 ③
【解析】 【分析】 A的溶液显蓝色,所以A是硫酸铜,D的固体可用于人工降雨,所以D是二氧化碳,C会
转化成二氧化碳,所以C是氧气,B会与C反应,所以B是铝,E是氢氧化钠,经过验证,推导正确。 【详解】 (1)D是二氧化碳,其化学式为CO2; (2)C是氧气,氧气的一种用途是:供给呼吸; (3)A-E的反应是硫酸铜和氢氧化钠反应生成氢氧化铜沉淀和硫酸钠,化学方程式为:CuSO4+2NaOH=Cu(OH)2↓+Na2SO4;
(4)因为银和氯化钠不能和这五种物质中的任何物质反应,而一氧化碳也只能转化为二氧化碳,不能跟其他物质反应,所以只有盐酸符合要求,盐酸代替硫酸铜会与氢氧化钠和铝反应,所以这位同学佩戴的铭牌是③。 【点睛】 在解此类题时,首先将题中有特征的物质推出,然后结合推出的物质和题中的转化关系推导剩余的物质,最后将推出的各种物质代入转化关系中进行验证即可。
2.A∼E是初中化学常见的五种不同类别的物质,C常用作建筑材料,E常用作食品干燥剂。
他们之间的关系如图所示,“−”表示相连的物质能发生反应,“→”表示一种物质能生成另一种物质(部分反应物、生成物和反应条件已略去). 请回答下列问题: (1)E的化学式是_____。 (2)D转化为C的化学方程式_____,反应现象是_____。 (3)A与B反应的化学方程式_____,其基本反应类型为_____。 【答案】CaO 2232CO+Ca(OH)=CaCO+HO 出现白色沉淀
22Fe+2HCl=FeCl+H 置换反应
【解析】 【分析】 A∼E是初中化学常见的五种不同类别的物质,C常用作建筑材料,则C为碳酸钙,属于
盐,E常用作食品干燥剂,则E是氧化钙,属于氧化物,E能生成D,D能生成C,则D是氢氧化钙,属于碱,B能和D、C反应,则B是酸,则B是盐酸,A和B反应,则A是金属单质。 【详解】 (1)E常用作食品干燥剂,则E是氧化钙,故E的化学式是CaO。 (2)C常用作建筑材料,则C为碳酸钙,E能生成D,D能生成C,则D是氢氧化钙,D转化为C的反应是氢氧化钙和二氧化碳反应生成碳酸钙和水,化学方程式为
2232CO+Ca(OH)=CaCO+HO,反应现象是出现白色沉淀。
(3)B能和D、C反应,则B是酸,则B是盐酸,A和B反应,则A是金属单质,A可以是铁,故A与B反应的化学方程式22Fe+2HCl=FeCl+H,反应符合一种单质和一种化合物生成另一种单质和另一种化合物的反应,故基本反应类型为置换反应。 【点睛】 C常用作建筑材料,则C为碳酸钙, E常用作食品干燥剂,则E是氧化钙, E能生成D,D能生成C,则D是氢氧化钙。
3.现欲探究一固体物质A的成分,已知其中可能含有FeCl3、CuCl2、NaCl、Ba(NO3)2中的一种或多种。按如图所示进行实验,出现的现象如图中所述(设过程中所有发生的反应都恰好完全反应)。 试根据实验过程和发生的现象做出判断,填写以下空白: (1)白色沉淀B的化学式为______,白色沉淀F的化学式为______。 (2)溶液C中肯定存在的酸根阴离子是______(写离子符号)。 (3)滤液G中共存在______种溶质。 (4)一定不存在的物质是______理由是______。 (5)固体物质A中一定存在的物质是______(写化学式)。 (6)写出过程②中生成蓝色沉淀反应的化学方程式______。 【答案】BaSO4 AgCl 3NO、Cl- 4 氯化铁 加入氢氧化钠后会生成蓝色沉淀 CuCl2、Ba(NO3)2 22CuCl+2NaOH=CuOH2NaCl() 【解析】 【分析】 硫酸根离子和钡离子反应会生成硫酸钡沉淀,氢氧根离子和铜离子会生成蓝色的氢氧化铜沉淀,和铁离子会生成红褐色的氢氧化铁沉淀,氯离子和银离子反应会生成氯化银沉淀;据此进行分析 【详解】 (1)固体混合物A中加入稀硫酸会生成白色沉淀B,所以A中一定含有硝酸钡,硝酸钡和硫酸反应生成硫酸钡沉淀和硝酸,所以C中含有硝酸;向溶液C、D中加入硝酸银溶液和足量稀硝酸,生成的白色沉淀为氯化银;所以白色沉淀B的化学式为BaSO4,白色沉淀F的化学式为AgCl; (2)由以上分析可知溶液C中肯定有硝酸和氯离子存在,所以溶液C中肯定存在的酸根阴离子是3NO、Cl-; (3)固体混合物A中加入氢氧化钠会生成蓝色沉淀E,所以A中一定含有氯化铜,氯化铜和氢氧化钠反应生成氢氧化铜沉淀和氯化钠,所以D中含有氯化钠;结合以上分析可知A中肯定含有氯化铜和硝酸钡;所以A物质经过①反应,C溶液中有硝酸和氯化铜;A物质经过②反应,D溶液中有氯化钠和硝酸钡;C、D再经过③反应,G溶液中有硝酸钠、硝酸钡、硝酸铜、硝酸,所以滤液G中共存在4种溶质; (4)一定不存在的物质是氯化铁,理由是:加入氢氧化钠后会生成蓝色沉淀; (5)固体物质A中一定存在的物质是CuCl2、Ba(NO3)2; (6)过程②中生成蓝色沉淀的反应是氯化铜和氢氧化钠反应生成氢氧化铜沉淀和氯化钠,化学方程式为:22CuCl+2NaOH=CuOH2NaCl()。 【点睛】 在解此类题时,首先分析题中所给物质的性质和两两之间的反应,然后依据题中的现象判断各物质的存在性,最后进行验证即可。
4.酸、碱、盐在生产生活中具有广泛的用途。 (1)化学实验室有失去标签的稀硫酸、氢氧化钠、氢氧化钙、碳酸钠、氯化钡五瓶无色 溶
液,现将其任意编号:A、B、C、D、E,然后两两组合进行实验,其部分现象如下表(微溶物视为可溶物):
实验 A+B A+C A+D B+C
现象 产生气体 产生沉淀 产生沉淀 产生沉淀
①写出溶液 B、C 中溶质的化学式: B_____,C_____。 ②写出溶液 A 与 D 反应的化学方程式_____。 (2)我国制碱工业先驱侯德榜发明了“侯氏制碱法”,其主要化学原理: NaCl+H2O+NH3+CO2=NaHCO3↓+X; 2NaHCO3Na2CO3+H2O+CO2↑等; 回答下列问题: ①X 的化学式为_____。 ②将碳酸钠和碳酸氢钠的混合物 l0g 充分加热至质量不再改变,冷却,称量剩余固体 质量为 6.9g,则原混合物中碳酸钠和碳酸氢钠的质量比为_____(写最简比)。 【答案】H2SO4 BaCl2 Na2CO3+Ca(OH)2=CaCO3↓+2NaOH NH4Cl 4∶21 【解析】 稀硫酸、氢氧化钠、氢氧化钙、碳酸钠、氯化钡五种溶液,能与两种物质发生反应生成沉淀的是碳酸钠、氯化钡,其中碳酸钠能与稀硫酸反应生成气体,所以A是碳酸钠,B是稀硫酸,稀硫酸能与氯化钡溶液反应生成沉淀,所以C是氯化钡,碳酸钠溶液能与氢氧化钙溶液反应生成沉淀,故D是氢氧化钙,则E是氢氧化钠。①溶液B、C中溶质分别是H2SO4、BaCl2 ②溶液A与D反应的化学方程式:Na2CO3+Ca(OH)2=CaCO3↓+2NaOH。 (2)①化学反应前后各种原子个数相等,所以X的化学式为NH4Cl。 ②设原混合物中碳酸氢钠的质量为x。 2NaHCO3Na2CO3 + H2O + CO2↑ 固体的差量 168 106 168-106=62 x l0g-6.9g=3.1g
16862=3.1xg,解得x=8.4g,原混合物中碳酸钠的质量是:l0g-8.4g=1.6g
则原混合物中碳酸钠和碳酸氢钠的质量比为:1.6g:8.4g=4:21 点睛:本题主要考查酸、碱、盐的反应以及反应现象,先判断出物质之间能发生的反应,然后利用反应现象进行确定问题即可迎刃而解。 5.A~G是初中化学常见的物质,它们之间的转化关系如图所示,图中“一”表示两种物
质间能发生化学反应,“→”表示两种物质间的转化关系,已知A是人体胃液里含有的酸,B、C、D、F均为氧化物,E中含有三种元素,G是最轻的气体(其中部分反应条件、反应物及生成物已略去),请回答下列问题:
(1)写出F物质的名称_____; (2)写出一个符合C和D反应的化学方程式_____; (3)写出B物质的一种用途_____; (4)写出A和E发生反应的微观实质_____。
【答案】水 CuO+CO Δ CuO+CO2 灭火 氢离子和氢氧根离子反应生成水
【解析】 【分析】 A~G是初中化学常见的物质,A是人体胃液里含有的酸,所以A是盐酸,B、C、D、F均
为氧化物,E中含有三种元素,G是最轻的气体,所以G是氢气,盐酸可以转化成B,且B和C可以相互转化,所以B是二氧化碳,C一氧化碳,D会与盐酸、一氧化碳反应,所以D可以是氧化铜,氢气和F可以相互转化,所以F是水,水和E可以相互转化,E会与A反应,所以E是氢氧化钙。 【详解】 (1)G是最轻的气体,所以G是氢气,氢气和F可以相互转化,故F是水。 (2)符合C和D的反应是氧化铜和一氧化碳在加热的条件下生成铜和二氧化碳,化学方
程式为2CuO+COCuO+CO。
(3)盐酸转化成的B和C可以相互转化,所以B是二氧化碳,故B物质的一种用途是灭火。 (4)水和E可以相互转化,E会与A反应,所以E是氢氧化钙,A和E发生反应是氢氧化钙和盐酸反应生成氯化钙和水,反应的微观实质是氢离子和氢氧根离子反应生成水。 【点睛】 A是人体胃液里含有的酸,则A是盐酸,G是最轻的气体,则G是氢气。