第十章电化学基础和氧化还原平衡修改
- 格式:pdf
- 大小:1.56 MB
- 文档页数:97

氧化还原反应和电化学反应氧化还原反应是化学反应中最为重要和常见的反应之一。
它涉及到物质中的电子转移过程。
在氧化还原反应中,物质可以同时发生氧化和还原。
与之相伴随的是电化学反应,电化学反应是指在化学反应中涉及电子的转移和电流的流动的反应。
一、氧化还原反应氧化还原反应中,氧化和还原是同时进行的。
氧化是指物质失去电子;还原则是指物质获得电子。
这一过程中,电子从一个物质转移到另一个物质。
氧化和还原总是同时发生,因为电子不能独立存在。
例如,当铁和氧气发生反应时,铁原子(Fe)失去两个电子,被氧(O2)接受,生成氧化铁(Fe2O3)。
这里,铁原子发生了氧化,而氧气发生了还原。
氧化还原反应在日常生活中非常常见。
例如,金属的生锈、水的电解、电池的工作原理等都是氧化还原反应的例子。
二、电化学反应电化学反应是指在化学反应中涉及电子的转移和电流的流动的反应。
它是由氧化还原反应导致的。
电化学反应可以分为两种类型:电解反应和电池反应。
1. 电解反应电解反应是指在电解池中,通过外加电压使化学反应发生。
在电解过程中,正极(阳极)接受电子,发生氧化反应;负极(阴极)释放电子,发生还原反应。
电解反应在工业生产和实验室中广泛应用。
例如,电解盐水时,氯离子(Cl-)在阳极上接受电子,发生氧化反应生成氯气(Cl2),而阳离子(Na+)在阴极上释放电子,发生还原反应生成氢气(H2)。
2. 电池反应电池反应是指在电化学电池内,将化学能转化为电能的反应。
电池由两个半电池组成,每个半电池都有一个氧化反应和一个还原反应。
半电池之间通过电子流进行电荷平衡。
常见的电池包括干电池、蓄电池和燃料电池等。
干电池是通过将氧化剂和还原剂隔离,以阻止反应直接进行,并通过电子在电路中流动来提供电能。
蓄电池是通过可逆的氧化还原反应来存储和释放电能。
燃料电池是通过将燃料和氧气直接反应生成电能。
总结:氧化还原反应和电化学反应密切相关,涉及到电子转移和电流的流动。
氧化还原反应是物质中的电子转移过程,分为氧化和还原。

![[指南]上大 无机化学b 第十章氧化答复中兴](https://uimg.taocdn.com/dfcef1260b4e767f5acfceb1.webp)


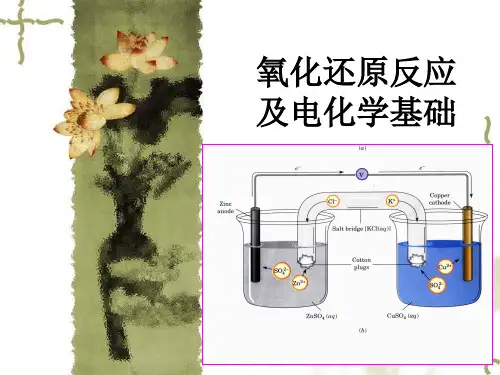




第10讲氧化还原反应与电化学基础【竞赛要求】氧化态。
氧化还原的基本概念和反应的书写与配平。
原电池。
电极符号、电极反应、原电池符号、原电池反应。
标准电极电势。
用标准电极电势判断反应的方向及氧化剂与还原剂的强弱。
电解池的电极符号与电极反应。
电解与电镀。
电化学腐蚀。
常见化学电源。
Nernst方程及有关计算。
原电池电动势的计算。
pH对原电池的电动势、电极电势、氧化还原反应方向的影响。
沉淀剂、络合剂对氧化还原反应方向的影响。
【知识梳理】一、氧化还原反应的基本概念1、氧化数在氧化还原反应中,由于发生了电子转移,导致某些元素带电状态发生变化。
为了描述元素原子带电状态的不同,人们提出了氧化数的概念。
1970年,国际纯粹与应用化学联合会(IUPAC)对氧化数的定义是:氧化数是某元素一个原子的荷电数,这个荷电数是假设把每个化学键的电子指定给电负性更大的原子而求得的。
例如,在NaCl中,钠的氧化数为 +1,氯的氧化数为–1。
在SO2中,硫的氧化数为+4,氧的氧化数为–2。
由此可见,氧化数是元素在化合状态时人为规定的形式电荷数。
确定氧化数的规则:(1)在单质中,元素的氧化数为零。
(2)在单原子离子中,元素的氧化数等于离子所带的电荷数。
(3)在大多数化合物中,氢的氧化数为 +1,只有在活泼金属的氢化物(如NaH,CaH2)中,氢的氧化数为–1。
(4)通常,在化合物中氧的氧化数为–2;但在过氧化物(如H2O2、Na2O2、BaO2)中氧的氧化数为–1;而在OF2和O2F2中,氧的氧化数分别为 +2和 +1。
(5)在所有氟化物中,氟的氧化数为–1。
(6)碱金属和碱土金属在化合物中的氧化数分别为 +1和 +2。
(7)在中性分子中,各元素氧化数的代数和为零。
在多原子原子离子中各元素氧化数的代数和等于离子所带的电荷数。
根据上述原则,可以确定化合物中某元素的氧化数。
2、氧化还原电对在氧化还原反应中,元素氧化数升高的物质是还原剂,元素氧化数降低的物质是氧化剂。

氧化还原反应和电化学氧化还原反应(简称“氧化还原反应”)是化学反应中一种非常重要的类型。
在氧化还原反应中,物质的电荷状态发生变化,原子失去或获得电子,从而形成离子,以完成化学反应。
电化学则是研究电能与化学能之间转化的学科。
一、氧化还原反应1. 概念和基本原理氧化还原反应是指在化学反应中,原子、离子或分子中的电子的互相转移过程。
氧化是指物质失去电子,而还原则是指物质获得电子。
在氧化还原反应中,存在着氧化剂和还原剂的概念。
氧化剂接受电子,自身被还原,而还原剂则失去电子,自身被氧化。
2. 氧化还原反应的应用氧化还原反应广泛应用于生活和工业领域。
例如,在电池中,氧化还原反应产生电能;在腐蚀过程中,金属发生氧化还原反应,导致金属的破坏;在生物体内,呼吸作用中的氧化还原反应产生能量。
二、电化学1. 电化学基本概念电化学是研究电能与化学能之间相互转化的学科。
它涉及到电解、电极反应、电池和电解质溶液等概念。
电化学通常分为两个分支:电解学和电池学。
2. 电化学实验电化学实验是研究电化学现象的重要手段。
在实验中,常见的电化学装置包括电解槽、电极、电解质溶液等。
通过实验可以观察到电流的流动和电极上发生的反应,从而揭示电化学过程的本质。
三、氧化还原反应与电化学的联系氧化还原反应与电化学紧密相关。
在电池中,氧化还原反应产生电能,而在电解槽中,电能则用于促使氧化还原反应发生。
此外,电极反应是电化学研究的重点之一,它涉及到氧化还原反应中电子的转移过程。
结论氧化还原反应是化学反应中重要的类型,通过氧化和还原的相互转化,实现能量的转化。
电化学则是研究电能与化学能之间相互转化的学科,它与氧化还原反应密切相关。
两者的研究和应用对于能源、环保等领域具有重要意义。
通过深入理解氧化还原反应和电化学,我们可以更好地应用于实际生活和工业中,促进科学技术的发展和进步。
这篇文章介绍了氧化还原反应和电化学的基本概念、原理和应用,并强调了两者之间的联系。
氧化还原反应与电化学反应氧化还原反应(简称氧化反应或还原反应)和电化学反应是化学领域中重要的两个概念。
尽管它们在某些方面存在联系,但实际上是两个独立的概念,具有不同的定义和特点。
本文将探讨氧化还原反应和电化学反应的概念、区别以及在实际应用中的重要性。
一、氧化还原反应氧化还原反应是指化学反应中物质的氧化态和还原态之间的转变。
在氧化还原反应中,某一物质被氧化,即失去电子,同时另一物质被还原,即获得电子。
典型的氧化还原反应可以表示为以下形式:氧化剂 + 还原剂→ 氧化产物 + 还原产物其中,氧化剂是指能够接受电子的物质,而还原剂是指能够提供电子的物质。
氧化剂在反应中被还原,还原剂在反应中被氧化。
这种电子的转移过程是氧化还原反应的核心。
例如,常见的金属与酸反应产生金属盐和氢气的反应就是典型的氧化还原反应。
在这个反应中,金属被酸氧化失去电子,而酸则被金属还原获得电子。
这种反应过程不仅仅发生在化学实验室中,还存在于自然界的许多过程中,如腐蚀、燃烧等。
二、电化学反应电化学反应是指化学反应中涉及电子转移的反应。
与氧化还原反应类似,电化学反应也涉及物质的氧化态和还原态的转变。
然而,电化学反应更加注重反应过程中的电流和电势差。
电化学反应可以通过电解或电池(包括电解池和电池)进行。
在电解中,外加电势通过电解质中的离子传递,导致氧化还原反应发生。
在电池中,氧化还原反应会产生电流,从而进行能量转换和电化学合成。
电化学反应在许多实际应用中发挥着重要作用。
例如,电解法是一种常用的工业制备金属的方法。
充电电池则是一种广泛使用的能量储存设备。
在电化学反应中,电流和电势差是关键参数,影响反应速率和反应的方向。
三、氧化还原反应与电化学反应的区别尽管氧化还原反应和电化学反应都涉及到物质的氧化态和还原态的转变,但它们在定义、特点和应用方面存在着一些区别。
首先,氧化还原反应是一个广义的概念,而电化学反应则是其中的一种特殊情况。
氧化还原反应可以发生在气相、液相或固相中,而电化学反应通常发生在电解质溶液中。
电化学中的氧化还原氧化还原反应是电化学中的重要概念,也是许多电化学过程的基础。
在电化学中,氧化还原反应是指物质失去电子的过程称为氧化,而物质获得电子的过程称为还原。
这种反应涉及电子的转移,因此也被称为电子转移反应。
氧化还原反应在电化学中具有广泛的应用,包括电池、电解、电镀等领域。
本文将介绍电化学中的氧化还原反应的基本概念、原理和应用。
1. 氧化还原反应的基本概念氧化还原反应是指物质中电子的转移过程。
在氧化还原反应中,发生氧化的物质失去电子,而发生还原的物质获得电子。
氧化还原反应可以用化学方程式表示,其中氧化反应和还原反应分别写在方程式的左右两侧,通过电子的转移实现物质的氧化和还原。
在氧化还原反应中,氧化剂是指能够接受电子的物质,而还原剂是指能够给出电子的物质。
氧化还原反应中的电子转移过程是通过电子传导体实现的。
在电化学中,常用的电子传导体包括金属导体、电解质溶液和离子传导体等。
通过这些电子传导体,氧化还原反应中的电子可以在物质之间传递,实现物质的氧化和还原。
2. 氧化还原反应的原理氧化还原反应的原理基于物质中电子的转移过程。
在氧化还原反应中,发生氧化的物质失去电子,而发生还原的物质获得电子。
这种电子的转移过程导致物质的化学性质发生变化,从而实现氧化还原反应。
在氧化还原反应中,氧化剂接受电子,而还原剂给出电子,通过这种电子的转移实现物质的氧化和还原。
氧化还原反应的原理还涉及电子传导体的作用。
在氧化还原反应中,电子传导体起着至关重要的作用,它们提供了电子传递的通道,使得氧化还原反应能够顺利进行。
不同的电子传导体对氧化还原反应的速率和效率都会产生影响,因此在设计和优化氧化还原反应过程时需要考虑电子传导体的选择和性能。
3. 氧化还原反应的应用氧化还原反应在电化学中具有广泛的应用。
其中最常见的应用之一是电池。
电池是利用氧化还原反应产生电能的装置,通过氧化剂和还原剂之间的氧化还原反应释放出电子,从而产生电流。
氧化还原反应氧化性还原性强弱判断教案第一章:氧化还原反应基本概念1.1 氧化还原反应的定义1.2 氧化还原反应的实质1.3 氧化还原反应的特征1.4 氧化还原反应的分类第二章:氧化性还原性的判断2.1 氧化性还原性的定义2.2 氧化性还原性的判断原则2.3 常见元素的氧化性还原性2.4 氧化性还原性的应用第三章:标准电极电势3.1 标准电极电势的定义3.2 标准电极电势的计算3.3 标准电极电势的应用3.4 常见金属的的标准电极电势第四章:氧化还原反应的平衡4.1 氧化还原反应平衡的定义4.2 氧化还原反应平衡的判断4.3 氧化还原反应平衡的计算4.4 氧化还原反应平衡的影响因素第五章:氧化还原反应的应用5.1 氧化还原反应在电池中的应用5.2 氧化还原反应在金属腐蚀中的应用5.3 氧化还原反应在合成中的应用5.4 氧化还原反应在其他领域的应用第六章:氧化还原反应的实验操作6.1 氧化还原反应实验的基本操作6.2 氧化还原反应实验的注意事项6.3 氧化还原反应实验案例分析第七章:氧化还原反应与生活7.1 氧化还原反应在生活中的应用7.2 氧化还原反应与人体健康的关系7.3 氧化还原反应在环境污染治理中的应用7.4 氧化还原反应在其他生活领域的应用第八章:氧化还原反应的现代分析方法8.1 氧化还原反应与现代分析方法的关系8.2 紫外-可见光谱法在氧化还原反应分析中的应用8.3 原子吸收光谱法在氧化还原反应分析中的应用8.4 电化学分析法在氧化还原反应分析中的应用第九章:氧化还原反应的案例分析9.1 氧化还原反应在药物合成中的应用案例9.2 氧化还原反应在材料科学中的应用案例9.3 氧化还原反应在环境保护中的应用案例9.4 氧化还原反应在其他领域中的应用案例第十章:氧化还原反应的综合训练10.1 氧化还原反应题目的设计与解析10.2 氧化还原反应的解题技巧与策略10.3 氧化还原反应的综合训练题目10.4 氧化还原反应综合训练题目的解答与分析重点和难点解析重点环节1:氧化还原反应基本概念解析:氧化还原反应是化学中的基础概念,理解其定义、实质、特征和分类对于后续的学习至关重要。
氧化还原反应教案精选案例大全第一章:氧化还原反应基本概念1.1 氧化还原反应的定义氧化还原反应的定义及特点氧化还原反应与化学反应的关系1.2 氧化还原反应的基本术语氧化剂、还原剂氧化数、氧化态电子转移1.3 氧化还原反应的表示方法半反应式离子方程式电子转移数第二章:氧化还原反应的类型2.1 单质之间的氧化还原反应同种元素之间的氧化还原反应不同元素之间的氧化还原反应2.2 化合物之间的氧化还原反应置换反应合成反应分解反应2.3 离子化合物与自由原子之间的氧化还原反应酸碱反应氧化剂与还原剂的反应第三章:氧化还原反应的判断与平衡3.1 氧化还原反应的判断氧化还原反应的实验判断氧化还原反应的理论判断3.2 氧化还原反应的平衡氧化还原反应的平衡常数氧化还原反应的平衡移动3.3 氧化还原反应的平衡计算标准电极电势的计算氧化还原反应的平衡常数计算第四章:氧化还原反应的应用4.1 电化学中的应用原电池电解质电镀4.2 分析化学中的应用滴定极谱分析原子吸收光谱分析4.3 合成化学中的应用有机合成催化剂材料合成第五章:氧化还原反应的实例解析5.1 实例一:铁的腐蚀与防护铁的腐蚀原理铁的防护方法5.2 实例二:漂白粉的制备与作用漂白粉的制备方法漂白粉的氧化还原反应原理5.3 实例三:合成氨的工业生产合成氨的反应原理合成氨的氧化还原反应过程5.4 实例四:药物的合成与分析药物合成中的氧化还原反应药物分析中的氧化还原反应5.5 实例五:环境污染与治理氧化还原反应在环境污染治理中的应用典型环境污染治理案例分析第六章:氧化还原反应在无机化学中的应用6.1 无机化学中的氧化还原反应类型酸碱反应中的氧化还原反应置换反应中的氧化还原反应合成反应中的氧化还原反应6.2 无机化学中的重要氧化还原反应水的电解硫酸的制备金属的提取与精炼6.3 氧化还原反应在无机合成中的应用制备无机化合物制备无机材料制备无机催化剂第七章:氧化还原反应在有机化学中的应用7.1 有机化学中的氧化还原反应类型加成反应中的氧化还原反应消除反应中的氧化还原反应还原反应中的氧化还原反应7.2 有机化学中的重要氧化还原反应醇的氧化酮的氧化醛的氧化7.3 氧化还原反应在有机合成中的应用合成有机化合物合成有机材料合成有机药物第八章:氧化还原反应在生物化学中的应用8.1 生物化学中的氧化还原反应类型呼吸作用中的氧化还原反应光合作用中的氧化还原反应代谢反应中的氧化还原反应8.2 生物化学中的重要氧化还原反应酶催化下的氧化还原反应血红蛋白的氧化还原反应谷胱甘肽的氧化还原反应8.3 氧化还原反应在生物检测与治疗中的应用氧化还原指示剂氧化还原探针氧化还原反应在生物治疗中的应用第九章:氧化还原反应在工业中的应用9.1 氧化还原反应在金属冶炼中的应用火法冶炼湿法冶炼9.2 氧化还原反应在化工生产中的应用合成纤维合成塑料合成橡胶9.3 氧化还原反应在能源转换中的应用电池燃料电池太阳能电池第十章:氧化还原反应在环境科学中的应用10.1 氧化还原反应在环境监测中的应用水质监测空气质量监测土壤污染监测10.2 氧化还原反应在环境治理中的应用废水处理废气处理固体废物处理10.3 氧化还原反应在环境友好型材料中的应用生物降解材料光催化材料空气净化材料第十一章:氧化还原反应在现代科技中的应用11.1 氧化还原反应在纳米技术中的应用纳米材料的合成纳米电子学11.2 氧化还原反应在光电子学中的应用太阳能电池激光技术11.3 氧化还原反应在生物医学中的应用生物传感器药物输送系统第十二章:氧化还原反应与生活常识12.1 氧化还原反应在日常生活中的应用食物的腐败与保存燃料的燃烧12.2 氧化还原反应在健康饮食中的应用营养素的氧化还原性质抗氧化剂的作用12.3 氧化还原反应在安全知识中的应用爆炸原理化学中毒的防护第十三章:氧化还原反应在药物化学中的应用13.1 氧化还原反应在药物合成中的应用药物合成中的氧化步骤药物合成中的还原步骤13.2 氧化还原反应在药物分析中的应用药物含量测定药物纯度分析13.3 氧化还原反应在药物治疗中的应用抗凝血药物抗氧化药物第十四章:氧化还原反应在材料科学中的应用14.1 氧化还原反应在金属材料中的应用金属的腐蚀与防护金属的合金化14.2 氧化还原反应在半导体材料中的应用晶体管的制造集成电路的制造14.3 氧化还原反应在新材料研发中的应用纳米材料的制备功能化材料的设计第十五章:氧化还原反应的未来发展趋势15.1 氧化还原反应在绿色化学中的应用可持续发展的化学环境友好型合成方法15.2 氧化还原反应在能源领域的挑战与发展清洁能源的制备与存储电池技术的创新15.3 氧化还原反应在生命科学中的探索生物体内的氧化还原平衡疾病与氧化应激的关系重点和难点解析本文主要介绍了氧化还原反应的基本概念、类型、判断与平衡、应用以及在不同领域中的具体实例和未来发展趋势。