免疫共沉淀(Immunoprecipitation, IP)解析
- 格式:ppt
- 大小:1.53 MB
- 文档页数:11

免疫共沉淀中的igg免疫共沉淀(immunoprecipitation, IP)是一种广泛应用于生物医学研究中的实验技术,其主要用于检测和研究蛋白质与其他生物大分子(如蛋白质、核酸、多肽等)之间的相互作用关系。
在免疫共沉淀中,常使用的IgG(免疫球蛋白G)作为抗体,用于特异性地结合目标蛋白,并通过其特异性结合能力来选择性地沉淀出目标蛋白。
IgG是人体内最常见的免疫球蛋白,属于抗体的一种。
IgG具有多种重要生物功能,包括与抗原特异性结合,介导免疫应答、中和病原体等。
在免疫共沉淀中,IgG可以通过与目标蛋白特异性结合来充当“捕获工具”,实现目标蛋白的富集和分离。
下面将从IgG的原理、应用和优化方面进行介绍。
IgG的原理:IgG分子由两条轻链和两条重链组成,其Fc(结晶片段)区域通过与Fc受体的结合来实现对抗原的识别和中和。
而在免疫共沉淀中,IgG通过其抗原结合的Fab区域表现出良好的特异性,选择性地与目标蛋白结合。
当与蛋白质复合物形成后,通过添加沉淀剂(如蛋白A/G琼脂糖)的作用,目标蛋白与IgG会以沉淀形式从混合液中分离出来。
IgG的应用:免疫共沉淀是研究蛋白质相互作用的重要技术,在很多领域得到了广泛的应用。
常见的应用包括但不限于:1. 研究蛋白质-蛋白质相互作用:通过使用两种特异性的IgG,分别对目标蛋白和亚单位结合,可以在混合系统中选择性地沉淀出目标蛋白结合的亚单位,从而研究它们之间的相互作用。
2. 蛋白质修饰研究:通过特异性的IgG结合目标蛋白,可以选择性地富集不同修饰状态的蛋白质,如磷酸化、乙酰化等,以便进一步研究其功能和调控机制。
3. 蛋白质-核酸相互作用研究:通过将IgG与对应的抗体结合,可以选择性地沉淀出特定的蛋白质-核酸复合物,用于研究其相互作用机制和功能调控。
IgG的优化:在免疫共沉淀实验中,提高IgG的特异性和亲和力对于提高实验结果的准确性至关重要。
以下是一些常见的IgG优化策略:1. 选择合适的IgG亚型:IgG有不同的亚型,如IgG1、IgG2、IgG3和IgG4,在特异性和亲和力上有所差异。

免疫共沉淀原理及步骤免疫沉淀(Immunoprecipitation, IP)原理IP是利用抗原蛋白质和抗体的特异性结合以及细菌蛋白质的“protein A/G"特异性地结合到抗体(免疫球蛋白)的FC片段的现象开发出来的方法。
目前多用protein A/G预先结合在argarose beads上,使之与含有抗原的溶液及抗体反应后,beads上的prorein A/G就能达到吸附抗原的目的。
通过低速离心,可以从含有目的抗原的溶液中将目的抗原与其它抗原分离。
免疫沉淀实验的操作步骤比较多,同时由于在非变性条件下进行实验,所以要得到一个完美的实验结果,不仅需要高质量的抗体,同时对免疫沉淀体系也需要有严格的控制指标。
免疫沉淀实验从:蛋白样品处理;抗体-agarose beads孵育;抗体-agarose beads复合物洗涤到最后的鉴定,每步都非常关键,需要严格控制实验流程中每个关键步骤的质量,才能最终达到你的实验目的。
IP实验步骤基本实验步骤(1)收获细胞,加入适量细胞IP裂解缓冲液(含蛋白酶抑制剂),冰上或者4℃裂解30min, 12,000g 离心30 min后取上清;(2) 取少量裂解液以备Western blot分析,剩余裂解液将1μg相应的抗体和10-50 μl protein A/G-beads加入到细胞裂解液,4°C缓慢摇晃孵育过夜;(3)免疫沉淀反应后,在4°C 以3,000 g速度离心5 min,将protein A/G-beads离心至管底;将上清小心吸去,protein A/G-beads用1ml裂解缓冲液洗3-4次;最后加入15μl的2×SDS 加样缓冲液,沸水煮10分钟;(4)SDS-PAGE, Western blotting或进行质谱分析。
一、样品处理:免疫沉淀实验成功与否,第一步处理样品非常关键。
免疫沉淀实验本质上是处于天然构象状态的抗原和抗体之间的反应,而样品处理的质量决定了抗原抗体反应中的抗原的质量,浓度以及抗原是否处于天然构象状态。

免疫共沉淀质谱免疫共沉淀质谱(immunoprecipitation-massspectrometry,简称IP-MS)是一种常用的蛋白质相互作用分析技术。
该技术结合了免疫沉淀和质谱分析,能够鉴定蛋白质相互作用和识别蛋白质复合物的成员,广泛应用于生命科学、疾病诊断和治疗等领域。
一、IP-MS 的基本原理IP-MS 技术的基本原理是利用特异性抗体将目标蛋白质从混合物中沉淀下来,然后用质谱分析鉴定沉淀物中的蛋白质。
该技术主要包括以下步骤:1. 样品制备:将需要分析的生物样品(如细胞、组织、血清等)进行处理,如细胞裂解、组织切片等,得到蛋白质混合物。
2. 免疫沉淀:将特异性抗体与目标蛋白质结合,形成抗原抗体复合物。
然后将混合物与抗原抗体复合物一起孵育,使复合物形成。
接着用亲和树脂或磁珠等材料将复合物捕获下来,得到免疫沉淀物。
3. 洗涤:用缓冲液对免疫沉淀物进行多次洗涤,去除非特异性结合的蛋白质和杂质。
4. 质谱分析:将免疫沉淀物用电泳或染色分析等方法进行分离,然后用质谱分析仪器对分离后的蛋白质进行鉴定和定量。
二、IP-MS 的应用1. 鉴定蛋白质相互作用:利用 IP-MS 技术可以鉴定蛋白质相互作用,例如鉴定蛋白质与核酸、蛋白质与蛋白质、蛋白质与小分子等的相互作用。
这些相互作用对于细胞信号转导、代谢途径、基因表达等生命过程起着重要作用。
2. 识别蛋白质复合物的成员:许多生物过程涉及到蛋白质复合物的形成,如核糖体、酶复合物等。
利用 IP-MS 技术可以识别蛋白质复合物的成员,进而揭示其功能和调控机制。
3. 疾病诊断和治疗:许多疾病的发生和发展都与蛋白质相互作用和复合物形成有关。
利用 IP-MS 技术可以鉴定疾病相关的蛋白质相互作用和复合物,从而为疾病的诊断和治疗提供新的思路和方法。
三、IP-MS 的优缺点IP-MS 技术具有以下优点:1. 特异性高:利用特异性抗体进行免疫沉淀,可以选择性地捕获目标蛋白质。


免疫共沉淀原理及步骤免疫沉淀(Immunoprecipitation, IP)原理IP是利用抗原蛋白质和抗体的特异性结合以及细菌蛋白质的“protein A/G"特异性地结合到抗体(免疫球蛋白)的FC片段的现象开发出来的方法。
目前多用protein A/G预先结合在argarose beads上,使之与含有抗原的溶液及抗体反应后,beads上的prorein A/G就能达到吸附抗原的目的。
通过低速离心,可以从含有目的抗原的溶液中将目的抗原与其它抗原分离。
免疫沉淀实验的操作步骤比较多,同时由于在非变性条件下进行实验,所以要得到一个完美的实验结果,不仅需要高质量的抗体,同时对免疫沉淀体系也需要有严格的控制指标。
免疫沉淀实验从:蛋白样品处理;抗体-agarose beads孵育;抗体-agarose beads复合物洗涤到最后的鉴定,每步都非常关键,需要严格控制实验流程中每个关键步骤的质量,才能最终达到你的实验目的。
IP实验步骤基本实验步骤(1)收获细胞,加入适量细胞IP裂解缓冲液(含蛋白酶抑制剂),冰上或者4℃裂解30min, 12,000g 离心30 min后取上清;(2) 取少量裂解液以备Western blot分析,剩余裂解液将1μg相应的抗体和10-50 μl protein A/G-beads加入到细胞裂解液,4°C缓慢摇晃孵育过夜;(3)免疫沉淀反应后,在4°C 以3,000 g速度离心5 min,将protein A/G-beads离心至管底;将上清小心吸去,protein A/G-beads用1ml裂解缓冲液洗3-4次;最后加入15μl的2×SDS 加样缓冲液,沸水煮10分钟;(4)SDS-PAGE, Western blotting或进行质谱分析。
一、样品处理:免疫沉淀实验成功与否,第一步处理样品非常关键。
免疫沉淀实验本质上是处于天然构象状态的抗原和抗体之间的反应,而样品处理的质量决定了抗原抗体反应中的抗原的质量,浓度以及抗原是否处于天然构象状态。

免疫沉淀(Immunoprecipitation, IP)原理IP是利用抗原蛋白质和抗体的特异性结合以及细菌蛋白质的“protein A/G"特异性地结合到抗体(免疫球蛋白)的FC片段的现象开发出来的方法。
目前多用protein A/G预先结合在argarose beads上,使之与含有抗原的溶液及抗体反应后,beads上的prorein A/G就能达到吸附抗原的目的。
通过低速离心,可以从含有目的抗原的溶液中将目的抗原与其它抗原分离。
免疫沉淀实验的操作步骤比较多,同时由于在非变性条件下进行实验,所以要得到一个完美的实验结果,不仅需要高质量的抗体,同时对免疫沉淀体系也需要有严格的控制指标。
免疫沉淀实验从:蛋白样品处理;抗体-agarose beads孵育;抗体-agarose beads复合物洗涤到最后的鉴定,每步都非常关键,需要严格控制实验流程中每个关键步骤的质量,才能最终达到你的实验目的。
IP实验步骤基本实验步骤(1)收获细胞,加入适量细胞IP裂解缓冲液(含蛋白酶抑制剂),冰上或者4℃裂解30min,12,000g离心30 min后取上清;(2) 取少量裂解液以备Western blot分析,剩余裂解液将1μg相应的抗体和10-50 μl protein A/G-beads加入到细胞裂解液,4°C缓慢摇晃孵育过夜;(3)免疫沉淀反应后,在4°C 以3,000 g速度离心5 min,将protein A/G-beads离心至管底;将上清小心吸去,protein A/G-beads用1ml裂解缓冲液洗3-4次;最后加入15μl 的2×SDS 加样缓冲液,沸水煮10分钟;(4)SDS-PAGE, Western blotting或进行质谱分析。
一、样品处理:免疫沉淀实验成功与否,第一步处理样品非常关键。
免疫沉淀实验本质上是处于天然构象状态的抗原和抗体之间的反应,而样品处理的质量决定了抗原抗体反应中的抗原的质量,浓度以及抗原是否处于天然构象状态。

实验入门之---免疫共沉淀(Co-IP)小编最近挺忙的,实验室各种事情要做,读研的都知道,就不多加唠叨了,研究做机制的,肯定会做到蛋白与蛋白之间的结合伴侣情况,转录激活功能等等,首先讲结合蛋白,就要涉及到免疫共测定实验。
好吧不多说了,上干货。
原理:免疫共沉淀(Co-Immunoprecipitation)是以抗体和抗原之间的专一性作用,为研究蛋白质相互作用的方法。
当细胞在非变性条件下被裂解时,完整细胞内存在的许多蛋白质-蛋白质间的相互作用被保留了下来。
如果用蛋白质X的抗体免疫沉淀X,那么与X在体内结合的蛋白质Y也能沉淀下来。
目前多用prorein A预先结合在argarose的beads上,使之与含有抗原的溶液及抗体反应后,beads上的prorein A就能吸附抗原达到精制的目的。
这种方法常用于测定两种目标蛋白质是否结合。
其优点为:(1)相互作用的蛋白质都是经翻译后修饰的,处于天然状态;(2)蛋白的相互作用是在自然状态下进行的,可以避免人为的影响;(3)可以分离得到天然状态的相互作用蛋白复合物。
缺点为:(1)可能检测不到低亲和力和瞬间的蛋白质-蛋白质相互作用;(2)两种蛋白质的结合可能不是直接结合,而可能有第三者在中间起桥梁作用;(3)必须在实验前预测目的蛋白是什么,以选择最后检测的抗体,所以,若预测不正确,实验就得不到结果,方法本身具有冒险性。
二、准备工作:1. 用预冷的PBS洗涤细胞两次,最后一次吸干PBS;2. 加入预冷的RIPA Buffer(1ml/107个细胞、10cm培养皿或150cm2培养瓶,0.5ml/5×106个细胞、6cm培养皿、75cm2培养瓶)3. 用预冷的细胞刮子将细胞从培养皿或培养瓶上刮下,把悬液转到1.5EP管中。
4. 4℃,12000g离心15-30min,立即将上清转移到新的离心管中。
5. 准备Protein A agarose,用PBS 洗3-4遍珠子,然后用PBS 配制成50%浓度。


ip蛋白免疫共沉淀
免疫共沉淀(Co-IP)是一种基于抗体和抗原之间的专一性作用,用于检测和确定生理条件下蛋白质之间相互作用的方法。
这种方法的基本原理是将蛋白质视为抗原,并利用抗体与之进行特异性结合的特性来进行研究。
当细胞在非变性条件下被裂解时,完整细胞内存在的许多蛋白质-蛋白质间的相互作用被保留了下来。
如果用预先固化在argarose beads上的蛋白质A的抗体免疫沉淀A蛋白,那么与A蛋白在体内结合的蛋白质B也能一起沉淀下来。
因此,免疫共沉淀技术可用于确定两种蛋白质在完整细胞内的相互作用。
然而,这种方法也有一些局限性,例如难以检测到弱或瞬时的相互作用,且多个相互作用蛋白质复合物的存在也可能引起非特异性相互作用。
请注意,这是一个涉及生物技术领域的复杂问题,需要更多详细的实验数据和具体的实验操作步骤来进行深入研究。
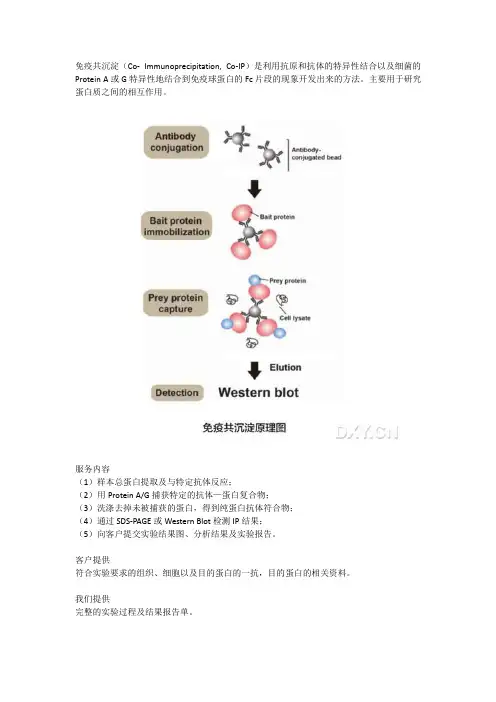
免疫共沉淀(Co- Immunoprecipitation, Co-IP)是利用抗原和抗体的特异性结合以及细菌的Protein A或G特异性地结合到免疫球蛋白的Fc片段的现象开发出来的方法。
主要用于研究蛋白质之间的相互作用。
服务内容
(1)样本总蛋白提取及与特定抗体反应;
(2)用Protein A/G捕获特定的抗体—蛋白复合物;
(3)洗涤去掉未被捕获的蛋白,得到纯蛋白抗体符合物;
(4)通过SDS-PAGE或Western Blot检测IP结果;
(5)向客户提交实验结果图、分析结果及实验报告。
客户提供
符合实验要求的组织、细胞以及目的蛋白的一抗,目的蛋白的相关资料。
我们提供
完整的实验过程及结果报告单。

免疫共沉淀实验原理及方法免疫共沉淀实验(immunoprecipitation)是一种常用的分子生物学实验方法,用于检测免疫反应的可视化。
该实验基于免疫学反应的原理,通过特异性抗体与目标分子结合,将目标分子从复杂的混合物中沉淀出来,以便进一步分析。
免疫共沉淀实验的原理是基于抗体与抗原之间的特异性结合。
首先,需要选择与目标分子特异性结合的抗体,并对抗体进行纯化和标记,常用的标记物有酶、放射性同位素、荧光素等。
然后,将标记的抗体与样品中的目标分子充分混合,在适当的条件下,使抗体与目标分子发生结合反应。
接下来,通过添加沉淀剂,例如蛋白A/G磁珠、蛋白G琼脂糖或亲和素等,将抗体/目标复合物与其他组分一起沉淀下来。
通过离心将沉淀物分离出来,然后用缓冲液洗涤,以去除非特异性结合的物质。
最后,将洗涤后的沉淀物进行破碎、蛋白质酶解等处理,并使用电泳、免疫印迹、质谱等技术对目标分子进行分析和鉴定。
在免疫共沉淀实验中,关键步骤包括抗体的选择和标记、样品的制备与处理、抗体与目标分子的结合、沉淀物的分离与洗涤以及沉淀物的分析和鉴定。
1.抗体的选择和标记:选择特异性结合目标分子的抗体,并对抗体进行纯化和标记。
例如,使用蛋白A/G或蛋白G将抗体结合于磁珠或琼脂糖上,再通过标记物的共价偶联(如酶、放射性同位素、荧光素等)对抗体进行标记。
2.样品的制备与处理:根据实验要求,选择适当的样品组织或细胞,将其裂解并得到包含目标分子的混合物。
裂解缓冲液的组成需要根据目标分子的特性进行优化,以保持目标分子的稳定性和活性。
可以加入适量的蛋白酶抑制剂、磷酸酯酶抑制剂和甲基化酶抑制剂等保护目标分子。
3.抗体与目标分子的结合:将标记的抗体加入到样品中,与目标分子发生特异性结合反应。
可以在低温(4℃)下进行反应,以减少非特异性结合。
4.沉淀物的分离和洗涤:通过添加适当的沉淀剂,将抗体/目标复合物与其他组分一起沉淀下来。
常用的沉淀剂有通过蛋白A/G磁珠、蛋白G琼脂糖或亲和素等。
免疫沉淀(Immunoprecipitation, IP)原理IP是利用抗原蛋白质和抗体的特异性结合以及细菌蛋白质的“protein A/G"特异性地结合到抗体(免疫球蛋白)的FC片段的现象开发出来的方法。
目前多用protein A/G预先结合在argarose beads上,使之与含有抗原的溶液及抗体反应后,beads上的prorein A/G就能达到吸附抗原的目的。
通过低速离心,可以从含有目的抗原的溶液中将目的抗原与其它抗原分离。
免疫沉淀实验的操作步骤比较多,同时由于在非变性条件下进行实验,所以要得到一个完美的实验结果,不仅需要高质量的抗体,同时对免疫沉淀体系也需要有严格的控制指标。
免疫沉淀实验从:蛋白样品处理;抗体-agarose beads孵育;抗体-agarose beads复基本实验步骤(1)收获细胞,加入适量细胞IP裂解缓冲液(含蛋白酶抑制剂),冰上或者4℃裂解30min, 12,000g离心30 min后取上清;(2) 取少量裂解液以备Western blot分析,剩余裂解液将1μg相应的抗体和10-50 μl protein A/G-beads加入到细胞裂解液,4°C缓慢摇晃孵育过夜;(3)免疫沉淀反应后,在4°C 以3,000 g速度离心5 min,将protein A/G-beads离心至管底;将上清小心吸去,protein A/G-beads用1ml裂解缓冲液洗3-4次;最后加入15μl的2×SDS 加样缓冲液,沸水煮10分钟;(4)SDS-PAGE, Western blotting或进行质谱分析。
一、样品处理:免疫沉淀实验成功与否,第一步处理样品非常关键。
免疫沉淀实验本质上是处于天然构象状态的抗原和抗体之间的反应,而样品处理的质量决定了抗原抗体反应中的抗原的质量,浓度以及抗原是否处于天然构象状态。
所以制备高质量的样品以用于后续的抗体-agarose beads孵育对免疫沉淀实验是否成功非常关键。
免疫沉淀(Immunoprecipitation )实验操作方法实验原理:免疫沉淀(Immunoprecipitation,IP )是利用抗原和抗体的特异性结合以及细菌蛋白质如 proteinA/G 特异性地结合到免疫球蛋白(抗体)FC 片段的现象而开发出来的特异分离富集 抗原的方法。
目前多用预先结合固化在Agarosebeads 上的proteinA/G (Agrose-proteinA/G ), 使之与抗体结合,再通过抗体特异性结合抗原而形成Agrose-proteinA/G 、抗体、抗原复合物,利用Agarosebeads 的重量,通过离心即可特异分离富集目的抗原。
实验步骤:1 .处理细胞:依据实验目的,设计实验,处理好细胞模型。
一般3X106细胞/处理(即六孔板一个孔,约200ug 总蛋白)。
2 .配IP 裂解液:200ul/孔(6孔板),并加入蛋白酶抑制剂,如果蛋白磷酸化水平影响实验结果则应加入磷酸酶抑制剂。
注意抑制剂的要现加现用。
3 .收集细胞:冰上操作,裂解细胞前用1XPBS (4度)洗1遍,每孔加入200ulIP 裂解液,冰上静置5分钟后刮下细胞并收集至EP 管中。
4 .超声:强度37%,5秒X4次(程序07)。
目的是使细胞裂解更完全并打断基因组DNA,但可能会影响蛋白质之间的相互作用,进行共免疫沉淀实验时要注意这一点。
5 .离心细胞裂解液:4度10000rpm10分钟。
6 .Agrose-proteinA/G 清洗:一般1ug 抗体对应15ulAgrose-proteinA/G (不同公司产品可能CopyrightMolecularStationCtntrfuQjbmM 翱higniTrtComplt 由事,,低.而4***不同,注意结合说明书及实验结果考虑),预清洗细胞裂解液的Agrose-proteinA/G 用量与结合抗体的用量一致。
取相应量的Agrose-proteinA/G 到EP 管中(剪枪头)并用500ul1xPBS (4度)洗两遍,5000rpmx2分钟,吸掉上清备用。
免疫共沉淀交联
免疫共沉淀和交联是免疫学实验中常用的两种技术手段,用于分析蛋白质相互作用、蛋白质定位以及复杂蛋白质结构的研究。
以下是它们的简要解释:
1. 免疫共沉淀(Immunoprecipitation,IP):免疫共沉淀是一种用于检测蛋白质相互作用的实验技术。
该技术利用抗体对目标蛋白的特异性结合来将其与其结合的蛋白质共沉淀下来。
通常,实验中会将目标蛋白的抗体与待测样品混合,使抗体与目标蛋白结合形成免疫复合物,然后通过加入适当的沉淀剂,如蛋白A/G琼脂糖或磁珠,将免疫复合物沉淀下来,最后通过洗涤和离心等步骤将非特异性结合的蛋白质去除,得到纯化的免疫沉淀物。
2. 交联(Cross-linking):交联是一种用于稳定蛋白质复合物结构的方法。
在免疫学实验中,交联通常是通过化学交联剂,如二甲亚砜(DMS)或戊二醛(Glutaraldehyde)等,将蛋白质复合物中的不同分子交联在一起。
这种方法可以在细胞或组织中固定蛋白质相互作用,以便后续的分析,如免疫印迹(Western Blotting)或质谱分析。
交联还可用于稳定蛋白质的结构,以便进行晶体学研究或结构分析。
综上所述,免疫共沉淀和交联是免疫学实验中常用的两种技术手段,它们分别用于检测蛋白质相互作用和稳定蛋白质复合物的结构,为研究蛋白质功能和相互作用提供了重要的实验手段。
1 / 1。
免疫沉淀(Immunoprecipitation)实验操作方法免疫沉淀(Immunoprecipitation)实验操作方法实验原理:免疫沉淀(Immunoprecipitation,IP)是利用抗原和抗体的特异性结合以及细菌蛋白质如protein A/G特异性地结合到免疫球蛋白(抗体)FC片段的现象而开发出来的特异分离富集抗原的方法。
目前多用预先结合固化在Agarose beads上的protein A/G(Agrose-proteinA/G),使之与抗体结合,再通过抗体特异性结合抗原而形成Agrose-proteinA/G 、抗体、抗原复合物,利用Agarose beads的重量,通过离心即可特异分离富集目的抗原。
实验步骤:1.处理细胞:依据实验目的,设计实验,处理好细胞模型。
一般3×106细胞/处理(即六孔板一个孔,约200ug总蛋白)。
2.配IP 裂解液:200ul/孔(6孔板),并加入蛋白酶抑制剂,如果蛋白磷酸化水平影响实验结果则应加入磷酸酶抑制剂。
注意抑制剂的要现加现用。
3.收集细胞:冰上操作,裂解细胞前用1×PBS(4度)洗1遍,每孔加入200ul IP裂解液,冰上静置5分钟后刮下细胞并收集至EP管中。
4.超声:强度37%,5秒×4次(程序07)。
目的是使细胞裂解更完全并打断基因组DNA,但可能会影响蛋白质之间的相互作用,进行共免疫沉淀实验时要注意这一点。
5.离心细胞裂解液:4度10000rpm 10 分钟。
6.Agrose-proteinA/G清洗:一般1ug抗体对应15ul Agrose-proteinA/G(不同公司产品可能不同,注意结合说明书及实验结果考虑),预清洗细胞裂解液的Agrose-proteinA/G用量与结合抗体的用量一致。
取相应量的Agrose-proteinA/G到EP管中(剪枪头)并用500ul1×PBS(4度)洗两遍,5000rpm×2分钟,吸掉上清备用。
免疫沉淀(Immunoprecipitation, IP)原理IP是利用抗原蛋白质和抗体的特异性结合以及细菌蛋白质的“protein A/G"特异性地结合到抗体(免疫球蛋白)的FC片段的现象开发出来的方法。
目前多用protein A/G预先结合在argarose beads上,使之与含有抗原的溶液及抗体反应后,beads上的prorein A/G就能达到吸附抗原的目的。
通过低速离心,可以从含有目的抗原的溶液中将目的抗原与其它抗原分离。
免疫沉淀实验的操作步骤比较多,同时由于在非变性条件下进行实验,所以要得到一个完美的实验结果,不仅需要高质量的抗体,同时对免疫沉淀体系也需要有严格的控制指标。
免疫沉淀实验从:蛋白样品处理;抗体-agarose beads孵育;抗体-agarose beads复基本实验步骤(1)收获细胞,加入适量细胞IP裂解缓冲液(含蛋白酶抑制剂),冰上或者4℃裂解30min, 12,000g离心30 min后取上清;(2) 取少量裂解液以备Western blot分析,剩余裂解液将1μg相应的抗体和10-50 μl protein A/G-beads加入到细胞裂解液,4°C缓慢摇晃孵育过夜;(3)免疫沉淀反应后,在4°C 以3,000 g速度离心5 min,将protein A/G-beads离心至管底;将上清小心吸去,protein A/G-beads用1ml裂解缓冲液洗3-4次;最后加入15μl的2×SDS 加样缓冲液,沸水煮10分钟;(4)SDS-PAGE, Western blotting或进行质谱分析。
一、样品处理:免疫沉淀实验成功与否,第一步处理样品非常关键。
免疫沉淀实验本质上是处于天然构象状态的抗原和抗体之间的反应,而样品处理的质量决定了抗原抗体反应中的抗原的质量,浓度以及抗原是否处于天然构象状态。
所以制备高质量的样品以用于后续的抗体-agarose beads孵育对免疫沉淀实验是否成功非常关键。