工业甲酸钠标准
- 格式:doc
- 大小:96.00 KB
- 文档页数:6

苯甲酸钠添加量的标准
苯甲酸钠的添加量标准取决于具体的应用场景和需求,并且可能
因国家或地区的法规和标准而有所不同。
一般来说,苯甲酸钠的添加
量应该根据具体的生产工艺和所需效果来确定,并且需要根据相关的
法规和标准来控制。
在食品行业中,苯甲酸钠被用作抑制微生物生长和延长食品的保
质期。
根据国际食品添加剂协会(IFAC)的食品添加剂使用标准,苯
甲酸钠的最大添加量为2.5克/千克(ppm)。
在化妆品和个人护理产品中,苯甲酸钠被用作防腐剂。
根据欧盟
化妆品法规(EC No 1223/2009),苯甲酸钠的最大允许添加量为0.5%。
在医药行业中,苯甲酸钠作为抗菌剂和防腐剂使用。
具体的添加
量需要根据药物的性质和用途来确定,并且需要符合相关的药典标准。
总之,苯甲酸钠的添加量标准需要根据具体的应用领域和相关法
规进行确定,建议在生产和使用过程中遵循相关的法规和标准,确保
安全合规。

GB21904-2008化学合成类制药⼯业⽔污染物排放标准序号污染物项⽬分析⽅法标准名称⽅法标准编号10急性毒性⽔质急性毒性的测定发光细菌法GB/T15441—199511总汞⽔质总汞的测定冷原⼦吸收分光光度法GB7468—8712总镉⽔质铜、锌、铅、镉的测定原⼦吸收分光光度法GB7475—8713烷基汞⽔质烷基汞的测定⽓相⾊谱法GB14204—9314六价铬⽔质六价铬的测定⼆苯碳酰⼆肼分光光度法GB7467—8715总砷⽔质总砷的测定⼆⼄基⼆硫代氨基甲酸银分光光度法GB7485—8716总铅⽔质铜、锌、铅、镉的测定原⼦吸收分光光度法GB7475—87⽔质镍的测定丁⼆酮肟分光光度法GB11910—8917总镍⽔质镍的测定⽕焰原⼦吸收分光光度法GB11912—89⽔质铜、锌、铅、镉的测定原⼦吸收分光光度法GB7475—8718总铜⽔质铜的测定⼆⼄基⼆硫代氨基甲酸钠分光光度法GB7474—87⽔质锌的测定双硫腙分光光度法GB7472—8719总锌⽔质铜、锌、铅、镉的测定原⼦吸收分光光度法GB7475—8720总氰化物⽔质氰化物的测定第⼀部分总氰化物的测定GB7486—8721挥发酚⽔质挥发酚的测定蒸馏后4-氨基安替⽐林分光光度法GB7490—87⽔质硫化物的测定亚甲基蓝分光光度法GB/T16489—199622硫化物⽔质硫化物的测定直接显⾊分光光度法GB/T17133—1997⽔质硝基苯、硝基甲苯、硝基氯苯、⼆硝基甲苯的测定⽓23硝基苯类GB13194—91相⾊谱法⽔质苯胺类化合物的测定N-(1-萘基)⼄⼆胺偶氮分光光24苯胺类GB11889—89度法25⼆氯甲烷⽔质挥发性卤代烃的测定顶空⽓相⾊谱法GB/T17130—19976实施与监督6.1本标准由县级以上⼈民政府环境保护主管部门负责监督实施。
6.2在任何情况下,企业均应遵守本标准规定的⽔污染物排放控制要求,采取必要措施保证污染防治设施正常运⾏。

4.3外观的测定在自然光或荧光灯光照下,将5g~10g试样放在洁白纸上,目视确定外观。
4.4 水分及挥发分的测定4.4.1 原理试样在103℃±2℃烘箱中干燥,用称量法测定其失重。
4.4.2 仪器称量瓶:40mm±2mm,高25mm±2mm。
4.4.3 测定步骤用已恒重的称量瓶,称取 1.8g~2.2g试样(称准至0.0002g),置于烘箱中,于103±2℃烘3h后取出,盖好称量瓶盖,在干燥器中冷却至室温,称量。
4.4.4计算水分及挥发分百分含量按式(1)计算:m1-m2X= ―――――×100 (1)m式中:X—水分及挥发分百分含量;m1—称物瓶加试样质量;m2—干燥后称物瓶加试样质量,g;m—试样质量,g。
允许误差:平行测定两个结果的差值不得大于0.2%,取两结果的算术平均值为测定结果。
4.5有机杂质含量的测定4.5.1原理:干燥试样在800℃高温下的灼烧失重,与在此温度下甲酸钠转化成碳酸钠的理论失重之差。
4.5.2仪器:铂坩埚或银坩埚,25ml ~30ml 。
4.5.3测定步骤在已恒重的铂坩埚或银坩埚中,称取经测定水分及挥发分后并研细均匀的试样0.25±0.02g(称准至0.0002g),于电炉上缓慢加热,直到试样全部碳化后,置于坩埚架上移入800±25℃高温炉中灼烧至无黑色(约30min 左右),取出坩埚,在空气中冷却1min,移入干燥器中冷却至室温,称重.4.5.4计算有机杂质百分含量按(2)计算:m 1-m 2X= ×100-0.2206×X 3M式中:X —有机杂质百分含量;m 1—坩埚加试样质量,g;m 2—灼烧后坩埚加试样质量,g;m —试样质量,g;0.2206—甲酸钠灼烧为碳酸钠理论失重的系数;X —甲酸钠的百分含量.允许误差:平行测定两个结果的差值不得大于0.2%,取两结果的算术平均值为测定结果。

工业甲酸钠(sodium formate)1、范围本标准规定了工业甲酸钠的技术要求、采样、试验方法、检验规则及标志、包装、运输和储存。
本标准适用于合成法制得的甲酸钠产品的质量检验,该产品主要用于生产甲酸、草酸、保险粉和制备还原剂、消毒剂等。
分子式:HCOONa分子量:68.01(按2001年国际相对原子质量)2、规范性引用文件下列文件中的条款通过本标准的引用而成为本标准的条款。
凡是注日期引用文件,其随后所有的修改单(不包括勘误的内容)或修订版均不适用于本标准,然而,鼓励根据本标准达成协议的各方研究是否使用这些文件的最新版本。
凡是不注日期的引用文件,其最新版本适用于本标准。
GB/T6678—2003 化工产品采样总则GB/T4348.2-2002 工业用氢氧化钠中氯化钠含量的测定GB/T 601-2002 化学试剂标准滴定溶液的制备GB/T 603-2002 化学试剂试验方法中所用制剂及制品的制备GB/T 1250-1989 极限数值的表示方法和判定方法GB/T 6682-1992 分析实验室用水规格和试验方法3、技术要求甲酸钠质量应符合表1中要求:表1 甲酸钠的质量要求除非另有规定,仅使用确认为分析纯的试剂和GB/T6682-1992中规定的三级水。
试验中所用标准滴定溶液、制剂及制品,在没有注明其他要求时,均按GB/T601-2002、GB/T603-2002规定制备。
检验结果的判定按GB/T1250-1989中5.2修约值比较法进行。
4.1 外观的评定:采用目视评定。
4.2 溶液A制备:称取样品约1.5g(精确至0.0002g),用无CO2水溶解并迅速转移至250mL容量瓶中,加无CO2水定容得溶液A 。
4.3甲酸钠含量测定4.3.1 原理由于甲酸钠的Kb=5.6*10-11,这样的弱碱显然不能用标准酸滴定,采用在碱性下甲酸钠与高锰酸钾充分反应并生成二氧化锰沉淀,沉淀在酸性中用草酸溶解,最后用高锰酸钾滴定过量的草酸,即可求得甲酸钠含量。


甲酸钠分析方法(总3页) -CAL-FENGHAI.-(YICAI)-Company One1-CAL-本页仅作为文档封面,使用请直接删除4.3 外观的测定在自然光或荧光灯光照下,将5g~10g试样放在洁白纸上,目视确定外观。
4.4 水分及挥发分的测定4.4.1 原理试样在103℃±2℃烘箱中干燥,用称量法测定其失重。
4.4.2 仪器称量瓶:40mm±2mm,高25mm±2mm。
4.4.3 测定步骤用已恒重的称量瓶,称取1.8g~2.2g试样(称准至0.0002g),置于烘箱中,于103±2℃烘3h后取出,盖好称量瓶盖,在干燥器中冷却至室温,称量。
4.4.4计算水分及挥发分百分含量按式(1)计算:m1-m2X= ―――――×100 (1)m式中:X—水分及挥发分百分含量;m1—称物瓶加试样质量;m2—干燥后称物瓶加试样质量,g;m—试样质量,g。
允许误差:平行测定两个结果的差值不得大于0.2%,取两结果的算术平均值为测定结果。
4.5有机杂质含量的测定4.5.1原理:干燥试样在800℃高温下的灼烧失重,与在此温度下甲酸钠转化成碳酸钠的理论失重之差。
4.5.2仪器:铂坩埚或银坩埚,25ml~30ml。
4.5.3测定步骤在已恒重的铂坩埚或银坩埚中,称取经测定水分及挥发分后并研细均匀的试样0.25±0.02g(称准至0.0002g),于电炉上缓慢加热,直到试样全部碳化后,置于坩埚架上移入800±25℃高温炉中灼烧至无黑色(约30min左右),取出坩埚,在空气中冷却1min,移入干燥器中冷却至室温,称重.4.5.4计算有机杂质百分含量按(2)计算:m1-m2X= ×100-0.2206×X3M式中:X—有机杂质百分含量;m1—坩埚加试样质量,g;m2—灼烧后坩埚加试样质量,g;m—试样质量,g;0.2206—甲酸钠灼烧为碳酸钠理论失重的系数;X—甲酸钠的百分含量.允许误差:平行测定两个结果的差值不得大于0.2%,取两结果的算术平均值为测定结果。

工业苯甲酸辛酯标准
工业苯甲酸辛酯是一种常见的有机化合物,广泛应用于塑料、涂料、油墨、香料、医药等领域。
为了确保其质量符合安全和环保要求,许多国家和地区都制定了相应的工业苯甲酸辛酯标准。
以下是一些国家和地区的工业苯甲酸辛酯标准:
1. 欧盟标准:欧盟REACH法规对工业苯甲酸辛酯进行了注册、评估、授权和限制,其中包括其质量标准。
根据REACH法规,工业苯甲酸辛酯的纯度应大于99%,并且不能含有有害的杂质。
2. 美国标准:美国环保局(EPA)对工业苯甲酸辛酯进行了限制和禁止使用,其中包括其质量标准。
根据EPA标准,工业苯甲酸辛酯的纯度应大于99%,并且不能含有有害的杂质。
3. 中国标准:中国国家标准(GB/T)对工业苯甲酸辛酯进行了规定,其中包括其质量标准。
根据GB/T标准,工业苯甲酸辛酯的纯度应大于99%,并且不能含有有害的杂质。
需要注意的是,不同国家和地区的工业苯甲酸辛酯标准可能存在差异,具体标准应根据当地法律法规和实际情况进行确认。
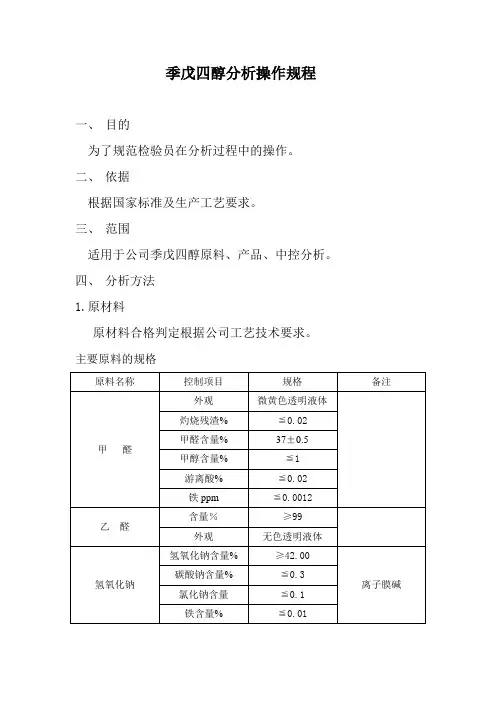
季戊四醇分析操作规程一、目的为了规范检验员在分析过程中的操作。
二、依据根据国家标准及生产工艺要求。
三、范围适用于公司季戊四醇原料、产品、中控分析。
四、分析方法1.原材料原材料合格判定根据公司工艺技术要求。
主要原料的规格1.1甲酸1.1.1含量测定:用减量法称取均匀试样0.8~1.0g(准确至0.0002g)放入预先已装有约80(20)ml无CO2的蒸馏水的250ml三角烧瓶中,加2滴酚酞(10g/l)指示剂,用0.5mol/L NaOH标准溶液滴定至淡粉色为终点。
按下式计算:X (%)=(C×V×0.04603)/m ×100 平行测定二次结果不大于0.2%,取算术平均值。
1.2.液碱1.2.1 NaOH含量的测定:原理:试样先加入氯化钡,将碳酸钠转为碳酸钡沉淀,以酚酞,用盐酸滴定.步骤:称取均匀试样1~1.5g(准至0.0001g)于预先注有约80ml 无CO2蒸馏水的250ml三角瓶中,加入20(10)ml(10%)氯化钡溶液(要处理)和2~3滴1%酚酞指示剂。
摇匀用1mol/L盐酸标准溶液滴定至溶液红色刚好褪去为终点。
按下式计算:X1(%)=N×V×4/m1.2.2 碳酸钠含量的测定:原理:试样用溴甲酚绿-甲基红混合指示剂,用盐酸滴定,再减去NaOH含量同氢氧化钠含量测定相同,用2~3滴0.1%甲基橙(溴甲酚绿-甲基红混合指示剂)为指示剂,滴至呈橙色为终点。
按下式计算:X2=C×(V1-V)×5.299/m式中:V——测NaOH含量时盐酸标准溶液之用量可称50克样定容1L再取50ml.1.2.3 氯化钠测定:试样50ML加硝酸10+50硝酸银,用铁铵钒(硫酸铁铵)指示剂.硫氰酸钾标准溶液滴至浅棕红色. 按下式计算:X=C×V×5.85/m1.3工业甲醛溶液1.3.1外观的测定:目测。
清晰无悬浮物物液体,低温时允许有白色混浊。
![[实用参考]工业甲酸钠标准](https://uimg.taocdn.com/23e46368312b3169a451a46f.webp)
工业甲酸钠(sodiumformate)1、范围本标准规定了工业甲酸钠的技术要求、采样、试验方法、检验规则及标志、包装、运输和储存。
本标准适用于合成法制得的甲酸钠产品的质量检验,该产品主要用于生产甲酸、草酸、保险粉和制备还原剂、消毒剂等。
分子式:HCOONa分子量:68.01(按20RR年国际相对原子质量)2、规范性引用文件下列文件中的条款通过本标准的引用而成为本标准的条款。
凡是注日期引用文件,其随后所有的修改单(不包括勘误的内容)或修订版均不适用于本标准,然而,鼓励根据本标准达成协议的各方研究是否使用这些文件的最新版本。
凡是不注日期的引用文件,其最新版本适用于本标准。
GB/T6678—20RR化工产品采样总则GB/T4348.2-20RR工业用氢氧化钠中氯化钠含量的测定GB/T601-20RR化学试剂标准滴定溶液的制备GB/T603-20RR化学试剂试验方法中所用制剂及制品的制备GB/T1250-1989极限数值的表示方法和判定方法GB/T6682-1992分析实验室用水规格和试验方法3、技术要求甲酸钠质量应符合表1中要求:除非另有规定,仅使用确认为分析纯的试剂和GB/T6682-1992中规定的三级水。
试验中所用标准滴定溶液、制剂及制品,在没有注明其他要求时,均按GB/T601-20RR、GB/T603-20RR规定制备。
检验结果的判定按GB/T1250-1989中5.2修约值比较法进行。
4.1外观的评定:采用目视评定。
4.2溶液A制备:称取样品约1.5g(精确至0.0002g),用无CO2水溶解并迅速转移至250mL容量瓶中,加无CO2水定容得溶液A。
4.3甲酸钠含量测定4.3.1原理由于甲酸钠的Kb=5.6R10-11,这样的弱碱显然不能用标准酸滴定,采用在碱性下甲酸钠与高锰酸钾充分反应并生成二氧化锰沉淀,沉淀在酸性中用草酸溶解,最后用高锰酸钾滴定过量的草酸,即可求得甲酸钠含量。
其化学反应如下:2KMnO4+3HCOONa+NaOH==2Na2CO3+K2CO3+2MnO2↓+2H2OMnO2+H2C2O4+H2SO4==MnSO4+2CO2↑+2H2O2KMnO4+5H2C2O4+3H2SO4==2MnSO4+K2SO4+10CO2↑+8H2O4.3.2试剂和溶液4.3.2.1高锰酸钾标准滴定溶液:C (1/5KMnO4)=0.1000mol/L ;4.3.2.2草酸标准滴定溶液:C (1/2H2C2O4)=0.1000mol/L ;4.3.2.3硫酸溶液:10%;量取55mL 浓硫酸缓慢加入适量水中,边加边搅拌,冷却后稀释至1000mL 。

甲酸钠的历史、用途和产品标准一、中国的甲酸钠、甲酸和草酸的技术源头1957年,许多科研单位和大学需要草酸试剂。
天津试剂四厂决定试制草酸,但是对草酸的生产原理和工艺设备一窍不通。
问题和愿望通过天津市化工局逐级上报,不久,化工部请来了罗马尼亚专家。
罗马尼亚专家,一个高高大大的胖子。
他到试剂四厂讲授技术原理,还带来了一套工艺流程图,没有设备图纸。
通过罗马尼亚专家的讲解,大家才明白,制造草酸首先要生产草酸的原料——甲酸钠,生产原理是煤气与苛化碱在高压卧式合成釜合成甲酸钠。
罗马尼亚的草酸工艺流程图交给天津有机合成厂工程技术人员观看讨论临摹(硫酸纸描图)后转交天津化工局设计处(现天津化工设计院),由该处进行化工设备设计。
在等待设计制造设备的期间,张树礼仔细研读翻译过来的技术文件及图纸,在序言部分,他读到“也可以使用塔式反应器合成甲酸钠……”,受到启发,张树礼和几位年青的工友决定使用钢管制造管式反应器,开始用煤气及岢化得来的烧碱试制甲酸钠。
采用小型煤气发生炉产生的煤气经过压缩机输入合成管道,当时试验的合成管道采用直径4英寸,高6米的管道制成,车间高度不够,就把管道竖在正中间,探伸到车间顶棚上面的天窗上。
由于对合成压力和管道的质量没有把握,大家担心爆炸,用装满沙土的麻袋包围着合成管道垒了一米多高的防护墙,像座碉堡。
合成管道内填充细碎的焦碳,来增加煤气与烧碱溶液的接触反应面积。
煤气从管道的底部压入,烧碱溶液从管道上端淋下,进行逆流合成反应。
合成压力4公斤,预热温度100度、102度、103度。
当时的工艺难度是确定多长的合成管道能够使合成反应温度提上来。
那时安装一个温度计都很困难,没有热电偶,只有玻璃管温度计。
最初的试验异常艰难。
二、采用罗马尼亚技术工艺试制草酸1958年,国家决定试剂四厂重新选址建设新厂,引进罗马尼亚甲酸钠、甲酸、草酸的生产工艺技术,最终能够生产甲酸钠、甲酸、草酸等。
为了组织新厂建设,天津市化工局任命了建厂委员会成员,陈健任主任,张树礼任副主任。

遇到污染防治问题? 赢了网律师为你免费解惑! 访问>>化学合成类制药工业水污染物排放标准( 最新版)前言为贯彻《中华人民共和国环境保护法》、《中华人民共和国水污染防治法》、《中华人民共和国海洋环境保护法》、《国务院关于落实科学发展观加强环境保护的决定》等法律法规和《国务院关于编制全国主体功能区规划的意见》, 保护环境, 防治污染, 促进制药工业生产工艺和污染治理技术的进步, 制定本标准。
本标准根据化学合成类制药工业生产工艺及污染治理技术的特点, 规定了化学合成类制药工业水污染物的排放限值、监测和监控要求, 适用于化学合成类制药生产企业水污染的防治和管理。
为促进区域经济与环境协调发展, 推动经济结构的调整和经济增长方式的转变, 引导化学合成类制药工业生产工艺和污染治理技术的发展方向, 本标准规定了水污染物特别排放限值。
化学合成类制药工业企业排放大气污染物(含恶臭污染物)、环境噪声适用相应的国家污染物排放标准, 产生固体废物的鉴别、处理和处理适用国家固体废物污染控制标准。
自本标准实施之日起, 化学合成类制药工业企业的水污染物排放控制按本标准的规定执行, 不再执行《污水综合排放标准》(GB 8978-1996)中的相关规定。
本标准为首次发布。
本标准由环境保护部科技标准司组织制订。
本标准起草单位: 哈尔滨工业大学、河北省环境科学研究院、环境保护部环境标准研究所。
本标准环境保护部年4 月29 日批准。
本标准自年8 月1 日起实施。
本标准由环境保护部解释。
化学合成类制药工业水污染物排放标准1 适用范围本标准规定了化学合成类制药工业水污染物的排放限值、监测和监控要求以及标准的实施与监督等相关规定。
本标准适用于化学合成类制药工业企业的水污染防治和管理, 以及化学合成类制药工业建设项目环境影响评价、环境保护设施设计、竣工环境保护验收及其投产后的水污染防治和管理。
本标准也适用于专供药物生产的医药中间体工厂(如精细化工厂)。
危险化学品产品生产许可证实施细则(无机产品(Ⅱ类)部分)1 总则1.1为了做好危险化学品无机产品(Ⅱ类)生产许可证发证工作,依据《危险化学品安全管理条例》(国务院令第344号)、《中华人民共和国工业产品生产许可证管理条例》(国务院令第440号)、《中华人民共和国工业产品生产许可证管理条例实施办法》(国家质检总局令第80号)、《国家质量监督检验检疫总局关于修改〈中华人民共和国工业产品生产许可证管理条例实施办法〉的决定》(国家质检总局令第130号)、《关于摩托车头盔等11类产品生产许可由省级质量技术监督部门负责审批发证的公告》(国家质检总局2010年第89号公告)、《关于印发<工业产品生产许可省级发证工作规范>的通知》(国质检监[2006]413号) 等规定,制定本实施细则。
1.2 本实施细则规定的危险化学品无机产品(Ⅱ类)划分为5个产品单元、20个产品品种(见表1)。
1.3 在中华人民共和国境内生产本实施细则规定的危险化学品无机产品(Ⅱ类)的,应当依法取得生产许可证。
任何企业未取得生产许可证不得生产本实施细则规定的危险化学品无机产品(Ⅱ类)。
1.4 本实施细则在实施过程中,相关产品的国家标准、行业标准和国家产业政策一经修订,企业应当及时执行。
本实施细则将根据国家标准、行业标准的变化和国家产业政策的调整实施动态修订。
1.5本实施细则中有关要求,国务院工业产品生产许可证主管部门认为需要听证的涉及公共利益的重大许可事项,将向社会公告,并举行听证。
5 审查要求5.1企业生产危险化学品无机产品(Ⅱ类)应执行的产品标准及相关标准(见表2)核查和产品检验应当按照新产品标准要求进行。
5.2 企业生产危险化学品无机产品(Ⅱ类)必备的生产设备和检测设备(见表3)设计文件规定的生产工艺设备进行。
2. 企业配备的生产设备和检测设备,可与上述设备名称不同,但应满足上述设备的功能要求。
3. 标△为型式检验项目所用检测设备,不做必备要求,可以委托具有资质的第三方检验机构进行检验,委托检验应符合附件2《危险化学品无机产品(Ⅱ类)生产许可证企业实地核查办法》中第6.4条的规定。
《二甲基二硫代氨基甲酸钠企业标准》1. 前言在化工行业中,二甲基二硫代氨基甲酸钠是一种重要的化工原料,被广泛应用于染料、医药和农药等领域。
由于其在生产过程中可能涉及到一些安全隐患和环境保护问题,因此制定企业标准显得尤为重要。
本文将从深度和广度的角度对二甲基二硫代氨基甲酸钠企业标准进行全面评估,并探讨其在化工生产中的重要性。
2. 二甲基二硫代氨基甲酸钠的基本性质与用途2.1 二甲基二硫代氨基甲酸钠的化学结构和性质二甲基二硫代氨基甲酸钠分子式为(NaO3S2CH3)2,是一种白色固体,易溶于水,在酸性条件下稳定,但在碱性条件下易分解。
其具有羧酸的性质,可与金属离子形成配合物,广泛应用于染料、医药和农药等领域。
2.2 二甲基二硫代氨基甲酸钠的用途二甲基二硫代氨基甲酸钠作为一种重要的化工原料,具有很高的应用价值。
在染料工业中,它被用作还原染料的固定剂;在医药工业中,它可用于生产抗肿瘤药物;在农药工业中,它可用于制备杀菌剂等。
然而,由于其在生产和运输过程中可能存在一定的安全隐患,因此有必要制定相应的企业标准来规范其生产和使用。
3. 二甲基二硫代氨基甲酸钠企业标准的重要性3.1 安全生产二甲基二硫代氨基甲酸钠在生产过程中可能涉及到一些危险化学品,如酸性物质、氧化剂等,一旦发生泄漏或事故,可能会对人员和环境造成严重危害。
制定企业标准是为了规范生产过程,减少安全隐患。
3.2 环境保护二甲基二硫代氨基甲酸钠的生产和使用过程中可能会产生废水、废气等污染物,对周围环境造成影响。
通过制定企业标准,可以规范废水处理、废气排放等环保措施,减少对环境的影响。
4. 个人观点与理解个人对于制定二甲基二硫代氨基甲酸钠企业标准的重要性深有体会。
在化工生产中,安全与环保永远是首要考虑的因素,只有通过制定严格的企业标准,才能有效地保障生产过程中的安全和环保。
企业标准的制定也有助于提高生产效率、降低成本、增强企业的竞争力。
希望通过不懈的努力,我国化工行业的企业标准能够不断完善,为行业的发展贡献力量。
二甲基二硫代氨基甲酸钠企业标准二甲基二硫代氨基甲酸钠企业标准1. 什么是二甲基二硫代氨基甲酸钠?二甲基二硫代氨基甲酸钠,又称为乙撑霉素硫醚钠,是一种常用的有机硫化合物,化学式为C4H8NNaS2,是白色结晶性固体。
它在医药和农业领域有着广泛的应用,如在医疗上用作治疗水生动物感染病原体的药物,或者在植物保护上用作杀虫剂和杀菌剂。
不同的应用领域需要对二甲基二硫代氨基甲酸钠有着相应的标准和要求。
2. 二甲基二硫代氨基甲酸钠的企业标准意义企业标准是对于某种物质或产品在生产、加工、使用等方面的规定和要求。
“二甲基二硫代氨基甲酸钠企业标准”是对于这一化合物在生产和使用过程中存在的安全、质量、环保等方面的规范和要求,它对于企业的生产经营起着非常重要的指导作用。
制定和执行科学、合理的企业标准是保障企业生产质量和生产安全的重要手段。
3. 二甲基二硫代氨基甲酸钠企业标准的制定为了确保二甲基二硫代氨基甲酸钠的生产和使用符合安全和质量要求,相关的部门和组织通常会制定相应的企业标准。
这些标准可能涉及二甲基二硫代氨基甲酸钠的生产工艺、质量指标、使用方法、储存要求、废弃物处理等多个方面。
制定标准需要对这些方面进行全面评估和调研,以确保标准的科学性和合理性。
4. 二甲基二硫代氨基甲酸钠企业标准的内容一般来说,二甲基二硫代氨基甲酸钠企业标准的内容会包括以下几个方面:一是对于生产工艺的规定,包括原料选用、生产过程控制、生产设备要求等;二是对于产品质量指标的规定,如纯度、杂质含量、外观要求等;三是对于产品使用和储存的要求,如使用方法、安全注意事项、储存条件等;四是对于废弃物处理的规定,如废弃物的收集、处理和排放要求等。
5. 个人观点与理解作为一种常用的有机硫化合物,二甲基二硫代氨基甲酸钠的安全生产和使用至关重要。
制定科学合理的企业标准是确保其安全和质量的重要手段。
企业在执行这些标准时也需要高度重视,加强对生产流程和产品质量的管理,提高企业的安全生产意识和质量控制水平。
甲酸生产工艺规程1 主题内容与适用范围本标准规定了甲酸生产的方法与工艺条件,操作控制安全生产与劳动保护等内容、适用于氢氧化钠合成生产甲酸。
2 引用标准GB2093-80 酸GB534-82 工业硫酸GB209-84 工业用氢氧化钠SH-QB403.1-91 甲酸含量分析SH-QB403.2-91 探气分折标准SH-QB403.3-91 液碱分析SH-QB403.4-91 合成液分析SH-QB403.5-91 酸化反应料分析SH-QB403.6-91 固体甲酸钠中甲酸钠含量分析3 产品说明3.1 名称工业甲酸,俗名蚁酸3.2 分子式HCOOHO3.3 结构式H ― COH3.4 分析量46.02483.5物理性质3.5.1 外观无色透明液体3.5.2 气味有刺激性气味3.5.3 比重20℃时:甲酸浓度100% d=1.2210甲酸浓度100% d=1.20453.5.4 沸点100.7℃3.5.5 熔点8.3℃3.5.6 闪点60.7℃3.5.7 分解温度160℃(有浓硫酸存在时为60~80℃)3.5.8 溶解度可与水、乙醇及醚以任何比例互溶。
3.5.9 共沸物组成23331pa,107℃时与水组成共沸物其组成HCOOH 77%H2O 23%3.5.10 熔化热13.835KJ/mol3.5.11 生成热20℃836.8KJ/mol3.5.12 蒸汽压见表13.5.13 燃烧热20℃346.6KJ/mol3.5.14 蒸发潜热25℃20KJ/mol100℃500.23KJ/mol3.5.15 液体比热20℃ 2.147J/8℃3. 5.16 液体异热系数20℃9.226W/mK3. 5.17 蒸汽比热100℃ 1.151J/g℃3.5.18 游离常数20℃ 1.8×10-425℃ 1.76×10-43.5.19 折光指数20℃ 1.3713730℃ 1.36733.5.20 临界常数临界温度t=308℃临界压力Pc = 7. 28 × 106Pa( 7. 28MPa)临界密度dc=0.392g/cm33.6 化学性质a 甲酸是较强的酸,可与碱反应生成盐。
工作场所空气有毒物质测定第112部分:甲酸和乙酸1 范围GBZ/T 300的本部分规定了工作场所空气中甲酸溶剂解吸-顶空气相色谱法和乙酸的溶剂解吸-气相色谱法。
本部分适用于工作场所空气中蒸气态甲酸和乙酸浓度的检测。
2 规范性引用文件下列文件对于本文件的应用是必不可少的。
凡是注日期的引用文件,仅注日期的版本适用于本文件。
凡是不注日期的引用文件,其最新版本(包括所有的修改单)适用于本文件。
GBZ 159 工作场所空气中有害物质监测的采样规范GBZ/T 210.4 职业卫生标准制定指南第4部分:工作场所空气中化学物质的测定方法3 甲酸和乙酸的基本信息甲酸和乙酸的基本信息见表1。
表1 甲酸和乙酸的基本信息4 甲酸的溶剂解吸-顶空气相色谱法4.1 原理空气中的蒸气态甲酸用浸渍硅胶采集,硫酸溶液解吸后进样,经气相色谱柱分离,氢焰离子化检测器检测,以保留时间定性,峰高或峰面积定量。
4.2 仪器4.2.1 浸渍硅胶管,溶剂解吸型,内装600mg/300mg 浸渍硅胶(4.3.2)。
4.2.2 空气采样器,流量范围为0mL/min~500mL/min。
4.2.3 溶剂解吸瓶,5mL。
4.2.4 顶空瓶,5mL。
4.2.5 超级恒温水浴。
4.2.6 微量注射器。
4.2.7 气相色谱仪,具氢焰离子化检测器;仪器操作参考条件:a)色谱柱:30m×0.32mm×0.5µm,FFAP;b)柱温:80℃;c)气化室温度:130℃;d)检测室温度:150℃;e)载气(氮)流量:1mL/min;f)分流比:20:1。
4.3 试剂4.3.1 实验用水为蒸馏水。
试剂为分析纯。
4.3.2 浸渍硅胶:将经过常规处理的多孔硅胶,在10.6g/L碳酸钠溶液中浸泡30min,倾去溶液,硅胶晾干后,备用。
4.3.3 硫酸溶液,5%(体积分数)。
4.3.4 硫酸乙醇溶液:15mL硫酸(ρ20=1.84g/mL)慢慢加入95%(体积分数)乙醇中,用乙醇稀释到100mL。
工业甲酸钠(sodium formate)1、范围本标准规定了工业甲酸钠的技术要求、采样、试验方法、检验规则及标志、包装、运输和储存。
本标准适用于合成法制得的甲酸钠产品的质量检验,该产品主要用于生产甲酸、草酸、保险粉和制备还原剂、消毒剂等。
分子式:HCOONa分子量:68.01(按2001年国际相对原子质量)2、规范性引用文件下列文件中的条款通过本标准的引用而成为本标准的条款。
凡是注日期引用文件,其随后所有的修改单(不包括勘误的内容)或修订版均不适用于本标准,然而,鼓励根据本标准达成协议的各方研究是否使用这些文件的最新版本。
凡是不注日期的引用文件,其最新版本适用于本标准。
GB/T6678—2003 化工产品采样总则GB/T4348.2-2002 工业用氢氧化钠中氯化钠含量的测定GB/T 601-2002 化学试剂标准滴定溶液的制备GB/T 603-2002 化学试剂试验方法中所用制剂及制品的制备GB/T 1250-1989 极限数值的表示方法和判定方法GB/T 6682-1992 分析实验室用水规格和试验方法3、技术要求甲酸钠质量应符合表1中要求:表1 甲酸钠的质量要求除非另有规定,仅使用确认为分析纯的试剂和GB/T6682-1992中规定的三级水。
试验中所用标准滴定溶液、制剂及制品,在没有注明其他要求时,均按GB/T601-2002、GB/T603-2002规定制备。
检验结果的判定按GB/T1250-1989中5.2修约值比较法进行。
4.1 外观的评定:采用目视评定。
4.2 溶液A制备:称取样品约1.5g(精确至0.0002g),用无CO2水溶解并迅速转移至250mL容量瓶中,加无CO2水定容得溶液A 。
4.3甲酸钠含量测定4.3.1 原理由于甲酸钠的Kb=5.6*10-11,这样的弱碱显然不能用标准酸滴定,采用在碱性下甲酸钠与高锰酸钾充分反应并生成二氧化锰沉淀,沉淀在酸性中用草酸溶解,最后用高锰酸钾滴定过量的草酸,即可求得甲酸钠含量。
其化学反应如下:2KMnO4+3HCOONa+NaOH==2Na2CO3+K2CO3+2MnO2↓+2H2OMnO2+H2C2O4+H2SO4==MnSO4+2CO2↑+2H2O2KMnO4+5H2C2O4+3H2SO4==2MnSO4+K2SO4+10CO2↑+8H2O4.3.2 试剂和溶液4.3.2.1高锰酸钾标准滴定溶液:C (1/5 KMnO4)=0.1000mol/L ;4.3.2.2草酸标准滴定溶液:C (1/2H2C2O4)=0.1000mol/L ;4.3.2.3硫酸溶液:10%;量取55mL 浓硫酸缓慢加入适量水中,边加边搅拌,冷却后稀释至1000 mL 。
4.3.2.4氢氧化钠溶液:100g/L 。
4.3.3 测定步骤用移液管准确吸取4.2中的溶液A 5mL 置于250mL 锥形瓶中,加少量纯水及2滴氢氧化钠溶液,再准确加入20mL 高锰酸钾标准溶液,在70℃水浴中加热10分钟,稍冷却,加入10mL 硫酸溶液,再准确加入20mL 草酸标准溶液,充分摇动,用高锰酸钾标准溶液滴定至溶液呈粉红色, 30秒内不消失即为终点。
以质量分数(%)表示甲酸钠含量X1,按(1)式计算: 1002505034.0]32)42(1[1⨯⨯⨯⨯-+⨯=m v c v v c X … ………(1) 式中: C 1—高锰酸钾标准滴定溶液实际浓度的数值,mol/L ;C 2—草酸标准溶液实际浓度的数值,mol/L ;V 2—加入高锰酸钾标准溶液体积的数值,mL ;V 4—滴定中消耗高锰酸钾标准滴定溶液体积的数值,mL ;V 3—加入草酸标准溶液体积的数值,mL ;m —试样质量的数值,g ;0.034—与1.00mL 高锰酸钾标准滴定溶液[C (1/5 KMnO4)=1.000mol/L]相当的以克表示的甲酸钠的质量。
4.3.4允许误差甲酸钠含量两次平行测定结果之差不应大于0.5﹪(质量分数),取算术平均值为测定结果。
4.4 氢氧化钠含量测定4.4.1 原理在样品中加入适量氯化钡使碳酸盐沉淀后用盐酸标准溶液滴定,计算氢氧化钠含量。
4.4.2 试剂和溶液4.4.2.1盐酸标准滴定溶液:C (HCl )=0.1000mol/L ;4.4.2.1氯化钡溶液:100g/L ;4.4.2.3酚酞指示剂:10g/L 。
4.4.3 测定步骤称取样品约2g(精确至0.0002g),用适量纯水溶解后置于250mL 锥形瓶中,再加20mL 氯化钡溶液,加酚酞指示剂2-3滴,用盐酸标准溶液滴定至红色刚好消失即为终点。
以质量分数(%)表示氢氧化钠含量X2,按(2)式计算: 100040.0112⨯⨯⨯=mv c X …………(2) 式中:V1—滴定中消耗盐酸标准滴定溶液体积的数值,mL ;C1—盐酸标准滴定溶液实际浓度的数值,mol/L ;m —试样质量的数值,g0.040—与1.00mL 盐酸标准滴定溶液[C (HCl )=1.000mol/L]相当的以克表示的氢氧化钠的质量。
4.5总碱测定4.5.1 原理用盐酸直接滴定样品中碳酸钠和氢氧化钠总量,计算总碱含量。
4.5.2 试剂和溶液4.5.2.1盐酸标准滴定溶液:C (HCl )=0.1000mol/L ;4.5.2.2氯化钡溶液:100g/L ;4.5.2.3酚酞指示剂:10g/L 。
4.5.3 测定步骤称取样品约2g(精确至0.0002g),用适量纯水溶解后,置于250mL 锥形瓶中,加10g/L 酚酞指示剂2-3滴,用C(HCl)= 0.1mol/L 标准溶液滴定至红色刚好消失即为终点。
以质量分数(%)表示总碱(以Na 2CO 3计)含量X 3,按(3)式计算: 100106.)(1123⨯⨯⨯-=mo c v v X …………(3) 式中:V 1—4.4.3中滴定氢氧化钠消耗盐酸标准滴定溶液体积的数值,mL ;V 2—滴定中消耗盐酸标准滴定溶液体积的数值,mL ;C 1—盐酸标准滴定溶液实际浓度的数值,mol/L ;m —试样质量的数值,g0.106—与1.00mL 盐酸标准滴定溶液[C (HCl )=1.000mol/L]相当的以克表示的碳酸钠的质量。
4.6 水分测定准确称取试样约2g((精确至0.0002g),放于已恒重的称量瓶中,在105℃烘3小时至恒重,放于干燥器中冷却至室温,称重。
以质量分数(%)表示水分含量X 4,按(4)式计算: 100214⨯-=mm m X …………(4) 式中: m1—干燥前试样和称量瓶质量的数值,gm2—干燥后试样和称量瓶质量的数值,gm —试样质量的数值,g4.7氯化钠含量测定4.7.1原理试样中的氯离子全部取代硫氰酸汞中的硫氰酸根离子,被取代的硫氰酸根离子与硝酸铁反应生成硫氰酸铁,显红色,在波长450nm 处,对有色溶液进行光度测定,反应式如下:2NaCl+Hg(NO3)2===HgCl2+2NaSCN3NaSCN+Fe(NO3)3===3NaNO3+Fe(SCN)34.7.2试剂和溶液4.7.2.1 硝酸(HNO3):AR ;4.7.2.2 硝酸铁[Fe (NO3)3.9H2O ]:AR ;4.7.2.3过氧化氢(H2O2):AR ;4.7.2.4硝酸铁溶液:8g/L (以Fe 计)。
在500mL 锥形瓶中,加入约4.0g 纯铁(纯度>99.5%),精确至0.01g ,加80mL 水,再小心加入80mL 硝酸(AR ),在通风柜中将溶液缓慢加热至沸腾,待反应进行完毕,亚硝酸气全部被驱除后,再加入几滴过氧化氢(AR ),使溶液脱色,继续煮沸2分钟,停止加热,冷却后将溶液全部移入500mL 容量瓶中,用水稀释至刻度,摇匀。
4.7.2.5硫氰酸汞溶液:0.5g/L ;称取0.1g 硫氰酸汞[Hg(SCN)2],称准至0.0001g ,置于250mL 烧杯中,加30mL 无水乙醇,在不断搅拌下,再加150mL 温水,使之溶解。
然后,将溶液过滤至200mL 容量瓶中,用水稀释至刻度,摇匀。
4.7.2.6 氯化钠标准溶液:0.1mg/mL ;称取预先在500℃—600℃灼烧至恒重的氯化钠基准试剂0.1g ,精确到0.0001g ,置于烧杯中,加入少量水溶解,再将溶液全部移入1000mL 容量瓶中,用水稀释至刻度,摇匀。
4.7.2.7氯化钠标准溶液:0.01mg/mL ;吸取20.0mL 氯化钠标准溶液(f ),置于200mL 容量瓶中,用水稀释至刻度,摇匀。
4.7.2.8酚酞指示溶液:10g/L 。
4.7.3仪器和设备:一般实验室仪器和分光光度计。
4.7.4标准曲线的绘制4.7.4.1 标准比色溶液的配制依次吸取0.0、2.0、4.0、6.0、8.0、10.0、12.0、15.0mL 氯化钠标准溶液(g ),分别置于50mL 容量瓶中。
然后,在每个容量瓶中依次加入5mL 硝酸、5mL 硝酸铁溶液和20mL 硫氰酸汞溶液,用水稀释至刻度,摇匀,静置30分钟显色。
4.7.4.2标准比色溶液吸光度的测定用分光光度计,于波长450nm 处,以水调整分光光度计零点,选用5cm 吸收池进行吸光度的测定。
4.7.4.3标准曲线的绘制以50mL 标准比色溶液中氯化钠的质量(mg )为横坐标,与其对应的吸光度为纵坐标,扣除空白溶液的昅光度,绘制标准曲线。
4.7.5 测定步骤称取20g 甲酸钠样品,称准至0.01g ,用水溶于200mL 容量瓶中,加1—2滴酚酞作指示剂,用硝酸中和至无色,用水稀释至刻度,摇匀。
再从该稀释溶液中移取10mL 试样溶液,置于50mL 容量瓶中,依次加5mL 硝酸、5mL 硝酸铁溶液和20mL 硫氰酸汞溶液,用水稀释至刻度,摇匀,静置30分钟显色。
同时做空白试验(加10mL 水于50mL 容量瓶中,其余步骤同试样测定)。
以质量分数(%)表示氯化钠含量X5,按(5)式计算: 1002001010)(3501⨯⨯⨯-=-m m m X …………(5) 式中:m1—试液吸光度相对应的氯化钠的质量,mg ;m0—空白试液相对应的氯化钠的质量,mg ;m —试样质量的数值,g4.8硫化物测定4.8.1 原理在弱酸性条件下,碘与硫代硫酸钠反应生成连四硫酸钠,计算出硫化物含量。
2Na 2S 2O 3+I 2=Na 2S 4O 6+2NaI4.8.2试剂和溶液4.8.2.1 碘标准滴定溶液:C (1/2I 2)=0.01000mol/L ;4.8.2.2 冰乙酸溶液:20%;4.8.2.3 淀粉指示剂:5g/L ;4.8.3 测定步骤称取样品约5g (精确至0.0002 g )于250mL 锥形瓶中,加水20mL ,冰乙酸10mL ,加淀粉指示液1mL ,用碘标准溶液滴定至试液呈蓝色,在30秒内不消失即为终点。