高中化学--大π键的书写及认识; (共14张PPT)
- 格式:ppt
- 大小:1.03 MB
- 文档页数:14

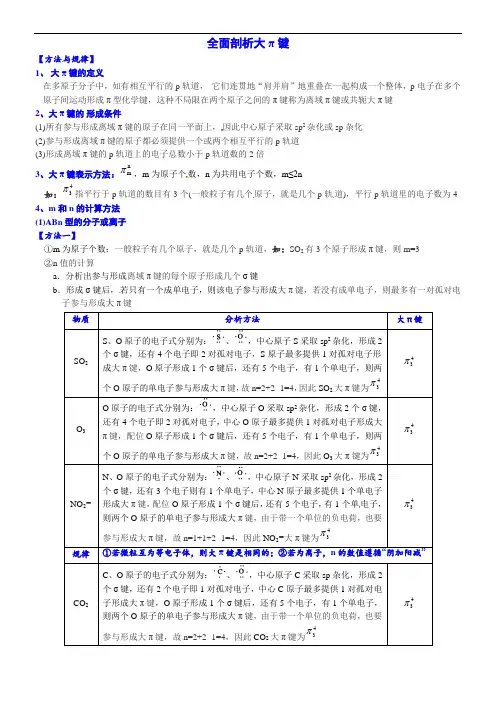
全面剖析大π键【方法与规律】1、大π键的定义在多原子分子中,如有相互平行的p轨道,它们连贯地“肩并肩”地重叠在一起构成一个整体,p电子在多个原子间运动形成π型化学键,这种不局限在两个原子之间的π键称为离域π键或共轭大π键2、大π键的形成条件(1)所有参与形成离域π键的原子在同一平面上,因此中心原子采取sp2杂化或sp杂化(2)参与形成离域π键的原子都必须提供一个或两个相互平行的p轨道(3)形成离域π键的p轨道上的电子总数小于p轨道数的2倍3、大π键表示方法:nmπ,m为原子个数,n为共用电子个数,m≤2n如:43π指平行于p轨道的数目有3个(一般粒子有几个原子,就是几个p轨道),平行p轨道里的电子数为44、m和n的计算方法(1)ABn型的分子或离子【方法一】①m为原子个数:一般粒子有几个原子,就是几个p轨道,如:SO2有3个原子形成π键,则m=3②n值的计算a.分析出参与形成离域π键的每个原子形成几个σ键b.形成σ键后,若只有一个成单电子,则该电子参与形成大π键,若没有成单电子,则最多有一对孤对电子参与形成大π键物质分析方法大π键SO2S、O原子的电子式分别为:、,中心原子S采取sp2杂化,形成2个σ键,还有4个电子即2对孤对电子,S原子最多提供1对孤对电子形成大π键,O原子形成1个σ键后,还有5个电子,有1个单电子,则两个O原子的单电子参与形成大π键,故n=2+2×1=4,因此SO2大π键为43π43πO3O原子的电子式分别为:,中心原子O采取sp2杂化,形成2个σ键,还有4个电子即2对孤对电子,中心O原子最多提供1对孤对电子形成大π键,配位O原子形成1个σ键后,还有5个电子,有1个单电子,则两个O原子的单电子参与形成大π键,故n=2+2×1=4,因此O3大π键为43π43πNO2-N、O原子的电子式分别为:、,中心原子N采取sp2杂化,形成2个σ键,还有3个电子则有1个单电子,中心N原子最多提供1个单电子形成大π键,配位O原子形成1个σ键后,还有5个电子,有1个单电子,则两个O原子的单电子参与形成大π键,由于带一个单位的负电荷,也要参与形成大π键,故n=1+1+2×1=4,因此NO2-大π键为43π43π规律①若微粒互为等电子体,则大π键是相同的;②若为离子,n的数值遵循“阴加阳减”CO2C、O原子的电子式分别为:、,中心原子C采取sp杂化,形成2个σ键,还有2个电子即1对孤对电子,中心C原子最多提供1对孤对电子形成大π键,O原子形成1个σ键后,还有5个电子,有1个单电子,则两个O原子的单电子参与形成大π键,由于带一个单位的负电荷,也要参与形成大π键,故n=2+2×1=4,因此CO2大π键为43π43π同理SCN—、NO2+、N3—互为等电子体,则大π键是相同的,大π键为43π物质分析方法大π键CO32—C、O原子的电子式分别为:、,中心原子C采取sp2杂化,形成3个σ键,还有1个单电子,中心C原子最多提供1个单电子形成大π键,O原子形成1个σ键后,还有5个电子,有1个单电子,则3个O原子的单电子参与形成大π键,由于带2个单位的负电荷,也要参与形成大π键,故n=1+2+3×1=6,因此CO32—大π键为64π64π同理NO3—、SO3互为等电子体,则大π键是相同的,大π键为64π【方法二】①m为原子个数:一般粒子有几个原子,就是几个p轨道,如:SO2有3个原子形成π键,则m=3②n值的计算(3个部位加起来的总和)a.中心原子=中心原子价电子数-形成σ键所提供的电子总数-孤电子数b.成键原子=成单电子数总和c.外界:阴阳离子,遵循“阴加阳减”物质分析方法大π键SO2①S的杂化:sp2②形成大π键的p轨道电子总数a.中心S原子=中心原子价电子数-形成σ键所提供的电子总数-孤电子数=6-2×1-2=2b.成键原子=2×1=2c.外界:0n=2+2=4,因此SO2大π键为43π43πNO2+①N的杂化:sp②形成大π键的p轨道电子总数a.中心N原子=中心原子价电子数-形成σ键所提供的电子总数-孤电子数=5-2×1-0=3b.成键原子=2×1=2c.外界:-1n=3+2-1=4,因此NO2+大π键为43π43πSO3①S的杂化:sp2②形成大π键的p轨道电子总数a.中心S原子=中心原子价电子数-形成σ键所提供的电子总数-孤电子数=6-3×1-0=3b.成键原子=3×1=3c.外界:0n=3+3=6,因此SO3大π键为64π64πNO3—①N的杂化:sp2②形成大π键的p轨道电子总数a.中心N原子=中心原子价电子数-形成σ键所提供的电子总数-孤电子数=5-3×1-0=264πb .成键原子=3×1=3 c.外界:1n=2+3+1=6,因此NO3—大π键为64π【方法三】①m为原子个数:一般粒子有几个原子,就是几个p轨道,如:SO2有3个原子形成π键,则m=3②n值的计算a.先计算微粒的总价电子数(a)b.计算原子之间的σ键,一对σ键存在2个电子(b)c.中心原子的孤对电子数(c)d.外围原子的价层电子中的孤对电子数,如:O原子为2s、2p中各有1对,共4个电子(d)③n=a-b-c-d物质分析方法大π键SO2总价电子数a=6+6×2=18σ键电子数b=2×2=4中心原子的孤对电子数c=2外围原子的价层电子中的孤对电子数d=2×4=8n=a-b-c-d=18-4-2-8=4,因此SO2大π键为43π43πNO2+总价电子数a=5+6×2-1=16σ键电子数b=2×2=4中心原子的孤对电子数c=0外围原子的价层电子中的孤对电子数d=2×4=8n=a-b-c-d=16-4-0-8=4,因此NO2+大π键为43π43πSO3总价电子数a=6+6×3=24σ键电子数b=3×2=6中心原子的孤对电子数c=0外围原子的价层电子中的孤对电子数d=3×4=12n=a-b-c-d=24-6-0-12=6,因此SO2大π键为64π64πNO3—总价电子数a=5+6×3+1=24σ键电子数b=3×2=6中心原子的孤对电子数c=0外围原子的价层电子中的孤对电子数d=3×4=12n=a-b-c-d=24-6-0-12=6,因此NO3—大π键为64π64π(2)多个中心原子(AmBn)型的分子或离子——用方法一①m为原子个数:一般粒子有几个原子,就是几个p轨道,如:SO2有3个原子形成π键,则m=3②n值的计算a.分析出参与形成离域π键的每个原子形成几个σ键b.形成σ键后,若只有一个成单电子,则该电子参与形成大π键,若没有成单电子,则最多有一对孤对电子参与形成大π键物质分析方法大π键C原子的电子式为:,每个C原子采取sp2杂化,形成3个σ键,每C原子有1个成单电子,该单电子参与形成大π键,因此其大π键为66π66πC、N原子的电子式为:、,C原子都采取sp2杂化,形成3个σ键,每C原子有1个成单电子,该单电子参与形成大π键,N原子形成2个σ键,还有3个电子,有一个成单电子参与形成大π键,所以n=5×1+1=6,因此其大π键为66π66π物质分析方法大π键C、N原子的电子式为:、,C原子都采取sp2杂化,形成3个σ键,每C原子有1个成单电子,该单电子参与形成大π键,N原子形成3个σ键,还有1对孤对电子,这对孤对电子一定参与形成大π键,所以n=4×1+2=6,因此其大π键为65π65πC、N原子的电子式为:、,C原子都采取sp2杂化,形成3个σ键,每C原子有1个成单电子,该单电子参与形成大π键,1号N原子形成3个σ键,还有1对孤对电子,这对孤对电子一定参与形成大π键,2号N原子形成2个σ键,还有3个电子,则有一个成单电子参与形成大π键,所以n=3×1+2+1=6,因此其大π键为65π65πC、O原子的电子式为:、,C原子都采取sp2杂化,形成3个σ键,每C原子有1个成单电子,该单电子参与形成大π键,O原子形成2个σ键,还有4个电子即2对孤对电子,O原子最多提供1对孤对电子形成大π键,所以n=4×1+2=6,因此其大π键为65π65πC、S原子的电子式为:、,C原子都采取sp2杂化,形成3个σ键,每C原子有1个成单电子,该单电子参与形成大π键,S原子形成2个σ键,还有4个电子即2对孤对电子,S原子最多提供1对孤对电子形成大π键,所以n=4×1+2=6,因此其大π键为65π65πC、Se原子的电子式为:、,C原子都采取sp2杂化,形成3个σ键,每C原子有1个成单电子,该单电子参与形成大π键,Se原子形成2个σ键,还有4个电子即2对孤对电子,Se原子最多提供1对孤对电子形成大π键,所以n=4×1+2=6,因此其大π键为65π65πC原子的电子式为:,C原子都采取sp2杂化,形成3个σ键,每C原子有1个成单电子,该单电子参与形成大π键,所以n=4×1=4,因此其大π键为44π44π。

大π键(化学) work Information Technology Company.2020YEAR大π键1.定义:在多原子分子中如有相互平行的p轨道,它们连贯重叠在一起构成一个整体,p电子在多个原子间运动形成π型化学键,这种不局限在两个原子之间的π键称为离域π键,或大π键。
2.形成大π键的条件①这些原子都在同一平面上;②这些原子有相互平行的p轨道;③p轨道上的电子总数小于p轨道数的2倍。
是3个或3个以上原子形成的π键通常指芳环的成环碳原子各以一个未杂化的2p轨道,彼此侧向重叠而形成的一种封闭共轭π键。
例如,苯的分子结构是六个碳原子都以sp2杂化轨道结合成一个处于同一平面的正六边形,每个碳原子上余下的未参加杂化的p轨道,由于都处于垂直于苯分子形成的平面而平行,因此所有p轨道之间,都可以相互重叠而形成以下图式:苯的大π键是平均分布在六个碳原子上,所以苯分子中每个碳碳键的键长和键能是相等的又如,1,3-丁二烯分子式为H2C=CH-CH=CH2.4个碳原子均与3 个原子相邻,故采用sp2杂化。
这些杂化轨道相互重叠,形成分子σ骨架,故所有原子处于同一平面。
每个碳原子还有一个未参与杂化的p轨道,垂直于分子平面,每个p轨道里面有一个电子,故丁二烯分子中存在一个“4轨道4电子”的p-p大π键。
通常用bπa 来表示,其中a为平行的p轨道的数目,b表示平行p轨道里电子数。
3.分类:离域π键:在这类分子中,参与共轭体系的所有π 电子的游动不局限在两个碳原子之间,而是扩展到组成共轭体系的所有碳原子之间。
这种现象叫做离域。
共轭π键也叫离域键或非定域键。
由于共轭π 键的离域作用,当分子中任何一个组成共轭体系的原子受外界试剂作用时,它会立即影响到体系的其它部分。
共轭分子的共轭π键或离域键是化学反应的核心部位。
定域π键:有机分子中只包含σ 键和孤立π 键的分子称为非共轭分子。
这些σ 键和孤立π 键,习惯地被看成是定域键,即组成σ 键的一对σ 电子和孤立π 键中一对π电子近似于成对地固定在成键原子之间。



大π键1.定义:在多原子分子中如有相互平行的p轨道,它们连贯重叠在一起构成一个整体, p电子在多个原子间运动形成π型化学键,这种不局限在两个原子之间的π键称为离域π键,或大π键。
2。
形成大π键的条件①这些原子都在同一平面上;②这些原子有相互平行的p轨道;③p轨道上的电子总数小于p轨道数的2倍。
是3个或3个以上原子形成的π键通常指芳环的成环碳原子各以一个未杂化的2p轨道,彼此侧向重叠而形成的一种封闭共轭π键。
例如,苯的分子结构是六个碳原子都以sp2杂化轨道结合成一个处于同一平面的正六边形,每个碳原子上余下的未参加杂化的p轨道,由于都处于垂直于苯分子形成的平面而平行,因此所有p轨道之间,都可以相互重叠而形成以下图式:苯的大π键是平均分布在六个碳原子上,所以苯分子中每个碳碳键的键长和键能是相等的又如,1,3-丁二烯分子式为H2C=CH—CH=CH2.4个碳原子均与3 个原子相邻,故采用sp2杂化。
这些杂化轨道相互重叠,形成分子σ骨架,故所有原子处于同一平面。
每个碳原子还有一个未参与杂化的p轨道,垂直于分子平面,每个p轨道里面有一个电子,故丁二烯分子中存在一个“4轨道4电子”的p-p大π键。
通常用bπa 来表示,其中a为平行的p轨道的数目,b表示平行p轨道里电子数。
3.分类:离域π键:在这类分子中,参与共轭体系的所有π 电子的游动不局限在两个碳原子之间,而是扩展到组成共轭体系的所有碳原子之间。
这种现象叫做离域。
共轭π键也叫离域键或非定域键。
由于共轭π 键的离域作用,当分子中任何一个组成共轭体系的原子受外界试剂作用时,它会立即影响到体系的其它部分。
共轭分子的共轭π键或离域键是化学反应的核心部位。
定域π键:有机分子中只包含σ 键和孤立π 键的分子称为非共轭分子。
这些σ 键和孤立π 键,习惯地被看成是定域键,即组成σ 键的一对σ 电子和孤立π 键中一对π 电子近似于成对地固定在成键原子之间.这样的键叫做定域键。

大π键;,离域π键,;共轭π键又称离域π键或共轭π键。
包含多个(三个或三个以上)原子的π键。
它的形成是由共面的n个原子各自提供一个相平行的p轨道,组成n个分子轨道,m个π电子在n个原子组成的分子骨架中运动。
这种π型化学键以符号又称离域π键或共轭π键。
表示。
大π键分为:(1)正常大π键;m=n,如苯C6H6中六个碳原子形成的大π键;(2)多电子大π键,m>n,如氯乙烯CH2=CH—C1,含键;(3)铁电子大π键,m<n如丙烯CH2=CHCH2。
离域π键子中多个原子有相互平行的p轨道,依次重叠构成一整体。
p电子不再局限在某两个原子之间,而是在多个原子间运动。
这种π型化学键称为离域π键,又称大π键。
用符号πmn表示,其中n为提供p轨道的原子数,m为离域电子数。
在有机物中相当普遍,如C6H6有π66,C5H-5有π65。
无机物中也常遇到,如NO2有π33,NO-3有π64,O3有π43等价键理论把构成两个原子间共价键的电子对看作在这两原子之间运动,称为定域键。
定域键只存在于两个原子之间的共价键。
靠定域键的作用而形成的多原子分子可认为是由相对独立的两个原子间的化学键把原子连接起来的。
这种模型较好地反映了由键上电子云所确定的分子性质如键能、键长、键角、键偶极、键极化度等离域键在多个原子之间形成的共价键。
它包括缺电子多中心键,富电子多中心键,π配键,共轭π键以及夹心键等。
具有离域键的分子不可能用惟一的仅含定域键的结构式描述。
相对于定域键结构而言,体系能量的降低,即体系额外的稳定化能称为离域能或共轭能。
离域能愈大,分子愈稳定。
p, π-共轭;π键与相邻原子上的p轨道发生的共轭。
它分为多电子、缺电子与等电子p,π-共轭三种类型。
例如氯乙烯,CH2=CH—Cl,的共轭体系是由3个原子(C,C,C1)与4个p电子(π键2个,氯原子2个)组成,共轭π键中的p电子数多于共轭键的原子数,称为多电子p,π-共轭。

大π键表示方式大π键(Big Pi Key)是一种新型的输入方式,通过将数字和符号映射到Pi(π)数字的不同位置来实现输入。
这种输入方式具有很强的安全性和隐秘性,因为π的小数位数非常长,大π键可以利用这一特点来实现输入敏感信息的安全传输。
大π键的工作原理是利用π的随机性和无限性来实现输入的复杂性和隐秘性。
通过将数字和符号映射到π的不同位置上,用户可以通过一系列的按键和滑动操作来输入各种信息。
这种输入方式不仅可以用于传统的密码输入,还可以应用在其他需要输入的场景,比如支付密码、数字签名等。
大π键的优点之一是安全性高。
由于π的小数位数非常长,且没有重复序列,因此基于π的输入方式可以实现极高的安全性。
即使输入的过程被窃听或者记录下来,也很难还原出用户输入的信息。
这为用户输入敏感信息提供了很好的保护。
另一个优点是隐秘性。
由于大π键将数字和符号映射到π的不同位置上,因此用户输入的信息表现为一系列的按键和滑动操作,而不是明文的数字和符号。
这种输入方式不会暴露用户输入的信息,从而保护了用户的隐私和个人信息安全。
除此之外,大π键还具有很好的兼容性和易用性。
它可以应用在各种数字输入场景,比如手机输入、电脑输入、支付密码输入等。
用户只需要通过一系列简单的操作就可以完成输入,不需要记忆复杂的密码或者使用特殊的设备。
这为用户提供了很大的方便和便利。
然而,大π键也存在一些局限性。
首先,由于π的小数位数非常长,因此输入的速度可能会比传统的输入方式慢一些。
用户需要花费更多的时间来完成输入操作。
其次,大π键的复杂性可能会导致一些用户在使用时感到困惑和不适应。
一些老年人或者技术水平较低的用户可能会觉得难以接受这种新的输入方式。
为了解决这些问题,我们可以考虑对大π键进行进一步的优化和改进。
首先,可以通过智能算法和预测技术来提高输入的速度和准确性。
比如在用户输入的过程中,系统可以根据用户的输入习惯和输入习惯来进行一定的预测,从而提高用户的输入效率。



大π键表示方式1.介绍大π键及其重要性1.1大π键的定义大π键是指由两个相邻的原子间存在的共轭双键和共轭三键所组成的键,通常由一个非常大的π轨道系统形成。
这种类型的键在有机化合物中非常常见,它们对分子的结构和性质有着重要的影响。
1.2大π键的重要性大π键不仅可以影响化合物的电子结构和成键性质,还可以影响化学反应的速率和产物选择。
因此,研究大π键的表示方式对于理解有机分子的性质和反应机理至关重要。
2.大π键的表示方式2.1 Lewis结构Lewis结构是表示有机分子中大π键的最简单和直观的方式之一。
通过Lewis结构,可以清晰地看到分子中的π电子体系以及键的位置和类型。
2.2共振结构有机分子中的大π键通常会存在共振结构,这些共振结构可以很好地反映出π电子在分子中的分布情况。
因此,通过共振结构可以更全面地理解大π键的性质和行为。
2.3分子轨道理论分子轨道理论是一种用来描述分子电子结构的理论方法,通过计算分子轨道可以得到大π键的形状、大小和能量。
这种方法提供了一种深入了解大π键的方式,对于理解分子的光电性质和反应性质有着重要的意义。
3.大π键表示方式的比较和应用3.1各种表示方式的优缺点比较Lewis结构简单直观,但无法表达共振性质;共振结构能够更全面地描述大π键的性质,但过于复杂;分子轨道理论提供了深入了解大π键的方式,但计算成本高。
因此,不同的表示方式适用于不同的研究目的和需求。
3.2应用举例以苯分子为例,通过Lewis结构可以清晰地看到苯环上的大π键;通过共振结构可以理解苯环的共振性质;通过分子轨道理论可以计算出苯环中π电子的排布情况和能级分布。
4.大π键表示方式在有机化学研究中的应用4.1有机分子设计与合成通过对大π键表示方式的研究和应用,可以指导新型有机分子的设计和合成,提高有机化合物的性能和功能。
4.2化学反应机理研究大π键表示方式的比较和应用可以帮助研究者深入理解有机化学反应的机理和动力学,为有机合成提供理论指导和实验依据。
大π键1.定义:在多原子分子中如有相互平行的p轨道,它们连贯重叠在一起构成一个整体,p电子在多个原子间运动形成π型化学键,这种不局限在两个原子之间的π键称为离域π键,或大π键。
2.形成大π键的条件①这些原子都在同一平面上;②这些原子有相互平行的p轨道;③p轨道上的电子总数小于p轨道数的2倍。
是3个或3个以上原子形成的π键通常指芳环的成环碳原子各以一个未杂化的2p轨道,彼此侧向重叠而形成的一种封闭共轭π键。
例如,苯的分子结构是六个碳原子都以sp2杂化轨道结合成一个处于同一平面的正六边形,每个碳原子上余下的未参加杂化的p轨道,由于都处于垂直于苯分子形成的平面而平行,因此所有p轨道之间,都可以相互重叠而形成以下图式:苯的大π键是平均分布在六个碳原子上,所以苯分子中每个碳碳键的键长和键能是相等的又如,1,3-丁二烯分子式为H2C=CH-CH=CH2.4个碳原子均与3 个原子相邻,故采用sp2杂化。
这些杂化轨道相互重叠,形成分子σ骨架,故所有原子处于同一平面。
每个碳原子还有一个未参与杂化的p轨道,垂直于分子平面,每个p轨道里面有一个电子,故丁二烯分子中存在一个“4轨道4电子”的p-p大π键。
通常用bπa 来表示,其中a为平行的p轨道的数目,b表示平行p轨道里电子数。
3.分类:离域π键:在这类分子中,参与共轭体系的所有π 电子的游动不局限在两个碳原子之间,而是扩展到组成共轭体系的所有碳原子之间。
这种现象叫做离域。
共轭π键也叫离域键或非定域键。
由于共轭π 键的离域作用,当分子中任何一个组成共轭体系的原子受外界试剂作用时,它会立即影响到体系的其它部分。
共轭分子的共轭π键或离域键是化学反应的核心部位。
定域π键:有机分子中只包含σ 键和孤立π 键的分子称为非共轭分子。
这些σ 键和孤立π 键,习惯地被看成是定域键,即组成σ 键的一对σ 电子和孤立π 键中一对π 电子近似于成对地固定在成键原子之间。
这样的键叫做定域键。