铁的单质—人教版高中化学必修一
- 格式:pptx
- 大小:1.64 MB
- 文档页数:26
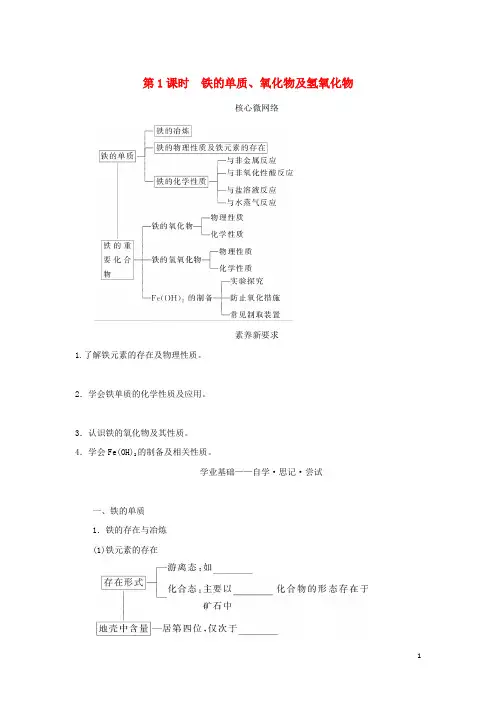
第1课时铁的单质、氧化物及氢氧化物核心微网络素养新要求1.了解铁元素的存在及物理性质。
2.学会铁单质的化学性质及应用。
3.认识铁的氧化物及其性质。
4.学会Fe(OH)2的制备及相关性质。
学业基础——自学·思记·尝试一、铁的单质1.铁的存在与冶炼(1)铁元素的存在(2)铁的冶炼①我国在西周晚期就掌握了冶铁的技术。
战国中期以后,铁制工具在社会生产中发挥了巨大的作用。
②工业炼铁的原理是用________的方法把铁从铁矿石中提炼出来。
2.铁的性质(1)物理性质纯净的铁是光亮的________色金属,密度较大,熔点较高。
具有________性、________性、________性,能被________吸引。
(2)化学性质①铁与非金属单质、酸、盐溶液的反应②实验探究铁粉与水蒸气的反应3.写出下列反应的化学方程式或离子方程式(1)与非金属单质(2)与水(常温不反应、高温与水蒸气反应)________________________________________________________________________ (3)与稀盐酸、稀H2SO4反应(离子方程式)________________________________________________________________________ (4)与某些盐(离子方程式)二、铁的氧化物均可与Al、CO、H2等反应,如3Fe x O y+2y Al3x Fe+y Al2O3特别提醒1.FeO、Fe2O3是碱性氧化物。
Fe3O4有固定的组成,属于纯净物,不是混合物,由于其与非氧化性酸反应生成铁盐和亚铁盐,故不属于碱性氧化物。
2.Fe3O4可看成FeO·Fe2O3,所以在书写Fe3O4与盐酸反应的方程式时,可将其看作FeO、Fe2O3分别与盐酸反应,然后把两个反应相加。
3.在高温条件下,Fe与Fe2O3可以发生反应,当铁足量时:Fe+Fe2O33FeO,当铁不足时:Fe+4Fe2O33Fe3O4。

第三章铁金属材料第一节铁及其化合物【必备方程式】知识点一铁的单质一、铁元素的存在1、含量铁元素在地壳中的含量仅次于氧、硅和铝。
2、存在形态(1)游离态:存在于陨铁中。
(2)化合态:主要以+2、+3价铁的化合物存在。
如黄铁矿(FeS2)、赤铁矿( Fe2O3)、磁铁矿(Fe3O4)、菱铁矿(FeCO3)等。
【习题】判断正误。
(1)铁元素在地壳中含量位于第三位。
()(2)在工业中炼制铁单质,所以自然界中无游离态铁。
()(3)工业炼铁,需加入还原剂。
()(4)钢和铁都是铁的合金,钢不易生锈,生铁易生锈,铁锈的主要成份是Fe3O4。
()二、铁的单质1、物理性质:银白色光泽、密度大,熔沸点高,延展性、导电、导热性较好、能被磁铁吸引。
2、化学性质:铁是较活泼的金属,铁原子的最外层电子数为2个,可失去2个或3个电子而显+2价或+3价,但+3价的化合物较稳定。
①与非金属反应:3Fe + 2O2Fe3O42Fe + 3C122FeCl3说明:铁丝在氯气中燃烧时,生成棕黄色的烟,加水振荡后,溶液显黄色。
△Fe + S FeS说明:铁跟氯气、硫反应时,分别生成+3价和+2价的铁,说明氧化性:氯气>硫。
①与水反应:A.在常温下,在水和空气中的O2、CO2等的共同作用下,Fe易被腐蚀(铁生锈)。
B.在高温下,铁能与水蒸气反应生成H2:3Fe + 4H2O(g)Fe3O4 + 4H2①与酸反应:A.与非氧化性酸(如稀盐酸、稀H2SO4等)的反应。
例如:Fe + 2H+Fe2++ H2↑B.铁遇到冷的浓H2SO4、浓HNO3时,产生钝化现象,因此金属铁难溶于冷的浓H2SO4或浓HNO3中。
但在加热条件也可以反应。
①与比铁的活动性弱的金属的盐溶液发生置换反应。
例如:Fe + Cu2+Fe2++ Cu【习题】1、下列物质中,不能与铁发生化学反应的是()A.盐酸B.氯化铁溶液C.氢氧化钠溶液D.氯气2、下列关于铁的叙述正确的是()。







第三章铁金属材料第一节第一课时铁的单质铁的氧化物本节是教材高一(必修一)第三章,在这一章学习的过程中,在初中阶段比较肤浅地了解一些铁的知识,本节要在这些知识的基础上结合离子反应、氧化还原反应等知识进一步加深学习铁的有关性质。
从本质上了解铁是一种变价金属。
在教学过程中考虑新旧知识的相互衔接,注意充分发挥理论知识对元素化合物知识的指导作用。
学习相关内容时应用理论知识加以解释,应用的过程也是进一步加深理解这些理论的过程。
例如,本节很多的反应都属于氧化还原反应,用电子转移的观点分析这些反应,既能加深对具体反应的理解,又可以巩固有关氧化还原反应的概念.通过介绍一些生活中的铁以及氧化物,进一步加深学生对这些知识的理解.教学目标1、掌握铁的单质氧化物的主要性质,了解其应用。
2、通过自主学习,自主进行知识网络的构建和知识的归纳整理,培养学生的自学能力和归纳总结能力。
核心素养1、分类、比较、分析、归纳、演绎等整理科学事实的基本方法,学习物质的性质。
学会学习和认识新化学物质的基本思路和方法。
2、通过铁的化合物的性质与用途的学习,使学生进一步认识化学在促进社会发展、改善人类的生活条件等方面所起到的重要作用,提高学习化学的兴趣,增强学好化学,服务社会的责任感和使命感。
重点:铁的单质、氧化物性质难点:铁的单质、氧化物性质查阅铁单质氧化物相关内容,预习课本。
【引入】三千年前,人类就开始使用金属铁,直到现在,铁对于人类来说仍然是最有用、最廉价、最丰富、最重要的金属了。
【图片展示】【设问】在地壳中含量排名第几?铁在自然界主要以什么形式存在?为什么?【生】化合态。
铁的性质很活泼。
【投影】铁的物理性质【学生活动】单质铁的常见化学性质【讨论】从水蒸气的产生、铁粉与水蒸气的反应,反应产物的检验等环节,讨论反应装置的设计。
【学生活动】画装置图:【演示实验视频】通过观察现象讨论结论【教师小结】实际生活当中我们不仅接触到了铁单质,而且还有很多的含铁的化合物。
化学高一(上)第一节铁及其化合物3.1.1 铁的单质◆教材分析本节教学内容是人教版(2019)高中化学必修第一册第三章《铁金属材料》的第一节《铁及其化合物》。
本次课主要是运用氧化还原反应的理论,探究铁及其化合物的氧化性或还原性。
通过铁及其化合物相互转化的关系,让学生建构起分类观和转化观等化学基本方法。
了解铁的化合物知识在人类生活和生产中的重要作用。
明确化学来源于生活并服务于生活的思想。
◆教学目标宏观辨识与微观探析:能依据物质类别、物质所含核心元素的化合价列举、描述、辨识含铁元素典型物质重要的物理性质与化学性质。
并掌握选用不同的氧化剂与还原剂实现铁与铁的化合物的相互转化。
证据推理与模型认知:通过铁及其化合物的探究实验,使学生掌握从物质类别、物质所含核心元素的化合价这两个基本角度去预测物质可能具有的性质的方法。
科学探究与创新意识:通过金属铁、铁的氧化物、铁的氢氧化物的氧化性或还原性的探究实验,使学生学会预测物质的性质——设计实验方案进行实验并进行观察——分析实验现象,得出结论的科学探究方法。
通过预测与假设、方案设计、实验记录、分析归纳。
科学精神与社会责任:使学生学会预测物质的性质,并通过实验探究得到证实,体验科学探究成功的喜悦;同时培养他们善于与他人合作的良好心理品质。
◆教学重难点【教学重点】1.铁单质、铁的氧化物、铁的氢氧化物的性质。
2.铁及其化合物之间的转化方法。
【教学难点】从物质类别、物质所含核心元素的化合价这两个基本角度去预测物质可能具有的性质,并设计实验掌握铁及其化合物之间转化的方法。
◆教学过程一、导入新课【讲述】铁是一种常见金属,在生活中应用广泛。
纯铁具有良好的延展性和导热性,导电性比铜、铝差,能被磁铁吸引。
铁与少量的碳制成合金——钢,是重要的工业材料。

《铁的单质》精品教案【学习目标】1.通过观察铁制品图片思考并总结铁的单质的物理性质;2.通过燕麦中还原铁粉的检验、作用的学习,回顾并总结初中涉及的铁的单质的化学性质;3.通过类比单质钠与水的反应预测铁与水蒸气的反应的可能性,及产物推断。
4. 通过演示实验铁与水蒸气反应,掌握铁与水蒸气反应的现象、原理和应用。
【学习过程】环节一:图片展示,引入新课1.铁单质的物理性质铁丝铁锅物质通性特性铁环节二:生活情境,归纳提升[问题2]燕麦中是否真的含有还原铁粉?1.燕麦中的还原铁粉有什么作用吗?2.燕麦中的还原铁粉进入人体后能被胃吸收吗?(用离子方程式解释)有什么作用?[思考·讨论]1.请同学们回顾已学知识,还有哪些物质可与铁反应呢?(写出化学方程式)2.请同学们观察上述化学反应方程式,铁的化合价变化有何异同?3.请同学们思考上述化学中,为什么Fe被氧化成不同价态的产物?4.请同学们概括铁单质氧化为+2价,+3价的条件分别是什么?[总结概括]请同学们依据上述规律,画出铁单质的价类二维图环节三:生产情境,实验探究[问题3]在钢铁冶炼中,炽热的铁水必须注入干燥的模具。
这是为什么呢?是否反应反应物反应条件反应原理情境1 炽热的铁与水情境2 冷的铁与水[类比思维] 活泼金属钠能与水发生反应,生成NaOH和H2[理论推测] Fe与水高温条件下能反应,生成H2和Fe(OH)x[实验探究]铁与水高温条件下的反应[演示实验]请同学们阅读p66[思考与讨论][实验改进]实验内容实验现象实验结论实验原理铁与水高温条件下的反应[总结概括]铁单质的价类二维图【学习效果】一、单项选择题I1.下列关于铁的叙述中错误的是( )A.纯净的铁是光亮的银白色金属B.铁能被磁体吸引C.铁是地壳中含量最多的金属元素D.铁具有延展性和导热性,可制作炊具2.下列说法正确的是( )A.金属首次被使用的年代与金属的性质无关B.自然界中的铁元素只存在于化合物中C.铁能与所有金属的盐溶液反应生成亚铁盐和金属D.高炉炼铁是用还原剂将铁从它的化合物中还原出来3.不能通过两种单质间化合直接得到的是()A.FeS B.NaCl C.H2O D.FeCl24.下列物质中,在一定条件下与铁反应,且铁元素的化合价能变为+3价的是( ) A.氯化铁溶液B.H2O2溶液C.硫酸铜溶液D.稀盐酸5.下列关于铁与水蒸气反应的描述中,不正确的是()A.铁与水蒸气的反应是氧化还原反应B.铁与水蒸气反应的产物是黑色的Fe2O3C.红热的铁能与水蒸气反应,放出的气体点燃时能发生爆鸣声D.常温下,铁与H2O不反应,但在空气中O2、H2O共同作用下能发生反应6.市场上销售的食品包装有很多种,其中一种为真空包装,如香肠、盐水鸭、月饼等食品,抽出包装袋内空气并放入一小包铁粉。
铁的单质温故1铁元素在自然界中主要是以2价和3价化合物的形态存在于矿石中,游离态的单质铁只存在于陨铁中。
铁元素在地壳中的含量仅次于氧、硅和铝,居第4位。
2工业炼铁高炉内的反应原理:Fe2O3+3CO 高温3Fe+3CO2颜色状态密度熔点沸点金属共性特性银白色,有金属光泽固体·cm-31535℃2750℃导热、导电、延展性好能被磁铁吸引注意:铁能导电,但其导电性不如铜和铝。
【例1】2021广东汕头月考下列说法正确的是A我国在战国中期即开始使用铁制品B自然界中的铁元素只存在于化合物中C铁能与所有金属的盐溶液反应生成亚铁盐和金属D高炉炼铁是用还原剂将铁从它的化合物中还原出来【解析】我国目前发现最早的人工冶铁制品是春秋初年秦国的铜柄铁剑,A项错误;自然界中的陨铁中的Fe以单质形态存在,B项错误;Fe只能将金属活动性比它弱的金属从其盐溶液中置换出来,C项错误;高炉炼铁是用CO等还原剂把Fe从铁矿石中还原出来,D项正确。
【答案】D铁的化学性质铁与氧化性较弱的氧化剂如盐酸、硫酸铜等反应,铁原子失去2个电子生成2价铁的化合物;而铁与氧化性较强的氧化剂如氯气等反应,铁原子则失去3个电子生成3价铁的化合物。
【例2】2021 北京西城区期末下列离子方程式书写正确的是A Fe+2H+=Fe3++H2↑B Fe2O3+6H+=2Fe3++3H2OC Fe+Ag+=Fe2++AgD Cl2+2H2O=2H++Cl−+ClO−【解析】Fe与H反应生成Fe2和H2,离子方程式为Fe+2H+=Fe2++H2↑,A项错误;Fe2O3和H反应生成Fe3和H2021子方程式为Fe2O3+6H+=2Fe3++3H2O,B项正确;离子方程式Fe+ 2Ag+=Fe2++2Ag未配平,C项错误;C2和H2021生成强酸HC和弱酸HC0,弱酸不能拆成离子形式,离子方程式为Cl2+2H2O=H++Cl−+HClO,D项错误。
【答案】B【思考】铁丝放入CuSO4溶液、AgNO3溶液中反应的现象分别是什么?【答案】铁丝放人CuSO4溶液中,铁丝的表面附着有一层红色物质,溶液由蓝色变为浅绿色。