靶向哺乳动物细胞线粒体的核酸转运
- 格式:docx
- 大小:45.89 KB
- 文档页数:11

mirna作用原理一、引言mirna(microRNA)是一类长度约为20~24个核苷酸的非编码RNA分子,是细胞内调控基因表达的重要因素。
在哺乳动物中,mirna可通过与mRNA靶标相互作用,调控基因转录、剪接和蛋白翻译等过程。
二、mirna的合成与成熟mirna的合成经历多个步骤,包括转录、成熟和靶标识别等过程。
具体步骤如下:2.1 转录mirna基因位于基因组的非编码区域,与mRNA的转录有所不同。
mirna的转录通常由RNA聚合酶II进行,但其转录起始位点可被辅助序列、转录因子和启动子等调控。
转录后的初始转录物被称为pri-mirna。
2.2 剪接和修饰pri-mirna在细胞核内由核酸酶Drosha切割生成前体mirna(pre-mirna)。
pre-mirna包含一个带有长的发夹结构,该结构可保护mirna序列免受核酸酶RNase的降解。
随后,pre-mirna被转运至胞质。
2.3 Dicer酶的介入在胞质中,pre-mirna被RNase III类酶Dicer切割,生成成熟的双链mirna (mature mirna)。
Dicer酶通过识别pre-mirna的发夹结构,切割出成熟mirna 序列。
2.4 修饰与装配成熟mirna的两个链的两端均会发生修饰,包括磷酸化和甲基化。
此外,成熟mirna还与Argonaute(AGO)蛋白相结合,形成RNA诱导沉默复合物(RISC),以实现靶向调控。
三、mirna的作用机制mirna通过与mRNA靶标相互作用,调控基因表达。
其作用机制主要包括激活RNase 活性和抑制翻译两种方式。
3.1 miRNA结合靶标mRNAmirna通过与mRNA的3’非翻译区(3’ UTR)相互作用,形成RNA复合物。
该相互作用主要通过mirna的5’末端6-7个碱基与mRNA的靶标区域互补配对。
3.2 激活RNase活性当mirna与mRNA结合时,mirna可以作为引导RNA,将RNA诱导沉默复合物(RISC)靠近目标RNA。

备战2024年高考生物易错题(新高考专用)易错点17 生物工程的“四个”不相等(含答案易错点17 生物工程的“四个”不相等目录01 易错陷阱(四大陷阱)02 举一反三【易错点提醒一】脱毒苗≠抗毒苗【易错点提醒二】杂交瘤细胞≠分泌所需抗体【易错点提醒三】卵子受精≠受精完成【易错点提醒四】受体细胞有抗性≠导入重组DNA03 易错题通关易错陷阱1:利用植物组织培养技术培养植物分生区可获得抗毒苗【分析】植物组织培养技术培养植物分生区获得的是脱毒苗,没有抗病毒的能力不是抗毒苗(基因工程可得到)。
易错陷阱2:第一次筛选得到的杂交瘤细胞即可分泌所需的抗体【分析】经过克隆化培养和抗体检测筛选后得到的杂交瘤细胞才能分泌所需抗体。
易错陷阱3:卵子受精就代表受精作用完成【分析】形成两个极体代表卵子受精,常以观察到两个极体或者雌、雄原核作为受精的标志。
易错陷阱4:受体细胞表现抗性就表示导入重组DNA【分析】受体细胞表现抗性也有可能导入空载体。
【易错点提醒一】脱毒苗≠抗毒苗【例1】甘薯由于具有增强免疫功能、防癌抗癌、抗衰老、防止动脉硬化等作用,故越来越被人们喜爱。
但甘薯属于无性繁殖作物,同时又是同源六倍体,具有自交不育和杂交不亲和性,这使甘薯生产和育种存在诸多常规方法难于解决的问题。
下列相关操作不合理的是()A.用于快速繁殖优良品种的植物组织培养技术,可以解决种苗用量大、成本高的问题B.利用茎尖分生组织培养脱毒苗,使植株具备抗病毒的能力,产品质量得到提高C.利用原生质体融合实现体细胞杂交,克服杂交不亲和,可以充分利用遗传资源D.利用培养的愈伤组织进行诱变育种,可以显著提高变异频率,有利于缩短育种年限【变式1-1】下列实例培育过程中应用到植物组织培养技术的是()①制造人工种子②培育抗盐转基因植物③培育抗病毒转基因烟草④培育单倍体A.②③④B.①③④C.①②④D.①②③④【变式1-2】辣椒素作为一种生物碱广泛用于食品保健、医药工业等领域。

肠道微生物组与健康:机制见解摘要:肠道微生物群现在被认为是有助于调节宿主健康的关键元素之一。
几乎所有的身体部位都被微生物定植,这表明与我们的器官存在不同类型的串扰。
由于分子工具和技术(即宏基因组学、代谢组学、脂质组学、宏转录组学)的发展,宿主和不同微生物之间发生的复杂相互作用正在逐步被破译。
如今,肠道微生物群偏差与许多疾病有关,包括肥胖、2 型糖尿病、肝脂肪变性、肠病(IBD)和几种类型的癌症。
因此,表明涉及免疫、能量、脂质和葡萄糖代谢的各种途径受到影响。
在这篇综述中,特别关注对该领域当前理解的批判性评估。
讨论了许多解释肠道细菌如何与保护或疾病发作有因果关系的分子机制。
我们检查了公认的代谢物(即短链脂肪酸、胆汁酸、三甲胺 N-氧化物),并将其扩展到最近确定的分子作用物(即内源性大麻素、生物活性脂质、酚衍生化合物、晚期糖基化终产物和肠联基因)及其特异性受体,如过氧化物酶体增殖物激活受体α (PPARα)和γ (PPARγ)、芳烃受体(AhR)和 G 蛋白偶联受体(即 GPR41、GPR43、GPR119、武田 G 蛋白偶联受体 5)。
总而言之,了解将肠道微生物与健康联系起来的复杂性和分子方面将有助于为已经开发的新疗法奠定基础。
人类肠道微生物组人类微生物组在这里被认为是微生物、它们的基因和产物的集合,它们从出生起就在我们体内定植并垂直转移。
虽然所有身体部位都被定植(图 1),但在肠道中发现的微生物数量最高,这已经得到了广泛的研究。
在这里,我们回顾了解决肠道微生物、其活性和介质分子如何促进我们健康的主要和最新发现。
图 1 根据不同身体部位的细菌总丰度。
不同器官中细菌数的边界,由细菌浓度和体积得出。
在健康受试者中,口腔和唾液微生物组包含数百万种微生物,这些微生物每天与我们的食物一起吞咽,但它们在肠道中的持久性受到许多因素的阻碍,包括胃的酸度、十二指肠内外胆汁酸(BA)的产生、消化酶和抗菌蛋白许多其他主要变量会影响进一步的下游微生物定植,例如 pH 值、氧浓度和氧化还原电位等化学参数、粘液、胆汁和抗体的生物产生,以及物理方面,包括肠道结构、蠕动和转运时间(图 1)。

靶向Bcl-2、Bcl-xl、Mcl-1、Bcl-w、A1反义核酸抑制消化系肿瘤细胞增殖效果的差异蒋建伟;吴风云;何金花;廖晓莉;王威;吴志慧【摘要】目的比较靶向Bcl-2、Bcl-xl、Mcl-1、Bcl-w、A1反义核酸(antisense oligodeoxynucleotide,ASO)对消化系统肿瘤细胞(肝癌HepG2细胞、胃癌MGC-803细胞、结肠癌Lovo细胞)的增殖抑制作用和致凋亡作用的差异.方法分别合成靶向Bcl-2、Bcl-xl、Mcl-1、Bcl-w、A1的反义核酸和随机序列反义核酸(random oligodeoxynucleotide,RODN),采用脂质体LipofectamineTM2000转染细胞,WST法检测相同浓度的5种ASOs对肝癌HepG2细胞、胃癌MGC-803细胞、结肠癌Lovo细胞的增殖抑制作用和致凋亡作用.结果 Bcl-2、Bcl-xl、Mcl-1、Bcl-w、A1等5种ASOs中,不论是对细胞增殖抑制还是致凋亡作用,均以Bcl-xl ASO、Mcl-1 ASO的作用效果较好.结论在Bcl-2、Bcl-xl、Mcl-1、Bcl-w、A1等5种ASOs中,Bcl-xl ASO、Mcl-1 ASO可明显抑制消化系肿瘤细胞增殖,诱导细胞凋亡.【期刊名称】《中国药理学通报》【年(卷),期】2010(026)008【总页数】6页(P1093-1098)【关键词】反义核酸;Bcl-2;Bcl-xl;Mcl-1;增殖;凋亡;肿瘤细胞【作者】蒋建伟;吴风云;何金花;廖晓莉;王威;吴志慧【作者单位】暨南大学医学院生化教研室,广东,广州,510630;暨南大学医学院生化教研室,广东,广州,510630;浙江省温州市平阳县人民医院,浙江,温州,325400;暨南大学医学院生化教研室,广东,广州,510630;广东省广州市番禺区中心医院检验科,广东,广州,511440;暨南大学医学院生化教研室,广东,广州,510630;暨南大学医学院生化教研室,广东,广州,510630;暨南大学医学院生化教研室,广东,广州,510630【正文语种】中文【中图分类】R329.24;R329.25;R735.022线粒体相关的细胞凋亡途径通过Bcl-2家族蛋白的调节。

细胞内蛋白质定位和转运机制细胞内蛋白质定位和转运机制是细胞内重要的生物学过程,它们维持了细胞的正常功能并参与了各种生物学活动。
本文将从细胞内蛋白质定位的基本原理、信号序列和定位机制以及蛋白质的转运机制等方面进行探讨。
一、细胞内蛋白质定位的基本原理细胞内蛋白质定位是指将蛋白质定向到细胞内特定的亚细胞结构或位置。
这一过程是通过特定的信号序列和机制实现的。
蛋白质定位的基本原理可以概括为两大类:靶向和扩散。
靶向是指蛋白质在合成过程中通过与一些特定的蛋白质或结构发生相互作用,从而被定向到细胞内的特定位置。
例如,细胞内的Golgi体是一个重要的分泌细胞器,某些蛋白质通过与Golgi体中的转运蛋白相互作用,从而被定位到Golgi体。
扩散是指蛋白质在合成过程中通过不断的扩散和分布,最终到达细胞内的特定位置。
这种定位机制主要依赖于蛋白质的物理和化学性质,以及细胞内各种蛋白质相互作用的平衡。
例如,细胞内水溶性蛋白质通过扩散和分布到达到达核内。
二、信号序列和定位机制在蛋白质的定位过程中,信号序列起到了非常重要的作用。
信号序列是蛋白质分子上的某一特定的氨基酸序列,它能够指导蛋白质被定位到特定的亚细胞结构或位置。
信号序列可以分为靶向信号序列和细胞内定位信号序列。
靶向信号序列通常位于蛋白质分子起始处,它能够与特定的蛋白质或结构发生相互作用,从而将蛋白质定向到细胞内的某个结构或位置。
细胞内定位信号序列通常位于蛋白质的内部,它能够改变蛋白质的物理和化学性质,从而影响蛋白质的定位。
蛋白质的定位机制可以分为几种类型:核定位、细胞质定位、内质网定位、线粒体定位、高尔基体定位等。
不同类型的定位机制通常与不同的信号序列和作用蛋白有关。
例如,核定位的信号序列通常富含正电荷氨基酸,而线粒体定位的信号序列则富含氨基酸序列(R-X-X-R)。
三、蛋白质的转运机制蛋白质定位到细胞内的特定位置后,往往需要通过转运机制到达目标位置。
蛋白质的转运可以分为受体介导转运和核孔复合物介导转运两种方式。

PHB2(Prohibitin 2)在线粒体中的研究进展董艳博;冯红【摘要】PHB2是真核细胞的一种在进化过程中高度保守的蛋白质,参与细胞的多种生命活动.有研究表明PHB2参与细胞周期的调节、转录调节、细胞增殖和凋亡、线粒体嵴形态的发生、信号转导等多种细胞过程.它广泛表达,分布于酵母、植物、蠕虫、苍蝇、哺乳动物等物种中,并且PHB2蛋白质是以复合物的形式定位于线粒体上.PHB2主要作为线粒体内膜的自噬受体,参与靶向线粒体的自噬和降解.研究综合了国内外的文献,对PHB2的功能,结构及表达进行阐述,为进一步研究PHB2蛋白质的功能提供了基础.【期刊名称】《天津科技》【年(卷),期】2018(045)001【总页数】4页(P36-39)【关键词】PHB2;线粒体;功能结构【作者】董艳博;冯红【作者单位】天津体育学院健康与运动科学系天津300381;天津体育学院健康与运动科学系天津300381【正文语种】中文【中图分类】Q4130 引言PHB首先作为细胞增殖的抑制剂而被发现,它的结构相当保守且普遍存在[1]。
其广泛分布于哺乳动物、原虫、植物、细菌以及真菌等生物体中。
人类基因组编码两种 PHB蛋白质,即 prohibitin 1(PHB1)和prohibitin 2(PHB2),phb1基因位于染色体17q21上,phb2基因位于染色体 12p13上[2]。
有研究表明,PHB1和PHB2的复合物是维持线粒体的功能所必需的,该复合物组成了一个环状大分子结构,在不同的细胞过程(如细胞周期进程和衰老)以及许多疾病(如肥胖,糖尿病和癌症等)中都发挥着重要作用(见图1)[3]。
1 PHB2的结构PHB2最初是由 Terashima及其同事们发现的,因与大鼠 B淋巴细胞的 IgM 受体(Immunoglobulin M receptor,免疫球蛋白质受体)相互作用而被命名为BAP37[4]。
PHB2蛋白质的氨基端有一段疏水区域,该区域将PHB2固定在膜上;羧基端含有一个保守的PHB结构域和一个可预测的螺旋区域,在酵母细胞中该区域与 PHB蛋白质复合物的合成密切相关[5]。

非编码RNA的研究与应用在近几十年的生命科学研究中,DNA和蛋白质一直是研究的重点,因为它们是生命体内最重要的两种分子。
但是,在过去的几十年中,随着RNA研究的深入,人们逐渐发现了RNA在生命过程中的重要性。
RNA通过转录和转录后修饰的方式,在细胞的生命活动中扮演着重要的角色。
近些年来,非编码RNA在RNA家族中引起了越来越多的关注。
非编码RNA的定义非编码RNA是指不参与编码蛋白质的RNA。
它们通常具有重要的生物学功能,包括转录调控、RNA剪切调控、蛋白质翻译调控以及RNA沉默等。
尽管非编码RNA在生命活动中扮演着重要的角色,但是长期以来它们一直被忽视或被认为只是某些细胞过程中附带存在的“垃圾”分子。
种类和功能非编码RNA通常可以分为两类:小的非编码RNA和长的非编码RNA。
小的非编码RNA的长度通常在20-30个核苷酸之间,包括RNA干扰RNA(siRNA)、微小RNA(miRNA)、piwi相关RNA(piRNA)和转运RNA(tRNA)等。
长的非编码RNA的长度通常超过200个核苷酸,包括长链非编码RNA(lncRNA)、circRNA(循环RNA)和snRNA(小核RNA)等。
siRNA是由双链RNA剪切后形成的小分子,它们主要通过靶向mRNA的特定区域,通过RNA序列匹配的方式降低转录和翻译活动。
miRNA是由小的非编码RNA构成的,它们在靶向mRNA以降低转录和翻译活动方面也发挥着重要的作用。
piRNA 主要存在于生殖细胞中,它们参与着细胞分裂和DNA修复等生命过程。
tRNA参与了蛋白质合成的过程,是细胞中蛋白质翻译的重要组成成分。
lncRNA是长链非编码RNA,它们在转录和表观遗传调控方面发挥着重要的作用。
circRNA是一类特殊的长链非编码RNA,它们通过形成循环结构维护其稳定性。
snRNA是小核RNA,在基因剪接、核糖体RNA组装以及mRNA剪切等生物过程中发挥重要作用。
非编码RNA的研究进展近年来,随着生物学研究的不断深入,越来越多的关于非编码RNA的研究也相继浮出水面。


线粒体靶向肽的原理
线粒体靶向肽的原理是通过特异性靶向线粒体,并进入线粒体内部实现对线粒体的调控和影响。
线粒体靶向肽通常是由特定的氨基酸序列组成,这些氨基酸序列具有线粒体靶向蛋白的识别和结合能力。
这些靶向肽可以通过不同的途径进入细胞,例如透皮吸收、细胞内摄入或转染等方式。
一旦进入细胞,并成功进入线粒体内部,线粒体靶向肽可以与特定的线粒体蛋白发生相互作用,从而实现对线粒体功能的调控和影响。
这些作用可以包括促进线粒体内物质的转运、调节线粒体内物质的合成、影响线粒体的膜电位等。
线粒体靶向肽的应用广泛,可以用于治疗线粒体疾病、改善线粒体功能、增强细胞活力等。
此外,线粒体靶向肽还可以用于药物载体,将药物有针对性地传递到线粒体内部,提高治疗效果。
同时,线粒体靶向肽还具有较低的细胞毒性,对正常细胞的影响较小,因此具有较好的治疗前景。

药物在特定细胞器中的靶向作用研究在药物研究领域中,了解药物在特定细胞器中的靶向作用是至关重要的。
通过研究药物在细胞器内的作用机制和相互作用,可以帮助我们更好地理解药物的药效学,并为开发新型药物提供指导。
本文将探讨药物在特定细胞器中的靶向作用的研究进展和应用前景。
细胞器是细胞内进行各种生化反应和功能的特定结构。
其中,核、线粒体、内质网、高尔基体等是药物的主要靶标。
通过发挥作用于特定细胞器的药物,可以调控细胞的生理和病理过程。
一、药物在核内的靶向作用研究核内是细胞的遗传物质DNA的存储和复制所在地,是细胞的控制中心。
研究发现,一些抗癌药物可以通过作用于核内的靶标来发挥治疗作用。
比如,顺铂是一种常用的抗癌药物,其通过与DNA结合形成DNA加合物,从而阻碍DNA的复制和转录过程,造成肿瘤细胞死亡。
二、药物在线粒体中的靶向作用研究线粒体是细胞内能量代谢的中心,也是氧化应激的主要发生地。
一些药物可以选择性地作用于线粒体内的特定蛋白,从而发挥治疗作用。
例如,抗氧化剂CoQ10可以提供线粒体所需的辅酶Q10,增强线粒体的功能,减轻氧化应激导致的细胞损伤。
三、药物在内质网中的靶向作用研究内质网是细胞内蛋白质合成和折叠的主要场所,它与细胞的应激响应密切相关。
一些药物可以通过干扰内质网的功能来发挥治疗作用。
例如,一种名为特立尼泊的药物可以抑制内质网中的蛋白质合成,从而诱导肿瘤细胞凋亡。
四、药物在高尔基体中的靶向作用研究高尔基体是细胞内负责蛋白质运输和修饰的重要细胞器。
一些药物可以通过作用于高尔基体的特定酶类蛋白,干扰蛋白质的糖基化和修饰过程,从而影响细胞的功能和信号转导。
例如,一种名为调节酶I型蛋白激酶(GlcNAcI)的抑制剂可以选择性地作用于高尔基体中的糖基化酶,从而影响细胞的黏附和迁移过程。
综上所述,药物在特定细胞器中的靶向作用研究对于深化我们对药物药效学的理解和指导新型药物的研发具有重要意义。
未来,随着技术的不断进步,我们可以更加精确地研究药物在特定细胞器中的作用机制,利用这一知识为药物的设计和合成提供更多的可能性,为临床治疗带来更多的选择和希望。
针已应用于细胞成像。
细胞成像使人们能够更加深入地了解亚细胞结构(如:溶酶体和线粒体),为人们更好地了解与pH 有关的生理和病理过程提供了一种可能。
近两年来,已经开发出了溶酶体和线粒体靶向的pH 可激活的荧光探针。
在这篇评论中,我们总结了已报道的两种pH 荧光探针并探讨了它们的结构设计、识别机理以及生物学应用。
3 溶酶体靶向的pH 可激活荧光探针溶酶体是真核细胞具有的膜结合囊泡。
在解离状态下两亲性小分子能够渗透溶酶体膜,但质子化后在酸性溶酶体中不渗透。
一般来说,在荧光探针分子中引入二甲基氨基,氰基和吗啉的结构用于溶酶体定位。
接下来,我们将讨论最近刚刚报道的基于吗啉基团的溶酶体靶向pH 可激活荧光探针。
课题组设计了探针1[10](如图1所示),该探针以吗啉为溶酶体靶向单元,罗丹明B 为荧光团,具有独特的五元螺环,在中性和碱性pH 值下,螺环封闭,罗丹明B 几乎不发荧光;在酸性条件下螺环打开时,会发出强烈的红色荧光。
此外,探针1还有具有良好的光物理特性,极好的光稳定性以及低细胞毒性,因而探针1适用于活细胞成像。
pH 滴定研究表明探针1在590 nm 处,出现荧光增强。
在pH 范围5.00~6.00之间,pH 与荧光强度具有良好的线性关系,其pKa 值为5.42,适用于溶酶体pH0 引言水合氢离子是生物系统中具有关键作用的物种。
在生物体中细胞、体液、器官中的酸碱稳态与很多生物过程有关,如:细胞的增殖与凋亡、内吞作用、离子转运等[1-2]。
哺乳动物的细胞内pH 的范围从4.5(溶酶体)到8.0(线粒体)。
1 溶酶体和线粒体pH 值对细胞生物过程的重要意义溶酶体是细胞中的“消化车间”,含有多种水解酶,可以降解大多数生物分子[3-4]。
在酸性环境中,pH 在4.5~5.5的范围内水解酶保持最佳的生物活性以进行消化和降解。
对于癌细胞而言,细胞质和溶酶体中的pH 值均低于正常细胞[5]。
溶酶体中pH 值的变化[6]可反映细胞状态和代谢过程。
• 80•医学研究生学报2021年1月第34卷第1期J Pcw tgm.V oU t N o.l, January, 2021综述L R P P R C蛋白与人类恶性肿瘤发生发展的关系李素芬,李彬,余敏综述,熊伟审校[摘要]富含亮氨酸的五肽重复序列(PPR)基序蛋白(LRPPRC)在人类肝癌细胞HePG2中被首次鉴定,其主要定位于 细胞外核膜、内核膜、核质、内质网、细胞骨架和线粒体。
LRPPRC是一种具有多功能的蛋白质,可以调节细胞能量代谢、参与 核编码mRNA的成熟以及调控信号转导通路。
LRPPRC蛋白的表达水平与多种人类恶性肿瘤的发生发展密切有关。
文章主 要综述LRPPRC蛋白的结构、功能及其与人类恶性肿瘤发生发展的关系,并进一步探讨LRPPRC蛋白在恶性肿瘤研究中的应 用前景,为恶性肿瘤的临床诊断与治疗提供理论基础和参考依据。
[关键词]LRPPRC蛋白;蛋白结构;能量代谢;恶性肿瘤[中图分类号]R73 [文献标志码] A [文章编号]1008-8199(2021)01-0080-06[D O I] 10.16571/ki. 1008-8199.2021.01.015Relation between LRPPRC and the occurrence and development of malignant tumorsLI Su-fen1, L I Bin1 , YU Min2reviewing,XIONG Wei1checking(Department o f Biochemistry and Molecular B iology, School o f Basic Medical Sciences/Key Laboratory o f Clinical Biochemistry o f Yunnan Province ^School o f Basic Medical Sciences, Dali University ^Dali671000, Yunnan, China;2. Laboratory o f Biochemistry and Molecular B iology, School o f Life Sciences, Yunnan University, Kunming650091, Yunnan, China)[A bstract ] LRPPRC is located in the extracellular nuclear membrane, inner nuclear membrane, nucleoplasm, endoplasmic reticulum, cytoskeleton and mitochondria, and was first identified as a leucine-rich pentapeptide repeat sequence (PPR) motif protein in HepG2 cells. LRPPRC is a multifunctional protein that can regulate energy metabol-ism, participate in the maturation of nuclear-en- coded mRNA, and regulate signal transduction pathways. Recent studies have reported that the expression level of LRPPRC is related to malignant tumors. This article mainly reviews the structure and function of LRPPRC, and the relation between LRPPRC and the occurrence and de-velopment of malignant tumors, and further explores the application prospects of LRPPRC in the study of malignant tumors, laying a theoretical foundation for the clinical diagnosis and treatment of malignant tumors.[Key words ] LRPPRC protein;protein structure;energy metabolism;malignant tumor〇引 言三角状五肤重复(pentatricopeptide repeat, P P R)蛋白是一类广泛存在于真核生物中含有35个 氨基酸的简单重复基序的R N A结合蛋白质,这类蛋基金项目:国家自然科学基金(31601155,31760331)作者单位:671000大理,大理大学基础医学院生物化学与分子生物学教研室、云南省高校临床生物化学检验重点实验室[李素芬(医学硕士研究生)、李彬、熊伟];650091昆明,云南大学生命科学学院生物化学与分子生物学实验室(余敏)通信作者:熊伟,E-m ail: *****************.cn 白主要参与基因的转录、转录后加工、RNA稳定性、RNA编辑及翻译过程。
线粒体蛋⽩转运 构成线粒体的蛋⽩主要是核基因编码的,少量是线粒体基因编码的,⽆论是核基因还是线粒体基因编码的蛋⽩质都要转运定位。
线粒体有四个组成部分,其中有两层膜,所以由细胞质核糖体合成的蛋⽩质转运到线粒体基质必须穿过两层膜障碍。
■线粒体基质蛋⽩(mitochondrial matrix protein)转运 线粒体基质蛋⽩,除极少数外,都是游离核糖体合成,并通过转运肽转运进来的,转运过程⼗分复杂。
■线粒体膜间隙蛋⽩的转运 线粒体膜间隙蛋⽩,如细胞⾊素c的定位需要两个导向序列,位于N端最前⾯的为基质导向序列(matrix-targeting sequence),其后还有第⼆个导向序列,即膜间隙导向序列(intermembrane-space-targeting sequence),功能是将蛋⽩质定位于内膜或膜间隙,这类蛋⽩有两种转运定位⽅式。
●保守性寻靶(conservative targeting)前体蛋⽩在N-端的基质导向序列引导下采⽤与线粒体基质蛋⽩同样的运输⽅式,将前体蛋⽩转运到线粒体基质,在基质中由转肽酶切除基质导向序列后,膜间隙导向序列就成了N端的导向序列,它能够识别内膜的受体和转运通道蛋⽩,引导蛋⽩质穿过内膜,进⼊线粒体膜间隙,然后由线粒体膜间隙中的转肽酶将膜间隙导向序列切除。
●⾮保守性寻靶(nonconservative targeting) 与保守性寻靶不同,蛋⽩质的⾮保守性寻靶⾸先在线粒体基质导向序列的引导下,通过线粒体的外膜和内膜,但是疏⽔的膜间隙导向序列作为停⽌转运序列(stop-transfer sequence)锚定在内膜上,从⽽阻⽌了蛋⽩质的C-末端穿过内膜进⼊线粒体基质;然后通过蛋⽩质的扩散作⽤,锚定在内膜上的蛋⽩逐渐离开转运通道,最后在转肽酶的作⽤下,将膜间隙导向序列切除,蛋⽩质释放到膜间隙,结合⾎红素后,蛋⽩质折叠成正确的构型。
■线粒体内膜和外膜蛋⽩的转运 图7-17显⽰线粒体内膜蛋⽩的N-端只有⼀个基质导向序列,内膜蛋⽩在基质导向序列的引导下,按基质蛋⽩的转运⽅式进⼊线粒体基质后,由转肽酶切除导向序列,然后通过构型的变化或与别的蛋⽩结合形成复合物后再插⼊到内膜中,详细机理尚不清楚。
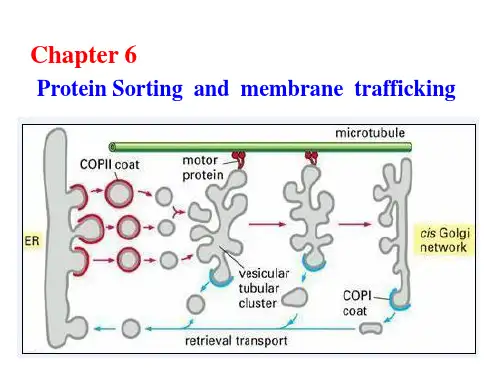
第十章细胞内蛋白质的分选和运输一个哺乳动物细胞含有近1万种、约1010个蛋白质分子。
除了少数蛋白质在线粒体核糖体上合成外,绝大部分蛋白质是由细胞核DNA编码、并在细胞质基质的核糖体上合成的。
蛋白质在细胞质基质中合成后,按其氨基酸序列中分选信号(sorting signal)的有无以及分选信号的性质被选择性地送到细胞的不同部位,这一过程称为蛋白质分选(protein sorting)和蛋白质靶向运输(protein targeting)。
另外,细胞外的蛋白质经胞吞作用进入细胞内部,也经历分选和靶向运输过程。
细胞中每一种蛋白质只有到达正确的位置才能行使其功能,例如激素受体必须进入细胞膜中才能识别相应的激素;RNA和DNA聚合酶必须送到细胞核中才能参与核酸的合成;酸性水解酶必须送到溶酶体才能进行大分子的降解作用。
因此,细胞内蛋白质的分选和运输对于维持细胞的结构与功能、完成各种细胞生命活动都是非常重要的。
第一节细胞内蛋白质的分选信号以及运输途径和方式细胞内各种蛋白质能够有条不紊地被运送到各自的目的地,关键是蛋白质在合成时带有分选信号,就象行李上贴上标笺一样注明了要到达的目的地,而在目的地有着能识别分选信号的受体,分选信号与相应受体的特异结合就引导蛋白质到达细胞的特定部位。
细胞内蛋白质的分选和靶向运输常常是多步骤的,有时要经过多次分选和运输才能完成。
目的地不一样,蛋白质运输的途径和方式也不一样。
一、信号假说和分选信号在20世纪70年代初有一个著名的实验:在体外无细胞系统中进行由mRNA编码的分泌蛋白在核糖体上合成,当合成系统中有微粒体存在时,所合成的蛋白质与体内合成的相同;如果在合成系统中去除微粒体,合成蛋白质的N-末端会多出一段短肽。
基于这一实验,1975年Blobel等人提出了信号假说(signal hypothesis),即在新合成蛋白质的N-末端有一段信号序列,称为信号肽(signal peptide),其作用是引导多肽链在合成过程中到内质网膜上,并在内质网中完成蛋白质的合成,而信号肽本身则在蛋白质合成完成前被内质网内的信号肽酶切除(图10-1)。
基因编辑在线粒体疾病中的应用
常丽颖;凌鑫宇;陈和祺;王雪;刘涛
【期刊名称】《高等学校化学学报》
【年(卷),期】2023(44)3
【摘要】线粒体作为细胞的能量工厂,在维持细胞能量代谢与人类生命活动中发挥着至关重要的作用.线粒体基因组的突变会导致一系列线粒体遗传代谢疾病的发生,严重威胁人类生命健康,发展靶向线粒体的基因编辑手段对于线粒体疾病的治疗具有重要意义.近年来,以限制性核酸酶、锌指核酸酶、转录激活因子样效应核酸酶、规律成簇的间隔短回文重复序列(CRISPR)以及碱基编辑器为代表的一系列基因编辑方法迅速发展.本文综合评述了基因编辑工具应用于哺乳动物细胞的线粒体DNA 的研究进展、不足和发展方向,以期为线粒体疾病治疗技术的开发提供参考.
【总页数】11页(P70-80)
【作者】常丽颖;凌鑫宇;陈和祺;王雪;刘涛
【作者单位】北京大学药学院;北京大学化学生物学交叉中心;北京大学药学院分子与细胞药理学系
【正文语种】中文
【中图分类】O629.74
【相关文献】
1.CRISPR-Cas9基因编辑技术在眼科疾病中的应用
2.CRISPR基因编辑技术及其在眼科疾病中的应用进展
3.CRISPR/Cas基因编辑技术在动物DNA病毒病中应用的研究进展
4.RNA治疗和基因编辑技术在肝脏疾病中的应用
因版权原因,仅展示原文概要,查看原文内容请购买。
大学细胞生物学考试练习题及答案91.[单选题]( )不是细胞表面受体。
A)离子通道B)酶联受体C)G蛋白偶联受体D)核受体答案:D解析:2.[单选题]下列选项中有关核被膜结构的叙述错误的是( ):A)双层核膜互相平行但不连续B)外核被膜可以看作是粗面内质网的一个特化区域C)内核膜无核糖体颗粒附着,但在其外表面有一层致密的纤维网络结构,即核纤层D)内核膜上有核纤层蛋白B受体答案:C解析:3.[单选题]关于核孔复合体的运输错误的是( )。
[军事医学科学院2006研]A)分为主动运输和被动运输B)主动运输和被动运输都需要核定位序列C)主动运输的有效孔径比被动运输大D)小GTP酶Ran在核质间穿梭答案:B解析:入核的被动运输不需要核定位信号,但其分子量要足够小。
4.[单选题]细胞分化过程中,基因表达的调节主要是( )水平的调节A)复制B)转录C)翻译D)翻译后答案:B解析:5.[单选题]有丝分裂时染色体趋向两极是由( )牵引的。
A)微管B)微丝C)中间纤维D)胶原纤维E. 应力纤维6.[单选题]下列细胞结构中,在光镜下不能观察到的是( )A)细胞骨架B)高尔基复合体C)核糖体D)中心体答案:C解析:7.[单选题]在下列DNA二级结构构型中,是左手螺旋的是( ):A)Z构型B)C构型C)B构型D)A构型答案:A解析:8.[单选题]关于细胞膜上糖类的不正确的叙述是 ( )A)质膜中糖类主要分布在膜的外表面B)主要以糖蛋白和糖脂的形式存在C)糖蛋白和糖脂上的低聚糖侧链从膜的胞质面伸出D)糖蛋白中的糖链对蛋白质及膜的性质影响很大答案:C解析:9.[单选题]细胞分化最主要的原因是( )A)染色体的选择性表达B)基因重排C)不同奢侈基因的选择表达D)不同管家基因的选择表达答案:C解析:10.[单选题]下列哪种结构不参与高尔基复合体的组成( )A)扁平囊B)小囊泡C)大囊泡D)微粒体答案:D解析:A)参与染色体的构建B)染色体的定位C)启动基因复制D)调控基因转录答案:B解析:12.[单选题]细胞通过细胞周期中的限制点(R点,哺乳动物中)时,( )A)DNA开始复制B)RNA开始转录C)蛋白质开始合成D)细胞进入有丝分裂期(M期)答案:A解析:13.[单选题]以下( )感觉不是由G蛋白偶联型受体介导的A)听觉B)味觉C)视觉D)嗅觉答案:A解析:14.[单选题]癌细胞的主要特点之一是( )。
靶向哺乳动物细胞线粒体的核酸转运付爱玲【摘要】Mitochondrial DNA (mtDNA)genome mutations and defects are the essential mechanism of a various of mitochondrial dysfunction associated with diseases. The studies of targeting de-livery nucleic acid into mammalian mitochondria can thoroughly correct mtDNA mutation, rescue mtDNA impairment and then reverse the progress of diseases. There’s obvious differences be-tween nucleic acid import pathway of mammalian mitochondria and gene transfection of nuclei. In this paper, the effective strat-egies of delivering DNA and RNA(tRNA,rRNA,mRNA and an-tisense RNA)into mitochondria have been reviewed, as well as the challenges and development.%线粒体 DNA(mitochondrial DNA, mtDNA)的遗传性突变和缺陷是多种线粒体功能失调相关疾病的根本原因。
靶向线粒体递送核酸,可从根本上纠正 mtDNA 突变、挽救 mtD-NA 损伤、阻断疾病进程。
哺乳细胞内线粒体的核酸转运途径与细胞核的基因转染大不相同。
该文综述了向哺乳动物细胞线粒体递送 DNA 和 RNA(tRNA、rRNA、mRNA 和反义RNA)的有效策略,并对其存在问题和发展趋势做一阐述。
【期刊名称】《中国药理学通报》【年(卷),期】2016(000)001【总页数】4页(P1-4)【关键词】线粒体转导;靶向序列;核酸转运;线粒体相关疾病;tRNA 载体;5s rRNA转导;穿梭蛋白【作者】付爱玲【作者单位】西南大学药学院,重庆 400716【正文语种】中文【中图分类】R-05;R329.24;R342.2;R342.3;R589.9;R977.6中国图书分类号: R-05; R329. 24; R342. 2; R342. 3; R589. 9; R977. 6线粒体是哺乳动物中唯一具有核外DNA的细胞器,它保留着自身完整的一套遗传系统,为氧化磷酸化相关复合物的生成提供必需的多肽和蛋白质。
哺乳动物线粒体DNA ( mitochondrial DNA,mtDNA)长度为16.5 kbp,共编码13个与氧化磷酸化有关的多肽和蛋白质、22个tRNA和2个rRNA,不包含基因间隔区和内含子[1]。
哺乳动物mtDNA突变显然对宿主细胞有明显的不良影响,并且大量的事实已证明线粒体基因组突变是引发多种疾病的主要原因[2]:在人类mtDNA中,已确定超过300个突变与疾病的发生有关( http: / /www.mitomap.org),如神经和肌肉退行性病变、心肌疾病、肿瘤、糖尿病和病理性衰老等[3]。
常见的突变包括编码蛋白的基因反义突变、tRNA和rRNA基因点突变、基因复制或删除等等[4]。
一般认为,当野生型和突变的mtDNA的比例达到一定的阈值时,就会出现临床症状[5]。
靶向线粒体基因组的核酸转运是治疗线粒体疾病的一个有效方法。
线粒体进行DNA转染的主要困难是它的双层膜、体积小、数量大。
为避开线粒体转染的难题,人们曾尝试间接蛋白质转导这一替代方法:通过质粒或病毒转染细胞,使细胞核表达由于mtDNA致病突变而缺乏的蛋白质,再经线粒体靶向序列将表达的蛋白质运输到线粒体[6]。
尽管这一间接方法可能会得到令人鼓舞的结果,向线粒体递送核酸可从根本上纠正mtDNA突变、挽救mtDNA损伤、阻断疾病进程。
已建立的方法主要有线粒体转导、载体介导、靶向肽或靶向序列引导、穿梭蛋白介导核酸进入细胞线粒体;此外,将外源RNA插入rRNA或tRNA中,根据线粒体对胞质内RNA的摄取作用,可将外源的RNA转运至线粒体内( Fig 1)。
向线粒体内转运核酸仍处于当今研究的前沿。
1.1整个线粒体转导在正常状态下,哺乳动物和植物细胞的线粒体极少从胞质中直接摄取DNA,因此常规的细胞转染方法不能使DNA进入线粒体。
而单细胞生物酵母和莱茵衣藻不同,它们的线粒体可从胞质中摄取少量的DNA。
在早期的研究中,Clark等[7]将分离的线粒体( mtDNA中含有抗生素耐受性序列)与哺乳细胞共孵育,得到了抗生素耐受性的细胞,表明分离纯化的线粒体可直接被细胞内吞,并在胞质中发挥作用,从而使原本对抗生素敏感的细胞对抗生素产生了耐受性。
然而,在以后的25年内,一直没有人关注这个发现。
直至Katrangi 等[8]报道了将分离的正常线粒体与去除线粒体的人A549肺癌细胞一起孵育,正常线粒体被细胞所摄取,从而恢复了细胞的呼吸链。
在最近的报道中,为提高线粒体进入细胞的效率,将细胞穿透肽Pep-1连接到分离的野生型线粒体(活力约为83. 5%)表面,加入到肌阵挛性癫痫伴蓬毛样红纤维综合症病人的细胞中,结果显示在给予线粒体3 d后,细胞的线粒体功能得到了恢复,包括恢复了氧化磷酸化亚单位(复合物Ⅰ、Ⅲ和Ⅳ)的活性、线粒体膜电位和ATP的生成量,同时降低了活性氧自由基的产生[9]。
此外,将外源线粒体显微注射到细胞内,可导致外源线粒体快速取代细胞自身的线粒体。
这个方法可用于改善受精卵线粒体功能的研究。
由于哺乳动物的受精卵线粒体来源于母系,母系线粒体中的遗传突变将传递给下一代,因此线粒体替代的方法可能会对母系遗传疾病有一定的治疗作用。
研究表明,将分离的线粒体显微注射到小鼠受精卵中,在胚胎发育的第一阶段可检测到外源线粒体和mtDNA[10-11],然而,随后其水平大幅下降,其机制尚不清楚。
1.2重组DNA的线粒体转导在验证外源线粒体替代的同时,研究还发现了线性DNA可直接进入分离的线粒体。
在缺乏任何人工手段下,线状的裸DNA可主动进入分离的植物、动物和真菌线粒体中[12]。
此外,外源DNA进入线粒体后,可进行转录和表达,并且一些损伤的DNA在进入植物和动物线粒体后也可被修复。
已知细胞核基因组在细胞DNA转染时,对DNA的序列和长度有所限制,但分离的人线粒体对线性DNA的长度和序列无选择性。
环状DNA(质粒)可通过电穿孔的方式进入线粒体。
在生理条件下,电穿孔可引发哺乳动物、原生生物或植物中分离的线粒体对DNA的摄取。
Yoon等[13]将来源于大肠杆菌的DNA中增加了一个转导起始区( origin of transfer,oriT)序列,然后将其转染入分离的线粒体,当把线粒体与活细胞孵育后,重组的DNA可在活细胞的线粒体内进行表达。
此外,有人在无复制性的大肠杆菌中构建哺乳动物的全部mtDNA,将这种含有mtDNA的大肠杆菌介导至体外培养的哺乳动物细胞质中,使克隆的mtDNA与细胞本身的线粒体mtDNA对接。
这种由大肠杆菌介导的mtDNA重组的方法也能得到设计的mtDNA[14]。
1.3线粒体靶向序列引导DNA进入向线粒体与整个线粒体转导的研究相反,通过线粒体靶向序列或靶向肽将DNA转运进入线粒体,这些研究开展较早、进展较快,并仍在持续进行。
已知由细胞核指导的线粒体前体蛋白在合成后,在N末端带有线粒体靶向序列。
该序列通过线粒体的蛋白导入途径,引导蛋白质进入线粒体。
常用的线粒体靶向序列有细胞色素氧化酶亚基8前体蛋白N末端的23个氨基酸( MSVLTPLLLRGLTGSARRLPVPR)等[15]。
线粒体靶向序列也可引导其他分子(核酸、纳米颗粒、脂质体)等进入线粒体。
将线粒体靶向肽的N末端与17个或322个碱基对的DNA回文序列连接,连接物也可进入分离的大鼠肝线粒体中。
在另外的体系中,线粒体靶向肽与肽核酸的一个片段连接,复合物可进入分离的哺乳动物细胞线粒体中。
近期研究表明,线粒体靶向肽与结合DNA的PEI偶联,多肽/PEI/ DNA复合物可定位在活细胞的线粒体[16]。
然而,该方法存在的问题是DNA与多肽的连接物不易合成,且易于水解,此外,线粒体靶向序列引导其他物质虽然可进入线粒体,但可能难以通透细胞膜,因此,需其他有效的途径弥补这个方法的缺陷。
为解决线粒体靶向序列与DNA的连接物可能难以进入细胞的问题,进一步开发了“转导载体”复合物。
该复合物包含了细胞穿透肽[17-18]、线粒体靶向肽和线粒体转录因子A( TFAM)或mtDNA结合因子。
其中后者可与DNA非共价结合,细胞穿透肽引导复合物进入细胞。
而线粒体靶向肽引导复合物进入线粒体。
这个复合物曾用于向帕金森病模型细胞的线粒体运送DNA,结果表明转导载体和DNA的共定位于线粒体,并阻断了线粒体损伤[19]。
此外,使用转导载体将正常的mtDNA运输进含有突变mtDNA的人类细胞,线粒体的功能可部分恢复。
如果通过转导载体将致病的mtDNA介导入人神经祖细胞,外源致病的mtDNA也可在线粒体中表达。
1.4纳米载体介导DNA进入线粒体设计的非阳离子脂质体载体MITO-porter能够用于向线粒体输送DNA[20]。
MITO-porter是一个内核含有运输的药物,外层分别为线粒体融合层和内吞体融合层的纳米颗粒。
MITO-porter经内吞进入细胞后,外层分别通过与内吞体膜和线粒体膜融合,以膜融合的方式携带药物进入活细胞线粒体基质中[21]。
有些双性载体也能够通过线粒体膜并聚集在线粒体内(如三苯基膦),这些载体可用于向线粒体内转运DNA。
双性载体可通透脂质双层膜进入线粒体中。
将PNA寡聚体与之共价连接后,在膜电势驱动下,双性载体将PNA携带进入培养的人细胞的线粒体。
此外,丝氨酸衍生的双性表面活性剂/DNA复合物也可经内吞机制进入细胞后,转染50%以上细胞的线粒体[22]。
尽管正常细胞的线粒体很少从胞质中摄取DNA,但在大多数物种中,线粒体可天然地从胞质中摄取RNAs,其中最常见的是tRNA。
这是由于线粒体的基因组并不编码完整的一套tRNA,因此线粒体就需分享胞质翻译系统中核编码的tRNAs。
不同物种能够转导进线粒体的tRNAs数量不同,例如有袋动物的线粒体仅可转导进一个tRNAs,而锥虫线粒体可转导进所有tRNAs[23]。
tRNAs进入线粒体的机制极可能是非特异tRNA导入复合体( tRNA import complex,RIC)途径。