酸碱平衡和酸碱滴定法
- 格式:doc
- 大小:212.00 KB
- 文档页数:9





无机及分析化学06酸碱平衡与酸碱滴定法酸碱平衡是无机及分析化学中的一个重要概念,它涉及到溶液中酸和碱之间的相互作用和平衡状态。
酸碱滴定法是一种常用于测定溶液中酸碱性质和浓度的分析方法。
本文将对酸碱平衡和酸碱滴定法进行详细介绍。
首先,我们来介绍酸碱平衡的基本概念。
酸碱平衡是指溶液中酸和碱之间的反应和平衡状态。
在溶液中,酸能够释放出H+离子,而碱能够接受H+离子。
这个过程被称为质子(H+)转移反应。
在酸碱平衡中,有两个重要的概念:酸性度(pH)和酸度常数(Ka)。
pH是用来表示溶液酸碱性强弱的指标,它的定义是pH=-log[H+],其中[H+]代表溶液中的氢离子浓度。
pH值越小,表示溶液越酸;pH值越大,表示溶液越碱。
在中性水溶液中,pH值为7酸度常数Ka用来衡量酸的强弱,它的定义是Ka=[H+][A-]/[HA],其中[H+]代表酸溶液中的氢离子浓度,[A-]代表酸的共轭碱的浓度,[HA]代表未解离酸的浓度。
Ka值越大,表示酸越强。
酸碱滴定法是一种常用于测定溶液中酸碱性质和浓度的分析方法。
在酸碱滴定中,通常会使用滴定管、酸度计、酸碱指示剂等实验装置和试剂。
滴定过程中需要滴定剂、指示剂和滴定的原料溶液。
滴定过程中,首先准备好要分析的溶液和滴定剂。
然后,用滴定管滴入适量的滴定剂到容器中,然后再加入适当的指示剂。
当滴定剂反应完全与原料溶液中的酸或碱反应完成时,指示剂的颜色将发生明显的变化。
通过测量滴定剂用量,可以计算出原料溶液中酸或碱的浓度。
酸碱滴定法有许多不同的类型,其中最常见的有酸碱滴定、氧化还原滴定和络合滴定。
酸碱滴定是根据滴定剂对溶液中的酸或碱进行中和反应来测定其浓度。
氧化还原滴定是通过滴定剂与溶液中的氧化还原反应来测定其浓度。
络合滴定是通过滴定剂与溶液中的金属离子形成络合物来测定其浓度。
酸碱滴定法在实际应用中有广泛的用途。
例如,它可以用于测定食品和药品中的酸碱度,以确保其安全和合规性。
此外,酸碱滴定还可以用于水质分析、环境监测和药物分析等领域。
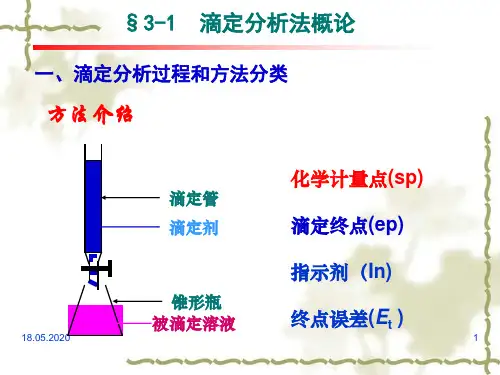


第7章酸碱平衡与酸碱滴定法7.1 溶液中酸碱平衡的处理方法 71酸碱滴定法是以酸碱反应为基础的滴定分析方法,是滴定分析中广泛应用的方法之一。
由于酸碱滴定法的基础是酸碱平衡,因此本章首先介绍溶液中酸碱平衡的基本理论,然后学习酸碱滴定法的基本原理及应用。
7.1 溶液中酸碱平衡的处理方法酸碱溶液中平衡型体之间存在三大平衡关系:①物料(质量)平衡,②电荷平衡,③质子平衡。
本章酸度的计算中,用质子平衡对酸碱平衡进行处理,最简单最常用。
因此分别介绍这些方法。
7.1.1 物料平衡平衡状态时,化学体系中某一组分的分析浓度等于该组分各种型体平衡浓度之和。
例题7-1:0.10 mol・L-1 HAc溶液,其物料平衡式为: cHAc=c(HAc) + c(Ac-)=0.10(mol・L-1)例题7-2:0.20 mol・L-1 NaHCO3溶液,其物料平衡式为:?2?c(Na+)=cNaHCO3=c(H2CO3) + c (HCO3) + c(CO3)=0.20 (mol・L-1)例题7-3:0.50 mol・L-1 NaOH溶液,其物料平衡式为: CNaOH=c(Na+ )=c(OH )=0.50 (mol・L-1)-例题7-4:0.50 mol・L-1 HCl溶液,其物料平衡式为: CHCl=c(Cl )=c(H+ )=0.50(mol・L-1 )-例题7-5:0.20 mol・L-1 NH4Cl溶液,其物料平衡式为: CNH4Cl=c(Cl )=c(NH4) + c(NH3)=0.20 (mol・L-1)-?7.1.2 电荷平衡处于平衡状态的水溶液是电中性的,即溶液中荷正电质点所带正电荷的总数与荷负电质点所带负电荷的总数相等。
例题7-6:0.10 mol・L-1 HAc溶液,其电荷平衡式为: c(H+ )=c(Ac- ) + c(OH )-对多价阳(阴)离子,平衡浓度各项中还有相应的系数,其值为相应离子的价数。

第三章酸碱滴定法1酸碱平衡理论基础一、酸碱质子理论随着科学的发展,人们对酸碱的性质、组成和结构的认识不断深入,提出了不同的酸碱理论,如电离理论、溶剂理论、质子理论、电子理论以及软硬酸碱原则等。
1923年丹麦化学家布朗斯台德和英国化学家劳瑞分别独立提出了酸碱质子理论。
酸碱质子理论认为:凡是能够给出质子的物质都是酸,又称为质子酸;凡是能够接受质子的物质都是碱,又称为质子碱。
按照酸碱质子理论,酸碱可以是中性分子和离子。
酸给出质子生成相应的碱,而碱结合质子后又生成相应的酸;酸与碱之间的这种依赖关系称共轭关系。
相应的一对酸碱被称为共轭酸碱对。
既能给出质子,又能接受质子的物质为两性物质。
共轭酸碱对的质子传递反应,称为酸碱半反应。
酸碱质子理论认为,酸碱半反应不能独立进行,即在溶液中,当一种酸给出质子后,溶液中必然有一种碱接受质子,酸碱反应的实质就是两个共轭酸碱对之间的质子传递。
按照酸碱质子理论,中和反应、酸碱解离及盐的水解等反应均可以表示为两个共轭酸碱对之间的质子传递,即称为酸碱反应。
例如:HF在水溶液中的解离反应是由给出的质子的半反应和接受质子的半反应组成的,两个酸碱对相互作用而达到平衡,反应式如下:。
盐类水解反应也是离子酸碱的质子转移反应。
例如:NaAc的分解:NH4+的分解:二、水的解离和溶液的pH值O所起的作用不同,前一个反应中,溶剂水起了酸的在上述两个反应中,H2作用,后一个反应中溶剂水起了碱的作用。
按照酸碱质子理论,水既能给出质子又能接受质子,也是一种两性物质,通常称为两性溶剂。
水分子间也可以发生质子的转移作用,反应如下式:或这种在溶剂分子间发生的质子传递作用,称为水的质子自递反应,反应的标准平衡常数表达式:或称为水的质子自递常数,又称为水的离子积常数,简称水的离子积。
25 ℃时,纯水中c (H +) = c (OH -) = 1.0 × 10-7 mol·L -1 =1.0 × 10-14水的离子积不仅适用于纯水中,也适用于酸碱溶液中,即不论是酸溶液还是碱溶液,都同时存在着H + 和OH -,只是二者的浓度不同,常温下,都有=1.0× 10-14 这一关系。
酸碱平衡和酸碱滴定法第2章酸碱平衡和酸碱滴定法教学目的:化学平衡是滴定分析法的理论基础,掌握化学平衡及相关计算;了解缓冲作用的原理相关计算;掌握酸碱滴定分析法的基本原理及应用。
教学重点:反应平衡常数,分布系数,质子平衡条件及[H+]的近似计算,缓冲溶液的有关计算,会配制缓冲溶液,滴定误差、滴定突跃、滴定可行性判据,一元弱酸、混合酸体系的滴定。
教学难点:平衡常数的计算,[H+]的近似计算,缓冲容量的推导,林邦误差公式的推导和应用;对于不同体系[D]eq计算的公式不同,关键是写出化学计量点产物的质子条件。
2.1 概述2.1.1酸碱平衡研究的内容1. 由投料组分的浓度和平衡常数求算各形式的浓度、活度或pH值2. 由pH值和相关的平衡常数求算各形式的分布分数3. 由某些形式的浓度和投料组分的浓度测算相关的平衡常数4. 缓冲溶液的理论及应用5. 酸碱指示剂、滴定曲线和终点误差2.1.2酸碱平衡的研究手段1.代数法: 代数法是最常用的,是教科书中主要介绍的方法。
它的理论性强,适用广泛是其它各种方法的基础。
但代数法比较繁琐、冗长,计算过程复杂,有时甚至无求解,再者,它的直观性差,不易用来讨论离子酸碱的全貌,这是它在教学中不利的一面。
在酸碱平衡中应用最为广泛。
例如,pH值的计算,分布分数(或副反应系数)的计算,缓冲问题,滴定曲线,常数测定,离子强度计算等都主要使用代数法2.图解法图解法是应大力提倡和推广的方法,数和形的结合历来是数理科学领会复杂概念和解决深奥问题的常规手段。
3.计算机方法计算机可以把我们从烦琐的计算中解放出来,并且它特别适合把公式转换为图形,有利于数和形的结合。
随着计算机的普及和提高,这一方法肯定会成为分析化学各种计算的主要方法。
不过,由于条件的限制,本教材还是以代数法和图解法作为主要内容。
2.1.3 离子的活度与平衡浓度活度:电解质溶液中离子实际发挥作用的浓度称为活度,即有效浓度。
-离子i的活度系数 c -平衡浓度浓度极稀的强电解质溶液:=1 中性分子的活度系数 =1离子的活度系数与离子强度:强电解质在溶液中电离为阴阳离子。
Chap3 酸碱平衡和酸碱滴定法§3~4酸碱缓冲溶液教案首页内容:导入:坐汽车,在汽车突然加速、减速时,会产生惯性,为防止惯性,要系安全带,安全带起的是缓冲作用,由此,我们想缓冲溶液的意义,应是具有缓冲作用的溶液,那么,安全带是用来缓冲惯性,缓冲溶液则是用来缓冲pH值的。
我们知道,一般的溶液,酸性的,碱性的,或两性的,向其中加入少量的酸或碱后,PH 值就会减小或增大,而往缓冲液中加入少量酸或碱,溶液的PH 值不会发生显著变化。
一、概念1、缓冲溶液(buffer solution):能减缓因外加强酸或强碱以及稀释而引起的pH急剧变化的溶液。
解释:p H 值不因加入少量酸或少量碱以及稍加稀释而发生显著变化。
通常有以下三种情况:(1) 向溶液中加入少量的强酸或强碱;(2) 溶液中的化学反应产生少量的酸或碱;(3) 溶液稍加稀释。
2、缓冲溶液的组成:(1) 共轭酸碱对(如:浓度较大的弱酸及其共轭碱,HAc-Ac-;浓度较大的弱碱及其共轭酸,NH3-NH4+);(2) 强酸(pH<2)强碱溶液(pH>12);(3) 两性物质。
3、分类(按用途):(1) 一般酸碱缓冲溶液(用于控制溶液的pH值);(2) 标准缓冲溶液(校正pH计用)。
二、缓冲溶液的作用原理1、以HAc-NaAc为例,说明其作用原理HAc-NaAc缓冲溶液中,存在下列平衡:(1) NaAc⇌Na++Ac-,(2) HAc⇌H++Ac-加入少量酸,则引入的H++Ac-⇌HAc;加入少量碱,则引入的OH-+H+⇌H20,可见pH值基本不变。
2、以NH3-NH4Cl为例,说明其作用原理NH 3-NH 4Cl 缓冲溶液中,存在下列平衡: (1) NH 3+ H 20⇌NH 4++OH - ,(2) NH 4Cl ⇌NH 4++ Cl -加入少量酸,则H ++OH -⇌H 20;加入少量碱,则OH -+NH 4+⇌ NH 3·H 20,可见pH 值基本不变。
三、 缓冲溶液pH 值的计算以HA-A -为例,计算c HA mol ·L -1HA+c A-mol ·L -1A -缓冲体系的pH 值: 物料平衡:①[Na +]=c A- ②[HA]+[A -]=c HA +c A-电荷平衡:③[Na +]+[H +]=[A -]+[OH -] ①代入③得,c A-+[H +]=[A -]+[OH -],即:④[A -]=c A-+[H +]-[OH -]将④代入②得,[HA]=c HA +c A--[A -]=c HA -[H +]+[OH -]得,得,作为控制酸度的缓冲溶液,因为缓冲剂本身的浓度大,对计算结果也不要求准确,可用近似的方法计算:eg1.求0.10mol ·L -1HAc 和0.20mol ·L -1Ac -缓冲溶液的pH 值。
[提示] 直接用公式:+-[H ][A ][HA]+Ka=[H ]=Ka -[HA][A ]⇒又:c -AKa+lgc HA近似式: pH=p +c -[H ]c -++++HA HA pH<6,[OH ]0,[H ]=Ka ,c [H ],c [H ],[H ]=KaHA -+c A c +[H ]--AA-c +[OH ]c ++--+HA HA pH>8,[H ]0,[H ]=Ka ,c [OH ],c [OH ],[H ]=Ka HA --c A c -[OH ]--A A ≈>>>>≈>>>>当时当时当时当时+-c -[H ]+[OH ]+HA [H ]=Ka+-c +[H ]-[OH ]-A精确式:eg2.求0.10mol ·L -1NH 4+和0.20mol ·L -1NH 3·H 20缓冲溶液的pH 值。
[提示] 直接用公式:eg3. 0.30mol ·L -1吡啶(C 5H 5N )和0.10mol ·L -1HCl 等体积混合,是否为缓冲溶液,求其pH 值。
[提示] 判断是否组成缓冲溶液,实际是判断是否生成共轭酸碱对,吡啶为有机弱碱,0.30mol ·L -1吡啶(C 5H 5N )和0.10mol ·L -1HCl 等体积混合,生成吡啶盐酸盐和过量的吡啶,二者是共轭酸碱对,因此能组成缓冲溶液。
直接用公式:注意:等体积反应浓度减半。
eg4. 欲使100mL 0.10mol ·L -1HCl 溶液的pH 值从1.00增大至4.44,需加入固NaAc 多少克。
[提示] 设需加入固NaAc m 克。
eg5. 今有某弱酸HB 及其盐配制缓冲溶液,其中HB 的浓度为0.25mol ·L -1。
于此100mL 缓冲溶液中加入200mgNaOH (忽略溶液体积变化),所得溶液的pH 值为5.60。
问原来所配制的缓冲溶液的pH 值为多少?(设HB 的Ka=5.0×10-6) [提示] 关键:求原溶液中的c B-。
由 求得原溶液中的c B-。
c-0.20Ac Ka+lgKa+lgc 0.10HAc=pH=p p c C H N 55pH=pKa+lgc+C H NH 550.30V-0.10V 0.10V(c =, c =)C H N +552V 2V C H NH55 -3-3(m-0.1010010M )/M 10010NaAc NaAc 4.44=4.74+lg-3-30.1010010/10010⨯⨯⨯⨯⨯⨯⨯⨯-3-3200104010010+c -6B-5.60=-lg5.010+lg-320010-3-3(0.2510010- )1001040⨯⨯⨯⨯⨯⨯⨯⨯•c NH H O0.2032pH=pKa+lg =pKa+lgc 0.104+NH四、 缓冲指数、缓冲容量及缓冲范围导入:以上节课的导出作为导入。
前面讲过,当向缓冲溶液中加入少量强酸或强碱或将溶液稍加稀释时,溶液的pH 值基本保持不变。
但是,如果继续加入强酸或强碱,比如无限度地加入大量的强酸或强碱,缓冲溶液对酸或碱的抵抗能力就要减弱,甚至失去缓冲作用。
就是说,缓冲溶液的缓冲作用都是有一定的限度的,每一种缓冲溶液只能加入有限量的酸或碱,才能保持溶液的pH 值不变。
所以每一种缓冲溶液只具有一定的缓冲能力,缓冲指数和缓冲容量是衡量缓冲溶液缓冲能力大小的尺度。
1、缓冲指数(buffer index)——β定义:dc ——加入强酸或强碱的无穷小量; dpH ——pH 的无穷小量。
其物理意义:相关酸碱组分分布线的斜率,β具有加和性。
加和性:结论:β与缓冲溶液的总浓度c HA 和组分比(共轭酸碱对的分布分数)有关:缓冲溶液分析浓度越大, β越大;总浓度一定时,组分比越接近1:1,缓冲指数越大;并且,当组分比等于1(即c HA =c A-)时,β有极值,缓冲溶液的缓冲能力最大,此时,pH=pKa 。
2、缓冲容量(buffer capacity)——α定义:β=β+β+β+-HAH OH +-d[H ]d[OH ]d[HA]+-=++ (dc=d[H ]+d[OH ]+d[HA])dpH dpH dpH +-=2.3[H ]+2.3[OH ]+2.3δδc HA -HAA +pH , β=2.3[H ];-pH , β=2.3[OH ];-HA-A pH(pH=pKa 1), β=2.3δδc .HA -HA A± 强酸控制溶液时强碱控制溶液时体系控制溶液时α=Δc=βΔpH=(δ2 A- —δ1A-)c HAα——缓冲容量;Δc——外加强酸或强碱的量;β——ΔpH区间缓冲溶液所具有的平均缓冲指数;ΔpH——因Δc而发生的pH值的变化;δ2 A- ——终态pH值(即pH2)时A-的分布分数;δ1 A- ——初态pH值(即pH1)时A-的分布分数;c HA——HA的总浓度(分析浓度)。
其物理意义:某缓冲溶液因外加强酸或强碱的量为Δc而发生pH的变化的幅度为ΔpH。
结论:影响α的因素为缓冲溶液的总浓度c HA和组分比(共轭酸碱对的分布分数):缓冲溶液分析浓度越大, α越大;总浓度一定时,组分比越接近1:1,缓冲容量越大;并且,当组分比等于1(即c HA=c A-)时,α有极值,缓冲溶液的缓冲能力最大;此时,pH=pKa。
——与缓冲指数相一致。
3、缓冲范围——pKa±1缓冲范围是指缓冲溶液起有效缓冲作用的有效pH值范围。
eg.HAc-Ac-缓冲溶液其pKa=4.74,那么,我们配制缓冲溶液时,要使其pH值在3.74~5.74范围内。
例如,前面计算缓冲溶液的pH值时,eg1. eg2. eg3.的pH值均在其有效缓冲范围之内:缓冲体系pKa 有效缓冲范围缓冲溶液的pH值eg1.HAc-Ac- 4.74 3.74~5.74 5.04eg2. NH3·H2O-NH4+ 9.26 8.26~10.26 9.56eg3.C5H5N-C5H5NH+ 5.23 4.23~6.23 5.53又如 HF-F- 3.18 2.18~4.18H2PO4-HPO42-7.20(pKa2) 6.20~8.20以0.10mol·L-1HAc-Ac-缓冲溶液为例,可绘制出其β-pH曲线,如图所示:图中,实线为0.10mol·L-1HAc-Ac-溶液在不同pH值时的缓冲指数β,虚线表示强酸和强碱溶液的缓冲指数β,阴影部分表示在pH4~6时,HAc-Ac-缓冲体系所具有的缓冲容量α。
从β-pH曲线上,可得到以下下结论:(1) 曲线两侧β很高,说明一定浓度的强酸在pH<2、强碱在pH >12时具有较大的缓冲容量。
若反应要求溶液的酸度控制在pH=0~2,或pH=12~14的范围内,则可用强酸或强碱控制其酸度;(2) 在pH=pKa±1的范围内,缓冲溶液具有较大的缓冲容量,此范围即为有效缓冲范围,在此范围内,pH离pK a点愈远,β愈小,并且,当pH=pKa时,β具有最大值,缓冲溶液的缓冲能力达到最大;超出此范围,缓冲能力将显著下降。
从缓冲组分的分布分数曲线来讨论缓冲容量的概念更为方便和直观。
见教材P61图2-6。
五、如何选择缓冲溶液1、关键:使欲控制的pH值落在缓冲溶液的缓冲范围之内(尽量与缓冲溶液的pKa接近);选时,先查出缓冲溶液中弱酸的pka,算出pka±1,得到缓冲范围,再看欲控制的溶液的pH值能落在哪个弱酸的pka±1内,就以这一个弱酸及其共轭碱组成的缓冲溶液来控制pH。
2、加入的缓冲溶液应不干扰测定,尤其对待测组分无干扰;3、缓冲溶液应有足够的缓冲容量;4、缓冲物质应廉价易得,避免污染。