三草酸合铁酸钾的制备与分析
- 格式:docx
- 大小:14.47 KB
- 文档页数:5


三草酸合铁酸钾的合成及分析一、三草酸合铁酸钾的合成方法:1.合成三草酸铁:将适量的氢氧化铁固体加入到约100mL的蒸馏水中,加热至沸腾溶解。
然后,将草酸二钠固体溶解在50mL蒸馏水中,加入到氢氧化铁溶液中。
搅拌反应物溶液,直到得到澄清的混合溶液。
将澄清溶液过滤并冷却,最后得到三草酸铁晶体。
2.合成三草酸合铁酸钾:将约2g的三草酸铁溶解在20mL的蒸馏水中,加入适量的氢氧化钾固体,直到溶液中不再产生气泡。
继续加热溶液,直至溶液变得澄清。
最后,对溶液进行冷却、过滤和干燥,得到三草酸合铁酸钾晶体。
二、三草酸合铁酸钾的分析方法:1.紫外可见光谱法:利用紫外可见光谱仪测量三草酸合铁酸钾在不同波长下的吸光度,并画出吸收光谱图。
通过比较吸收峰位置和强度,可以确定样品的组成和浓度。
2.X射线衍射分析法:将样品放入X射线衍射仪中,通过测量样品对X射线的衍射情况,分析样品的晶体结构和组成。
3.火焰原子吸收光谱法:将样品溶解在适当的溶剂中,使用火焰原子吸收光谱仪测量溶液的吸光度。
根据吸光度与样品浓度的关系,确定三草酸合铁酸钾的浓度。
4.离子色谱法:通过离子色谱仪测量样品中铁离子和钾离子的浓度。
根据测量结果,计算三草酸合铁酸钾中铁和钾的含量。
总结:三草酸合铁酸钾是一种重要的无机化合物,通过合成和分析方法可以得到该化合物的纯品以及对其进行质量控制。
其中,紫外可见光谱法、X 射线衍射分析法、火焰原子吸收光谱法和离子色谱法是常用的分析方法。
通过这些方法,可以得到三草酸合铁酸钾的结构、浓度以及含量等重要信息。

三草酸合铁酸钾的合成及分析一、实验目的1. 了解铁酸钾的性质和合成方法。
二、实验原理铁酸钾(K3[Fe(CN)6])是一种无色晶体,存在六配位的铁离子和氰离子的配合物。
它是一种有用的化学试剂和指示剂,广泛应用于分析和催化领域。
铁酸钾的合成方法主要包括两种:酸法和碱法。
酸法:将黄色的亚铁氰化钾溶液和氧化钾混合,加入过量的盐酸,将生成的铁氰酸离子酸化,放置沉淀,过滤、洗涤后即得到铁酸钾。
碱法:将氰化钾和过氧化氢混合,产生的氰化氢被钠氢碳酸中和,得到氢氧化钠、氧气和氰化钠。
再将氢氧化钠与铁(Ⅲ)盐的溶液混合,产生沉淀,此沉淀即为铁酸钾。
三草酸合铁酸钾的合成方法:用黄色的铁氰酸钾和铁(Ⅲ)盐在玻璃器皿中共同混合,加热反应1.5h后,冷却并静置,过滤,洗涤,干燥即得到产物。
三草酸合铁酸钾的结构:三草酸合铁酸钾的分子式为KFe[Fe(CN)6]·3H2O,由一个铁氰酸铁离子和一个氰化铁离子构成。
铁氰酸铁离子为八面体结构,氰化铁离子为六角形结构。
三草酸合铁酸钾的分析方法主要包括热重分析、红外光谱、元素分析等方法。
热重分析:在氧气气氛下进行热重分析,可确定三草酸合铁酸钾的含量。
红外光谱:通过光谱仪进行分析,可确定三草酸合铁酸钾的结构。
三、实验操作1. 实验仪器天平、热风干燥箱、pH计、电磁加热板、恒温水浴器、玻璃仪器(烧杯、漏斗、滴定管、量筒等)、滤纸、蒸馏水等。
2. 实验步骤(1) 预处理将玻璃器皿洗净,烘干。
a. 热重分析:将少量三草酸合铁酸钾样品称重,放入热风干燥箱中,在氧气气氛下升温至800℃,记录下失重量。
b. 红外光谱:取少量三草酸合铁酸钾样品,粉碎后压成KBr片,通过光谱仪进行分析,记录红外光谱图像。
c. 元素分析:将少量三草酸合铁酸钾样品进行量化分析,测定其元素含量。
(4) 计算根据实测的结果,计算三草酸合铁酸钾的含量和元素组成。
四、实验注意事项1. 操作过程中,应注意个人安全,避免直接接触铁氰酸钾和铁(Ⅲ)盐。

三草酸合铁(III)酸钾的制备、性质和组成分析(设计性实验)姓名:小土豆实验日期:2012-11-05三草酸合铁(III)酸钾的制备、性质和组成分析引言:三草酸合铁(III)酸钾合成工艺有多种,例如,可采用氢氧化铁和草酸氢钾反应;也可用硫酸亚铁铵与草酸反应得到草酸亚铁,再在过量草酸根存在下用过氧化氢氧化。
K3[Fe(C2O4)3]·3H2O为亮绿色晶体,溶于水(0℃时4.7g/100g水,100℃时117.7g/100g 水),难溶于乙醇、丙酮等有机溶剂。
110℃失去结晶水,230℃分解。
该配合物对光敏感;可进行下列光反应:2 K3[Fe(C2O4)3] 2FeC2O4+3K2C2O4+2CO2因此,在实验室中可用碱草酸根含铁(III)酸钾作成感光纸;进行感光实验。
另外,由于它具有光的化学性质,能定量进行化学反应,常用作化学光量计材料。
一、实验目的1.掌握三草酸合铁(III)酸钾的制备方法。
2.加深对铁(Ⅲ)和铁(Ⅱ)化合物性质的了解;3.掌握容量分析等基本操作。
4.学习用高锰酸钾法测定C2O2-4与Fe3+的原理和方法。
二、实验原理本实验采用三氯化铁和草酸钾直接反应制备。
FeCl3 +3K2C2O4== K3[Fe(C2O4)3] +3KCl用稀H2SO4可使三草酸合铁﹝III﹞酸钾分解产生Fe3+和C2O42-,用高锰酸钾标准溶液滴定试样中的C2O2-4,此时Fe3+不干扰测定,滴定后的溶液用锌粉还原。
2Fe3+ +Zn==Zn2+ +2Fe2+过滤除去过量的锌粉,使用高锰酸钾标准溶液滴定Fe2+通过消耗高锰酸钾标准溶液的体积及浓液计算得到C2O42-和Fe3+的含量。
5Fe2+ + MnO4- + 8H+==5Fe3+ +Mn2+ +4H2O三、主要仪器和试剂台秤,抽滤瓶,布氏漏斗循环水泵,棕色容量瓶,烧杯,量筒,草酸钾(K2C2 O4 H2O,化学纯),三绿化铁(FeCl3·6H2O,化学纯),H2SO4(2mol/L,0.2mol/L) ,KMnO4标准溶液(0.0200mol/L),锌粉(分析纯),丙酮。


实验三三草酸合铁( III )酸钾的合成及组成分析一、实验目的1、掌握三草酸合铁(山)酸钾的合成方法;2、掌握确定化合物化学式的基本原理和方法;3、综合训练无机合成、滴定分析和重量分析的基本操作。
二、实验原理三草酸合铁(山)酸钾K3[Fe(C2O4)3]?3H2O为亮绿色单斜晶体,易溶于水而难溶于乙醇、丙酮等有机溶剂,受热时,在110C下可失去结晶水,至U 230 C即分解。
该配合物为光敏物质,光照下易分解。
它是一些有机反应很好的催化剂,也是制备负载型活性铁催化剂的主要原料,因而具有工业生产价值。
目前制备三草酸合铁( I I I )酸钾的工艺路线有多种。
本实验首先利用(NH4)2Fe(SO4)2 与H2C2O4反应制取FeC2O4,反应方程式为:(NH4)2Fe(SO)2+ H2C2O4 = FeC2O4 ( s)+ (NH4)2 SC4+ H2 SO 在过量K2C2O4存在下,用H2 O2氧化FeC2O4,即可制得产物:6 FeC2O4 + 3 H2 02+ 6 K2C2O4= 4 K3[Fe(C2O4)3] + 2Fe (OH) 3 (s)反应中产生的Fe(OH) 3可加入适量的H2C2O4也将其转化为产物:2 Fe (OH) 3+3 H2C2O4 + 3 K2C2O4= 2 K3[Fe(C2O4)3] + 6H2O该配合物的组成可通过重量分析法和滴定方法确定。
( 1) 用重量分析法测定结晶水含量将一定量产物在110 C下干燥,根据失重的情况便可计算出结晶水的含量。
( 2) 用高锰酸钾法测定草酸根含量C2O42-在酸性介质中可被Mn O4-定量氧化,反应式为:5 C2O42-+ 2 Mn。
4-+ 16H = 2Mn2+ 10 CO2 + 8H2O用已知浓度的KMnO4标准溶液滴定C2O42-,由消耗KMnO4的量,便可计算出QQ2-的含量。
( 3) 用高锰酸钾法测定铁含量先用过量的Zn粉将Fe3+还原为FW +,然后用KMnO q标准溶液滴定Fe2+:Zn+ 2 Fe3+= 2 Fe2++ Zn2+2++MnO4-+8 H+=5 Fe3++Mn2++4 H2O5 Fe由消耗KMnO4的量,便可计算出Fe3+的含量。

三草酸合铁酸钾的制备和组成分析探究一、制备方法1.直接合成法直接合成法是将亚铁盐溶液与草酸溶液反应得到三草酸合铁(Ⅲ)沉淀,然后用钾盐溶液处理沉淀得到三草酸合铁(Ⅲ)酸钾。
反应方程式如下:Fe²⁺+3C₂H₂O₄→2FeC₂H₂O₄+2H⁺+2e⁻2FeC₂H₂O₄+6KOH→Fe₂(C₂H₂O₄)₃+6K⁺+3H₂O2.间接分解法间接分解法是将硫酸亚铁和草酸钾反应得到草酸亚铁沉淀,然后在高温条件下和高氧化性剂氯酸钾反应得到三草酸合铁(Ⅲ)酸钾。
反应方程式如下:FeSO₄+K₂C₂O₄→K₂Fe(C₂O₄)₂+K₂SO₄K₂Fe(C₂O₄)₂+4KClO₄+8HCl→2K₃Fe(C₂O₄)₃+4KCl+4H₂O二、组成分析组成分析是对合成产物的成分进行检测和鉴定,可以通过以下几个方面进行分析:1.元素分析2.热分析热分析可以通过测定样品的热稳定性和热分解过程来分析三草酸合铁(Ⅲ)酸钾的组成。
可以通过热重分析(TGA)和差热分析(DSC)等仪器进行热分析。
3.光谱分析光谱分析可以通过测定样品的吸收光谱和荧光光谱来分析三草酸合铁(Ⅲ)酸钾的组成。
常用的光谱分析方法包括红外光谱(FTIR)、紫外-可见光谱(UV-Vis)和荧光光谱等。
4.结晶分析结晶分析可以通过X射线衍射(XRD)和电子显微镜(TEM)等方法来研究三草酸合铁(Ⅲ)酸钾的晶体结构和形貌。
综上所述,三草酸合铁(Ⅲ)酸钾的制备方法包括直接合成法和间接分解法,组成分析可以通过元素分析、热分析、光谱分析和结晶分析等方法进行。
这些分析方法可以帮助我们了解三草酸合铁(Ⅲ)酸钾的结构组成和性质,为其进一步应用提供支持。


合成三草酸合铁酸钾的原理三草酸合铁酸钾合成的原理是在适当的条件下,将三草酸和铁离子反应生成三草酸合铁酸钾。
三草酸,也称为柠檬酸,是一种有机酸,化学式为C6H8O7,它可从柑橘类水果中提取得到。
柠檬酸是一种弱酸,在水中可以脱离三个H离子,形成柠檬酸三阴离子,也就是C6H5O73-。
铁离子可以从铁盐中得到,比如铁(II)盐或铁(III)盐。
在溶液中,铁(II)离子可被氧化为铁(III)离子。
在合成三草酸合铁酸钾的反应中,一般使用铁(III)盐,比如硫酸亚铁(III)溶液(Fe2(SO4)3)。
实验中可以先将硫酸亚铁(III)固体与适量的水反应,生成硫酸亚铁(III)溶液。
接下来,将柠檬酸固体加入硫酸亚铁(III)溶液中,开始反应。
柠檬酸中的柠檬酸三阴离子与铁离子发生配位反应,形成了柠檬酸铁离子。
柠檬酸铁离子的结构中,铁(III)离子与柠檬酸的羧基连接,形成配合物。
配合物中的铁离子与柠檬酸配体之间通过坐标键连接。
这一配位反应是一个可逆的化学反应,柠檬酸铁离子的生成与分解可在适当的条件下互相转化。
柠檬酸铁离子是以溶液形式存在的,在溶液中,铁离子与柠檬酸三阴离子之间会保持动态平衡。
当铁离子的浓度增加时,与之配位的柠檬酸三阴离子也会增多,反之亦然。
通过控制反应的条件,可以促使三草酸合铁酸钾的形成。
一般来说,反应过程需要在适当的温度和pH值下进行,这样可以保证反应的进行,并得到较高的产率。
合成反应结束后,需要将产物进行分离和纯化。
最常用的方法是通过溶剂萃取或晶体析出来分离纯化三草酸合铁酸钾。
总的来说,三草酸合铁酸钾的合成是通过将柠檬酸与铁离子反应生成柠檬酸铁离子,然后通过适当的条件控制,使反应体系中柠檬酸铁离子的浓度升高,最终形成了三草酸合铁酸钾。
这个过程是一个可逆的配位反应,需要在适当的温度和pH值下进行。

实验三三草酸合铁(III)酸钾的合成及组成分析一、实验目的1、掌握三草酸合铁(III)酸钾的合成方法;2、掌握确定化合物化学式的基本原理和方法;3、综合训练无机合成、滴定分析和重量分析的基本操作。
二、实验原理三草酸合铁(III)酸钾K3[Fe(C2O4)3]•3H2O为亮绿色单斜晶体,易溶于水而难溶于乙醇、丙酮等有机溶剂,受热时,在110℃下可失去结晶水,到230℃即分解。
该配合物为光敏物质,光照下易分解。
它是一些有机反应很好的催化剂,也是制备负载型活性铁催化剂的主要原料,因而具有工业生产价值。
目前制备三草酸合铁(III)酸钾的工艺路线有多种。
本实验首先利用(NH4)2Fe(SO4)2与H2C2O4反应制取FeC2O4,反应方程式为:(NH4)2Fe(SO4)2+H2C2O4=FeC2O4(s)+(NH4)2 SO4+H2 SO4在过量K2C2O4存在下,用H2 O2氧化FeC2O4,即可制得产物:6 FeC2O4+3 H2 O2+6 K2C2O4=4 K3[Fe(C2O4)3]+2Fe(OH)3(s)反应中产生的Fe(OH)3可加入适量的H2C2O4也将其转化为产物:2 Fe(OH)3+3 H2C2O4+3 K2C2O4=2 K3[Fe(C2O4)3]+6H2O该配合物的组成可通过重量分析法和滴定方法确定。
(1)用重量分析法测定结晶水含量将一定量产物在110℃下干燥,根据失重的情况便可计算出结晶水的含量。
(2)用高锰酸钾法测定草酸根含量C2O42-在酸性介质中可被MnO4-定量氧化,反应式为:5 C2O42-+2 MnO4-+16H+=2Mn2++10 CO2+8H2O用已知浓度的KMnO4标准溶液滴定C2O42-,由消耗KMnO4的量,便可计算出C2O42-的含量。
(3)用高锰酸钾法测定铁含量先用过量的Zn粉将Fe3+还原为Fe2+,然后用KMnO4标准溶液滴定Fe2+:Zn+2 Fe3+=2 Fe2++Zn2+5 Fe2++MnO4-+8 H+=5 Fe3++Mn2++4 H2O由消耗KMnO4的量,便可计算出Fe3+的含量。
三草酸合铁酸钾的制备与分析
一、三草酸合铁酸钾的制备方法:
1.氢氰酸法:
将氢氰酸加入到含铁离子的溶液中,然后加入过量的氢氧化钾溶液,
搅拌均匀并加热,得到三草酸合铁酸钾的沉淀。
反应方程式如下:6KOH+6HCN+FeCl3→K4[Fe(CN)6]+3KCl+6H2O
反应的温度和反应时间会影响产率和纯度。
2.氯化铁法:
将氯化铁溶液加入过量的氰化钾溶液中,搅拌均匀并加热,得到三草
酸合铁酸钾的沉淀。
反应方程式如下:
6KCN+FeCl3→K4[Fe(CN)6]+3KCl
该方法操作简单,但是氯化铁的溶液对皮肤有刺激性,需要注意安全。
二、三草酸合铁酸钾的分析方法:
1.离子交换色谱法:
离子交换色谱法可以用于分离和测定三草酸合铁酸钾。
将样品溶解在
适当的溶剂中,通过离子交换柱分离出三草酸合铁酸钾,并用紫外光谱仪
测定其吸收峰。
2.原子吸收光谱法:
原子吸收光谱法可以用于测定三草酸合铁酸钾中的铁离子含量。
将样品溶解在适当的溶剂中,然后经过适当的稀释,用原子吸收光谱仪测定其吸收峰。
3.毛细管电泳法:
毛细管电泳法可以用于分离和测定三草酸合铁酸钾。
将样品溶解在适当的溶剂中,通过毛细管电泳仪分离出三草酸合铁酸钾,并用紫外光谱仪测定其吸收峰。
03.三草酸合铁酸钾的制备与分析三草酸合铁酸钾是一种重要的无机化合物,具有一定的应用价值。
本文将介绍其制备方法和分析方法。
一、制备方法三草酸合铁酸钾可以通过以下步骤制备:1. 预备的试剂:氯化钾(KCl)、硫酸铁(II)(FeSO4)、草酸(H2C2O4)、过氧化氢(H2O2)、氢氧化钾(KOH)、氢氧化铵(NH4OH)、酒精(EtOH)等。
2. 将3.2克硫酸铁(II)溶于100毫升水中,加热至溶解。
3. 加入少量过氧化氢或氧化铁(III),将溶液氧化为氧化铁。
4. 重量取15克草酸,加入水中溶解,再加入适量氢氧化钾调节pH值至4左右。
5. 过滤后,将草酸溶液与氯化钾按摩尔比1:0.5加入氧化铁溶液中,并在搅拌下保持温度在50℃左右。
6. 反应后将沉淀用水洗涤至无草酸盐残留,再用氢氧化铵洗至中性,最后用酒精洗涤至无杂质。
7. 对得到的产物进行干燥即得三草酸合铁酸钾。
二、分析方法1. 配置样品:将三草酸合铁酸钾取约0.1克,置于烤炉加热至150℃以上,维持2h至恒重,冷却后,称取其质量。
这样处理后,样品质量相对不变,而中和水分则失去。
2. 定量分析:配制标准酸溶液,称取约0.1克灰色物质,用氢氧化钾-氢氧化铵缓冲液调节溶液pH值为10±0.1,加入标准酸溶液,以调节溶液pH为7±0.1。
在这个pH值下,手动或自动滴定直到转棕红色。
根据滴定量计算样品中铁含量。
综上所述,三草酸合铁酸钾制备较为简单,只需使用少量试剂,但需要注意控制反应温度,充分洗涤干净才能得到纯净的产物。
在分析中,通过恒重法和滴定法可以对样品进行定量分析,对于样品的铁含量一目了然。
三草酸合铁酸钾引言三草酸合铁酸钾(Potassium ferric oxalate)是一种化学化合物,常用于摄影和蓝图制作等领域。
它具有吸湿性、稳定性和储存性能好的特点,因此在实验室和工业中得到广泛应用。
本文将介绍三草酸合铁酸钾的化学性质、制备方法、应用领域和安全注意事项。
化学性质三草酸合铁酸钾是一种无色结晶固体,化学式为K3[Fe(C2O4)3]。
它易溶于水,在酸性条件下呈现橙色,而在强碱性条件下则为淡绿色。
三草酸合铁酸钾的溶液具有弱酸性,pH 值约为4.5。
制备方法制备三草酸合铁酸钾的方法有多种,下面介绍其中两种常用的方法。
方法一:酸碱法将适量的草酸和草酸铵溶解在水中,得到的溶液中加入适量的氢氧化钾溶液,搅拌至完全反应,并过滤除去生成的沉淀。
将沉淀洗涤并干燥,即可得到三草酸合铁酸钾。
方法二:重结晶法先将草酸铵溶解在热水中,然后逐渐加入草酸和氧化钾溶液,搅拌混合并使之完全反应。
将反应混合物过滤除去杂质,然后将过滤液冷却至室温,待结晶生成后进行过滤和干燥,最终得到三草酸合铁酸钾。
应用领域1. 摄影领域:三草酸合铁酸钾是一种常用的感光剂,可用于制备铁蓝墨水及照相底片。
它能够与光敏胶层中的银盐反应,通过光化学反应将暗影转化为明暗关系分明的画面。
2. 蓝图制作:三草酸合铁酸钾能够与铁离子反应形成蓝色沉淀,因此被广泛应用于蓝图制作。
在制作蓝图时,将三草酸合铁酸钾的溶液涂布在纸上,再放置在阳光下曝晒一段时间,即可形成蓝色的图案。
3. 分析化学:三草酸合铁酸钾可用作铁离子的定量分析试剂。
它能够与铁离子形成稳定的络合物,通过比色法或滴定法进行定量分析。
安全注意事项1. 使用三草酸合铁酸钾时应佩戴防护眼镜和手套,避免接触皮肤和眼睛。
2. 避免与强氧化剂和还原剂同存放,以防止不安全的反应。
3. 使用时应注意防止吸入粉尘或溶液的情况,如果不慎吸入,应及时供氧并寻求医生帮助。
结论三草酸合铁酸钾是一种常用的化学化合物,被广泛应用于摄影、蓝图制作和分析化学等领域。
长江大学工程技术学院化学工程系
实验教学教案用纸
三草酸合铁酸钾的制备与分析(8学时)
、实验目的
1、掌握三草酸合铁(III )酸钾的合成方法;
2、掌握确定化合物化学式的基本原理和方法;
3、综合训练无机合成、滴定分析和重量分析的基本操作。
二、实验原理
长江大学工程技术学院化学工程系
实验教学教案用纸
(4)确定钾含量
根据配合物中结晶水、C2Q2-、Fe3+的含量便可计算出K*含量。
三、实验仪器与试剂
仪器:分析天平、烘箱等。
1
试剂:H2SQ(6mol?L )、出00(饱和)、K 2G Q4 (饱和)、H2Q2 ( w 为0.05 )、
1
C2H5QH ( w 为 0.95 和 0.5 八 KMnQ 4标准溶液(0.02 mol ?L- )、(NHJ 2Fe(SQ02 ?6巴0( s)、
Zn粉
四、实验步骤
(一)三草酸合铁的制备
称取6 g Fe屑放入锥形瓶中,加20 mL 20% NaCO溶液,小心加热10min, 倒出碱洗条。
2~3次,再加25mL 6mol・L USQ溶液,水浴加热至几乎不再产生气
[1]。
水温应控制在 80〜90 C,反应过程中要适当补加H2O,以保持原体积[2]。
趁热过滤,冷却
结晶,抽滤至干,称量
称取4g自制的FeSO4・ 7H2O晶体放入烧杯中,加 15mL H 20和1mL 3 mol L —1H2SO4溶液,
加热溶解,再加 25mL 1mo1 -L “ H2C2O4溶液,搅拌并加热至沸,静置得FeC z O q • 2H2O
沉淀,倒出上层清液,加20 mL蒸馏水,搅拌并温热,静置后倾出上层清液。
在上述沉淀中加入 10 mL饱和K2C2O4溶液,水浴加热至 40C,缓慢滴加20 mL 3%H 2O2 溶液,搅拌并保温在40C左右[此时有Fe (OH 3沉淀产生]。
滴完加HQ后,力卩至沸,再加8mL 1 mol L一1H2CO4 (先加5mL,然后慢慢滴加其余 3mL),并一直保持溶液至沸。
趁热过滤[3],在滤液中加10mL 95% C2H5OH温热使可能生成的晶体溶解。
冷却结晶,抽滤至干⑷,称量。
晶体置干燥器内避光保存。
长江大学工程技术学院化学工程系
实验教学教案用纸
(二)产品化学式的确定
(1)结晶水的测定精确称取0.5~0.6g已干燥的产物,分别放入2个已干燥至恒重的洁净的瓷坩埚中,称量瓶中,置于烘箱中。
在110C干燥1h,再在干燥器中冷却至室温,称重。
重复干燥、冷却、称量等操作直至恒重。
根据称量结果,计算结晶水的质量。
(2)GO;的测定称取0.15~0.20g (准至0.1mg)自制的三草酸根合铁(川)酸钾晶体于锥形瓶中,加入30mL蒸馏水和10mL 3mol・L 一hSQ溶液溶解。
在锥形瓶中先滴加10mL 0.02 mol nQ标准溶液呵,加热至溶液褪色再
继续用KMnQ标准溶液滴定温热溶液至粉红色(0.5min内不褪色)。
记录KMnQ 标准溶液的用量。
保留滴定后的溶液,用作Fe3+离子的测定。
平行测定2〜3次。
(3)Fe3+离子的测定将上述滴定后溶液加热近沸,加入半药匙Zn粉,直至
溶液的黄色消失。
用短颈漏斗趁热将溶液过滤于另一锥形瓶中,再用5mL蒸馏水
通过漏斗洗涤残渣一次,洗涤液与滤液合并收集于同一锥形瓶中。
最后用KMnO
(三)三草酸合铁(III)酸钾的性质
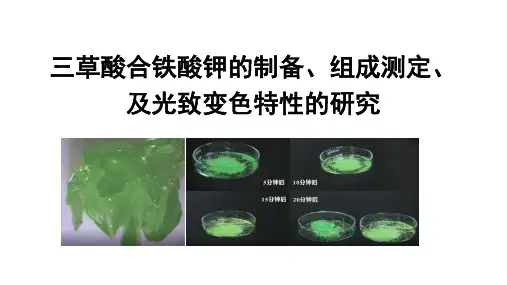
(1)将少量三草酸合铁(川)酸钾放在表面皿上。
在日光下观察晶体颜色变化。
并与放在暗处的晶体比较。
该配合物极易感光,室温下光照变色,发生下列光化学反应,即
2[Fe(C2O4)3]3 ―一2 FeC2O4 + 3C2O42- + 2CO2T
⑵ 制感光纸。
按三草酸合铁(川)酸钾0.3g、铁氰化钾0.4g加水5mL的比例配成溶液,涂
在纸上即成感光纸。
附上图案,在日光下(或红外灯光下)照射数秒钟,曝光部分呈蓝色。
被遮盖部分就显影映出图案来。
它在日光照射或强光下分解生成的草酸亚铁。
遇到六氰合铁(川)酸钾生成滕
氏蓝。
反应方程式为
FeC2O4 + K3[Fe(C2O4)3] === KFe[Fe(CN)6] J + K2C2O4
(3)制感光液。
取0.3〜0.5三草酸合铁(川)酸钾,加5 mL水配成溶液。
用滤纸条做成感光纸。
同(2)中操作。
曝光后夫掉图案。
用质量分数约为 3.5%的六氰
长江大学工程技术学院化学工程系
实验教学教案用纸
五、实验记录与结果
1.K MnO4 的标定
长江大学工程技术学院化学工程系
实验教学教案用纸
六实验思考与讨论
1、测定GO;的计算公式是什么?怎样确定GO;的配位数?
2、测定Fe3+离子时,当KMnO标准溶液逐滴加入时,待滴定液的颜色为什么逐
渐变黄?
3、根据实验情况,请你谈谈实验成败的关键是什么?
三草酸合铁(III)酸钾冏Fe(C2Q)3]?3H2O为亮绿色单斜晶体,易溶于水而难溶于乙醇、丙酮等有机溶剂,受热时,在110C下可失去结晶水,到230E即分解。
该配合物为光敏物质,光照下易分解。
它是一些有机反应很好的催化剂,也是制备负载型活性铁催化剂的主要原料,因而具有工业生产价值。
目前制备三草酸合铁(III )酸钾的工艺路线有多种。
本实验首先利用(NH)2Fe(SO)2与H2C2O4反应制取FeCO,反应方程式为:
(NH)2Fe(SO)2+ HC2O = FeCQ (s) + (NF L) 2 SO4+ H SO4
在过量&QC4存在下,用F2 02氧化FeCQ,即可制得产物:
6 FeC2Q+ 3 H2 O2 + 6 心^04= 4 K3【Fe(C2Q)3] + 2Fe (0H 3 (s)
反应中产生的Fe (0H 3可加入适量的也将其转化为产物:
2 Fe ( 0H 3+
3 H2C2C4+ 3 ©GO = 2 K3【Fe(C2O)3] + 6HO
该配合物的组成可通过重量分析法和滴定方法确定。
(1) 用重量分析法测定结晶水含量
将一定量产物在110C下干燥,根据失重的情况便可计算出结晶水的含量。
(2) 用高锰酸钾法测定草酸根含量
C2C4* 1 2- 3在酸性介质中可被MnO定量氧化,反应式为:
5 C2Q2-+ 2 MnO-+ 16H+= 2Mrn+ + 10 CQ+ 8H0
用已知浓度的KMn(标准溶液滴定C2O2-,由消耗KMnO勺量,便可计算出QO2- 的含量。
(3) 用高锰酸钾法测定铁含量
先用过量的Zn粉将Fe3+还原为Fe2 +,然后用KMnC标准溶液滴定Fe2+:
Zn+ 2 Fe3+= 2 Fe2++ Zn2+
5 Fe2+ + MnO + 8 H + = 5 Fe3++ M* + 4 H2Q。