化学平衡图像题总汇
- 格式:doc
- 大小:104.50 KB
- 文档页数:4

化学平衡图像一、选择题1.一定温度下,在2L 的密闭容器中,X 、Y 、Z 三种气体的物质的量随时间变化的曲线如右图所示,下列描述正确的是( )A .反应开始到10s ,用Z 表示的反应速率为0.158mol/(L·s )B .反应开始时10s ,X 的物质的量浓度减少了0.79mol/LC .反应开始时10s ,Y 的转化率为79.0%D .反应的化学方程式为:X(g)+ Y(g)Z(g)2.( 广东19)合成氨工业对国民经济和社会发展具有重要的 意义。
对于密闭容器中的反应:N 2(g)+3H 2(g)2NH 3(g),673K ,30MPa 下n(NH 3)和n(H 2)随时间变化的关系如下图所示。
下列叙述正确的是A .点a 的正反应速率比点b 的大B .点 c 处反应达到平衡C .点d (t 1时刻) 和点 e (t 2时刻) 处n(N 2)不一样D .其他条件不变,773K 下反应至t 1时刻,n(H 2)比上图中d 点的值大3.下图是可逆反应A+2B 2C+3D 的化学反应速率与化学平衡随外界条件改变(先降温后加压)而变化的情况,由此可推断( )A .正反应是放热反应B .若A 、B 是气体,则D 是液体或固体C .逆反应是放热反应.D .A 、B 、C 、D 均为气体4.同压、不同温度下的反应:A (g )+B (g )C (g );△HA 的含量和温度的关系如图3所示,下列结论正确的是 ( )A .T 1>T 2,△H>0B .T 1<T 2,△H>0C .T 1>T 2,△H<0D .T 1<T 2,△H<05.现有可逆反应A (g )+2B (g )nC (g );△H<0,在相同温度、不同压强时,A 的转化率跟反应时间(t )的关系如图4,其中结论正确的是()A .p 1>p 2,n >3B .p 1<p 2,n >3C .p 1<p 2,n <3D .p 1>p 2,n=36.对于反应2A (g )+B (g )2C (g );△H<0,下列图象正确的是 ( )7.T ℃时,A 气体与B 气体反应生成C 气体。
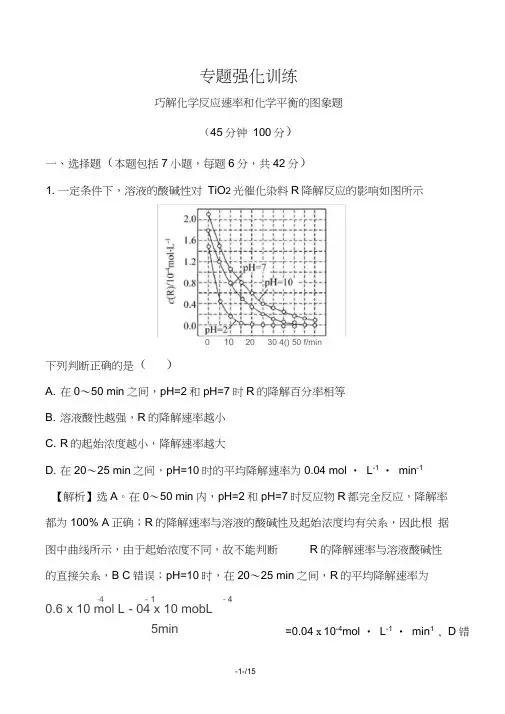
专题强化训练巧解化学反应速率和化学平衡的图象题(45分钟 100分)一、选择题(本题包括7小题,每题6分,共42分)1. 一定条件下,溶液的酸碱性对 TiO 2光催化染料R 降解反应的影响如图所示下列判断正确的是( )A. 在0〜50 min 之间,pH=2和pH=7时R 的降解百分率相等B. 溶液酸性越强,R 的降解速率越小C. R 的起始浓度越小,降解速率越大D. 在20〜25 min 之间,pH=10时的平均降解速率为0.04 mol • L -1 • min -1【解析】选A 。
在0〜50 min 内,pH=2和pH=7时反应物R 都完全反应,降解率 都为100% A 正确;R 的降解速率与溶液的酸碱性及起始浓度均有关系,因此根 据图中曲线所示,由于起始浓度不同,故不能判断 R 的降解速率与溶液酸碱性 的直接关系,B C 错误;pH=10时,在20〜25 min 之间,R 的平均降解速率为 -4 - 1 - 4 0.6 x 10 mol L - 04 x 10 mobL5min=0.04 x 10-4mol • L -1 • min 1 , D 错0 10 20 30 4() 50 f/min2. (2015 •武汉模拟)有一化学平衡mA(g)+nB(g)—pC(g)+qD(g),如图所示的是A的转化率与压强、温度的关系。
下列叙述正确的是()A. 正反应是放热反应;m+n >p+qB. 正反应是吸热反应;m+n<p+qC. 正反应是放热反应;m+n<p+qD. 正反应是吸热反应;m+n>p+q【解析】选D。
图象中有三个量,应定一个量来分别讨论另外两个量之间的关系。
定压强,讨论T与A的转化率的关系:同一压强下,温度越高,A的转化率越高,说明正反应是吸热反应;定温度,讨论压强与A的转化率的关系:同一温度下,压强越大,A的转化率越高,说明正反应是气体体积减小的反应,即m+n >p+q 【加固训练】如图是温度和压强对反应X+J2Z影响的示意图。

化学平衡图像一、选择题(本题包括35小题,每小题2分,共70分。
每小题有一个或两个选项符合题意。
)1.一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如右图所示,下列描述正确的是()A.反应开始到10s,用Z表示的反应速率为0.158mol/(L·s)B.反应开始时10s,X的物质的量浓度减少了0.79mol/LC.反应开始时10s,Y的转化率为79.0%D.反应的化学方程式为:X(g)+Y(g)Z(g)2.T℃时,A气体与B气体反应生成C气体。
反应过程中A、B、C浓度变化如图(Ⅰ)所示,若保持其他条件不变,温度分别为T1和T2时,B的体积分数与时间的关系如图(Ⅱ)所示,则下列结论正确的是()A.在(t1+10)min时,保持其他条件不变,增大压强,平衡向逆反应方向移动B.t1+10)min时,保持容器总压强不变,通入稀有气体,平衡向逆反应方向移动C.T℃时,在相同容器中,若由0.3mol·L—1 A 0.1 mol·L—1 B和0.4 mol·L—1 C反应,达到平衡后,C的浓度仍为0.4 mol·L—1D.其他条件不变,升高温度,正、逆反应速率均增大,且A的转化率增大3.已知可逆反应aA+bB cC中,物质的含量A%和C%随温度的变化曲线如图所示,下列说法正确的是()A.该反应在T1、T3温度时达到过化学平衡B.该反应在T2温度时达到过化学平衡C.该反应的逆反应是放热反应D.升高温度,平衡会向正反应方向移动4.右图表示反应N 2(g)+3H2(g)2NH3(g);ΔH=-92.2kJ/mol。
在某段时间t0~t6中反应速率与反应过程的曲线图,则氨的百分含量最高的一段时间是()A.t0~t1B. t2~t3C. t3~t4D. t5~t65.反应过程中A(g)、B(g)、C(g)物质的量变化如图所示,根据图中所示判断下列说法正确的是()A .10~15 min 可能是加入了正催化剂B .10~15 min 可能是降低了温度C .20 min 时可能是缩小了容器体积D .20 min 时可能是增加了B 的量6.在一定条件下,将X 和Y 两种物质按不同的比例放入密闭容器中反应,平衡后测得X ,Y 的转化率与起始时两物质的物质的量之比n x /n y 的关系如图所示,则X ,Y 的反应方程式可表示为( )A . 2X +Y 3ZB . 3X +2Y 2ZC . X +3Y ZD . 3X +Y Z7.可逆反应aX (g )+bY (g )cZ (g )在一定温度下的一密闭容器内达到平衡后,t 0时改变某一外界条件,化学反应速率(v )-时间(t )图象如右图。

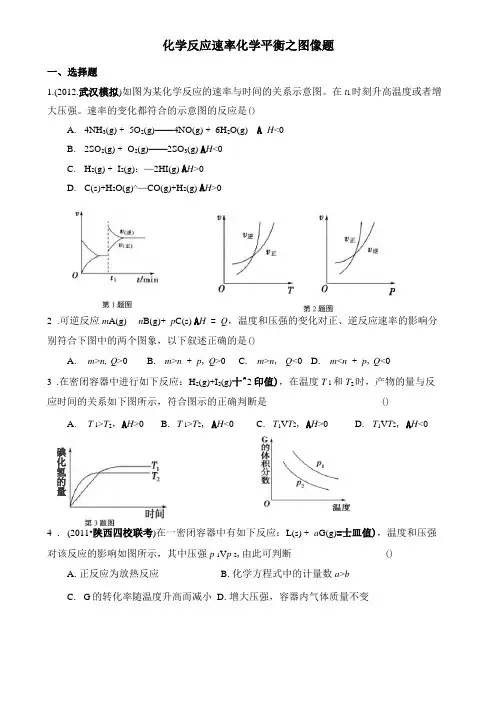
化学反应速率化学平衡之图像题一、选择题1.(2012.武汉模拟)如图为某化学反应的速率与时间的关系示意图。
在t 1时刻升高温度或者增大压强。
速率的变化都符合的示意图的反应是()A. 4NH 3(g) + 5O 2(g)——4NO(g) + 6H 2O(g)B. 2SO 2(g) + O 2(g)——2SO 3(g) A H <0C. H 2(g) + I 2(g):—2HI(g) A H >0D. C(s)+H 2O(g)^—CO(g)+H 2(g) A H >02 .可逆反应m A(g) n B(g)+ p C(s) A H = Q ,温度和压强的变化对正、逆反应速率的影响分别符合下图中的两个图象,以下叙述正确的是()A . m >n, Q >0B . m >n + p , Q >0C . m >n , Q <0D . m <n + p , Q <03 .在密闭容器中进行如下反应:H 2(g)+I 2(g)十^2印值),在温度T 1和T 2时,产物的量与反应时间的关系如下图所示,符合图示的正确判断是() A . T 1>T 2,A H >0B . T 1>T 2, A H <0C . T 1V T 2, A H >0D . T 1V T 2, A H <04 . (2011•陕西四校联考)在一密闭容器中有如下反应:L(s) + a G(g)=士皿值),温度和压强对该反应的影响如图所示,其中压强p 1V p 2,由此可判断()A .正反应为放热反应B .化学方程式中的计量数a >bC . G 的转化率随温度升高而减小D .增大压强,容器内气体质量不变A H <0 碘化氢的量C . 4NH 3(g) + 5O 2(g) 4NO(g) + 6H 2O(g) A H <05 .下图是表示外界条件(温度和压强)变化对反应的影响,L (s ) +G (g ) ==2R (g ), △H >0,在图中y 轴是指A.平衡混合物中R 的质量分数B.平衡混合物中G 的质量分数6 .在一定条件下,固定容积的密闭容器中反应:2NO 2 (g ) O 2 (g ) + 2NO (g );△H >0,达到平衡。


高考专题训练—化学平衡图像类型及解读1、反应2X(g)+Y(g)2Z(g)+Q,在不同温度(T1和T2)及压强(p1和p2)下,产物Z的物质的量n与反应时间t的关系如图所示。
下列判断正确的是()A.T1<T2,p1<p2B.T1<T2,p1>p2C.T1>T2,p1>p2D.T1>T2,p1<p2【答案】:C【解析】:温度越高,速率越快,反应就先达到平衡,因此p2相同时,T1>T2;压强越大,速度越快,反应先达到平衡,因此T2相同时,p1>p2。
2、在容积一定的密闭容器中发生可逆反应:A(g)+2B(g)2C(g)ΔH >0,条件变化时,影响平衡移动的关系如图所示。
下列说法不正确的是()A.p1<p2,纵坐标指A的质量分数B.p1>p2,纵坐标指C的质量分数C.p1>p2,纵坐标指混合气体的平均摩尔质量D.p1>p2,纵坐标指A的转化率【答案】:A【解析】:结合图象可确定,若p1<p2,增大压强平衡正向移动,A的质量分数将减小,气体的物质的量减小,即混合气体的平均摩尔质量增大,C项正确;但升高温度,平衡正向移动,A的质量分数减小与图象不符,故A错误;若p1>p2,增大压强平衡正向移动,混合气体中C的质量分数增加,A的转化率将增大,故B、D项正确。
故选A。
3、(2019·许昌高二检测)已知:2SO2(g)+O2(g)2SO3(g)ΔH<0且压强p1<p2,下列图象中曲线变化错误的是()【答案】:C【解析】:该反应为放热反应,升高温度,反应速率增大,平衡向逆反应方向移动,SO2的平衡转化率降低,A项正确;温度不变时,增大压强,平衡正向移动,SO3的百分含量增大,B项正确;升高温度,平衡逆向移动,平衡常数减小,C项错误;升高温度,正、逆反应速率均增大,由于平衡逆向移动,故升温瞬间v(逆)>v(正),D项正确。

化学平衡图像专题1、某温度下,在体积为5L的容器中,A、B、C三种物质物质的量随着时间变化的关系如图1所示,则该反应的化学方程式为_________ ,2s内用A的浓度变化和用B的浓度变化表示的平均反应速率分别为_________、_________。
2、把除去氧化膜的镁条投入到盛有少量稀盐酸的试管中,发现氢气发生的速率变化情况如图2所示,其中t1~t2速率变化的主要原因是_________;t2~t3速率变化的主要原因是_________ 。
3、某温度下,在密闭容器里SO2、O2、SO3三种气态物质建立化学平衡后,改变条件,对反应2SO2+O22SO3(正反应放热)的正、逆反应速率的影响如图3所示。
① 加催化剂对速率影响的图象是( )。
②增大O2的浓度对速率影响的图象是( )③增大反应容器体积对速率影响的图象是( )。
④升温对速率影响的图象是( ) 4、符合右图图象的反应为( )。
A.N2O3(g)NO2(g)+NO(g)B.3NO2(g)+H2O(l )2HNO3(l )+NO(g)C.4NH3(g)+5O2(g)4NO(g)+6H2O(g)D.CO2(g)+C(s)2CO(g)5、FeCl 3溶液与KSCN 溶液混合时存在下列平衡:Fe 3+(aq)+SCN -(aq)Fe(SCN)2+(aq),已知某一条件下,反应达平衡时,Fe(SCN)2+的物质的量浓度与温度的关系如图所示,下列说法正确的是:( ) A.该反应为吸热反应 B .T 1、T 2时反应的平衡常数分别为K 1、K 2,则K 1>K 2C .反应处于D 点时,一定有v 正大于v 逆 D .A 点的c(Fe 3+)比B 点的c(Fe 3+)大6、mA(s)+nB(g)qC(g)(正反应为吸热反应)的可逆反应中,在恒温条件下,B 的体积分数(B%)与压强(p )的关系如图所示,有关叙述正确的是( )。
A.n<q B.n>qC.X点,v正<v逆;Y点,v正>v逆 D.X点比Y点反应速率快 7、图7表示mA(g)+nB(g)pC(g)+qD(g)ΔH = Q,在不同温度下经过一定时间混合体系中C 的质量分数与温度T的关系;图8表示在一定条件下达到平衡后t时刻(温度不变)改变影响平衡的另一个条件重新建立新平衡的反应过程,判断该反应是( )。

高中化学学习材料唐玲出品化学平衡图象题总汇一、图象题的一般解题思路这类题目是讨论自变量x(如时间、温度、压强等)与函数值y(如物质的量、浓度、质量分数、转化率)之间的定量或定性关系,因此,要运用数学方法解决此类题目。
1.分析纵横坐标及曲线表示的意义。
2.分析曲线的变化趋势与纵横坐标的关系。
3.分析特殊点(起点、拐点、终点)及其含义。
4.有两个以上变量时,分别讨论两个变量的关系,此时确定其他量为恒量。
二、图象题的类型1.物质的量(或浓度)—时间图象例1.某温度下,在体积为5L的容器中,A、B、C三种物质物质的量随着时间变化的关系如图1所示,则该反应的化学方程式为_________,2s内用A的浓度变化和用B的浓度变化表示的平均反应速率分别为_________、_________。
分析这类题目是讨论同一时间段内各物质的变化量的比例关系,且要注意物质的量减少的为反应物,物质的量增多的为生成物。
又因物质的量都不变时,反应物、生成物共存,故方程式要用“”表示。
答案2A3B+C;0.08mol/(L·s);0.12mol/(L·s)。
2.速率—时间图象例2.把除去氧化膜的镁条投入到盛有少量稀盐酸的试管中,发现氢气发生的速率变化情况如图2所示,其中t1~t2速率变化的主要原因是_________;t2~t3速率变化的主要原因是_________。
图2氢气发生速率变化曲线分析这类题目是讨论速率受外界条件影响而变化的图象。
因速率随时间延长先升高后降低,故速率要受反应过程中物质的浓度、温度(或压强)两种因素变化的影响。
例3.某温度下,在密闭容器里SO2、O2、SO3三种气态物质建立化学平衡后,改变条件,对反应2SO2+O22SO3(正反应放热)的正、逆反应速率的影响如右图所示。
①加催化剂对速率影响的图象是()。
②升温对速率影响的图象是()。
③增大反应容器体积对速率影响的图象是()。
④增大O2的浓度对速率影响的图象是()。
25化学平衡图像专题1.在密闭中充入A 、B 或G 、H 进行可逆反应:aA 〔g 〕+ bB 〔g 〕 gG 〔g 〕+ hH 〔g 〕+Q ,图甲、图乙分不表示在虚线所示部位改变温度〔T 学平稳与反应速率〔v 〕的阻碍〔t 表示时刻〕,那么以下结论中正确的选项是〔 〕 A .开始时充入G和H ,a+b <g+h ,Q <0 B .开始时充入G 和H ,a+b <g+h ,Q >0 C .开始时充入G 和H,a+b >g+h ,Q >0 D.开始时充入A 和B ,a+b >g+h,Q >02.在A+B C 〔正反应是放热反应〕中,如图能正确表示反应速率〔纵坐标〕与温度〔横坐标〕关系的是〔 〕3.以下反应符合如图中两个图像的是〔v 表示反应速率,P 表示压强,x%表示反应物的百分含量,t 表示时刻〕〔 〕 A .N 2O 3〔g 〕 NO 2〔g 〕+ NO 〔g 〕〔正反应吸热〕B .4NH 3〔g 〕+ 5O 2〔g〕 4NO 〔g 〕+ 6H 2O 〔吸热反应〕C .3NO 2〔g 〕+ H 2O 〔g 〕 HNO 3〔g 〕+ NO 〔g 〕〔正反应放热〕 D.CO 2〔g 〕+ C 〔s 〕2CO 〔g 〕〔正反应吸热〕4.化学反应X 2〔g 〕+ Y 2〔g 〕 2XY 〔g〕〔正反应放热〕,达到平稳状态时,如图中5〔g.可逆反应mA 〔s 〕+nB 〔g 〕 pC 〔g 〕〔正反应放热〕B .m+n <p B .n >p.x 点时混合物的v 正>v 逆D .x 点比y 点混合物的反应速率慢 7.在容积固定的密闭容器中存在如下反应:A 〔g 〕+ 3B 〔g 〕 2C 〔g 〕〔正反应放热〕,某研究小组研究了其他条件不变时,改变某一条件对上述反应的阻碍,并依照实验数据作出以下关系图:甲 乙B C DA D A CA以下判定正确的选项是〔 〕 A .图I 研究的是不同催化剂对反应的阻碍,且乙使用的催化剂效率较高B .图Ⅱ研究的是压强对反应的阻碍,且甲的压强较大C .图Ⅱ研究的是温度对反应的阻碍,且甲的温度较高D .图Ⅲ研究的是不同催化剂对反应的阻碍,且甲使用的催化剂效率较高 8.可逆反应:2X+Y 2Z 〔g 〕+Q ,气体的平均摩尔质量〔M 〕随温度变化如下图,那么以下讲法正确的选项是〔 〕 A .X 和Y 可能差不多上固体 B .X 和Y 一定差不多上气体 C .假设Y 为固体,X 一定是气体 D .X 和Y 不可能差不多上气体 【化学平稳图像专题】 1.B 、2.B 、3. C 、4. A 、5.D 、6.C D 、7. AB 、8.C 练习: 1.在恒温时,一固定容积的容器内发生如下反应:2NO 2〔g 〕N 2O 4(g),达到平稳时,再向容器内通入一定量的NO 2〔g 〕,重新达到平稳后,与第一次平稳时相比,NO 2的体积分数 〔 〕 A .不变 B .增大 C .减小 D .无法判定 2.在一密闭容器中,反应 a A 〔g 〕b B 〔g 〕达平稳后,保持温度不变,将容器体积增加一倍,当达到新的平稳时,A 的浓度变为原先的60%,那么〔 〕A .平稳向正反应方向移动了B .平稳向逆反应方向移动了C .物质B 的质量分数增加了D .a <b 3.甲为恒温恒压容器,乙为恒温恒容容器。
平衡图像1.某温度下,在体积为5L的容器中,A、B、C三种物质物
所示,则该反应的化学1质的量随着时间变化的关系如图s内用A的浓度变化和用B的浓度,2方程式为_________ 。
变化表示的平均反应速率分别为_________、_________
把除去氧化膜的镁条投入到盛有少量稀盐酸的试管中,发2.
速~t现氢气发生的速率变化情况如图2所示,其中t21速率变化的主要~t率变化的主要原因是_________;t32_________原因是。
RN(气)3.在密闭容器中进行下列反应:M(气)+
(气)+2L。
此反应符合下面图像,下列叙述是正确的是是气体(A) 正反应吸热,L 是固体(B) 正反应吸热,L 是气体(C) 正反应放热,L (D) 正反应放热,L是固体或
液体 4.已知可逆反应:
下列各图表示上述可逆反应建立平衡的过程及改变某一条件后建立起新的平衡过程的曲线:________________________。
(1)加入稀有气体后的平衡图为。
(2)降低温度后的平衡图为________________________ 3()体系加压后的平衡图为________________________。
________________________。
)升高温度后的平衡图为(4 ________________________ (5)减小生成物浓度后的平衡图为。
)加入催化剂后的平衡图为
(6________________________
1
平衡图像)下列图象中正确的Q>0g()△H=-Q((5.对于可逆反应:Ag)+3B(g2AB)322.] 是
[
)(gcC(g) dD H=Q,试根据下图回答:有可逆反应6.△
填(大、小)压强比_____________(1)(填大、小)(2)_____________体积(填高、低)℃比T℃____________)(3温度T21 Q值是_____________(填正、负)(4)【达标练习】并达到平衡,在此))2Z(气在容积固定的4L密闭容器中,进行可逆反应:X(气)+2Y(气
1.的)与时间tv(正)、v(逆的浓度改变表示的反应速率过程中,以Y) 关系如右图,则图中阴影部分面积表示(
的物质的量的减少B. YA. Y的浓度的减少
的物质的量的减少D. XC. Z的浓度的增加
(气)(气)+bB cC(气)+dD(气)△H 图所示,下列叙述正确aA2.可逆反应的是()
(A)p<p,a+b<c+d,T<T,△H<0 2211(B)p>p,a+b>c+d,T>T,△H<0
2112 2
平衡图像0 >,△Hc+d,T>T(C)p<p,a+b>2112)以上答案均不对(D
可逆反应,在(气)△H nB(气)pC3、对于mA(固)+的百分含量与压强的关系如图所示,则下列判一定温度下平衡时B 断正确的是>(B)np <p (A)m+n v (C)x点的状态是v>逆正点的反应速度慢(D)x点比y时,产物的量彧T,在温度T和(g)4.在密闭的容器中进行如下的反应:H(G+I2HI(g)2221 ) ( 时间的关系如下图所示,符合图象的正
确的判断是
H>0 A.T>T,△210 <T.T>,△HB21 0 <T,△H>C.T210
T,△H<D.T<21
,下图是某一时间段中反应速率与ΔH<02NH 5.一密封体系中发生下列反应:N +3H 2 23
反应进程的曲线关系图:
回答下列问题:(1)处于平衡状态的时间段是.______ 时刻体系中分别是什么条件发生了变化?、t、(2)tt413、、
)下列各时间段时,氨的百分含量最高的是(3______.t~.~tB ~tA.t .t Ct D~.tt65410323
3。