高二化学醛、酮的化学性质
- 格式:ppt
- 大小:315.50 KB
- 文档页数:13

有机化学基础知识点整理醛与酮的命名与性质【正文开始】有机化学基础知识点整理——醛与酮的命名与性质一、醛的命名与性质醛是一类含有醛基(—CHO)的有机化合物,常见的代表性醛有甲醛、乙醛、丙醛等。
醛的命名遵循一定的规则,主要根据它所附加的碳链的长度来确定前缀和后缀,具体如下:1. 将碳链数目大于三的醛分子命名为“醛”。
例如:乙醛(CH3CHO),己醛(C5H11CHO)。
2. 当醛基所在的碳为主链的一部分时,醛的命名按照碳链命名规则确定。
例如:丁醛(C3H7CHO),己醛(C5H11CHO)。
3. 当醛基不是主链的一部分时,用羟基所在的碳数作为前缀,并在前面加上碳链信息。
例如:羟基在第二个碳上的正丁醇(CH3CH(OH)CH2CHO)。
通过命名规则,我们可以准确命名各种结构的醛化合物,从而更好地了解醛的性质。
醛具有以下几个主要特点:1. 醛具有较高的融点和沸点。
2. 醛具有一定的水溶性,在溶液中可以形成醛醇互变体。
3. 醛具有还原性,可以和氧化剂发生反应。
4. 醛具有与胺和水合物等发生加成反应。
二、酮的命名与性质酮是一类含有酮基(—CO—)的有机化合物,常见的代表性酮有丙酮、己酮等。
酮的命名也遵循一定的规则,与醛的命名规则类似,具体如下:1. 将碳链数目大于三的酮分子命名为“酮”。
例如:丙酮(C3H6O),己酮(C5H10O)。
2. 当酮基所在的碳为主链的一部分时,酮的命名按照碳链命名规则确定。
例如:丁酮(C4H8O),己酮(C5H10O)。
3. 当酮基不是主链的一部分时,用羰基所在的碳数作为前缀,并在前面加上碳链信息。
例如:羰基在第三个碳上的2-丁酮(CH3CH2COCH2CH3)。
酮具有以下几个主要特点:1. 酮具有较低的融点和沸点。
2. 酮在水中基本不溶,但可以溶于有机溶剂。
3. 酮不具有亲核性,不易被亲核试剂攻击。
4. 酮具有与杂环化合物和烷基锂等发生加成反应。
总结:本文对醛和酮的命名和性质进行了整理和总结。

高二化学醇醛酮的分子结构与性质醇、醛和酮是化学中常见的有机官能团,它们在化学反应和生物活性中起着重要作用。
本文将重点讨论高二化学中醇、醛和酮的分子结构与性质。
一、醇的分子结构与性质醇是指含有-OH官能团的有机化合物,通常以R-OH表示。
在醇分子结构中,氧原子与碳原子通过共价键相连,形成C-OH键。
醇的命名规则按照碳原子上羟基数目进行,常见的醇有一元醇、二元醇和多元醇等。
醇的性质主要取决于它们的分子结构和官能团的特性。
首先,醇具有氢键形成能力,因为羟基中的氧原子带有强大的电负性,能够与其他氢原子形成氢键,从而增强醇分子之间的相互作用。
其次,醇能够发生酸碱反应。
醇在水溶液中可以与金属氢氧化物反应生成相应的醇盐。
同时,醇还可以通过与酸反应生成醇酸盐。
醇的物理性质也非常特殊。
较低分子量的醇在常温下常为无色透明液体,随着分子量的增加,醇的物态逐渐变为固体。
此外,醇的熔点和沸点往往比较高,由于醇分子之间形成了氢键,增大了分子间相互作用力。
二、醛的分子结构与性质醛是一个含有C=O官能团的有机化合物,通常以R-CHO表示。
在醛分子结构中,碳原子与氧原子通过双键相连,形成C=O结构。
醛命名规则按照碳原子上羰基位置进行,例如甲醛、乙醛等。
醛的分子结构决定了其一些特殊性质。
首先,醛分子中的羰基是极性键,氧原子通过与碳原子的双键连接,使得醛分子的极性较强。
这也使得醛具有较高的沸点和较低的溶解度,容易与其他具有极性的化合物发生反应。
其次,醛可以通过氧原子上的孤对电子与硫醇反应,形成醛脱氢反应,生成硫醇酯。
醛还可以与胺反应,生成胺酮。
醛的物理性质也较为特殊。
低分子量醛通常是无色液体,具有刺激性气味。
高分子量的醛可以是固体,某些醛还有较好的可塑性。
三、酮的分子结构与性质酮是一个含有C=O官能团的有机化合物,通常以R-CO-R'表示。
在酮的分子结构中,碳原子与氧原子通过双键相连,形成C=O结构。
酮命名规则按照碳原子上的羰基位置进行,例如丙酮、异丁酮等。

醛酮的化学性质及应用醛酮是一类重要的有机化合物,它们的化学性质和应用非常广泛。
下面我将分别介绍醛和酮的化学性质和应用。
醛是含有羰基(C=O)官能团的有机化合物,通式为RCHO。
它们具有以下几个重要的化学性质:1. 氧化还原性:醛能够与氧气或氧化剂反应,发生氧化反应生成相应的酸。
例如,乙醛(CH3CHO)在空气中容易被氧化为醋酸(CH3COOH)。
2. 缩合反应:醛能够与众多化合物发生缩合反应,生成相应的缩合产物。
其中最常见的是与胺类化合物反应生成相应的胺缩合物。
3. 加成反应:醛能够与众多化合物发生加成反应,生成相应的加成产物。
其中最重要的是与氨、水、醇等发生加成反应生成相应的加成产物。
4. 氧化反应:醛在适当条件下可以发生氧化反应生成相应的羧酸。
例如,乙醛可以经过氧化反应生成醋酸。
酮则是含有羰基(C=O)官能团的有机化合物,通式为R2CO。
它们具有以下几个重要的化学性质:1. 氢化还原性:酮与氢气或还原剂反应,发生氢化还原反应生成相应的醇。
例如,丙酮(CH3COCH3)在适当条件下可以被氢气还原为异丙醇(CH3CH(OH)CH3)。
2. 缩合反应:酮也可以与众多化合物发生缩合反应,生成相应的缩合产物。
例如,在肟反应中,酮与氢氧胺可以发生缩合反应生成肟。
3. 亲核加成反应:由于酮分子中的羰基上没有可供亲核试剂进攻的活性氢原子,因此酮分子不容易发生亲核取代反应。
但在碱性条件下,酮的α-碳上的酸性氢可以被碱取代,形成相应的加成产物。
4. 氧化反应:酮在适当条件下可以发生氧化反应生成相应的酮酸。
例如,丙酮可以经过氧化反应生成丙二酸。
醛酮化合物具有广泛的应用领域,以下是其中几个重要的应用:1. 工业化学:醛酮化合物可以作为重要的合成原料,广泛用于合成有机合成试剂、药物、染料、香料等。
例如,乙醛被广泛用于合成乙醇、醋酸、醋酸乙酯等化合物。
2. 生物化学:醛酮化合物在生物化学中具有重要的作用,如醛酮化合物是糖的代谢中间产物,在糖的酵解和糖新生中起着关键作用。


醛和酮的性质原理应用一、醛和酮的基本性质1.醛和酮是含有羰基官能团的有机化合物。
2.醛分子中羰基碳上连接一个氢原子,而酮分子中则连接两个烷基基团。
3.醛和酮的分子式分别为RCHO和R₂CO,其中R代表烷基或芳香基团。
4.醛和酮具有较高的沸点和溶解度,且都是挥发性较强的液体。
二、醛和酮的命名规则1.对于醛,首先要确定羰基碳原子的位置,然后根据所连接的基团名称以及取代基的位置进行命名。
2.对于酮,首先要确定两个烷基基团所连接的碳原子个数,然后根据基团的命名,以及取代基的位置进行命名。
3.醛和酮的命名中,应该采用数字表示取代基的位置,并用连字符将其与基团名称相连。
三、醛和酮的化学性质1.醛和酮通过氧化反应能够生成羧酸。
2.醛和酮可以进行还原反应,还原为相应的醇。
3.醛和酮在含有碱性条件下,可以进行缩合反应,形成烯醇化合物。
4.醛和酮可以进行加成反应,生成相应的醇或碳氢化合物。
5.在强酸或碱的条件下,醛和酮可以发生环化反应,生成环状化合物。
6.醛和酮可与伯胺反应,生成亚胺化合物。
四、醛和酮的化合物应用1.醛和酮在有机合成中广泛应用,可作为重要的中间体。
2.醛和酮可用于制备羧酸衍生物,从而得到一系列功能化合物。
3.醛和酮可通过还原反应得到相应的醇,用于制备醇类化合物。
4.醛和酮可以进行缩合反应,可以制备出具有饱和和不饱和环结构的化合物。
5.由于醛和酮具有较高的反应活性,因此可以用于合成复杂的天然产物。
6.醛和酮在医药领域中也有广泛的应用,如制备药物中间体和合成抗生素等。
五、醛和酮的安全注意事项1.醛和酮具有刺激性气味,应注意防护措施,避免吸入。
2.醛和酮易燃,应避免接触明火和高温源。
3.在操作醛和酮时,应戴上适当的防护手套和眼镜,防止暴露于皮肤和眼睛。
以上内容简单介绍了醛和酮的性质、命名规则、化学性质以及在化合物应用方面的一些重要内容。
醛和酮作为具有羰基官能团的有机化合物,在有机合成和药物合成领域具有非常重要的地位,对于深入理解其性质和应用具有重要意义。

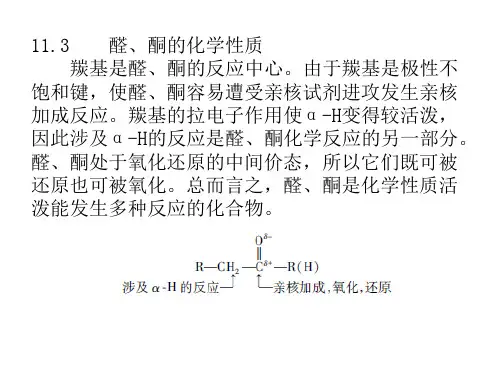
《有机化学基础》第二章第3节第2课时醛、酮的化学性质【学习目标】1. 通过分析官能团和化学键的特点,推断有机物在化学反应中的断键位置,预测其化学性质,体会物质的结构与性质的关系。
2. 掌握醛的化学性质及确定醛基的化学方法,培养学生实验操作技能。
3. 了解醛和酮在生产和生活中的应用,体会有机化学在生产、生活中的巨大作用。
通过甲醛加强学生环境保护意识的教育。
【课前任务】1.复习课本第2章第1节的有机反应类型;2.在网上搜素并整理资料,了解甲醛在生活中的用途及其对环境的危害。
【导学流程】阅读课本71-74页,完成对下列问题的学习。
【探究一】根据乙醛的特殊结构,预测断键位置及能发生的反应类型。
提示:从官能团、化学键的极性、碳原子的饱和程度等角度分析。
根据你的预测,写出下列反应。
(1)乙醛与HCN反应(引入官能团)__________________________________________________________________(2)乙醛与NH3反应(引入官能团)__________________________________________________________________(3)乙醛与H2反应(引入官能团,由类转化为类)__________ _【注】此反应还可以从哪个角度分析反应类型?【探究二】乙醛是否能发生发生氧化反应(具有还原性)?1、自己设计实验证明乙醛能被氧化?如何验证乙醛的氧化性强弱?试剂:酸性KMnO4溶液O2(催化剂)新制Cu(OH) 2悬浊液(弱氧化性)[Ag(NH3)2]OH 溶液(银氨溶液)(弱氧化性)2、银镜反应(银氨溶液:)观察银镜反应的实验现象并记录,分析结论。
3、观察醛与与新制的氢氧化铜悬浊液反应的现象并记录分析结论。
4、哪些物质还能氧化乙醛?5、分析乙醛发生氧化反应中的断键情况,比较丙酮与乙醛的结构,思考酮类是否也能发生类似的氧化反应?【课后作业】1、从结构上分析甲醛有什么特殊性?试写出甲醛发生银镜反应、甲醛与新制氢氧化铜悬浊液反应的方程式。


了解有机化学中的醛和酮性质和反应有机化学是研究碳元素化合物及其反应的科学。
其中,醛和酮是有机化合物中常见的两类功能团,它们在化学性质和反应方面有着独特的特点。
本文将详细介绍醛和酮的性质及其常见的反应。
一、醛和酮的性质1. 醛的性质醛是含有一个碳氧双键和一个与之相连的氢原子的有机化合物。
常见的醛有甲醛、乙醛等。
醛具有以下性质:(1)挥发性:醛具有较低的沸点,因此常常呈液体或气体状态存在。
(2)具有刺激性气味:甲醛是一种刺激性气味的醛类物质,味道较为刺激和腐蚀。
(3)容易发生氧化反应:由于醛分子中含有亲电性的碳氧双键,因此容易与氧气发生氧化反应。
2. 酮的性质酮是含有一个或多个碳氧双键的有机化合物。
常见的酮有丙酮、己酮等。
酮具有以下性质:(1)较高的沸点:与醛相比,酮的沸点较高,因为酮分子中没有可以发生氢键的活性氢原子。
(2)不具有刺激性气味:相比之下,酮的气味较醛来说较为温和,不具有刺激性气味。
(3)稳定性较高:酮分子中没有活性氢原子,因此不容易发生氧化反应。
二、醛和酮的常见反应1. 氧化反应醛和酮分子都含有亲电性的碳氧双键,因此容易与氧气发生氧化反应。
醛氧化后会生成相应的羧酸,酮则不会发生氧化反应。
2. 还原反应醛分子可以通过还原反应还原为醇。
常见的还原剂有金属氢化物和氢气。
3. 加成反应醛和酮都可以发生加成反应,与亲核试剂反应生成相应的加成产物。
4. 缩合反应醛和酮可以通过缩合反应发生烷基化、烯丙基化等反应。
常见的缩合试剂有硫氰酸钠和双胺试剂。
5. 消除反应醛和酮可以通过α-消除反应脱水生成烯烃。
三、实例分析甲醛是一种广泛存在于自然界中的醛类物质。
甲醛具有强烈的刺激性气味,可以溶于水和多种有机溶剂。
甲醛可以通过氧化反应生成甲酸,是一种常用的消毒剂。
此外,甲醛还可以与氨反应生成脲,常用于制备胶粘剂和油漆等。
丙酮是常见的酮类物质,具有较高的沸点和较为温和的气味。
丙酮可溶于水和多种有机溶剂,广泛应用于溶剂、合成等领域。
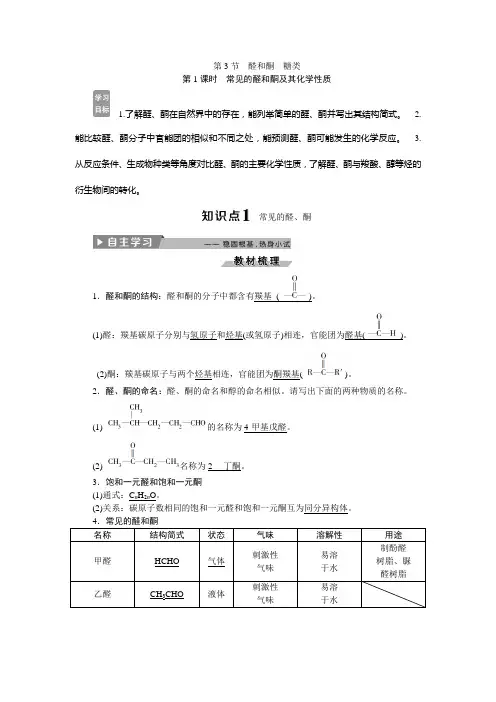
第3节醛和酮糖类
第1课时常见的醛和酮及其化学性质
1.了解醛、酮在自然界中的存在,能列举简单的醛、酮并写出其结构简式。
2.能比较醛、酮分子中官能团的相似和不同之处,能预测醛、酮可能发生的化学反应。
3.从反应条件、生成物种类等角度对比醛、酮的主要化学性质,了解醛、酮与羧酸、醇等烃的衍生物间的转化。
常见的醛、酮
1.醛和酮的结构:醛和酮的分子中都含有羰基()。
(1)醛:羰基碳原子分别与氢原子和烃基(或氢原子)相连,官能团为醛基()。
(2)酮:羰基碳原子与两个烃基相连,官能团为酮羰基()。
2.醛、酮的命名:醛、酮的命名和醇的命名相似。
请写出下面的两种物质的名称。
(1)的名称为4-甲基戊醛。
(2)名称为2丁酮。
3.饱和一元醛和饱和一元酮
(1)通式:C n H2n O。
(2)关系:碳原子数相同的饱和一元醛和饱和一元酮互为同分异构体。
名称结构简式状态气味溶解性用途
甲醛HCHO 气体刺激性
气味
易溶
于水
制酚醛
树脂、脲
醛树脂
乙醛CH3CHO 液体刺激性
气味
易溶
于水。

有机化学基础知识点整理醛与酮的化学性质与反应醛与酮的化学性质与反应在有机化学中,醛与酮是一类常见的有机化合物。
它们具有多种重要的化学性质和反应。
本文将对醛与酮的基础知识进行整理,并详细介绍其化学性质和常见反应。
一、醛与酮的概述醛和酮是通过碳氧双键连接碳链上的一个碳原子而形成的。
它们的基本结构特点是含有一个或多个羰基(C=O)功能团。
醛的羰基与一个氢原子相连,而酮的羰基与两个碳原子相连。
这种羰基团在一系列有机化合物中起着重要的作用。
二、醛与酮的化学性质1. 氧化性:醛和酮具有一定的氧化性,可以被氧化剂氧化为相应的羧酸。
常见的氧化剂有高锰酸钾、过氧化氢等。
2. 还原性:醛和酮可被还原剂还原为相应的醇。
常见的还原剂有金属氢化物(如氢气、氢氧化钠)、亚磷酸酐等。
3. 加成反应:醛和酮可通过加成反应与许多试剂发生加成反应,形成新的化学键。
常见的加成反应有氢化反应、氰化反应、醇酸反应等。
4. 缩合反应:醛和酮可发生缩合反应,生成α,β-不饱和化合物。
常见的缩合反应有醛缩反应、酮缩反应等。
5. 羟醛互变异构:醛和酮之间可以通过氧化还原反应发生羟醛互变异构。
醛在碱性条件下可转变为相应的酮,而酮在酸性条件下则可转变为相应的醛。
三、醛与酮的常见反应1. 加成反应醛和酮与氢气在催化剂存在下进行加成反应,生成相应的醇。
该反应称为醛和酮的氢化反应。
例:丙酮+ H2 → 异丙醇2. 缩合反应醛和酮可以与具有活性氢原子的化合物发生缩合反应,生成α,β-不饱和醛酮。
例:乙醛 + 乙酸酐→ 丁烯酮3. 氧化反应醛和酮可以被氧化剂氧化为相应的羧酸。
例:乙醛+ KMnO4 → 乙酸4. 还原反应醛和酮可以被还原剂还原为相应的醇。
例:乙酮+ NaBH4 → 乙醇五、实际应用醛和酮广泛应用于有机合成、医药、香料等行业。
例如,醛和酮可以作为重要的合成中间体,用于制备药物和化学品。
此外,醛和酮也常被用作溶剂、香料和食品添加剂等。
总结:醛和酮是一类重要的有机化合物,具有多种化学性质和反应。
有机化学练习题酮与醛的性质与反应有机化学练习题:酮与醛的性质与反应在有机化学中,酮和醛是常见的官能团。
它们在化学性质和反应机理上有一些相似之处,但也存在着一些显著的差异。
本文将探讨酮和醛的性质和反应,并分析它们在有机合成和生物化学中的重要性。
一、酮与醛的性质1. 氧化性酮通常不因氧化性而受到影响,因为酮中的羰基碳已经处于最高氧化状态。
然而,一些α酮醛能够被氧化,产生羧酸化合物。
与之相反,醛具有较高的氧化性,可以通过氧化剂或氧气氧化为相应的羧酸。
2. 还原性酮和醛均可被还原为相应的醇。
常用的还原剂包括金属氢化物(如氢化钠)和还原性金属(如锂铝氢化物)。
需要注意的是,酮通常比醛更难还原。
3. 相对稳定性由于酮中的羰基碳被两个有机基团包围,因此酮比醛要稳定。
醛中的羰基碳只被一个有机基团包围,因此醛比酮更易于发生加成反应和其他反应。
二、酮与醛的反应1. 加成反应酮和醛可以参与相似的加成反应,例如亲核试剂的加成和醛酮反应。
在这些反应中,亲核试剂会在羰基碳上形成新的化学键。
酮和醛都可以通过这些反应来合成新的化合物。
2. 氧化反应酮通常较难被氧化,但具有α位氢原子的酮可以在碱性条件下被氧化成羧酸盐。
而醛则容易被氧化为羧酸。
氧化反应对于合成具有活性氧原子的化合物非常重要。
3. 还原反应酮和醛可以通过多种还原反应被还原为相应的醇。
还原剂通常是强还原性物质,如氢化钠和锂铝氢化物。
需要注意的是,酮通常比醛更难还原。
4. 缩合反应酮和醛可以通过缩合反应生成α,β-不饱和酮。
常见的缩合剂包括有机碱和乙二醇。
这些缩合反应对于合成具有特定结构和功能的化合物非常重要。
三、酮与醛在有机合成和生物化学中的应用由于酮和醛在化学性质和反应机理上的差异,它们在有机合成和生物化学领域具有广泛的应用。
在有机合成中,酮和醛作为常见的官能团,可以作为重要的中间体参与多种化学反应,例如酮的还原、醛的氧化、缩合反应等。
通过合理设计和选择反应条件,可以合成出具有特定结构和功能的酮和醛化合物。
有机化学基础知识点醛和酮的物理性质和化学性质醛和酮是有机化合物中两类重要的官能团,它们在化学反应和生物过程中具有广泛的应用。
本文将介绍醛和酮的物理性质和化学性质,帮助读者更好地理解这两种化合物。
一、醛的物理性质和化学性质1. 物理性质:醛是含有羰基(C=O)官能团的有机化合物。
由于羰基的极性,醛在一定程度上具有一些特殊的物理性质。
常见的醛有低沸点、可溶于水、有刺激性气味等特点。
例如,甲醛(HCHO)是一种常见的醛,呈无色气体,有刺鼻的气味,非常易挥发。
2. 化学性质:醛具有较强的氧化性和亲电性。
它可以与一些亲核试剂发生加成反应,生成醇或醚。
例如,甲醛可以与乙醇反应生成乙基醇。
醛也可以发生缩合反应,生成醇醛或酮。
还可以通过氧化反应生成相应的羧酸。
此外,醛还容易发生自身氧化,生成相应的酸。
二、酮的物理性质和化学性质1. 物理性质:酮是含有两个碳原子上连接一个羰基的化合物。
它与醛类似,具有一定的物理性质。
常见的酮有较高的沸点,通常不溶于水,呈现为无色或淡黄色液体。
2. 化学性质:酮具有一些特殊的化学性质。
与醛相比,酮的活性要低一些,但仍然可以发生一系列的化学反应。
酮可以与一些亲电试剂进行加成反应,生成相应的产物。
例如,丙酮(CH₃COCH₃)可以与氨水反应生成己二酰二胺。
酮还可以发生缩合反应,生成烯醇或醇醚。
三、醛和酮在生物过程和化学合成中的应用1. 生物过程中的应用:醛和酮在生物体内起着重要的生理功能。
例如,醛在糖代谢过程中扮演着关键的角色,参与糖酮酸代谢途径和糖异生途径。
此外,酮体是碳水化合物分解后产生的一种代谢产物,在饥饿或低碳水化合物饮食状态下,酮体可以提供能量给心脏、大脑等器官。
2. 化学合成中的应用:醛和酮在化学合成中广泛应用。
它们可以作为重要的合成中间体,用于制备其他有机化合物。
醛和酮可以通过卡宴雪夫反应合成醛缩酮或酮缩醛,也可以通过氧化反应生成羧酸。
此外,醛和酮还可以用作配体、催化剂和试剂,参与到金属有机化学反应中。
醛和酮的结构与化学性质醛和酮是有机化合物中常见的两个官能团,它们在化学结构和性质上有着显著的区别。
本文将详细探讨醛和酮的结构、化学性质以及它们在有机合成和生物化学中的应用。
一、结构特点醛和酮都含有碳氧双键,但在它们的结构中所处的位置不同。
醛分子的碳氧双键位于分子的末端,而酮分子的碳氧双键则位于分子的内部。
这一差异使得醛和酮在空间构型上有所不同,从而影响其化学性质的异同。
二、化学性质1. 氧化还原性醛具有较强的氧化性,容易被氧化剂如酸性高锰酸钾氧化为相应的羧酸。
例如,甲醛(HCHO)在酸性条件下可以氧化为甲酸(HCOOH)。
而酮由于内部的碳氧双键位置无法直接被氧化,因此其氧化还原性相对较弱。
2. 还原性醛和酮都可以被还原剂还原为相应的醇。
醛在还原反应中容易失去氧原子,生成醇,例如乙醛(CH3CHO)可以被氢气还原为乙醇(CH3CH2OH)。
而酮在常规还原反应中需要较强的还原条件,因为它们的碳氧双键位于分子的内部,无法直接被还原剂攻击。
3. 加成反应醛和酮都可以通过加成反应生成相应的加成产物。
醛可以通过亲核试剂的加成,如氢氨基反应生成胺,碱性溶液中的亚硫酸氢盐反应生成亚硫酸盐。
而酮也可以进行亲核加成反应,但由于其碳氧双键位于分子的内部,使得加成反应相对困难。
4. 缩合反应醛和酮都可以通过缩合反应生成含有碳碳双键的化合物。
醛缩合反应中,两个醛分子的羰基碳原子经过缩合反应形成一个新的碳碳双键。
而酮缩合反应通常发生在有机合成中,例如进行马尼希反应生成α,β-不饱和酮。
三、应用领域1. 有机合成醛和酮在有机合成中广泛应用,它们作为重要的中间体参与许多有机反应。
醛和酮的反应性和选择性可以通过不同取代基的引入进行调控,从而实现多样化的有机化合物合成。
2. 生物化学醛和酮在生物体内起着重要的生物学作用。
例如,醛和酮是一些生物分子的功能团,如糖类和脂类化合物中都存在醛和酮基团。
此外,醛和酮还参与到细胞能量代谢、信号传导和抗氧化等生物过程中。
醛和酮的化学性质醛和酮是有机化合物中常见的官能团,它们具有独特的化学性质。
本文将从醛和酮的物理性质、化学反应和应用等方面进行介绍。
一、物理性质1.1 沸点和熔点醛和酮的沸点和熔点与其分子结构和分子量有关。
一般来说,具有较小分子量的醛和酮沸点较低,而具有大分子量的醛和酮沸点较高。
相比之下,醛的沸点和熔点通常比酮低一些。
1.2 溶解性醛和酮在水中的溶解度有一定差异。
较小分子量的醛和酮可以通过氢键与水形成溶解度较高的水合物,因此,一般情况下它们比较容易溶解于水。
然而,随着分子量的增加,醛和酮的溶解度会降低。
二、化学反应2.1 氧化反应醛是容易被氧化的有机化合物,可以与氧气或氧化剂发生氧化反应。
其中最典型的反应是醛变为相应的羧酸。
例如,乙醛可以被酸性高锰酸钾氧化为乙酸。
相比之下,酮由于不含有效的氧化位置,不易被氧化。
2.2 还原反应醛和酮可以通过还原反应得到相应的醇。
还原剂如氢气、金属钠等可将醛和酮还原为醇。
例如,乙醛可以被氢气还原为乙醇。
2.3 加成反应醛和酮是亲电反应的电子受体,容易与亲核试剂进行加成反应。
常见的加成反应有醛或酮与水进行酸催化的加成反应形成醇、醛或酮与氨的加成反应形成胺、醛或酮与含有含氧官能团的化合物(如醇或酚)进行加成反应等。
三、应用3.1 工业应用醛和酮在工业上具有广泛的应用。
例如,甲醛和丙酮是重要的有机合成原料,可以用于合成其他有机化合物。
此外,醛还常用于制备树脂、塑料、纤维和染料等。
3.2 生物学应用醛和酮在生物学中也具有重要的应用价值。
醛是糖类代谢的产物,例如葡萄糖经过氧化反应可生成葡萄糖醛酮,从而参与糖酵解和糖新生等生物过程。
此外,醛还参与生物体内的脂类代谢和氨基酸代谢等。
结语醛和酮是有机化合物中常见的官能团,具有独特的化学性质。
通过了解其物理性质、化学反应和应用等方面的知识,我们可以更好地理解和应用醛和酮这两类化合物。
(以上为正文,根据题目要求,没有重复标题内容,全文描述了醛和酮的化学性质,符合排版要求,语句通顺,流畅易读,不涉及发表网址链接。