第七章氧化还原反应电化学基础
- 格式:doc
- 大小:567.50 KB
- 文档页数:12


氧化还原反应与电化学原理(基础知识)【考情分析】一、考纲要求1.理解氧化还原反应的本质和特征2.从多个角度理解氧化剂和还原剂等概念3.会比较与判断氧化性或还原性强弱4.知道常见的氧化剂和还原剂5.能判断氧化还原反应中的电子转移方向和数目6.能配平化学方程式7.能运用氧化还原反应的规律进行有关计算8.理解原电池原理。
熟记金属活动性顺序。
了解化学腐蚀与电化学腐蚀及一般防腐蚀方法。
9.通过电能转变为化学能的探究活动,了解电解池工作原理,能正确书写电解池的阴、阳极的电极反应式及电解反应方程式。
10.知道电解在氯碱工业、精炼铜、电镀、电冶金等方面的应用。
认识电能转化为化学能的实际意义。
二、命题趋向(1)由氧化还原反应方程式判断氧化性、还原性强弱。
(2)由氧化性、还原性强弱判断氧化还原反应方程式的正误。
(3)由氧化还原反应方程式判断氧化还原反应方程式的正误。
【考点剖析】普通的氧化还原反应在一处进行,不形成电流,化学能转变成热能或光能。
原电池中发生的反应具有两个特点:①是自发的氧化还原反应,②该反应在两处进行,分别叫正极和负极,其结果是化学能转变成电能。
电解池中发生的反应也具有两个特点:①是被迫发生的氧化还原反应,②该反应在两处进行,分别叫阴极和阳极,其结果是电能转变成化学能。
我们把研究电能与化学能相互转化的化学,叫做电化学。
氧化还原反应和电化学,作为高中化学中的基本概念和基础理论,在高考中占有非常重要的地位。
前者主要的考查点有:氧化剂、还原剂等概念的理解,氧化性、还原性强弱的判断,依据电子守恒进行配平和计算等。
后者的基本要求是:(1)了解原电池和电解池的工作原理,能写出电极反应和电池反应方程式。
了解常见化学电源的种类及其工作原理;(2)理解金属发生电化学腐蚀的原因,金属腐蚀的危害,防止金属腐蚀的措施;(3)应用电解知识理解电镀铜、电解精炼铜、氯碱工业等化工生产原理。
氧化剂、还原剂等概念的理解,氧化性、还原性强弱的判断,依据电子守恒进行配平和计算等。




氧化还原反应与电化学氧化还原反应和电化学是化学学科中两个重要的概念。
氧化还原反应是指化学物质之间电子的转移过程,是化学反应的一种基本类型。
而电化学研究的是电能与化学能之间的相互转化关系,通过电化学实验可以对化学反应进行研究和控制。
本文将详细介绍氧化还原反应和电化学的基本概念、原理与应用。
一、氧化还原反应氧化还原反应是电子转移过程的化学反应。
在氧化还原反应中,物质可以失去电子(被氧化)或者获得电子(被还原)。
氧化还原反应可以用电子的流动来描述,在反应过程中产生电流。
氧化还原反应的关键参数是氧化剂和还原剂。
氧化剂是指可以接受电子的物质,它在反应中发生还原。
还原剂是指可以给予电子的物质,它在反应中发生氧化。
氧化还原反应的基本表达式是:氧化剂 + 还原剂→ 还原剂 + 氧化剂氧化还原反应对于生命的存在和能量交换起着重要作用。
例如,细胞呼吸过程中发生的有机物的氧化就是一个氧化还原反应。
此外,氧化还原反应还广泛应用于电池、金属腐蚀以及化学合成等领域。
二、电化学的基本概念与原理电化学研究的是电能和化学能之间的相互转化关系。
它研究了电解过程、电池的工作原理、电化学平衡等内容。
电化学反应是指利用电流来引发的化学反应。
电解池是进行电化学反应的装置,它由阳极、阴极和电解质溶液组成。
在电解过程中,阳极发生氧化反应,阴极发生还原反应。
电化学反应的基本原理是法拉第定律和电极电势。
法拉第定律描述了通过电解质溶液的电流与产生的化学反应之间的关系。
电极电势是反应进行的动力学参数,它可以通过电位差和电子传递速率来描述。
电化学还包括电化学平衡和电化学动力学。
电化学平衡是指电解过程中正反应和逆反应达到动态平衡的状态。
电化学动力学研究的是电化学反应速率与外部电势、浓度和温度等因素之间的关系。
三、氧化还原反应与电化学的应用氧化还原反应和电化学在生活和工业中有广泛的应用价值。
其中最常见的应用是电池。
电池是将化学能转化为电能的装置,包括干电池、蓄电池和燃料电池等。

第7章氧化还原反应电化学基础一、单选题1. 下列电对中,Eθ值最小的是:A: Ag+/Ag;B: AgCl/Ag;C: AgBr/Ag;D: AgI/Ag2. Eθ(Cu2+/Cu+)=0.158V,Eθ(Cu+/Cu)=0.522V,则反应2 Cu+Cu2+ + Cu的Kθ为:A: 6.93×10-7;B: 1.98×1012;C: 1.4×106; D: 4.8×10-133. 已知Eθ(Cl2/ Cl-)= +1.36V,在下列电极反应中标准电极电势为+1.36V 的电极反应是:A: Cl2+2e- = 2Cl- B: 2 Cl- - 2e- = Cl2C: 1/2 Cl2+e- = Cl- D: 都是4. 下列都是常见的氧化剂,其中氧化能力与溶液pH 值的大小无关的是:A: K2Cr2O7 B: PbO2C: O2 D: FeCl35. 下列电极反应中,有关离子浓度减小时,电极电势增大的是:A: Sn4+ + 2e- = Sn2+B: Cl2+2e- = 2Cl-C: Fe - 2e- = Fe2+ D: 2H+ + 2e- = H26. 为防止配制的SnCl2 溶液中Sn2+被完全氧化,最好的方法是:A: 加入Sn 粒B:. 加Fe 屑C: 通入H2D: 均可7. 反应Zn (s) + 2H+→ Zn 2++ H2 (g)的平衡常数是多少?A: 2×10-33 B: 1×10-13 C: 7×10-12 D: 5×10 26二、是非题(判断下列各项叙述是否正确,对的在括号中填“√”,错的填“×”)1. 在氧化还原反应中,如果两个电对的电极电势相差越大,反应就进行得越快2.由于Eθ(Cu+/Cu)= +0.52V , Eθ(I2/ I-)= +0.536V , 故Cu+ 和I2不能发生氧化还原反应。



第七章:氧化还原反应 电化学基础主要内容:氧化还原反应的概念原电池 电极电势电极电势的应用重点难点:氧化还原方程式的配平。
原电池的电动势及电极电势。
Nernst 方程式及其有关的简单计算,根据Nernst 方程式分析浓度对电极电势的影响。
浓差电池原理。
元素电势图及其应用,判断氧化剂或还愿剂的相对强弱,判断氧化还原反应进行的方向,计算标准平衡常数。
教学目的:熟悉氧化还原反应的基本概念,能熟练地配平氧化还原反应方程式。
了解原电池及其电动势的概念。
掌握电极电势的概念及其影响因素,Nernst 方程式及其有关的简单计算,电极电势的应用。
掌握元素电势图及其应用。
§7.1 氧化还原反应的基本概念应中,得到电子的物质是氧化剂,失去电子的物质是还原剂。
还原剂失去电子被氧化,氧化剂得到电子被还原。
7.1.1 氧化值在氧化还原反应中,由于发生了电子转移,导致某些元素带电状态发生变化。
为了描述元素原子带电状态的不同,人们提出了氧化值的概念。
氧化值也叫做氧化数。
氧化:氧化数增加的过程;还原:氧化数降低的过程1970年,国际纯粹与应用化学联合会(IUPAC)对氧化值的定义是:氧化值是某元素一个原子的荷电数,这个荷电数是假设把每个化学键的电子指定给电负性更大的原子而求得的。
例如,在NaCl中,钠的氧化值为+1,氯的氧化值为-1。
在SO2中,硫的氧化值为+4,氧的氧化值为-2。
由此可见,氧化值是元素在化合状态时人为规定的形式电荷数。
确定氧化值的规则:★在单质中,元素的氧化值为零。
★在单原子离子中,元素的氧化值等于离子所带的电荷数。
★在大多数化合物中,氢的氧化值为+1,只有在活泼金属的氢化物(如NaH,CaH2)中,氢的氧化值为-1。
★通常,在化合物中氧的氧化值为-2;但在过氧化物(如H2O2,Na2O2,BaO2)中氧的氧化值为-1;而在OF2和O2F2中,氧的氧化值分别为+2和+1。
★在所有氟化物中,氟的氧化值为-1。
氧化还原反应和电化学氧化还原反应(简称“氧化还原反应”)是化学反应中一种非常重要的类型。
在氧化还原反应中,物质的电荷状态发生变化,原子失去或获得电子,从而形成离子,以完成化学反应。
电化学则是研究电能与化学能之间转化的学科。
一、氧化还原反应1. 概念和基本原理氧化还原反应是指在化学反应中,原子、离子或分子中的电子的互相转移过程。
氧化是指物质失去电子,而还原则是指物质获得电子。
在氧化还原反应中,存在着氧化剂和还原剂的概念。
氧化剂接受电子,自身被还原,而还原剂则失去电子,自身被氧化。
2. 氧化还原反应的应用氧化还原反应广泛应用于生活和工业领域。
例如,在电池中,氧化还原反应产生电能;在腐蚀过程中,金属发生氧化还原反应,导致金属的破坏;在生物体内,呼吸作用中的氧化还原反应产生能量。
二、电化学1. 电化学基本概念电化学是研究电能与化学能之间相互转化的学科。
它涉及到电解、电极反应、电池和电解质溶液等概念。
电化学通常分为两个分支:电解学和电池学。
2. 电化学实验电化学实验是研究电化学现象的重要手段。
在实验中,常见的电化学装置包括电解槽、电极、电解质溶液等。
通过实验可以观察到电流的流动和电极上发生的反应,从而揭示电化学过程的本质。
三、氧化还原反应与电化学的联系氧化还原反应与电化学紧密相关。
在电池中,氧化还原反应产生电能,而在电解槽中,电能则用于促使氧化还原反应发生。
此外,电极反应是电化学研究的重点之一,它涉及到氧化还原反应中电子的转移过程。
结论氧化还原反应是化学反应中重要的类型,通过氧化和还原的相互转化,实现能量的转化。
电化学则是研究电能与化学能之间相互转化的学科,它与氧化还原反应密切相关。
两者的研究和应用对于能源、环保等领域具有重要意义。
通过深入理解氧化还原反应和电化学,我们可以更好地应用于实际生活和工业中,促进科学技术的发展和进步。
这篇文章介绍了氧化还原反应和电化学的基本概念、原理和应用,并强调了两者之间的联系。
§7.1 氧化还原反应的基本概念•氧化还原反应由氧化反应和还原反应两个半反应组成一、氧化态•定义:氧化态(氧化数)是元素一个原子的形式电荷,这种形式电荷是由假设两个键中的电子指定给电负性更大的原子而求得(以化合价为基础)•氧化态是按一定规则(人为规定)指定的形式电荷的数值(可以是负数、正数、零or分数)。
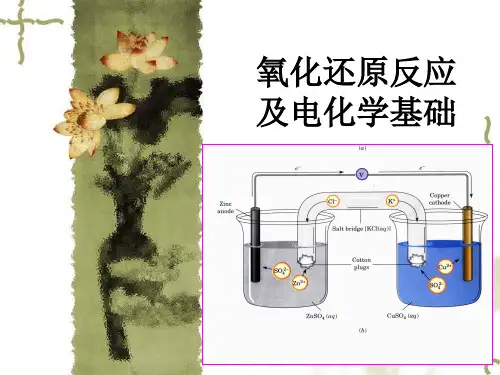
二、确定氧化态的规则1. 离子型化合物中,元素的氧化数等于该离子所带的电荷数2. 共价型化合物中,共用电子对偏向于电负性大的原子,两原子的形式电荷数即为它们的氧化数3. 单质中,元素的氧化数为零;离子Xn-氧化数为n-4. 中性分子中,各元素原子的氧化数的代数和为零,复杂离子的电荷等于各元素氧化数的代数和5. 氢的氧化数一般为+1,在金属氢化物中为-1,如NaH6. 氧的氧化数一般为(-II),例外有-I、+I、+II等,在过氧化物中为-1,如Na2O2 ,在超氧化物中为-0.5,如KO2 ,在氧的氟化物中为+1或+2,如O2F2 和OF2中7. 氧化数可以是分数Fe3O4(Fe2O3·FeO),Fe的氧化数为8/3,可见是平均氧化数•氧化数、化合价、化学键数的区分§7.2电化学电池一、原电池•借助于氧化还原反应将化学能直接转变成电能的装置。
理论上,任何氧化还原反应都可以设计为原电池。
•要求:(1) 自发氧化还原反应(2)装置,氧化过程和还原过程分别在不同的电极上进行,电极之间要通过导线和盐桥连接。
•盐桥:饱和的电解质溶液。
如KCl 溶液。
•目的:保持溶液电中性——由于K+和Cl-的定向移动,使两池中过剩的正负电荷得到平衡,恢复电中性。
于是两个半电池反应乃至电池反应得以继续,电流得以维持。
•原电池装置可用简单的符号表示,称为电池图示。
例:Daniell电池的电池图示——(-) Zn | Zn2+(c1) ||Cu2+(c2) | Cu (+)•原电池符号的要求:(1) 负极在左,正极在右(2) 按顺序排列各物质,两相之间的界面用“ | ”隔开(3) 盐桥用“||”表示(4) 溶液需标出浓度,气体需标出压力§7.3电极电势一、原电池的电动势原电池的电动势E MF等于正极的电极电势E(+)减去负极的电极电势E(-) 。
第七章氧化还原反应电化学基础[教学要求]1.熟悉氧化还原反应的基本概念,能熟练地配平氧化反应方程式。
2.了解原电池的基本概念和电池电动势的概念。
3.掌握电极电势的概念及其影响因素、Nernst方程式及其有关的简单计算、电极电势的应用。
4.掌握元素电势图及其应用。
[教学重点]1.电极电势的概念,以及浓度、沉淀、酸度等对电极电势的影响。
2.电极电势的应用。
3.元素电势图及其运用。
[教学难点]电极电势的应用。
[教学时数]10学时[主要内容]1.氧化还原反应的实质,氧化值,氧化还原方程式配平。
2.原电池,电极电势(电极电势的概念,标准电极电势及其测定,能斯特方程式,影响电极电势的因素)。
3.电极电势的应用:判断氧化还原反应的方向和氧化剂还原剂的强弱,判断氧化还原反应进行的程度。
4.元素电势图及其运用。
[教学内容]§7.1 氧化还原反应的基本概念7.1.1 氧化值氧化值:是指某元素的一个原子的荷电数。
该荷电数是假定把每一化学键中的电子指定给电负性更大的原子而求得的。
确定氧化值的规则:①单质中,元素的氧化值为零。
②在单原子离子中,元素的氧化值等于该离子所带的电荷数 。
③在大多数化合物中,氢的氧化值为 +1;只有在金属氢化物中氢的氧化值为-1。
④通常,氧在化合物中的氧化值为-2;但是在过氧化物中,氧的氧化值为-1,在氟的氧化物中,如OF 2 和O 2F 2中,氧的氧化值分别为+2和+1。
⑤中性分子中,各元素原子的氧化值的代数和为零 ,复杂离子的电荷等于各元素氧化值的代数和。
例: K 2Cr 2O 7 Cr 为+6Fe 3O 4 中,Fe 为+8/3 Na 2S 2O 3中,S 为+2Na 2S 4O 6中,平均为2.5 (2个S 为0, 二个S 为+5) 但 CrO 5中Cr 为+6,而不习惯认为10。
7.1.2 氧化还原反应方程式的配平 配平原则:① 电荷守恒:氧化剂得电子数等于还原剂失电子数。
② 质量守恒:反应前后各元素原子总数相等。
配平步骤:①用离子式写出主要反应物和产物(气体、纯液体、固体和弱电解质则写分子式)。
②分别写出氧化剂被还原和还原剂被氧化的半反应。
③分别配平两个半反应方程式,等号两边的各种元素的原子总数各自相等且电荷数相等。
④确定两半反应方程式得、失电子数目的最小公倍数。
将两个半反应方程式中各项分别乘以相应的系数,使得、失电子数目相同。
然后,将两者合并,就得到了配平的氧化还原反应的离子方程式。
有时根据需要可将其改为分子方程式。
例:配平下列反应方程式423424KMnO (aq)K SO (aq)MnSO (aq)K SO (aq)+−−−−→+酸性溶液中小结:(1)酸性介质中配平的反应方程式里不应出现OH –,在碱性介质中配平的反应方程式不应出现H+ 。
(2)一般先配平H、O以外的原子数,然后再配平H、O原子数,方法如下。
§7.2 电化学电池7.2.1 原电池的构造原电池由两个半电池组成,每个半电池可由同一元素的两种不同状态组成。
例如,锌-铜电池(Daniell Cell电池):负极: Zn -2e = Zn2+ 氧化反应 正极: Cu2+ + 2e = Cu 还原反应 电池反应:Zn + Cu2+ = Cu + Zn2+原电池符号(电池图示):2121 () Zn Zn (1.0mol L )Cu (1.0mol L ) Cu ()+-+--⋅⋅+ (1) 负极写在左边,正极写在右边(2) 用∣表示电极与离子溶液之间的物相界面(3) 不存在相界面,用,分开。
加上不与金属离子反应的金属惰性电极。
(4) 用∣∣表示盐桥(饱和KCl 或NH4NO3 + 琼脂)。
作用:沟通两个半电池;作为正、负离子通道,使两个“半电池”的溶液都保持电中性,使反应能继续进行,电流不断产生。
(5) 表示出相应的离子浓度或气体压力。
(-)Zn ∣Zn2+(c 1/ mol·dm-3)∣∣Cu2+(c 2/mol·dm-3) ∣Cu(+) 要求:给出总反应方程式,要能够设计为原电池,写出电池符号和半反应(电极反应)方程式。
给出电池符号,要能够写出半反应 (电极反应)和放电总反应方程式. 例:氧化半反应: H 2 - 2e = 2H + 还原半反应: Cl 2 + 2 e = 2Cl –总反应: H 2 + Cl 2 = 2H + + 2Cl –* 7.2.2 电解池与Faraday 定律1.电解池利用电能发生氧化还原反应的装置被称为电解池。
2. Faraday 定律1834年,M. Faraday 提出电化学过程的定量学说:①在电化学电池中,两极所产生或消耗的物质B 的质量与通过电池的电荷量成正比。
②当给定的电荷量通过电池时,电极上所产生或消失B 的质量正比于它的摩尔质量与转移电子数之比值。
7.2.3 原电池电动势的测定2121() Zn Zn (1.0mol L ) Cu (1.0mol L ) Cu ()+-+--⋅⋅+ E MF — 电动势,可以由数字电压表或电位差计来测定。
MF E Θ---标准电动势,例如,铜--锌原电池MF E 1.10V Θ=7.2.4 原电池的最大功与Gibbs 函数电功(J)=电荷量(C)×电势差(V)max MF W zFE =-电池反应:r m max r m MFG W G zFE ∆=∆=-E MF — 电动势(V );F — 法拉第常量 : 96485(C·mol -1) Z — 电池反应中转移的电子的物质的量标准状态:MFr m G zFE ΘΘ∆=- §7.3 电极电势7.3.1 标准氢电极和甘汞电极 1. 标准氢电极(SHE)将铂片表面镀上一层多孔的铂黑(细粉状的铂),放人氢离子浓度为1mol·L-1的酸溶液中(如HCl)。
不断地通人压力为100kPa 的氢气流,使铂黑电极上吸附的氢气达到饱和。
这时,H 2与溶液中H +可达到平衡:+-22H +2e H 表示为:规定:E Θ( H +/H 2) =0.0000V2. 甘汞电极(SCE)表示方法:电极反应:标准甘汞电极:饱和甘汞电极:,7.3.2 标准电极电势1.标准电极电势和标准电动势标准电极电势:指定温度(25°C),浓度Ci均为 1 mol/dm3, 气体的分压pi都是标准压力(1bar= 100 kPa), 固体及液体都是纯净物状态下的电极电势。
用EΘ来表示。
无法测定其绝对值,只有相对值。
电对的标准电极电势:(EΘ电对)EΘ原电池的标准电动势:MF2.电极电势的测定(-)(Pt),H2( 105Pa)|H+(1mol·dm-3) ||Cu2+(1mol·dm-3) |Cu (+)Eθ= 0.337 VEθ(Cu2+/Cu)=0.337V(-)(-) (Pt),H2( 105Pa) |H+(1mol·dm-3) ||Zn2+(1mol·dm-3) |Zn(+)Eθ= -0.763 VEθ (Zn2+ / Zn ) = -0.763V3.标准电极电势表①采用还原电势;②Eθ小的电对对应的还原型物质还原性强;Eθ大的电对对应的氧化型物质氧化性强。
③ E θ无加和性Zn2+ + 2e= Zn E θ( Zn 2+ / Zn)= - 0.763V Zn - 2e = Zn 2+ E θ( Zn2+ / Zn)= - 0.763V④ 一些电对的 E θ与介质的酸碱性有关酸性介质:E A θ ;碱性介质E B θ:4.m rG Θ∆与电极电势的关系7.3.3 Nernst 方程 1.Nernst 方程对于电池反应:当T=298.15K 时:J 为电池反应的反应商对于电极反应:氧化型+ze -还原型例:书写Nernst方程的规则(1) 氧化型、还原型为参与电极反应的所有物质,其浓度方次为其在电极中反应中的系数。
气体用分压表示。
(2) 电对中的固体、纯液体浓度为1,不写出。
(3) 浓度单位为mol·L- 1;分压为bar, 1 bar =100kPa2.影响电极电势的因素①氧化型或还原型的浓度或分压电极反应:氧化型+ze-还原型[氧化型]减小,E减小;[还原型]减小,E增大。
②介质的酸碱性③沉淀的生成对电极电势的影响例:已知φθ(Ag+/Ag) 0.799 V 在此半电池加入KCl,若沉淀达到平衡后 [Cl-]=1.00 mol·L-1 ,求 φ =? (Ksp(AgCl) = 1.8 ×10-10 ) 解:[Ag+ ]= Ksp (AgCl)/[Cl-]= 1.8×10-10mol·L- 1E(Ag+/Ag)= 0.799+0.059lg 1.8×10-10=0.222 V AgCl + e= Ag + Cl – φθ=0.222 V小结:氧化型形成沉淀 ,E ↓; 还原型形成沉淀 ,E ↑。
氧化型和还原型都形成沉淀,看二者的sp K Θ相对大小。
若sp K Θ (氧化型) <sp K Θ(还原型),则 E ↓;反之,则 E ↑。
④ 配合物的生成对电极电势的影响氧化型形成配合物,E ↓, 还原型形成配合物, E ↑,氧化型和还原型都形成配合物,看f K Θ 的相对大小。
若f K Θ(氧化型) >f K Θ(还原型),则E ↓;反之,则 E ↑。
§ 7.4 电极电势的应用7.4.1 判断氧化剂、还原剂的相对强弱E Θ小的电对对应的还原型物质还原性强;E Θ大的电对对应的氧化型物质氧化性强。
7.4.2 判断氧化还原反应进行的方向反应自发进行的条件为△r G m<0因为△r G m=–zFE MF即:E MF>0 反应正向自发进行;E MF<0 反应逆向自发进行。
因为:,对于非标准态下的反应:例:试判断反应在25℃时的标准态下能否向右进行?解:7.4.3 确定氧化还原反应进行的限度求氧化还原反应的平衡常数例:求反应解:7.4.4 元素电势图元素电势图的表示方法如碘在酸性溶液中的电势图为:表示方法:①各物种按氧化值从高到低向右排列;②各物种间用直线相连接,直线上方标明相应电对的E Θ ,线下方为转移电子数。
1.判断歧化反应能否发生E E A B C ΘΘ←−−→←−−→右左条件:E 右ø >E 左ø 时, 则B 发生歧化反应,B = A + C 。
若E 右ø<E 右ø 时,则发生反歧化反应,即归中反应, A + C = B如,根据:可以得出结论,在水溶液中Fe3+和Fe 可发生反应生成Fe2+2.计算电对的标准电极电势例:解:得:作业:P214:2,5,6,13,14,18,21。