腹内高压与腹腔间隔室综合征
- 格式:pdf
- 大小:73.42 KB
- 文档页数:2

腹腔室隔综合征护理腹腔室隔综合征( abdominal compartment syndrome, ACS) 是指由于严重腹部损伤、急性重症胰腺炎以及腹腔长时间复杂手术等因素引起的腹内压( intra-abdominal pressure, IAP) 非生理性、进行性、急剧升高所导致的多器官功能不全或衰竭。
一、临床表现1腹膨胀和腹肌紧张,这是腹腔内容量增加导致腹腔高压的最直接表现。
开腹减压可见肠管高度水肿,涌出切口之外,术后肠管不能还纳。
2因横膈上抬、胸腔压力升高吸气压峰值增加>8.34kPa(85cmH2O)3少尿由肾血流灌注不足,醛固酮和ADH增高引起。
此时对液体复苏,使用袢利尿剂呋塞米(速尿)也不会使尿量增加。
4.难治性低氧血症和高碳酸血症因机械通气不能提供足够肺泡通气量,而致动脉血氧分压降低,CO2潴留。
因ACS是一种罕见病,但是及其危重,其死亡率可高达62. 5%~75. 0% ,二、ACS治疗:唯一的有效的方法就是手术开腹减压,而且应该最大限度的打开腹腔,一般要做到剑突至耻骨联合正中切口减压,更为重要的是开腹减压后,敞开皮肤和筋膜不缝合能最大限度地降低腹内压,但可导致内脏膨出和肠瘘。
(早期用20~30个布巾钳或单股尼龙线连续缝合皮肤而筋膜不缝合方法可防止腹腔高压,但少数情况下此方法减压不够,现在用可吸收或不吸收人工合成材料网片连接腹壁缺损,既覆盖内脏、防止内脏脱出,又可减轻腹壁张力、降低腹内压,效果显然优于前者,是合理的选择。
目前国外应用最多的是无菌包装的3升静脉营养输液袋,根据切口大小整形后,用单股线连续缝在皮缘或筋膜缘上暂时性“关腹”。
)尽管如此,肠管腹腔感染率也很高,这也是死亡率居高不下的原因。
因此术后针对ACS的护理就显得尤为重要:1.腹内压(IAP)的监测与护理:测量膀胱压间接反映IAP, 因膀胱压与腹内压有很好的相关性,并且测量方法简便、创伤小, 被认为是临床间接测量IAP 的“金标准”。
腹腔间隙综合征腹腔间隙综合征温州市中心医院重症医学科尤荣开间隙综合征(Compartment syndrome,CS)是指在一局限的间隙内,压力升高所引起组织功能和循环障碍的表现。
CS多发生于肢体骨筋膜间隙,称为骨筋膜间隙综合征;若发生在眼球称青光眼;发生于颅腔时称为颅内高压综合征;发生于腹腔的间隙则称为腹腔内高压(Intra-abdominal hypertension,IAH)。
腹腔间隙综合征(Abdominal compartment syndrome,ACS)是腹腔内压力(Infra-abdominal pressure,IAP)非生理性急剧升高,影响内脏血流及器官组织功能,并进一步引起一系列病理生理改变,主要表现为有呼吸道阻力增加、肺顺应性下降,甚至进行性缺氧,心输出量减少、周围循环阻力增加,少尿甚至无尿的一种临床危重综合征。
【定义】ACS:持续的腹内压力>20mmHg(存在或不存在腹腔灌注压<60mmHg),同时伴有IAH相关的新的器官功能障碍/衰竭。
【发现历史】早在十九世纪末期,Marey和Burt就曾注意到IAP升高对呼吸功能的影响;1890年,Hernricius对猫和狗的研究表明,当IAP升高到27和1150pxH2O(25pxH2O=0.098kPa)时可导致动物的死亡;直到1911年,Emerson第一次报道了在多种动物模型中腹内高压可导致心血管功能的异常;1913年,Wendt首次提出腹内高压与肾功能不全的关系;1984年Kron等首次提出ACS概念,用来描述腹内压增高后所导致的心血管、肺、肾、胃肠以及颅脑等多器官系统的功能障碍。
【病因】腹腔是一个封闭腔,生理状态下,腹内压平均为零(相当于大气压)或接近零。
任何腹腔内容量增加均可引起腹内压升高,但在腹水、妊娠和腹腔巨大肿瘤等慢性状态下,腹腔内容量缓慢增加,腹壁渐被牵张,腹内压无急剧升高,因而无急性腹腔高压症状出现,也就不致发生ACS。


最新:腹腔间隔室综合征(完整版)导言当人体固定腔内压力增加,导致缺血、肌肉损伤和器官功能障碍时,就会发生间隔综合征。
这些“固定”空间受到肌肉和筋膜的限制,当它们肿胀时顺应性的改变十分有限。
腹内高压被定义为持续的腹内压力(IAP)超过12mmhg。
腹腔间隔室综合征(ACS)是一种常见于危重病人的严重疾病。
ACS是由于腹腔内稳态压力发展到反复病理升高以上(>20mmHg),并伴有相关器官功能障碍。
不识别和立即管理ACS可能导致不良的预后,因为ACS 被认为是死亡率一个独立预测因子。
在治疗危重病人时,特别是那些有明显液体移位的病人时,应临床高度怀疑并经行常规监测和管理。
临床诊断在不稳定的患者有相关的腹部紧张或扩张时应该考虑;然而,有时它也可以没有腹胀。
定义ACS的确切临床条件是有争议的。
这种功能障碍可能与呼吸问题有关如高气道峰压和通气氧合不匹配,或肾灌注下降引起的尿量减少,但这些问题在干预后通常是可逆的。
腹部间隔室综合征有内科和保守的治疗方法,治疗的目的是识别和治疗间隔综合征的原因。
然而,临床恶化的患者可能需要紧急手术减压。
病因腹部隔室综合征可分为原发性和继发性ACS。
原发性ACS的原因包括腹部钝性或穿透性创伤、出血、腹主动脉瘤(AAA)破裂、肠梗阻和腹膜后血肿。
继发原因包括怀孕,腹水,肠梗阻,烧伤,腹腔内脓毒血症和大量补液(>3L)。
腹内压升高的慢性原因包括妊娠、肝硬化、肥胖、腹内恶性肿瘤和腹膜透析。
这些都是导致腹腔内高压的原因,腹腔高压被定义为>12mmHg。
在这种情况下,由于压迫症状而出现的器官功能障碍定义为腹部间隔综合征。
研究表明,由AAA破裂引起的ACS后死亡率接近47%。
一旦其他器官系统由于压迫而受累,这种疾病就会变得具有毁灭性,原发性ACS的结果往往越来越差。
流行病学所有ICU患者都可能出现ACS。
在一系列已确定的混杂疾病的ICU 人群中,35%的通气患者被发现有腹内高压(IAH)或ACS。


一、腹内压监护腹内压监护是由专业监护人员通过直接或间接测量的手段对腹腔内压力进行监测,以早期发现腹腔高压(intra-abdominal hypertension, IAH),让病人得到规范化治疗,降低或减轻腹腔间室综合征(abdominal compartment syndrome, ACS)的发病率和死亡率的技术。
1.适应症各类腹腔间室综合症(abdominal compartment syndrome, ACS),包括原发ACS、继发ACS、复发ACS。
腹腔间室综合症是描述腹内压增高后所导致的心血管、肺、肾、胃肠以颅脑等多器官系统的功能障碍。
临床上定义为持续的腹内压大于20mmg(有/无腹腔灌注压小于60mmg),同时伴有IAH相关的新的器官功能障碍/衰竭。
原发ACS是指原发于腹腔盆腔区域疾病而导致的腹腔间室综合征,通常需要外科或放射介入干预。
继发ACS是指非腹腔盆腔区域疾病而导致的腹腔间室综合征。
复发ACS是指原发/继发的ACS,经外科或内科处理缓解后重新发展而来的ACS。
腹内高压的常见原因: 1)、创伤和腹腔出血;2)腹部手术;3)、后腹腔出血;4)、腹膜炎,通常为继发性或复发性(如胰腺炎、复发脓肿);5)、腹腔镜和气腹;6)、巨大切口疝修复;7)、为预防术后切口疝而用尼龙腹带腹部包扎;8)、需用大量液体复苏时,通常液体量>5升/24小时;9)、麻痹性、机械性或假性肠梗阻、病情危重的患者,如休克、心肺复苏后、体外循环心脏手术后、严重高血压及外科手术后。
2.常见的腹内压监测方法常用的腹内压监测法有直接穿刺腹腔测压和经胃、结肠、膀胱、子宫、下腔静脉等间接测压。
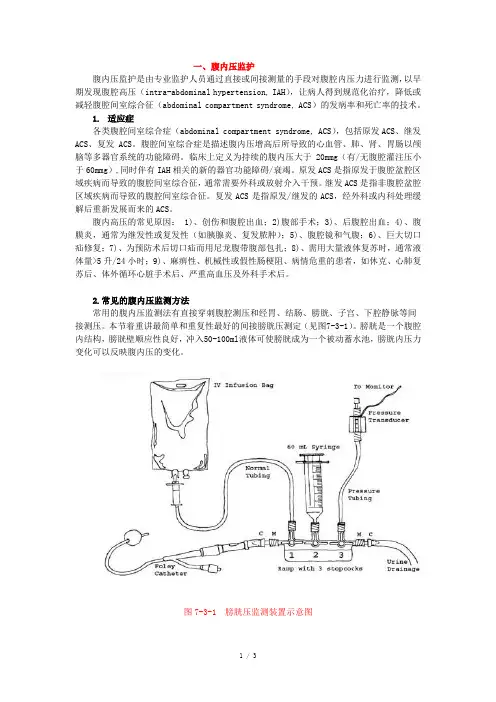
本节着重讲最简单和重复性最好的间接膀胱压测定(见图7-3-1)。
膀胱是一个腹腔内结构,膀胱壁顺应性良好,冲入50-100ml液体可使膀胱成为一个被动蓄水池,膀胱内压力变化可以反映腹内压的变化。
图7-3-1 膀胱压监测装置示意图膀胱内压测压方法:患者体位取完全平卧位,经尿道插入双腔Foley尿管,排空膀胱后10分钟,再注入生理盐水25ml,接压力传感器,以腋中线处为调零平面,在呼气末读数,测得压力即为膀胱内压力,单位以mmg表示。

腹腔高压和腹腔间隔室综合征诊疗指南(2013版)世界腹腔间隔室综合征联合会(World Society of the Abdominal Compartment Syndrome,WSACS)分别于2006年和2007年发布关于腹腔高压(intra-abdominal hypertension,IAH)/腹腔间隔室综合征(abdominal compartment syndrome,ACS)的专家共识和诊疗指南,此次进行了更新。
该指南包括IAH和ACS的相关定义、危险因素和处理流程(本编译稿删去儿科患者的内容,请参考原文),推荐级别采用GRADE分级标准(1、2代表所推荐的级别为推荐或建议,A、B、C、D 代表证据的级别从高到低),具体内容如下。
1相关定义(1)腹内压(intra-abdominal pressure,IAP)是指腹腔内的稳态压力。
(2)间歇性IAP测量的标准是经膀胱注入最多25 ml无菌生理盐水测得。
(3)IAP应该以mm Hg表示,在仰卧位、呼气末、腹部肌肉无收缩时测得,传感器零点水平置于腋中线处。
(4)成人危重症患者的IAP大约为5~7 mm Hg(1 mm Hg=0.133 kPa)。
(5)IAH定义为持续或反复的IAP病理性升高≥12 mm Hg。
(6)ACS定义为持续性的IAP>20 mm Hg(伴或不伴腹腔灌注压25 mm Hg。
(8)原发性IAH/ACS是由盆腹腔的创伤或病变导致,通常需要早期外科或放射介入治疗。
(9)继发性IAH/ACS是指原发病变非起源于盆腹腔。
(10)复发性IAH或ACS是指原发或继发的IAH/ACS经过手术或药物治疗后再次发生。
(11)腹腔灌注压(abdominal perfusion pressure,APP)=平均动脉压-腹内压。
以上定义与2006年相同,以下为2013年的新定义:(12)多间隔室综合征是两个或两个以上解剖部位的间隔室压力增高的状态。



一、概述腹腔是一个封闭的腔,与外界相对隔绝。
在正常情况下,腹腔内压力(intra-abdominal pressure, IAP)为零或接近于零。
当腹腔内压力异常升高>20mmHg时,称为腹腔内高压(intra-abdominal hypertensiou,IAH)。
早在19世纪末就有人描述IAH。
Kron腹腔间隔室综合征是指因各种原因引起腹内高压导致心血管、肺、肾、腹腔内脏、腹壁和颅脑等功能障碍或衰竭的综合征。
ACS以腹内高压、严重腹胀为特征,其临床表现酷似肠梗阻,也可视为肠梗阻的一种特殊类型。
二、病因与分类ACS是从IAH的基础上发展而来的,引起IAH的病因很多,结合分类归纳如下:1、按病情进展:可分为急性ACS和慢性ACS,临床上所指的ACS均系急性。
(1)急性病因:常发生在严重创伤、急腹症或腹部大手术后,最常见的病因是严重腹部创伤、急性胰腺炎,完全性肠梗阻和腹主动脉瘤破裂。
(2)慢性病因:如腹腔肿瘤、腹水、妊娠、中心性肥胖症、慢性腹部透析等。
2、按解剖部位:可分为腹膜后、腹腔和腹壁三种病因。
(1)腹膜后:有胰腺炎、腹主动脉瘤破裂、主动脉手术后等。
(2)腹腔:急性胃扩张、肠梗阻、肠麻痹、腹腔脓肿、腹腔内出血、腹腔镜气腹等。
(3)腹壁:烧伤焦痂、腹裂修补或脐膨出、巨大腹壁疝修补术、高张力缝闭腹部切口等。
均可引起IAH。
三、发病机制ACS既可发生于手术病人,也可发生于非手术病人,既可发生于手术前,也可发生于手术后。
正常情况下腹腔容积和内容物维持在大气压水平(7.5mmHg),使其处于一个生理相对平衡状态,当任何原因导致腹腔内压升高,如急性胰腺炎、出血、肿瘤引起腹膜后体积增加,肠梗阻、肠系膜静脉阻塞,内脏破裂引起腹腔内容积增大,烧伤焦痂,张力缝合引起腹壁外挤压等,均可使这种平衡遭到破坏,终至发生ACS。
四、病理生理IAH发展会造成机体多器官、多系统功能障碍或衰竭。
1、心血管紊乱:IAH致下腔静脉及门静脉受压和胸内压力增加,使上、下腔静脉回流减少,心排出量(cardiac output, CO)降低,腹内压>20mmHg时此影响更为明显。
腹内高压与腹腔间隔室综合征阴建兵肖江梅陈炜(铜川矿务局中心医院,陕西铜川727000)腹腔是由腹壁、膈肌、后腹膜和盆底包绕的间隔室,任何原因引起的腹腔内容量增加都可导致腹腔内压力(intraabdominalpressure,IAP)增加。
虽然腹壁与膈肌有一定限度的扩张,但是当IAP过高时,腹腔内的器官与邻近的组织都将受压,当IAP增高到一定程度时,腹腔压力-容积曲线不呈直线,较小体积改变就会引起较大压力变化,犹如肢体的筋膜间隔综合征。
肝、肾、下腔静脉等被压,膈肌上抬都将影响心、肺,极大地扰乱了机体的生理状况。
近年来有关腹内高压(intraadominalhypertension,IAH)与腹腔间隔室综合征(abdominalcompartmentsyndrome,ACS)的文献日渐增多,熟悉和掌握IAH与ACS的定义、诊断方法和治疗原则,对于早期诊断、合理治疗ACS尤为重要。
本文就相关文献进行综述。
1历史回顾早在1863年Marey等就认为胸内压与IAP是相互影响的[1];Bert的动物实验证实了Marey的假设,并指出膈肌下降会导致IAP升高[2],注意到腹内压升高对呼吸功能的影响。
1890年Heinricius对麻醉后的猫和豚鼠IAH模型的研究表明IAP>27 ̄46cmH2O(1cmH2O=0.098kPa)时,发生呼吸衰竭的机会增大[3]。
1911年Emerson等证明:腹内压过度升高会引起静脉回心血流量的减少,最终导致心脏功能衰竭[4]。
1913年Wendt采用直肠测压法观察发现,IAP越高,尿量越少。
提出腹内高压与肾功能不全的关系[5]。
1923年Thorington等在观察腹腔内压升高对肾功能影响时发现当实验动物IAP在20 ̄41cmH2O时出现少尿,大于41cmH2O时则出现无尿[6]。
1931年,Overholt等通过一个穿刺导管和一种新的传感器直接测量了IAP。
第二次世界大战期间由于战争创伤所导致大量的创伤、休克及器官衰竭患者。
1947年Bradley等[7]首次报道了IAP增高会引起肾静脉压力增高、肾血流量减少、肾小球滤过率降低。
1951年Baggot报道了手术时肠管高度扩张腹壁张力大而强行关腹的患者有较高的病死率,预示腹内高压可产生严重的后果[3]。
20世纪60年代后随着腹腔镜技术的应用,腹内压增高带来的病理生理改变逐渐为临床医师认识。
20世纪80年代后逐渐意识到IAH对循环系统具有潜在的危害并加以重视,称为腹内高压(IAH)。
1980年Kron最早用膀胱测压来监测腹内压,并在1984年首次提出腹腔间隔室综合征(ACS)这个名词来描述腹腔主动脉瘤手术后腹内高压所致的病理生理学改变[8]。
近年来才意识到腹腔作为一个密闭的腔室,腹内压增高可导致ACS并逐渐受到重视。
ACS就是在这个背景下提出来的一个新的概念。
2相关概念及定义2.1腹内压(intra-abdominalpressure,IAP)正常腹腔内压力是腹腔间隙内稳定状态下的压力,主要由腹腔内脏器的静水压产生。
正常IAP在5mmHg(1mmHg=0.133kPa)左右,IAP因人而异且可随呼吸变化,吸气时上升,呼气时下降。
一般应在仰卧位呼气末、腹肌松弛状态下进行测量。
波动范围0 ̄7mmHg。
稳定和平衡的IAP对维护各脏器正常功能和维持机体生理内稳态非常重要。
2.2腹腔灌注压(abdominalperfusionpressure,APP)腹腔灌注压=平均动脉压(meanarterialpressure,MAP)-IAP。
MAP=舒张压(DBP)+1/3(收缩压SBP+舒张压DBP),在IAH和ACS治疗过程中,腹腔灌注压是一个预示终止复苏和患者存活的指标。
2.3腹内高压(intraabdominalhypertension,IAH)是指IAP持续或反复的病理性升高≥12mmHg。
根据腹内压力不同,IAH可分为四级(详见后述)。
2.4腹腔间隔室综合征的概念与诊断标准2006年腹腔间隔室综合征世界联合会(WSACS)第二次会议中将ACS的定义统一为:腹腔间隔室综合征是腹腔压力稳定升高并且>20mmHg伴或不伴有腹腔灌注压(APP)≤60mmHg,同时合并有新的器官功能障碍和衰竭。
3病因与分类腹腔与外界相对隔离,任何原因引起的腹腔内容物体积增加或腹壁顺应性降低都可导致腹腔内压增加。
3.1根据腹内压升高的时间分为慢性和急性慢性IAP升高起病缓慢,发展较隐匿,临床上较为少见,主要包括慢性腹水、妊娠、腹腔巨大肿瘤、慢性非卧床腹膜透析和中央型病理性肥胖等。
在IAP升高时,腹腔可有一个逐步适应的过程。
急性IAP升高在数小时或数日内发生,通常是由于腹腔内容积增加或者由于腹壁顺应性降低、活动受限所致,虽然腹壁与膈肌有一定限度的扩张,但是当IAP过高时,腔内的器官与邻近的组织都将受压,犹如肢体的筋膜间隔综合征,临床多见。
又可分为:①自发性:腹膜炎、肠梗阻(特别是肠扭转)、腹主动脉瘤破裂等;②创伤性:腹腔内或腹膜后出血、空腔脏器穿孔等;③手术后:术后腹膜炎、腹腔脓肿、肠麻痹等;④医源性:过量灌肠、大量补液、腹腔填塞止血、腹腔镜手术中的气腹及腹壁高张力下关腹等。
3.2根据病变部位可进一步分为腹壁型、腹腔型和腹膜后型腹壁型最常见的病因是腹部大面积烧伤、焦痂形成;腹腔型常见于腹部创伤,特别是腹部钝器伤所致肝和(或)脾破裂,腹腔内大出血使腹腔容积扩大。
此外,严重的肠胀气、肠梗阻、小儿巨结肠及乙状结肠扭转等,以及抢救危重患者时使用呼气末正压通气(PEEP)的压力过高,也会导致ACS;腹膜后型指原发于腹膜后的疾病导致的ACS,如重症胰腺炎、骨盆骨折、讲座与综述170基层医学论坛2009年第13卷2月上旬刊腹膜后出血和感染等。
3.3根据IAP升高的原因和方式又可分为原发性和继发性原发性:主要见于各种腹部病变,由腹膜炎、肠梗阻、腹部和盆腔创伤导致的大出血等,其中以腹腔内出血最为常见;继发性:主要由于因腹部以外的疾病,如败血症、大面积烧伤、大量液体复苏、外科手术时强行关腹等其他情况。
4临床表现与病理生理研究发现当IAP升高时,除肾上腺外其他腹腔内和腹膜后的所有器官血流均有不同程度的减少。
IAP增高损害多个系统和器官,具体机制尚不清楚。
目前认为主要与直接压迫、血管渗漏、缺血/再灌注损伤、血管活性物质和细胞因子的释放、氧自由基的产生、细胞内三磷酸腺苷(ATP)合成减少等综合作用,尤其在大量液体复苏时血管通透性增加可致严重脏器水肿、细胞外液的大量增加,以及胃肠道细菌易位等而出现一系列组织器官功能障碍和病理生理变化有关[9]。
通过直接或间接方式影响机体,产生一系列临床表现。
4.1胃肠道的影响IAP升高最直接的作用在腹腔内脏器表面,而对压力反应最早、最敏感及受影响最大的是胃肠道系统。
IAP升高,使肠腔压力升高,肠壁血管受压、肠道壁缺血。
IAP≥1.47kPa(15cmH2O)肠道血供及黏膜的血供即有明显的下降[10],造成肠道壁的缺血,肠道麻痹及水肿,黏膜屏障受损,肠蠕动的减弱或消失,肠腔内细菌的过度繁殖,炎症递质对于肠黏膜屏障的破坏,细菌易位。
严重者可致黏膜坏死或肠段坏死。
而肠麻痹及水肿又加重腹内压的升高,造成了恶性循环。
4.2心血管系统的影响IAH对心血管系统的直接影响是回心血量及心输出量减少。
腹腔内压>0.98kPa(10cmH2O)时,中心静脉压即升高,直接压迫上、下腔静脉和门静脉,造成回心血流量减少;同时膈肌上抬使胸腔压力升高,心室舒张末期容积减少,进一步减少了回心血量,造成心排血量(CO)减少,前负荷降低,这些都会导致CO减少。
平均动脉压下降,体内肾素-血管紧张素-醛固酮系统被激活,全身动脉收缩,后负荷增加。
心率加快、中心静脉压升高、肺毛细血管嵌压升高、心率加快是最早、最直观的变化,当IAP仅为1.33kPa时,这一变化即可发生。
研究表明,IAP达15mmHg时,静脉回流受影响;IAP达30mmHg时,心室收缩功能降低,心室曲线向右、向下移动[10]。
Barnes等[11]发现,IAP≥40mmHg时CO减少36%,腹腔动脉、肠系膜上动脉及肾动脉血流量分别减少42%,61%和70%。
ACS持续会引起患者休克。
动物模型上证实IAH导致的直接死因是心功能衰竭。
IAH违背了Starlings定律,通常反映血管内容积情况的指标如肺动脉楔压(pulmonaryarteryocclysionpressure,PAOP)、中心静脉压(centralvenouspressure,CVP),不仅不能正确反映血管内容积状况,反而给人以误导,易被误诊为心力衰竭。
一般情况下,当PAOP、CVP升高,CO下降,意味着液体过多、心力衰竭应予快速利尿;IAH情况下则完全相反,快速利尿只会加快患者死亡,此时应该积极实施液体复苏。
4.3呼吸系统的影响IAP增加,使膈肌抬高,胸腔容积减少,一方面使胸壁的顺应性降低,减少了胸壁活动的幅度,肺容积减少(肺活量减少),肺顺应性降低;另一方面使肺的气道阻力增加,吸气压增高,肺实质内中性粒细胞聚集,大量的炎性递质的释放,导致肺水肿、低氧血症、高碳酸血症,造成肺泡萎缩和肺不张,通气/血流比例失调,通气与换气功能障碍,进一步导致氧分压下降,呼吸性酸中毒及呼吸衰竭[12]。
临床表现为呼吸急促、血氧饱和度的进行性下降。
临床易判断为感染、急性呼吸窘迫综合征(ARDS)等而漏诊ACS。
IAP急性升高造成的呼吸功能障碍的3大特征为:高通气阻力、低氧血症及高碳酸血症,其直接原因是机械性压迫,此时使用呼气末正压通气会进一步加重内环境紊乱。
4.4肾功能的影响IAP大于2.49kPa(30cmH2O)肾灌注会停止,表现出少尿、无尿的必然结果,最后导致肾功能障碍、衰竭。
一般认为其原因有[13]:腹腔高压回心血量减少,CO下降及IAP增高直接压迫肾动脉、肾静脉和肾实质导致肾灌注血流减少,肾小球滤过率下降;肾血管阻力的增加,可使肾素-血管紧张素水平升高,使血浆抗利尿激素和醛固酮分泌增加,血管收缩,肾静脉及肾脏直接受压使肾实质水肿加剧,进一步使肾功能衰竭,Doty等认为ACS中肾功能障碍的主要原因是肾静脉受压。
液体复苏能使IAP、CO恢复正常,但肾血流、肾小球滤过率、尿量却丝毫不受影响。
腹腔减压术及肾包膜切开术能逆转上述指标。
4.5肝功能的影响IAP升高使进入肝脏的动脉和静脉血(门静脉)血流量均明显减少[14],肝脏缺血。
胃、食管侧支血管增加。
另一方面,IAP升高,使下腔静脉升高,肝静脉回流受阻,使肝功能的损害加重,出现肝功能的损伤。
肝脏血流减少导致肝线粒体功能障碍,能量物质产生减少,乳酸清除率下降,后者可作为反映复苏疗效的有效指征。