无机化学期中试题答案
- 格式:docx
- 大小:45.10 KB
- 文档页数:6


无机化学试题一、选择题20分,每题2分1.已知:298K时,反应C石墨+ O2g→CO2g⊿r H mΘ=·mol-1CO g+ 1/2O2g→CO2g ⊿r H mΘ=·mol-1则反应C石墨+ 1/2O2g→CO g的⊿r H mΘ等于 ;kJ ·mol-1 kJ ·mol-1kJ ·mol-1 D. kJ ·mol-12.已知反应Ag+ 2Bl 4Cg的平衡常数kθ=,则反应4CgAg+2Bl的平衡常数为A. B. -0.123 C. D.3.根据下列反应:2Fe3++ Fe →3Fe2+2FeCl3 + Cu →2FeCl2+ CuCl22KMnO4 + 10FeSO4+ 8H2SO4→2MnSO4+ 5Fe2SO3+ K2SO4+ 8H2O判断电极电势最大的电对是Mn2++/Fe2++/Fe +/Cu4.BCl3分子中,B以SP2杂化轨道成键,则该分子的空间构型是A.三角形B.平面三角形C.直线形D.四面体5. 对于主量子数n=3的电子层,可以容纳的轨道数n2和电子数是和6 和9 C.9和18和186. 在配合物K3C O C13NO23中,中心离子的电荷是A. +5B. +4C. +3D.+27.下列氧化物中, 熔点最高的是A. CaOB. MgOC. SO3D. P2O58.原电池符号为:-Zn∣ZnS04c1‖Fe2S043c2, FeS04c3∣Pt+若加氨水于锌电极溶液中,使Zn2+生成锌氨配离子ZnNH342+,这时电池电动势将 ;A. 增大B.减小C.不变D.不能确定9. 酸性溶液中,锰的元素电势图如下:试判断发生歧化反应的物质是 ;A. MnO4- 和MnO42- B. Mn3+ 和Mn2+ C. Mn3+ 和MnO42- D. MnO2和Mn3+10.以下分析报告是四种酸性未知溶液的定性分析结果,合理的是A. H,NO2-,Mn04-,CrO42- B. Fe2,Mn2+,SO42-,Cl-C. Fe3,Ni2,Iˉ,ClˉD. Fe2,SO42-,Clˉ,Cr2O72-二、填空题20分,每题2分1.配合物KPtC13NH3的名称是;内界是;外界是;中心离子的电荷数是 .2.对于一可逆反应,当浓度商Q<Kc 时,反应_________进行;当浓度商Q=Kc时,反应_________; 当浓度商Q>Kc时,反应_________进行;3.多原子分子的极性除了与有关,还与分子的有关;号元素Cr的核外电子排布为________________________,该元素在周期表中_____周期_____族 _____ 区;5.金属中导电性最强的是 ;密度最小的是 ;熔点最高的是 ;硬度最大的是 ;分子中的C原子在成键时采取的杂化轨道类型是 ,CH4分子的几何构型为;而H2S分子中的S原子在成键时采取的杂化轨道类型是 ,H2S分子的几何构型是 ;为___酸___碱盐,水解显____性;NH4C1为___酸___碱盐,水解显____性.8.硫化物ZnS、CuS、 MnS、SnS、HgS 中易溶于稀盐酸的是 , 不溶于稀盐酸但溶于浓盐酸的是,不溶于浓盐酸但可溶于硝酸的是 ,只溶于王水的是 .9.难溶电解质MgOH2,分别在1纯水中;2 MgC12溶液中;3NH4C1溶液中溶解,溶解度大小顺序为_________ > _________ > _______.10.当以金属与酸作用制取盐,最后溶液pH值等于3时,溶液中余下Fe3+杂质的浓度是 ;已知K sp FeOH3= 4×10-38三、判断题10分,每题1分1.温度越高,活化能就越大,反应速率也越快;2.氢卤酸除氢氟酸因分子缔合关系是弱酸外,其余全是强酸,它们的酸性强弱顺序是HC1〈 HBr〈 HI ;3.铜与浓HNO3反应生成NO2,铜与稀HNO3反应生成NO,所以稀HNO3的氧化性比浓HNO3强;4.金刚石与石墨是同素异形体,由金刚石转变为石墨的△r H> 0;5.硼酸是三元酸;在酸中、碱中、受热、见光都不稳定;7.金属铁可与CuC12溶液反应而置换出金属铜;金属铜也能与FeC13溶液反应,但只能使FeC13还原为FeC12,而不能置换出金属铁;8.天平的感量是指针偏移一格时所需的毫克数;9.电离能和电子亲和能都是只从一个方面反映孤立气态原子失去和获得电子的能力,电负性则反映了化合态原子吸引电子能力的大小;10.配离子的K不稳愈大,其稳定性愈大,在溶液中愈不易解离;四、简答题20分,每题10分1.根据下列实验现象确定各字母所代表的物质;2.配平化学反应方程式:A. C + HNO4→B. Cr2O72-+ H2S + H+→五.计算题20分,每题10分1. 1273K时,反应FeOs+COg Fes+CO2g的Kc=;若CO的起始浓度为mol·L-1,CO2的起始浓度为 mol·L-1时,问1反应物、生成物的平衡浓度各是多少2CO的转化率是多少3增加FeO的量,对平衡有何影响2.已知:EθPb2+ /Pb= , EθSn2+ / Sn=判断反应Pb2+ + Sn →Pb + Sn2+能否在下列条件下自发进行(1) CPb2+ = CSn2+ =1 mol·L-1;(2) CPb2+ = mol·L-1 , CSn2+ =2 mol·L-1.六.推断题10分有一黑色铁的化合物固体A,溶于HC1时可得浅绿色溶液B,同时放出有腐败臭鸡蛋味的气体C,若将此气体导入硫酸铜溶液中,可得黑色沉淀物D;若将氯气通入B溶液中,则溶液变为黄色E,再加几滴硫氰化钾,溶液变血红色F;问A、B、C、D、E、F各为何物,并写出有关反应式;无机化学试题答案一. 选择题20分,每题2分1B, 2C.3C..5C.6C.8A.9C二、填空题30分,每题3分1三氯一氨合铂Ⅱ酸钾,PtC13NH3-,K+,+2.2逆向;平衡;正向;3分子组成,空间构型;4 1S22S22P63S23P63d54S1,4,ⅥB, d.5 Ag;Li;W;Cr6 SP3,正四面体;SP3,V字角型7 弱酸强碱,碱;强酸弱碱,酸;8 ZnS、MnS,SnS, CuS, HgS;9 3>1>210 4×10-5三、判断题10分,每题1分1×2√3×4×5×6√7√8√9√10×四、简答题20分,每题10分1解:A Ni2+ 2 分B Ni NH362+ 4 分C 镁试剂 6 分D Fe OH38 分E KFe Fe CN610分2 A. 3C + 4HNO3 → 3CO2↑+ 4NO↑ + 2H2OB. Cr2O72-+ 3H2S + 8H+→ 2Cr3+ + 3S↓ +7H2O五.计算题20分,每题10分1六.推断题A、FeS ,B、FeC12 ,C、H2S ,D、CuS , E、FeC13 , F、FeSCNn3-n;反应方程式如下:FeS + 2HC1 = FeC12 + H2S↑; Cu2+ + S2- = CuS ↓;2FeC12 +C12 = 2FeC13 ;Fe3+ + nSCN- = FeSCNn3-n ,n=1-6.。

无机化学期中考试参考答案一、单项选择题(共15分)二、真空题(每空1分,共20分)16. 阳离子电荷与其半径之比,阳离子的极化能力, BeCl 2 > CaCl 2 > HgCl 2,BaCO 3 > SrCO 3 > CaCO 3 > MgCO 3 > BeCO 317. <18. [Fe(CN)5CO]3-; [PtCl 2(OH)2(NH 3)2]; [CrBr 2(H 2O)4]Br ·2H 2O19. 62g t 0g e ; 32g t 2g e20.PF 3<PCl 3<PBr 3<PI 321.(σ 1s )2 (σ *1s )2 (σ 2s )2 (σ *2s )2 (π 2py )2 (π 2pz )2 (σ 2px )2 3 反磁性 CO (N 2) 22.重铬酸根有氧化性,氨离子有还原性23. 阴离子半径较大时,其盐的溶解度常随阳离子的半径增大而减小 24. 6:6, 8:8, 4:4 三、简答题25. 酸性顺序: HClO <HClO 3<HClO 4。
氧化性顺序: HClO >HClO 3>HClO 4。
原因:①三分子中非羟氧依次增多,诱导效应增大;②酸根结构的影响。
酸根结构的稳定性依次增强,ClO 4-是四面体结构,最为稳定。
26.27.四、计算题与判断(共30分)28. 解:① 因 Cu + + e - == Cu φ(Cu + /Cu)= 0.521VΔr G = - n F φ F = 96.5 kJ·V -1·mol -1 G 终 — r G 始 = - n F φ G = n F φ + G = 1×96.5×0.521 = 50.28 kJ·mol -1 ② 因Cu 的G 最低,所以最稳定;③ 因CuO + 的G 最高,所以氧化性最强;④ 因Cu + 位于Cu 和Cu 2+ 连线的上方,所以Cu + 会发生歧化反应2Cu + == Cu + Cu 2+29.30.ϕ([Co(CN)6]3-/[Co(CN)6]4-) =ϕ(Co 3+/Co 2+) - 0.0591 lg)])Co(CN ([)])Co(CN ([466−稳稳K K= 1.808 - 0.0591 lg 1964100.1100.1⨯⨯= -0.852 V按 ϕ值,H 2O 可氧化[Co(CN)6]4-2[Co(CN)6]4- + 2H 2O 2[Co(CN)6]3- + 2OH − + H 2↑lg K = 0591.0)]852.0(829.0[2−−−= 0.778 K = 6.0所以[Co(CN)6]4-在水溶液中不稳定。

无机化学试题及答案一、选择题(每题2分,共20分)1. 下列哪种元素属于碱土金属?A. 锂B. 钠C. 钙D. 钾2. 以下化合物中,哪一个是共价化合物?A. NaClB. HClC. CaOD. FeCl33. 元素周期表中,第IA族元素的原子最外层电子数是多少?A. 1B. 2C. 3D. 44. 以下哪个反应是氧化还原反应?A. 2H2O → 2H2 + O2B. 2H2 + O2 → 2H2OC. 2CO + O2 → 2CO2D. 2H2O + CO2 → H2CO35. 以下哪种物质的化学式是正确的?A. 氧化铜:CuOB. 硫酸:H2SO4C. 氯化钠:NaClD. 所有选项都正确6. 根据路易斯酸碱理论,以下哪种物质是酸?A. H2OB. NH3C. HClD. NaOH7. 以下哪种物质是强酸?A. 醋酸B. 碳酸C. 硫酸D. 氢氧化钠8. 以下哪种物质是强碱?A. 氢氧化钠B. 氢氧化钾C. 氨水D. 所有选项都是强碱9. 以下哪种物质是两性氧化物?A. Al2O3B. MgOC. SiO2D. Fe2O310. 以下哪种物质是强电解质?A. 醋酸B. 乙醇C. 氯化钠D. 蔗糖二、填空题(每题2分,共20分)1. 元素周期表中,第VIIA族元素的原子最外层电子数是________。
2. 常见的碱金属元素有锂、钠、钾、铷、铯和________。
3. 金属铝的化学符号是________。
4. 元素周期表中,第IIIB族元素的原子最外层电子数是________。
5. 元素周期表中,第VIII族元素的原子最外层电子数是________。
6. 氢氧化钠的化学式是________。
7. 氧化铁的化学式是________。
8. 硫酸铜的化学式是________。
9. 碳酸钙的化学式是________。
10. 氯化铵的化学式是________。
三、简答题(每题10分,共30分)1. 描述什么是路易斯酸碱理论,并给出一个例子。
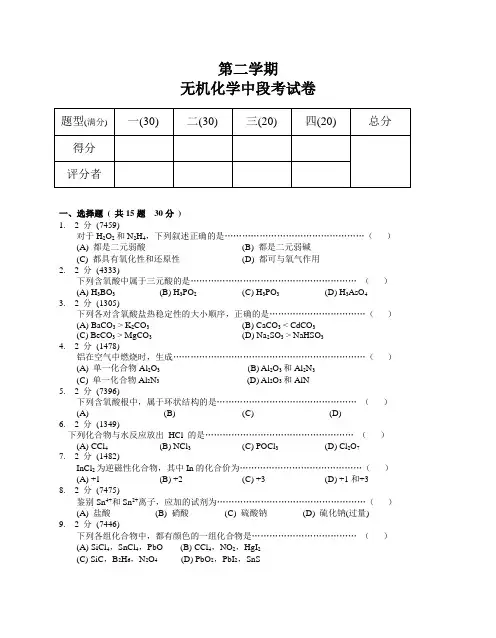
第二学期无机化学中段考试卷题型(满分)一(30)二(30)三(20)四(20)总分得分评分者一、选择题( 共15题30分)1. 2 分(7459)对于H2O2和N2H4,下列叙述正确的是…………………………………………()(A) 都是二元弱酸(B) 都是二元弱碱(C) 都具有氧化性和还原性(D) 都可与氧气作用2. 2 分(4333)下列含氧酸中属于三元酸的是…………………………………………………()(A) H3BO3(B) H3PO2(C) H3PO3(D) H3AsO43. 2 分(1305)下列各对含氧酸盐热稳定性的大小顺序,正确的是……………………………()(A) BaCO3 > K2CO3(B) CaCO3 < CdCO3(C) BeCO3 > MgCO3(D) Na2SO3 > NaHSO34. 2 分(1478)铝在空气中燃烧时,生成…………………………………………………………()(A) 单一化合物Al2O3(B) Al2O3和Al2N3(C) 单一化合物Al2N3(D) Al2O3和AlN5. 2 分(7396)下列含氧酸根中,属于环状结构的是…………………………………………()(A) (B) (C) (D)6. 2 分(1349)下列化合物与水反应放出HCl 的是……………………………………………()(A) CCl4(B) NCl3(C) POCl3(D) Cl2O77. 2 分(1482)InCl2为逆磁性化合物,其中In的化合价为……………………………………()(A) +1 (B) +2 (C) +3 (D) +1和+38. 2 分(7475)鉴别Sn4+和Sn2+离子,应加的试剂为……………………………………………()(A) 盐酸(B) 硝酸(C) 硫酸钠(D) 硫化钠(过量)9. 2 分(7446)下列各组化合物中,都有颜色的一组化合物是………………………………()(A) SiCl4,SnCl4,PbO (B) CCl4,NO2,HgI2(C) SiC,B2H6,N2O4 (D) PbO2,PbI2,SnS将过量SiF4通入NaOH溶液中,主要产物是……………………………………()(A) H4SiO4,NaF (B) Na2SiO3,NaF(C) Na2SiO3,Na2SiF6(D) SiO2,HF11. 2 分(1421)将NCl3通入碱性溶液,其水解产物是…………………………………………()(A) NH3和ClO-(B) NH3和Cl-(C)和Cl-(D)和Cl-12. 2 分(4348)PCl3和水反应的产物是…………………………………………………………()(A) POCl3和HCl (B) H3PO3和HCl(C) H3PO4和HCl (D) PH3和HClO13. 2 分(7463)下列各对物质,水解能力对比,正确的是………………………………………()(A)>(B)>(C) SnCl2 > SnCl4(D) PCl3 > BiCl314. 2 分(4361)二氧化氮溶解在NaOH溶液中可得到:(A) NaNO2和H2O (B) NaNO2,O2和H2O(C) NaNO3,N2O5和H2O (D) NaNO3,NaNO2和H2O15. 2 分(1460)下列硫化物,能溶于Na2S溶液生成硫代酸盐的是…………………………()(A) SnS (B) SnS2(C) PbS (D) Bi2S3二、填空题( 共12题30分)16. 5 分(7452)N2O3很容易分解为和。

中专二年级期中无机化学试题班级_____________ 姓名_____________将选择题答案填入下列表格:一﹑选择题(每题 3 分,共45 分)1.氧化还原反应的本质是()A.化合价的升降B.电子的转移C.与化合价无关D.与得失电子无关2.氧化还原反应的判断标准是()A. 电子的转移B. 与化合价无关C. 化合价的升降D.与得失电子无关3.关于氧化还原反应中得失电子的说法正确的是()A.得电子过程发生时,无失电子过程B.得失电子同时发生C. 失电子过程发生时,无得电子过程D.不发生得失电子4.下列物质中能做氧化剂的是()A. FeB.AlC.H+D.Cu5.下列物质中能做还原剂的是()A.Fe2+B.Fe3+C.H+D.Al3+6.关于原电池的说法正确的是()A.原电池是将化学能转化为电能的装置B. 原电池是将电能转化为化学能的装置C. 原电池是将热能转化为电能的装置D. 原电池是将生物能能转化为电能的装置7.下列关于氧化还原反应和原电池的说法错误的是()A.从理论上讲,凡是氧化还原反应都有可能组成原电池 B.电对相同的两个半电池,不能发生氧化还原反应,也不能组成原电池 C 只要原电池的两极的电极电势不相等,就能产生电动势..D.在一个原电池中,总是电极电势高的电对作正极8.关于Cu-Zn 原电池的下列说法中错误的是()A.盐桥中的电解质可保持两个半电池中的电荷平衡B.盐桥用于维系氧化还原反应的进行C.盐桥中的电解质不能参与电池反应D. 电子通过盐桥流动9.不属于金属的防护的是()A.加保护层B.制成耐腐蚀的合金C.电化学保护D.焊接10.同位素的定义为()A.质子数相同而中子数不同的一类原子称为同位素B. 质子数相同而中子数相同的一类原子称为同位素C. 质子数不同而中子数不同的一类原子称为同位素D. 质子数不同而中子相同的一类原子称为同位素11.主量子数有几个取值()A.4B.5C.6D.712.对于核外电子运动状态的描述中,m 表示哪个量子数()A.主量子数B.角量子数C.磁量子数D.自旋量子数13.电子的自选状态有几种()A.1B.2C.3D.414.下列哪个键不属于化学键()A.色散力B.金属键C.离子键D.共价键15.不属于范德华力的是()A.取向力B.色散力C.诱导力D.氢键二、填空题(每空 1 分,共25 分)1 2 3 4 5 6 7 8 9 10 11 12 13 14 151.在氧化还原反应中,得电子的物质叫_________,它的反应产物是________;失电子的物质叫__________ ,它的反应产物是____________。

无机化学试题及答案一、选择题(每题2分,共20分)1. 下列元素中,属于碱金属的是:A. NaB. MgC. AlD. Si答案:A2. 以下化合物中,属于共价化合物的是:A. NaClB. HClC. MgOD. Fe答案:B3. 下列反应中,属于氧化还原反应的是:A. 2H2 + O2 → 2H2OB. HCl + NaOH → NaCl + H2OC. CO2 + H2O → H2CO3D. 2NaOH + CO2 → Na2CO3 + H2O答案:A4. 根据元素周期表,下列元素中原子半径最大的是:A. LiB. NaC. KD. Rb答案:D5. 下列化合物中,属于离子晶体的是:A. SiO2B. NaClC. CO2D. H2O答案:B6. 根据化学键理论,下列化合物中,含有离子键的是:A. NaClB. H2C. CH4D. N2答案:A7. 下列反应中,属于酸碱中和反应的是:A. 2HCl + Zn → ZnCl2 + H2B. NaOH + HCl → NaCl + H2OC. 2H2O2 → 2H2O + O2D. 2H2 + O2 → 2H2O答案:B8. 根据酸碱质子理论,下列物质中属于酸的是:A. NaOHB. H2OC. NH3D. HCl答案:D9. 下列化合物中,属于配位化合物的是:A. NaClB. [Cu(NH3)4]SO4C. H2OD. CO2答案:B10. 下列化合物中,属于金属晶体的是:A. NaClB. SiO2C. MgOD. Fe答案:D二、填空题(每题2分,共20分)1. 元素周期表中,第______周期的元素属于过渡元素。
答案:4-72. 根据元素周期表,同一周期内,元素的金属性从左到右逐渐______。
答案:减弱3. 金属键的强度与金属离子的______有关。
答案:电荷4. 根据化学键理论,离子晶体的熔点与构成晶体的离子的______有关。

中级无机化学试题及答案一、选择题(每题2分,共20分)1. 下列元素中,哪一个是过渡金属?A. 铁B. 碳C. 氧D. 钠答案:A2. 以下化合物中,哪一个是共价化合物?A. NaClB. HClC. MgOD. Fe答案:B3. 哪种类型的晶体结构具有最紧密的堆积?A. 简单立方B. 体心立方C. 面心立方D. 六角密堆积答案:D4. 哪个元素的原子序数是26?A. 铁B. 钴C. 镍D. 锌答案:C5. 以下哪个元素是碱土金属?A. 锂B. 铍C. 钙D. 钡答案:C6. 哪种类型的键是离子键?A. NaCl中的键B. HCl中的键C. O2中的键D. C2H4中的键答案:A7. 以下哪个化合物是超酸?A. HClB. H2SO4C. H3PO4D. H2S答案:B8. 哪个元素属于卤素?A. 氟B. 氯C. 溴D. 碘答案:B答案:A, B, C, D9. 以下哪种化合物是金属有机化合物?A. 四氯化碳B. 四氯化钛C. 四氯化锆D. 四氯化铌答案:B10. 哪种类型的晶体结构具有最紧密的堆积?A. 简单立方B. 体心立方C. 面心立方D. 六角密堆积答案:D二、填空题(每题2分,共20分)11. 过渡金属元素通常位于周期表的________区和________区。
答案:d区和f区12. 根据八隅体规则,碳原子最多可以形成________个共价键。
答案:413. 金属键是由________和________之间的相互作用形成的。
答案:金属离子和自由电子14. 元素周期表中,第________周期是最长的周期。
答案:六15. 元素的电负性越大,其非金属性越________。
答案:强16. 金属晶体的堆积方式主要有简单立方堆积、体心立方堆积和________堆积。
答案:面心立方17. 碱金属元素位于周期表的________族。
答案:一18. 元素的原子半径随着原子序数的增加而________(增大/减小)。


无机化学期中考试参考答案及评分标准一、选择题(27分,每小题3分)C D B A A C B B B二、填空题 (多空题每空1分,单空题每空2分,共30分 )10、(6分,每空1分)(-) Zn│Zn 2+(C θ)‖H +(C θ)│H 2(P θ)│Pt(+)正极反应:2H + + 2e - = H 2 负极反应:Zn - 2e - = Zn 2+电池反应:Zn +2H + = Zn 2+ + H 2E θMF =0-(-0.763)=+0.763(V)平衡常数:lgK θ = 0.763 ⨯ 2 / 0.0591 = 25.82K θ= 6.62 ⨯ 102511、(2分)0.1412、(4分,每空1分) NH 2- ;NH 3 ;(CH 3)2NH 2+ ;C 6H 5NH 3+13、(2分)PH=6.3914、(2分,)(4)<(3)<(2)<(1)15、(2分)K θSP ={Ca 2+}3[ PO 43-]2 ;S =16、(2分)(4)>(1)>(2)>(3)17、(6分)每空1分) -1 -3 +2 , -0.5mol ,-1.5mol, -1mol18、(4分)每空1分)减小,减小,正向,增大三、计算题(共四题,43分)19 、(8分)解:Ac -+ H 2O = HAc + OH -10514θa θw θb 105.6101.8101.0(HAc)K K )(Ac K ----⨯=⨯⨯== (4分) ∵500K c a0≥θ,∴可用最简式。
1610o θb OH L mol 107.50.100105.6c K c ----⋅⨯=⨯⨯=⋅=pH=14-pOH=14-lg7.5⨯10-6=8.88 (4分)20、(8分)解: (CuI)K 1lg 10.0592)/Cu (Cu E /CuI)(Cu E θsp 2θ2θ+=+++ =0.159+0.0592lg 12101.271-⨯=0.742(V)21、(13分) 解:(1) CaCO 3(s) = CaO (s) + CO 2 (g)13θm f 2θm f θm f θm r mol kJ 178.3)1206.9(] ) 393.5(635.1[s),(CaCO H Δg)],(CO H Δs)(CaO,H [Δ(298.15K)H Δ-⋅=---+-=-+=113θm 2θm θm θm r K m ol 160.4J 92.9213.6][39.7s),(CaCO S g)],(CO S s)(CaO,[S (298.15K)S --⋅⋅=-+=-+=Δ)15.298()15.298()15.298(K m rS T K m rH K m rG θθθ∆-∆=∆=178.3-298.15⨯160.4⨯10-3=130.5kJ ·mol -1 (6分) ∵)K 15.298(m rG θ∆<0,所以在常温下该反应不能自发进行。

《无机化学》期中试卷-参考答案一.简答题:(40分)1. 下列四种水溶液(1)0.2 mol·dm --3KCl ;(2)0.1 mol·dm -3C 12H 22O 11;(3)0.25 mol·dm -3NH 3;(4)0.04 mol·dm -3BaCl 2 按凝固点由高到低应该如何排列?答:(2)(4)(3)(1)分子或离子(质点)浓度越大,凝固点越低2.下列两个反应在298K 和标准态时均为非自发反应,哪一个在高温时仍为非自发反应?(1) HgO (s) === Hg (l) +21O 2 (g) (2) 2 N 2 (g) + O 2 (g) === 2 N 2O (g)答:反应 (2) 在高温时仍为非自发反应,因为该反应为熵减反应。
3.试举例说明在什么情况下θr m H ∆、θf m H ∆ 和θc m H ∆的数值相等。
答:符号θf m H ∆ 表示的是某温度下,由处于标准状态的各种元素的指定单质生成标准状态的1mol 某纯物质时的热效应。
符号θc m H ∆表示的是在100 kPa 的压强下1mol 物质完全燃烧时的热效应。
完全燃烧在热力学上有严格的规定,碳的燃烧产物为CO 2 (g),氢的燃烧产物是H 2O (l),氮、硫、氯的燃烧产物分别为N 2 (g),SO 2 (g) 和HCl (aq)。
如:1mol H 2(g)完全燃烧反应H 2 (g) +21O 2 (g) === H 2O (l) 的θr m H ∆、θf m H ∆ 和θc m H ∆在数值上相等,即该反应的焓变等于H 2 (g)的标准摩尔燃烧焓,也等于H 2O (l)的标准摩尔生成焓,即2θc m ,H (g)H ∆= 2θf m,H O (l)H ∆ = θr m H ∆注意:如果上述反应的产物是H 2O (g),则2θc m ,H (g)H ∆≠2θfm,H O (l)H ∆ 因为H 2 (g) 完全燃烧的产物应是液态H 2O ,而不是气态H 2O 。
2015-2016-1《无机化学》期中考试参考答案与评分标准一、选择题(每小题2分)二、填空题(每空1分)1、<,>。
2、右;增加。
3、0级;2级。
三、是非题(每小题1分)1、错;2、对;3、错;4、对;5、错;6、对;7、错;8、对;9、错;四、问答题(每小题6分)1、解:该反应是气体分子数减少的放热反应,高压有利于反应向右移动,使CH3OH平衡时的含量提高。
(2分)温度升高不利于生成CH3OH,但是可以加快反应速率;加入催化剂也有利于提高反应速率。
应特别指出的是催化剂只有在适当高的温度下,才能具有催化活性和选择性。
因此催化反应的温度往往比较高。
(2分)氢气含量提高,有利于平衡向右移动,可提高CO的转化率。
(2分)2、解:p(反应物)或c(反应物)增大,k不变,v(正)增大,K不变,平衡向右移动;(2分)T升高,k增大,△r H<0,k(正)和k(逆)都增大,但k(逆)增大的倍数比k(正)增大的倍数大,K减小,平衡向左移动;(2分)加入催化剂,k(正)、k(逆)都增大,K不变,(k(正)、k(逆)增大倍数相同),平衡不移动。
(2分)五、计算题(每小题9分,共18分)1、解:C(s)+2S(s)→CS2(l)△r H=87.9kJ·mol-1△r S=(151.0-2×31.9-5.7)J·mol-1·K-1 = 81.5J·mol-1·K-1△r G=(87.9-298×10-3×81.5)kJ·mol-1 =63.6kJ·mol-1△f G(CS2,l)=△r G=63.6kJ·mol-1T≥()K=1.08×103K2、解:NiO(s)+CO(g)Ni(s)+CO2(g) 开始n/mol 2.0 x 0平衡n/mol x-2.0 2.0n(总) = x molK=θθC CO C CO ][][2=0.20.2-x 1.0 x =4.0 n (CO)=4.0mol△r G=-RT ln K=-8.314J·mol-1·K-1×10-3T ln1.0=0kJ·mol-1。
中科院无机化学试题及答案一选择题(30分):1下列溶剂最能溶解离子型溶质的是()ACCl4;BCH3OH;CC5H12;D(C2H5)2O。
2下列物质中碱性最强的是()AR4NOH;BR3NHOH;CR2NH2OH;DNH3(aq)。
3硼酸晶体中质点间的作用力是()A氢键,范德华力;B共价键;C离子键;D离子键,共价键。
4对于常见分子筛的成分中,硅铝比越大,下列说法正确的是()A耐酸性强,热稳定性差;B耐酸性差,热稳定性差;C耐酸强,热稳定性强;D耐酸怀差,热稳定强。
5下列金属中,熔沸点相差最大的是()ALi;BAl;CGa;DIn。
6NCl3的水解产物是()ANH3+HOCl;BNH3+HCl;CHNO2+HCl;DNH2OH+HCl。
7已知某反应的活化能为114kj.m0l-1,采用一种催化剂可使其活化能降低一半,该反应速率将加快倍数约是()A1X102;BI X1010;C1X106;D1X108O8有两个平行反应:A-B和A-C,如果要提高B的产率,降低C的产率,最好的办法是()A增加A的浓度;B增加C的浓度;C控制反应温度;D选择某种催化剂。
9下列物质在水中溶解度最小的是ALiF;BNaF;CKF;DCsF。
ANaN 3; BAgN 3; CPb(N 3)2;DBa(N 3)2。
10下列离子中最易水解的是11下列氟化物中,估计最强的氟化剂是12BF 3路易斯共振结构式数目有13关于单质硅,下列叙述正确的是A 能溶于盐酸中;B 能溶于硝酸中;C 能溶于氢氟酸中;D 能溶于氢氟酸和硝酸组成的混酸中。
14下列化合物中,热稳定性最高的是15制备NO 2时最好采用的热分解物质是 AFe 3+ ; BSc 3+; CY 3+;DLa 3+。
APF 5; BAsF 5; CSbF 5;DBiF 5。
A1; B2; C3;D4。
--()APb(NO3)2;BNaNO3;CKNO3;DNH4NO3。
无机化学试题第一章气体填空题:1、某广场上空有一气球,假定气压在一日内基本不变,早晨气温15℃时,气球体积为25.0L;中午气温为30℃,则其体积为 26.3 L;若下午的气温为25℃,气球体积为 25.9 L。
2、某真空集气瓶的质量为134.567g。
将一温度为31℃,压力为98.0 kPa的气体充入其中,然后再称其质量为137.456g,则该气体的质量m= 2.889g。
如果集气瓶中装满31℃的水,其总质量为1067.9g(该温度下水的密度为0.997g·mL-1),集气瓶的容积为0.936 L;该气体的密度ρ= 3.09 g.·L-1,摩尔质量M=79.6g·moI-1。
3、恒定温度下,将1.0L 204kPa的氮气与2.0L 303kPa的氧气充入容积为3.0L的真空容器中,则p(N2)= 68 kPa; p(O2)= 202 kPa; 容器内的总压力p=270 kPa。
4、在温度T时,在容积为c L的真空容器中充入氮气和氩气。
容器内压力为a kPa,若p(N2)=b kPa, 则p(Ar)= a-b kPa; N2和Ar的分体积分别为 bc/aL和 (a-b)c/a L; n(N2)= bc/RT mol,n(Ar)= (a-b)c/RT mol。
5、在相同温度、压力、体积下,两种气体的摩尔质量分别为M1和M2(M1>M2)。
试比较:n1 = n2, m1> m2; Ēk,1= Ēk,2; v1< v2; ρ1>ρ2。
若体积增大,温度、压力保持不变,则ρ1, ρ2都不变。
选择题:1、一定温度下,某容器中含有相同质量的H2,O2,N2与He的混合气体,其中分压最小的组分是………………………………………………………………( B )(A)N2 (B)O2(C)H2(D)He2、某温度下,一容器中含有2.0mol O2,3.0mol N2及1.0mol Ar。
大学无机化学试题及答案一、选择题(每题2分,共20分)1. 以下哪种元素的原子序数为11?A. 钠B. 镁C. 铝D. 硅答案:A2. 氢氧化钠的化学式是:A. NaOHB. Na2OC. KOHD. NaCl答案:A3. 以下哪种化合物属于共价化合物?A. 氯化钠B. 氧化镁C. 二氧化碳D. 氢氧化钠答案:C4. 金属钠与水反应生成的气体是:A. 氧气C. 氢气D. 二氧化碳答案:C5. 以下哪种物质是强酸?A. 醋酸B. 碳酸C. 硫酸D. 氢氧化钠答案:C6. 以下哪种元素属于碱金属族?A. 锂B. 钠C. 钙D. 钾答案:B7. 以下哪种元素的原子结构具有2个电子层?A. 氢B. 氦C. 锂D. 钠答案:C8. 以下哪种化合物的化学式是H2O2?B. 水C. 过氧化氢D. 双氧水答案:C9. 以下哪种物质是强碱?A. 氨水B. 氢氧化钠C. 氢氧化镁D. 碳酸钠答案:B10. 以下哪种元素的原子序数为8?A. 氧B. 氟C. 氖D. 氩答案:A二、填空题(每题2分,共20分)1. 元素周期表中,位于第ⅢA族的元素是_______。
答案:硼2. 元素周期表中,位于第ⅤA族的元素是_______。
答案:氮3. 元素周期表中,位于第ⅦA族的元素是_______。
4. 元素周期表中,位于第ⅠA族的元素是_______。
答案:氢5. 元素周期表中,位于第ⅡA族的元素是_______。
答案:铍6. 元素周期表中,位于第ⅥA族的元素是_______。
答案:氧7. 元素周期表中,位于第ⅧA族的元素是_______。
答案:氦8. 元素周期表中,位于第ⅠB族的元素是_______。
答案:铜9. 元素周期表中,位于第ⅡB族的元素是_______。
答案:锌10. 元素周期表中,位于第ⅢB族的元素是_______。
答案:镧三、简答题(每题10分,共30分)1. 描述什么是金属键,并举例说明。
答案:金属键是由金属原子释放的自由电子与正离子之间的电磁吸引力形成的化学键。
无机化学期中试卷答案2017.11.一、选择题 ( 共10题 20分 )1、B2、B3、B4、A5、A6、D7、A8、C9、C 10、C二、填空题 ( 共 10题 20分 )1、降低;降低;变小;向左2、-457.8;向左3、Ni(OH)3(s) + e - = Ni(OH)2(s) + OH -(aq); Cd(s) + 2OH -(aq) = CdO(s) + H 2O(l) + 2e -4、1.66;K =p p p p p p p p (CO)(H O)(H )(CO )222O O O O ⋅⋅5、<; >6、-1305.6;-16.57、碱;酸;HCO 3-;Fe(OH)(H 2O)52+8、AgCl ;Mg(OH)2+2H +Mg 2++2H 2O 9、Br 2、BrO -;Br -和BrO 3-10、1.0,2.2 ⨯ 10-20,-0.24三、问答题(3小题,共20分) 1、答:NH 3·H 2O NH 4++OH -(1)加入固体NH 4Cl ,使上述平衡向左移动,pH 下降。
(2)加入固体NaOH ,使上述平衡向左移动,pH 上升。
(3)加入HCl ,其与NH 3反应,c (NH 3)减小,使c (OH -)下降,pH 下降。
(4)加水稀释,c (NH 3·H 2O)下降,α上升,但c (OH -)下降,pH 值下降。
2、答: H 2SH ++HS - K (H 2S) + HS -H ++S 2- K (H 2S) H 2S2H +S K K =K (H 2S)·K(H 2S)=[(S )/][(H )/](H S)/2-22c c c c c c O O O ⋅+ 所以 c (S 2-)·[c (H +)]2=c (H 2S)·K (H 2S)·K (H 2S)·(c )2当H 2S 成饱和溶液时,等号右边可以认为是个常数,则c (S 2-)与c(H +)的平方成反比。
无机化学期中试题答案
广州市生物医药高级职业技术学校
无机化学期中考试试卷-A
学校:班别:学号:姓名:评分:
注意事项
(考试时间:90分钟)
1、请首先按要求在试卷的标封处填写您的姓名、考号和所在单位的名称。
2、请仔细阅读各题目的回答要求,在规定的位置填写您的答案。
3、不要在试卷上乱写乱画,不要在标封区填写无关内容。
一、填空。
(每空2分,共10分)
1.主量子数n=2,则l=0,1 ;m=0,-1,+1。
2. 等性sp2、sp3杂化轨道的夹角分别为120°,109。
28
,。
3.分子间力包括取向力、诱导力、色散力。
三、判断题。
(请将答案填入下面表格,每小题1分,共10分)
四、完成下列各题。
(每题10分,共20分)
1.写出下列原子在基态时的电子排布。
(每小题3分,共6分)
(1). Mn: 1s22s22p63s23p63d54s2;
(2). Cu:1s22s22p63s23p63d104s1;
2. 判断半径大小。
(每小题2分,共4分)
(1)Fe2+与Fe3+
Fe2+>Fe3+同一元素离子,正电荷越高则半径越小。
(2)O、S、As As > S > O
3.计算下列中心原子的价层电子对数,并判断下列分子的分子构型以及有无极性。
(每小题5分,共10分) 1. CO 2
价层电子对数=(4+0)/2=2;直线型;无极性 2.NH 3
价层电子对数=(5+1*3)/2=4;三角锥体;有极性
五、计算题。
(每题10分,共30分)1.已知某原子的电子分布是1s
2
2s 2 2p 63s 2 3p 64s 2
(1)这元素的原子序数是多少?并写出该原子的轨道分布图(3分)(2)这元素属第几周期?第几族?是主族元素还是过渡元素?(3分)(3)请写出这个原子的价电子排布式。
(4分)解:(1)20
(2)第四周期,IIA ;主族元素.
(3)4s 2
2.在给定的条件下,氮气和氢气在密闭容器中合成氨,已知,反应之前氮气和氢气的浓度为1.0mol/l,
3.0mol/l ;反应4s 后,测得氮气、氢气和氨各自的浓度为0.8mol/l ,2.4mol/l ,0.4mol/l ,求该反应的平均速率。
N 2 + 3H 2
→ 2NH
3
V=(1.0-0.8)/4mol/(l*s )=0.05mol/(l*s )
3. 已知一化学反应的活化能为117.15kJ/mol ,问在什么温度时反应的速率常数k 的值是400K 时速率常数的值的2倍。
(10分)(lg2=0.3010) 解:设温度为T 时,速率常数k 的值是400K 时速率常数
的2倍。
lg 12k k =303R .2E a (1
212T T T T -)
)
1
4001(314.8303.21171502lg T -??=
)(408k T = 答略。
二、单项选择。
(在每小题的四个备选答案中,选出一个正确的答案,并将其码写在题干的()内,每小题2分,共30分)
1.已知某一反应A+B →C 为可逆反应,△rHm<0,则有( A )
A .Ea 正Ea 逆 C .Ea 正=Ea 逆 D .不确定
2.下列物质中,哪个是非极性分子:( B) A .H 2O B .CO 2
C .HCl
D .NH 3
3.极性共价化合物的实例是:(B )
A .CO 2
B .HCl
C .CCl 4
D .BF 3
4. N 的氢化物(NH 3)的熔点都比它同族中其他氢化物的熔点高得多,这主要由于NH 3:(C )
A .分子量最小
B .取向力最强
C .存在氢键
D .诱导力强
5. 不合理的一套量子数(n ,l ,m ,s i )是:(B )
A .4,0,0,21+
B .4,0,-1,21
-
C .4,3,+3,21-
D .4,2,0,21
+
6. 氯溴、碘的性质随原子序数增加而增加的有________(B ) A. 第一电离能 B. 离子半径 C. 单质分子中的键能 D. 电负性
7. 具有饱和性和方向性的是_________(A ) A. 氢键 B.离子键 C. 取向力 D.金属键
8. 下列化合物采取不等性SP 3
杂化的是___________.(B ) A.BCL 3 B.H 2O C.CH 4 D.H g CL 2
9.下列四个量子数所描述的电子运动状态中,能量最高的电子是:( B ) A 、(4、1、0、+1) B 、(4、2、1、-1) C 、(4、0、0、+2
1) D 、(4、1、1、-2
1)
10.下列分子间能形成氢键的是:( D )
A 、HF ——HI
B 、H 2O ——H 2Se
C 、NH 3——H 3As
D 、NH 3——H 2O
11.已知反应 2A(g) ===2C(g) +B(g) 为一基元反应,A 的反应级数为,总
反应级数为(A )
A.2,2 B、2,1 C、2,0 D、2,-2
12.核电荷数=核内质子数 =( A )
A.核外电子数
B.周期数
C.原子量
D.质量数
13.各亚层最多容纳电子数____个. ( D )
A.2l
B.2l+1
C.2l-1
D.4l+2
中的O的化合价为( C)
14.CO
2
A.+2
B.+1
C.-2
D.+6
15. 影响化学反应的因素有( D)
A.浓度
B.温度
C.催化剂
D. A+B+C
16.硼有10B和11B两种同位素组成,硼元素的原子量为10.8,求10B和11B在自然界中各自的百分比。
( A )
A. 10B占20%,11B占80%
B. 10B占10%,11B占90%
C. 10B占30%,11B占70%
D. 10B占40%,11B占60%
17.主量子数n代表的意义是(B )
A. 表示原子轨道(电子云)的形状
B. 决定电子离核平均距离的远近;决定电子能量高低的主要因素
C. 决定原子轨道在空间的伸展方向
D. 表示电子本身有两种相反方向自旋运动
18.当自旋量子数是+1/2的时候,电子的自旋状态是( C )
A.向左方向
B.向右方向
C.顺时针方向
D.逆时针方向
19.关于化学键的叙述,正确的是(A )
A. 离子化合物可能含有共价键
B. 共价化合物可能含有离子键
C. 离子化合物中只含离子键
D. 以上均不正确
20.下列含有配位键的化合物是(D )
D.A和B
A. NH4+
B. CO
C.N
2
三、判断正误,对的打“√”,错误打“×”。
(每题1分,共10分)
1. 电子云是描述核外某空间电子出现的几率密度的概念。
(√)
2. 原子轨道的形状由量子数m决定,轨道的空间伸展方向由l决定。
(×)
3. P区元素的原子填充电子时是先填入3d,然后是4s,所以失电子时,也是按这个顺序。
(×)
4.某反应的速率常数的单位是mol-1·dm3·s-1,该反应是一级反应。
(×)
5. 活化能大的反应受温度的影响大。
(√)
6. 反应级数与反应分子数是同义词。
(×)
7. NaH中,Na的电负性为0.9,H的电负性为2.1,NaH中为共价化合物,Na显正价。
(√)
8. 同一周期,随着核电荷数的递增,原子半径逐渐增大。
(×)
9. 离子化合物中,各原子间都以离子键结合。
(×)
10.活化能均为正值,反应热可以是正值也可以是负值。
当正反应的活化能大于逆反应的活化能,则正反应为吸热反应。
(√)。