流行病临床试验设计
- 格式:ppt
- 大小:334.50 KB
- 文档页数:25


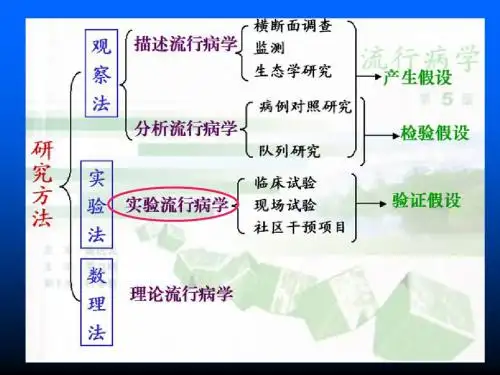
第十六章流行病学实验研究流行病学实验研究包括:临床试验、现场试验,设计方法主要有随机化对照试验和类实验。
第一节概述一、概念实验:严格控制条件,人为采取措施,前瞻观察效应。
流行病学实验研究:通过比较给予干预措施的实验组人群和对照组人群的结局,从而判断干预措施效果的一类前瞻性研究方法。
实验研究比观察性研究能更好地控制各类偏倚,在同样的受控条件下容易重复。
“人为介入”(干预)存在突出的伦理问题。
二、特点1、实验法:必须控制研究因素和外部因素,研究对象分组要遵循随机化的原则。
2、对照:有平行对照组。
3、干预三、分类1、临床(治疗)试验在医院进行,研究对象高度选择(主要是病人),受控条件较好。
2、现场试验(1)个体实验:在一定区域或实地环境下进行,研究对象为定义明确的人群,包括病人和正常人,研究期间长,受控条件较差。
但研究对象处于真实生活环境中,外推普遍性好。
处理分配单位是个体。
(2)社区干预试验:与个体试验的主要区别是:处理分配单位是群体。
四、优缺点1、优点①人为控制条件,标准化评价②实验组和对照组的可比性好③外部因素对结果的影响小④验证因果关系的强度高2、缺点①设计和实施较复杂②结论外推到一般人的代表性较差③存在医德和伦理问题第二节临床试验的定义和特征一、定义按实验法的原理,运用随机分配的原则将实验对象分为试验组和对照组,给予前者某种治疗措施,不给予后者该措施或给予安慰剂,经过一段时间同等观察后评价该措施产生的效应。
其目的是评价临床治疗和预防措施的效果和进行病因研究。
通常应用临床随机对照试验(RCT)二、特征1、论证强度高2、前瞻性研究3、人道主义原则4、研究对象的依从性5、实施的复杂性第三节临床试验设计的组成部分一、研究因素1、性质研究因素主要是外界强加于研究对象的,其性质可是生物的、化学的、物理的和社会的因素,也可是研究对象本身具有某些特征。
2、强度所使用的药物或措施的总量、次数、每次的剂量、疗程的数量等。



流行病学实习三——临床试验设计北京大学近年来,随着人们对健康意识的提高和医学科技的不断进步,临床试验在医学领域扮演着至关重要的角色。
临床试验作为确认新药疗效、评估治疗手段有效性以及研究特定疾病群体表现等的重要途径之一,对保护人类健康具有重要意义。
本文将以北京大学为例,探讨其中一次临床试验设计。
在北京大学医学部的临床试验中心,研究人员进行了一项针对心血管疾病的临床试验,旨在研究不同药物对于高血压患者的疗效。
该试验采用随机分组的方法,将患者分为两组,一组接受传统治疗,另一组则接受新型药物治疗。
通过比较两组患者的症状、生命体征以及心血管相关指标的变化,研究人员旨在评估新型药物的安全性和疗效。
为了确保试验结果的准确性和可靠性,研究人员在试验设计上做了多重考量。
首先,他们选择了足够数量的患者样本以保证试验结果的统计学意义。
通过统计计算,确定了每组患者的样本量,并在临床试验中进行招募和筛选工作。
其次,为了避免潜在的干扰因素对试验结果的影响,研究人员使用随机分组的方法,将患者随机分配到两个治疗方案中,从而避免了选择性偏倚的发生。
这样做可以将患者个体差异的影响降至最低,并确保两组之间在静态上具有可比性。
此外,在试验过程中,北京大学的研究人员还关注到了试验结果的可操作性和实用性。
他们依据临床实际,采用了一种标准化的测量方法来记录患者的症状和生命体征变化,并制定了一套符合临床实践的评估指标,如血压、心率等。
这些指标的选择不仅符合国际标准,还与临床医生在日常工作中常用的评估方法相一致,这使得试验结果更具可操作性,并有助于将研究结论迅速应用于临床实践。
当然,在临床试验中,保证患者的伦理权益是至关重要的。
北京大学医学部的研究人员严格遵守了相关伦理规范,并获得了相应的伦理审批。
在试验过程中,他们为患者提供了详细的试验资讯,并在患者明确知情并同意的情况下进行试验。
同时,研究人员监测患者的健康状况,并在试验过程中及时提供必要的医疗援助和支持,确保患者的健康与安全。


临床试验Clinical trialClinical trial1本次授课重点内容临床试验的概念临床试验的设计临床试验中对照的选择和类型临床试验的评价原则2一、临床试验概述临床试验的意义临床试验的分期临床试验的特点临床试验的主要应用范围31.1.临床试验临床试验临床试验(临床试验(Clinical trail Clinical trail)是以患者)是以患者为研究对象,对比观察干预措施效应的前瞻性研究狭义的临床试验通常是指用来比较不同的处理的处理((药物或治疗方法)对某种疾病疗效的治疗试验4临床试验的意义2.临床试验的意义2.新药物和新的治疗方法出现如何选择合适的药物和治疗方法使患者受到更大的益处和最小的风险临床试验是科学证据的主要来源,是临床治疗进步的基础5国际上关于新临床试验的分期Ⅰ期临床药理学毒理学研究Ⅱ期疗效的初步临床研究Ⅲ期全面的疗效评价蕌蕌Ⅳ期销售后的监测蕌6Ⅰ期临床试验Ⅰ期临床试验:在大量的基础研究之后,新的药物或疗法用于人体试验。
是小规模的临床试验,又称探索性试验,是新药临床评价的最初阶段。
7地点:有条件的单位人群:自愿者,知情同意患者,不少于20例 目的:提供人体试验的基本数据,为Ⅱ期临床试验打下基础存在弱点:观察数量少,没有对照,结论不确定8Ⅱ期临床试验Ⅱ期临床试验:是对新药的有效性、安全性进行初步评价,确定给药剂量。
是评价药物疗效与不良反应,决定最适剂量的主要阶段。
9设计方案:严格的随机对照试验以平行对照为主,通常与标准疗法进行比较研究的例数不少于研究的例数不少于200200例例对药物的安全性、有效性、使用剂量等做出初步的评价10Ⅲ期临床试验Ⅲ期临床试验,是多中心临床试验,最好选择最好选择33家以上的指定医院进行,实例。
300例。
验组例数一般不少于300验组例数一般不少于需要诊断标准、疗效标准的科学性、权威性和统一性。
11第一、二、三类新药均须进行第一、二、三类新药均须进行ⅢⅢ临床试验。



流行病学中的临床试验和干预研究流行病学是研究疾病在人群中分布、发生和传播规律的科学。
在流行病学研究中,临床试验和干预研究是重要的方法,用于评估预防、治疗或干预措施对人群健康的影响。
本文将介绍流行病学中的临床试验和干预研究的定义、分类和具体应用。
一、临床试验的定义和分类1. 定义临床试验是一种为了评估新的预防、治疗或干预措施在人体中安全性和有效性的研究方法。
它通过随机分配受试者到不同的干预组或对照组,并进行比较来确定效果。
临床试验可以是观察性或实验性的,并且其结果对于指导临床决策具有重要意义。
2. 分类根据研究对象和目的,临床试验可以分为预防性试验和治疗性试验两类。
预防性试验旨在评估一种干预措施对疾病预防的效果。
例如,针对某一病毒的疫苗是否能有效预防相关疾病的发生,需要进行大规模的临床试验。
治疗性试验则旨在评估一种干预措施对疾病治疗的效果。
例如,在药物研发阶段,需要通过临床试验来确定该药物对患者病情的改善以及不良反应的发生情况。
二、干预研究的定义和分类1. 定义干预研究是一种为了评估特定干预措施对疾病发生和发展的影响的研究方法。
它与临床试验相似,但一般基于人群而非个体。
2. 分类根据研究策略和目的,干预研究可以分为两类:观察性干预研究和实验性干预研究。
观察性干预研究采用回顾或前瞻性的方法,对干预措施进行评价。
研究人员观察实施干预措施前后人群中的疾病发生率或疾病相关因素的变化,来判断干预措施的效果。
例如,通过观察不同地区饮食习惯与心血管疾病发病率的关系,推测出健康饮食对心血管健康的影响。
实验性干预研究则通过分组实施干预措施,并比较不同组别之间的差异来评估干预效果。
例如,在某一地区随机分配不同社区实施特定健康干预措施,如健康教育或体育锻炼,并对比多个干预组之间的差异,从而评估干预的有效性。
三、临床试验和干预研究的应用1. 预防研究临床试验和干预研究在预防研究中发挥重要作用。
通过比较干预组和对照组之间的结果,可以评估预防措施对疾病发生的影响。
临床流行病学临床试验临床流行病学是一门研究疾病在人群中分布及其影响因素的学科。
在研究大规模人群时,常需要进行临床试验来验证某种治疗方法的有效性。
本文将介绍临床流行病学临床试验的基本步骤和注意事项。
一、确定研究目的临床流行病学临床试验的第一步就是明确研究的目的。
研究目的可以是评估某种新的药物疗法的疗效,或比较两种不同治疗方法的优劣。
必须确保研究目的明确、科学合理。
二、制定研究设计制定研究设计是临床流行病学临床试验的核心环节之一。
研究设计至关重要,需要合理且可靠。
常见的研究设计包括随机对照试验、队列研究、病例对照研究等。
根据研究目的和具体情况选择最适合的研究设计。
三、招募研究对象招募研究对象是临床试验的一项重要任务。
需要根据研究目的确定招募标准,并通过广泛的宣传和筛选,选取符合条件的研究对象。
在招募过程中,需确保研究对象的知情同意,并保证他们的权益得到充分的保护。
四、随机分组和盲法处理随机分组和盲法处理是临床试验的两项重要原则。
随机分组可以避免实验组和对照组之间的偏差,使试验结果更加可靠。
而盲法处理可以避免主观因素的干扰,保证试验结果的客观性。
五、实施试验并收集数据在实施试验时,需确保按照研究设计的要求进行操作,并且确保数据的准确性和完整性。
数据的收集可以通过面试、问卷调查等方式进行。
同时,还需保证试验过程的规范化和标准化,以减小误差。
六、数据分析和结果解读收集完试验数据后,需要进行数据分析和结果解读。
常见的数据分析方法包括统计学方法和生物学分析方法。
通过数据分析,可以获得试验结果的统计学意义,并从中解读出结论。
临床流行病学临床试验的结果可以为临床实践提供科学的依据,帮助医生和决策者做出更准确的治疗决策。
然而,临床试验也存在一些风险和限制,例如样本量过小或者不具备代表性等。
因此,在进行临床试验前,需充分的预先评估,并做好充分的准备工作。
总之,临床流行病学临床试验在疾病治疗领域发挥着重要的作用。
通过科学合理的设计和严谨的实施,可以为临床实践提供有效的证据,推动医学科学的进步。
临床医学研究常用的设计方案12研临床流行病学临床医学研究一直是医学领域的重要组成部分之一。
而在实施临床研究时,常常需要采用各种设计方案,其中之一便是研究临床流行病学。
本文将对临床流行病学的设计方案进行探讨。
临床流行病学是研究人群中疾病的广泛分布、发病原因以及疾病防控措施的科学。
在进行临床流行病学研究时,需要借助一定的设计方案,以确保研究结果的可靠性。
首先,横断面研究是临床流行病学中常用的一种设计方法。
该方法通过在特定时间点对一群个体或群体进行观察和调查,来评估某一特定疾病在人群中的分布情况。
横断面研究的数据收集相对简单,但并不能确定因果关系,只能提供疾病的流行情况。
其次,纵向研究是一种更为复杂和耗时的研究设计。
纵向研究通过长期跟踪观察一组人群,随着时间的推移,记录其发病情况和暴露因素的变化,以揭示疾病和暴露因素之间的关系。
纵向研究可以提供较为准确的因果关系,并可用于评估干预措施的效果,但需要投入大量的时间和资源。
此外,病例对照研究也是临床流行病学中常用的一种设计方案。
病例对照研究通过比较患病者(病例组)和非患病者(对照组)之间的暴露差异来评估疾病发生的危险因素。
该方法适用于疾病罕见、发病周期长或研究主题非常敏感的情况。
病例对照研究可以提供较快的研究结果,并且可以在相对较短的时间内进行。
此外,临床试验作为一种广泛运用于临床医学研究的设计方案,也在临床流行病学中得到了应用。
临床试验通过随机分组与对照组进行比较来评估某种干预措施的疗效或副作用。
在临床流行病学中,有时需要进行干预措施的评估,比如疫苗的效果评估等。
临床试验能够提供更直接的证据,但需要符合伦理要求,并且需要大样本和较长时间的观察。
另外,在临床流行病学研究中,群组随机化试验也是一种常用的设计方案。
群组随机化试验是随机选择一定数量的群体进行干预,然后对比干预组和对照组的结果,以评估干预措施的效果。
该设计方案适用于社区层面的干预措施研究,可以提供较为全面和客观的评估结果。
流行病学研究设计类型流行病学研究是研究疾病在人群中分布和影响因素的科学。
随着疾病模式的变化,流行病学研究设计也不断进化和完善。
本文将简要介绍流行病学研究设计的几种类型。
观察性研究流行病学研究可以分为观察性研究和实验性研究。
观察性研究是通过直接观察研究对象的行为、生活习惯、环境、疾病等,而非人为调节其因果关系来研究疾病的发生和影响因素。
观察性研究包括:横断面研究横断面研究,也称为横向研究或截面研究,是指在一段时间内,对某群体进行一次调查,收集有关其疾病、生活方式、社会和经济状况等数据并进行分析。
横断面研究可以描述研究对象的当前状态,但不能确定其因果关系。
病例-对照研究病例-对照研究是一种回顾性研究,通常用于探究疾病和暴露因素之间的关联。
研究对象被分为病例组和对照组,对照组是一组与病例组相似的人群,但没有疾病。
然后比较两组的暴露情况,以确定是否存在关联。
队列研究队列研究是指对一群人进行长期的观察,以了解暴露因素对于疾病发生的影响。
队列研究分为前向队列研究和后向队列研究。
在前向队列研究中,研究人员在暴露后开始跟踪从未患有该疾病的群体。
在后向队列研究中,研究人员在具有该疾病风险因素的群体中进行跟踪观察。
实验性研究实验性研究是通过对实验组和对照组进行人为干预,评估其效果以确定干预因素对疾病的影响。
实验性研究包括:随机对照研究随机对照研究是通过随机分配实验对象到实验组和对照组,对干预进行比较评估其效果。
这种方法能够控制干预因素和其他因素的影响,但需要大量的时间和资源。
临床试验临床试验是评估新治疗方法的有效性和安全性的方法,通常包括三个阶段:初步试验、随机对照试验和后期试验。
流行病学研究设计类型有多种方法,在选择研究方案时需要综合考虑研究目的、数据可行性、人力及财力资源等因素。
选择最合适的研究方法能够帮助我们更好的了解疾病发生的因素和控制方法,从而改善人民健康。