西北大学2012物理化学考研
- 格式:docx
- 大小:71.19 KB
- 文档页数:8

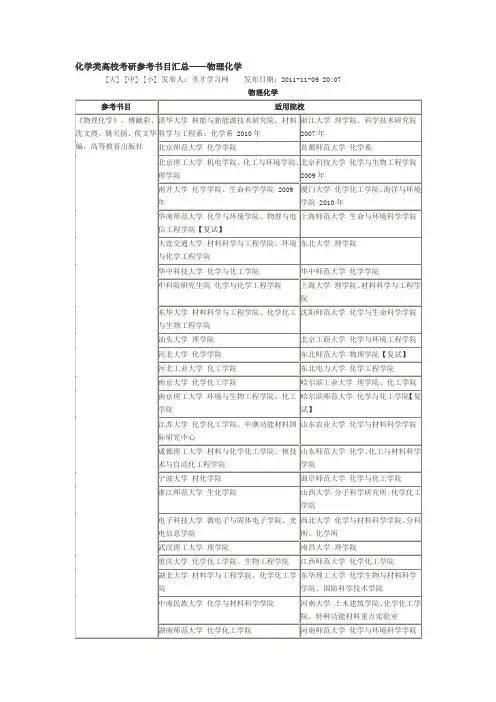
考试科目代码考试科目名称241日语(二外)242法语(二外)243德语(二外)244俄语(二外)245英语(二外)246阿拉伯语601数学乙611政治学612管理学(含公共管理)613美术理论(艺术概论、中外美术史)614美学原理615宗教学概论616文学概论617语言学概论618中国古代文学史619影视概论620法理学与宪法学621新闻传播史论622综合英语623综合日语624考古学综合625文化遗产基础综合626文物保护学综合627马克思主义哲学原理628中国哲学史629社会学概论630马克思主义基本原理631国际关系概论632数学分析633普通物理634有机化学635无机化学636分析化学(含仪器分析)637地理信息系统638城市规划原理639生物化学(生科院)640中药综合641生态学642数据结构与程序设计643地史学644新闻传播基础645艺术概论646自然辩证法概论647中国近代史648文学基础701中国史702世界史703中国思想文化史801经济学(含政治经济学、西方经济学)802世界政治与经济803管理学与运筹学(管理学占100分,运筹学占50 804经济学805信息资源管理806西方经济学与应用统计学(西方经济学占100807中西美学史808中外文化史809综合一(含比较文学与世界文学、中国现当代810综合三(含古代汉语、现代汉语、对外汉语教811综合二(含古代文论、古代汉语、古典文献学812影视理论专题813诉讼法学814新闻传播业务815英美文学与语言学816日本文学与文化817西方哲学史818西方社会学理论819马克思主义中国化研究(含毛泽东思想、邓小820国际关系史821高等代数822数学史(含科技期刊史、自然科学史)823量子力学824固体物理825光学826物理化学827化工容器设计828化工原理829微生物学(化工)830有机化学(化工)831食品化学832区域分析与区域规划833激光原理834自然地理学835经济地理学836环境学837环境工程学838城市规划基础(含道路交通规划和市政工程规839植物生物学840动物生物学841微生物学842细胞生物学843电子线路(含模拟、数字)844软件工程学科专业基础综合(数据结构与操作50%)845教育技术学846地球科学概论847基础物理848历史学专业综合849模拟电路850数字电路851数据结构852细胞生物学(工程)853广播电视概论(新闻学院)854广播电视概论(文学院)855文学鉴赏与批评856物理化学(专)参考书目《标准日本语》初级(上、下册),人民教育出版社。


西北大学化学工程、工艺专业复试的一些问题〔合集5篇〕篇1:西北大学化学工程、工艺专业复试的一些问题西北大学关于化学工程、工艺专业复试的一些问题一、英语〔50分〕:笔试占20分,比拟简单,全部是选择题,题型有单项选择、完型、阅读、翻译。
听力和口语占30分,听力就十道小题,听力好的应该没问题,听力估计占非常,所以听力不好的也不用太担忧;口语就是简单的英语自我介绍,然后用英语答复两个问题,因此英语不用花费太多精力。
二、专业课〔250〕:笔试考物理化学,参考书是《物理化学》〔傅献彩,南大第四版〕和《物理化学导教诲学导考》〔卢荣,南大第四版〕,此项占150分,是拉分项,需花费大量的精力。
专业课面试50分,先是中文自我介绍,教师可能打断问些问题,都不是太难,主要是所学课程和毕业设计或毕业论文。
实验技能50分:一直考得是离心泵,教师一般问几个相关的问题,好好准备就行了。
就这么多了,预祝各位学弟学妹顺利通过复试!篇2:中南大学化学工程与工艺专业化学工程与工艺专业学生主要学习化学工程学与化学工艺学等方面的根本理论和根本知识,受到化学与化工实验技能、工程理论、计算机应用、科学研究与工程设计方法的根本训练.具有对现有企业的消费过程进展模拟优化、革新改造,对新过程进展开发设计和对新产品进展研制的根本才能。
培养具备化学工程与化学工艺方面的知识,能在化工、炼油、冶金、能、轻工、医药、环保和军工等部门从事工程设计、技术开发、消费技术管理和科学研究等方面工作的工程技术人才。
化学工程与工艺专业就业前景:相关从业人员都表示,化工专业毕业生要找到一份工作并不难,但找什么样的工作就因人而异了。
该专业毕业生的就业情况和所在院校及院校专业方向也有一定关系。
由于化工各个方向分类较细,各个大学都有自己擅长的专业方向。
如有些学校侧重石油化工、煤化工;有些侧重医药化工;有的那么侧重金属冶炼或精细化工等。
另外,还有一些人对化工就业存在这样的误区,担忧学这个专业毕业后要去挖煤、炼石油。

2013物化826一、选择题(每个选择题有A、B、C、D四个答案,其中只有一个是正确的。
每小题2分,共40分)1. 相对理想气体,实际气体的压力和体积分别会出现: ( )(A) 压力正偏差,体积正偏差 (B) 压力正偏差,体积负偏差(C) 压力负偏差,体积正偏差 (D) 压力负偏差,体积负偏差2. 在标准压力下,C(石墨) + O2(g)=CO2(g) 的反应热为△rHөm,下列哪种说法是错误的? ( )(A) △rHөm是CO2(g)的标准生成热 (B) △rHөm△=rUөm (C) △rHөm是石墨的燃烧热 (D) △rUөm <△rHөm3. n mol某气体在恒容下,由T1加热到T2,熵变为△S1,相同量的气体在恒压下由T1加热到T2,其熵变为△S2,则△S1与△S2的关系为: ( ) (A) △S1>△S2 (B) △S1<△S2 (C) △S1=△S2(D) △S1=△S2=04. 已知 373 K 时,液体A的饱和蒸气压为 5×104 Pa,液体 B 的饱和蒸气压为105 Pa,A和B构成理想液体混合物,当A在溶液中的物质的量分数为0.5 时,气相中B的物质的量分数为: ( )(A) 1/1.5 (B) 1/2 (C) 1/2.5 (D) 1/35. 把500g樟脑(熔点451.15K)和0.1mol的某新合成的有机物相混合,所得的混合物熔点为443.15K,已知该有机物0.13g和5g樟脑混合物的熔点为447.15K,则该有机物的相对分子量为:( ) (A) 130 (B) 260 (C) 140 (D) 2806. 加入惰性气体能增大平衡转化率的反应是:()(A) C6H5C2H5(g)= C6H5C2H5(g)+H2(g)(B)CO(g)+H2O(g)=CO2(g)+H2(g)(C) 1.5H2(g)+N2(g)=2NH3(g)(D)CH3COOH(l)+C2H5OH(l)=H2O(l)+CH3COOC2H5(l)7. CuSO4与水可生成CuSO4⋅ H2O,CuSO4⋅ 3H2O,CuSO4 ⋅ 5H2O 三种水合物,则在一定温度下与水蒸气平衡的含水盐最多为:( )(A) 3种 (B) 2种 (C) 1种 (D) 不可能有共存的含水盐8. 对单原子理想气体分子,发生一个物理变化,欲求其热力学性质,要知道:()(A) qt、 qr、 qv (B) qt (C) qr、 qe、qn (D) qe、 qn9. 300 K时,分布在J= 1转动能级上的分子数是J= 0 能级上分子数的3exp(-0.1)倍,则分子转动特征温度是:( )(A) 10K (B) 15K (C) 30K (D) 300K10. 给处于右图(图1)II区的系统中投入一块结晶的A(s),发生的现象是:( )(A) A(s)将很快溶解(B)(B) A(s)将稳定存在(C)(C) A(s)量将增加(D) (D) B(s)量将增加11. 在 Hittorff 法测迁移数的实验中,用 Ag 电极电解 AgNO3溶液,测出在阳极部AgNO3的浓度增加了 x mol,而串联在电路中的 Ag 库仑计上有 y mol 的 Ag 析出, 则Ag+离子迁移数为:( )(A) x/y (B) y/x (C) (x-y)/x (D) (y-x)/y12. 291K,纯水的无限稀释摩尔电导率为 4.89×10-2 S·m2·mol-1,此时水中m(H+)=m(OH-)=7.8×10-8 mol·kg-1,则291K时纯水的电导率k(S·m-1)为:( )(A) 3.81×10-6 (B) 3.81×10-8 (C) 3.81×10-7 (D) 3.81×10-513. 有如下两个电池,其中a1< a2,电池的动势分别为E1和E2:(1)Cu(s)│Cu2+(a1)ǁCu2+(a2)│Cu(s) E1(2)Pt(s)│Cu2+(a1),Cu+(a’)ǁCu2+(a2), Cu+(a’)│Pt(s) E2两个电池的反应都可以表示为:Cu2+(a2) → Cu2+(a1),则两个电池电动势的关系为:():(A) E1 = 2E2 (B) E1 = 1 / 2E2 (C) E1= E2 (D) 无法比较14. 关于阈能,下列说法中正确的是:( )(A) 阈能的概念只适用于基元反应 (B) 阈能值与温度有关(C) 阈能是宏观量、实验值 (D) 阈能是活化分子相对平动能的平均值15. 平行反应B→P(E1);B→Q(E2),已知活化能E1>E2,指前因子A1>A2。


考试科目:《物理化学》(总分) 136分一单选题 (共126题,总分值126分 )1. 室温下,以下几种离子中无限稀释摩尔电导率Λ最大的为()。
(1 分)A. K+B. Na+C. H+D. Zn2+2. 反应C(s)+O2(g)=CO2(g),2 CO(g) +O2(g)= 2CO2(g),C(s)+ 1/2 O2(g)=CO(g)的平衡常数分别为K1Θ、K2Θ,这三个平衡常数之间的关系是()(1 Θ、K3分)A. K3Θ=K1ΘK2ΘB. K3Θ= K1Θ/K2ΘC.D.3. 101.3 kPa下,110 ℃的水变为110 ℃的蒸气,吸热 Q.此过程环境的熵变ΔS(环)()。
(1 分)A. = 0B. > 0C. < 0D. = Q/T4. 对恒沸混合物的描述,下列各种叙述中哪一种是不正确的?_________________。
(1 分)A. 与化合物一样,具有确定的组成B. 不具有确定的组成C. 平衡时,气相和液相的组成相同D. 其沸点随外压的改变而改变5. 1 mol 水在 100℃, 101.3 kPa下变成同温同压下的水蒸气( 水蒸气视为理想气体 ), 然后等温可逆膨胀到 10.13 kPa, 则全过程的ΔH =()(已知水的气化焓为 40.67 kJ/mol)。
(1 分)A. 0B. 40.67 JC. 40.67 kJD. - 40.67 J6. (1 分)A. -484.5B. 0C. -873.5D. 194.87. 下列函数中为强度性质的是:()(1 分)A. SB. (G/p)TC. (U/V)TD. C V8. 第一类永动机不能制造成功的原因是(1 分)A. 能量不能创造也不能消灭B. 实际过程中功的损失无法避免C. 能量传递的形式只有热和功D. 热不能全部转换成功9. 一贮水铁箱上被腐蚀了一个洞,今用一金属片焊接在洞外面以堵漏,为了延长铁箱的寿命,选用哪种金属片为好?(1 分)A. 铜片B. 铁片C. 镀锡铁片D. 锌片10. dU=CvdT及dUm=Cv,mdT适用的条件完整地说应当是(1 分)A. 等容过程B. 无化学反应和相变的等容过程C. 组成不变的均相系统的等容过程D. 无化学反应和相变且不做非体积功的任何等容过程及无反应和相变而且系统内能只与温度有关的非等容过程11. 基元反应 H + Cl2──> HCl + Cl 的反应的分子数为()。

西北大学2012年招收攻读硕士学位研究生试题(分析化学)科目名称:分析化学(含仪器分析)科目代码:637适用专业:分析化学共7页答案请答在答题纸上,答在本试题上的答案一律无效一.选择题(共20分,每题1分)1.有一碱液,可能含有 NaOH, Na2CO3, NaHCO3。
今用 HCl 溶液滴定,以酚酞为指示剂时,消耗HCl的体积为15.80mL;又加入甲基橙指示剂,继续用HCl溶液滴定,又消耗HCl体积为9.76mL,此碱液的组成为:()•NaOH; b. Na2CO3;c. Na2CO3 + NaHCO3; d. NaOH +Na2CO3•在铜氨溶液中,当氨的平衡浓度为1.00×10-3mol·L-1时,溶液中的主要存在形式是:(铜氨络离子的lgβ1~β5分别为 4.31, 7.98, 11.02, 13.32, 12.86。
()a. Cu(NH3)52+;b. Cu(NH3)2+;c. Cu(NH3)32+;d. Cu(NH3)42+3. 在间接碘量法测定铜时,Fe3+干扰测定,可加入下列何种溶液消除干扰。
()a. 邻二氮菲;b. HCl;c. H3PO4d. NH4F。
4. 在含有 Fe3+、Fe2+的溶液中,加入下列何种溶液 Fe3+/Fe2+电对的电位将降低()6. 下列有关平均值的置信区间的论述中,错误的是()•当置信度与测定次数一定时,一组测量值的精密度越高,平均值的置信区间越小。
•平均值的数值越大,置信区间越宽。
•其他条件不变时,给定的置信度越高,平均值的置信区间越宽。
•在一定的置信度和标准偏差时,测定次数越多,平均值的置信区间包括真值的可能性越大。
7. 沉淀的类型与聚集速度有关,与聚集速度大小有关的因素是()a. 物质的性质;b. 溶液的c. 过饱和度;d.相对过饱和度。
8. 移取 20.0mL KHC2O4·H2C2O4试液两份。
其中一份酸化后,用 0.0400mol·L-1 KMnO4溶液滴定至终点时,消耗 KMnO4体积 20mL; 另取一份试液若以 0.100 mol·L-1NaOH 溶液滴定至酚酞变色点,消耗 NaOH 的体积是()a. 20.0mL;b. 15.0 mL;c. 30.0 mL;d. 25.0 mL。

西北大学2012年招收攻读硕士学位研究生试题(无机化学)a. HF,CaF2,LiFb. OF2,BF3,PF5139西北大学化学与材料科学学院2013年硕士学位研究生报考指南c. LiF,SF6,SiF4 d. NF3,BeF2,AlF3能量反应物(XY 生成物下列定义中不正确的是()b. H+ (aq)的r Gθm= 02 (g)的r H θm= 0140。
的配位数为,配离子的空141⑤0.1mol · kg-1CaCl2⑥0.1 mol · kg-1 HAc2.12 44 g 锌与稀酸反应,在300 K 和99.97 kPa 下,于水面上收集到氢气2.15dm3。
已知300 K 时的水蒸气压为3.57 kPa ,原子量:S 32 ,Cl 35.5 ,Zn 65.4 。
142西北大学化学与材料科学学院2013年硕士学位研究生报考指南143西北大学化学与材料科学学院2013年硕士学位研究生报考指南3.4 BaCrO4的K spθ=1.2×10-10,BaSO4的K spθ=1.1×10-10,两者十分相近,为什么BaCrO4能溶于强酸,而BaSO4却不能溶于强酸?3.5分子在什么场合表现出氧化性?氧化性是否为氢的主要化学性质?3.6氢能否形成离子化合物?这类离子化合物,在水溶液中是否以盐的例子形式存在?四、根据实验现象写化学方程式或判断化合物组成(10分×3=30分)4.1金属M与过量的干燥氯气共热得到无色液体A,A与金属作用转化为固体B,将A溶于盐酸中后通入H2S得黄色沉淀C,C溶于Na2S溶液得无色溶液D。
将B溶于稀盐酸后加入适量HgCl2有白色沉淀E生成。
向B的盐酸溶液中加入适量NaOH 溶液有白色沉淀F 生成。
F 溶于过量的NaOH 溶液得无色溶液G。
向G 中加入BiCl3溶液有黑色沉淀H生成。
试给出M,A,B,C,D,E,F,G.H各为何物质。

考研物理化学(相平衡)历年真题试卷汇编2(总分46, 做题时间90分钟)1. 填空题填空题请完成下列各题,在各题的空处填入恰当的答案。
1.二元合金处于低共熔温度时,体系的自由度F=______。
(2012年北京科技大学)SSS_TEXT_QUSTI该题您未回答:х该问题分值: 2答案:正确答案:0解析:二元合金处于低共熔温度时,F=C—P+1,P=3,则F=0。
2.在三相点附近的温度范围内,TaBr3固体和液体的蒸气压方程分别为lgp/Pa=14.691—5 650/T和lgp/Pa=10.291—3 265/T,则TaBr3三相点的温度为______。
(2011年陕西师范大学)SSS_TEXT_QUSTI该题您未回答:х该问题分值: 2答案:正确答案:542.05 K解析:在三相点 p1 =ps即解得 T=542.05 K2. 单项选择题单项选择题下列各题的备选答案中,只有一个是符合题意的。
1.在二组分同液相图中(见图6一1),当系统从物系点P冷却到点L时,系统将出现( )(2015年西北大学)SSS_SINGLE_SELA A(s),E(l),C(s)三相共存B B(s),D(l),C(s)三相共存C C(l)D C(s)该题您未回答:х该问题分值: 2答案:D解析:基本相图中的竖直线段都表示一个纯物质,P点对应于稳定化合物c的组成,故冷却时产生C(S)。
2.水的三相点处自由度数为( )(2013年西北大学)SSS_SINGLE_SELA 1B 2C 3D 0该题您未回答:х该问题分值: 2答案:D解析:相律表达式为F=C—P+2。
水是单组分体系,故C=1,三相点处P=3,所以F=0。
3.某体系存在C(s)、H2 O(g)、CO(g)、CO2(g)、H2(g)五种物质,相互建立了下述三个平衡: H2 O(g)+C(s)<=>H2(g)+CO(g) CO2(g)+H2(g)<=>H2O(g)+CO(g) CO2(g)+C(g)<=>2CO(g) 则该系统的独立组分数为( )(2011年北京科技大学)SSS_SINGLE_SELA 4B 3C 2D 1该题您未回答:х该问题分值: 2答案:B解析:系统的独立组分数可表示为C=S—R—R'。

西北大学2012年招收攻读硕士学位研究生试题(分析化学)科目名称:分析化学(含仪器分析)科目代码:637适用专业:分析化学共7页答案请答在答题纸上,答在本试题上的答案一律无效一.选择题(共20分,每题1分)1.有一碱液,可能含有NaOH, Na2CO3, NaHCO3。
今用HCl 溶液滴定,以酚酞为指示剂时,消耗HCl的体积为15.80mL;又加入甲基橙指示剂,继续用HCl 溶液滴定,又消耗HCl体积为9.76mL,此碱液的组成为:()NaOH;b. Na2CO3;c. Na2CO3 + NaHCO3;d. NaOH +Na2CO3在铜氨溶液中,当氨的平衡浓度为 1.00×10-3mol·L-1时,溶液中的主要存在形式是:(铜氨络离子的lgβ1~β5分别为 4.31, 7.98, 11.02, 13.32, 12.86。
()a. Cu(NH3)52+;b. Cu(NH3)2+;c. Cu(NH3)32+;d. Cu(NH3)42+3. 在间接碘量法测定铜时,Fe3+干扰测定,可加入下列何种溶液消除干扰。
()a. 邻二氮菲;b. HCl;c. H3PO4d. NH4F。
4. 在含有Fe3+、Fe2+的溶液中,加入下列何种溶液Fe3+/Fe2+电对的电位将降低()c. H2SO4;d. NH4Fa. 邻二氮菲;b. HCl ;5.将0.0089gBaSO4换算为Ba。
计算时换算因数应为()a. 0.59b. 0.588c. 0.5884d. 0.586. 下列有关平均值的置信区间的论述中,错误的是()当置信度与测定次数一定时,一组测量值的精密度越高,平均值的置信区间越小。
平均值的数值越大,置信区间越宽。
其他条件不变时,给定的置信度越高,平均值的置信区间越宽。
在一定的置信度和标准偏差时,测定次数越多,平均值的置信区间包括真值的可能性越大。
7. 沉淀的类型与聚集速度有关,与聚集速度大小有关的因素是()a. 物质的性质;b. 溶液的c. 过饱和度;d.相对过饱和度。
(C) (101.325 /3) kPa (D) (2/3)×101.325 kPa133西北大学化学与材料科学学院2013年硕士学位研究生报考指南9. 在T,p时,理想气体反应C2H6(g) =H2 (g) + C2H4(g)的K c / K x为:(A) RT(B) 1/(RT) (C) RT/p(D) p/(RT)10. 设某分子的一个能级的能量和简并度分别为ε1 = 6.1×10-21 J,g1 = 3,另一个能级的能量和简并度分别为ε2= 8.4×10-21J,g2= 5,计算在300 K时,这两个能级上分布的粒子数之比(N1/N2):(A) 3 (B) 2 (C) 1.046 (D) 0.18411. 电池电动势与温度的关系为:E/V = 1.01845 - 4.05×10-5(t/℃- 20) - 9.5×10-7(t/℃- 20)2 298 K 时,电池可逆放电,则:(A) Q > 0 (B) Q < 0 (C) Q = 0 (D) 不能确定12. 已知Λ∞m(H2O, 291K)= 4.89×10-2 S⋅m2⋅mol-1,此时(291 K)纯水中的:m(H+) = m(OH-) = 7.8×10-8mol·kg-1,则该温度下纯水的电导率为:(A) 3.81×10-9 S·m-1(B)3.81×10-6 S·m-1(C)7.63×10-9 S·m-1(D)7.63×10-6 S·m-113. 已知下列两个电极反应的标准电极电位为:Cu2++ 2e-─→ Cu(s) φ1θ= 0.337 VCu++ e-─→ Cu(s) φ2θ= 0.521 V由此可算得Cu2++ e-─→Cu+的φθ值为:(A) 0.184 V(B) 0.352 V(C) -0.184 V (D) 0.153 V14.对应电池:Ag(s)|AgCl(s)|KCl(aq)|Hg2Cl2(s)|Hg(l)的化学反应是:(A)2Ag(s)+Hg22+(aq) = 2Hg(l) +2Ag+(B)2Hg+2Ag+ = 2Ag +Hg22+(C)2AgCl+2Hg = 2Ag +Hg2Cl2(D)2Ag+Hg2Cl2 = 2AgCl +2Hg15.如果规定标准氢电极的电极电势为1 V,可逆电极电极电势ϕ值和电池的电动势E值将有何变化(A) E ,ϕ各增加1 V(B) E ,ϕ各减少1 V(C) E 不变,ϕ增加1 V(D) E 不变,ϕ减少1 V16.一级反应,反应物反应掉1/n所需要的时间是:(A) -0.6932/k(B) (2.303/k) lg[n/(n-1)](C) (2.303/k) lg n(D) (2.303/k) lg(1/n)17.在反应A→k1B→k2C,A→k3D中,活化能E1>E2>E3, C是所需要的产物,从动力学角度考虑,为了提高C的产量,选择反应温度时,应选择:(A) 较高反应温度(B) 较低反应温度(C) 适中反应温度(D) 任意反应温度18.受激物的磷光光谱是由于下述哪种原因所致:(A) 三重态向基态的跃迁(B) 单重态到三重态的跃迁(C) 振动模式不同(D) 核自旋跃迁19.当某一反应物的初始浓度为0.04 mol·dm-3时,消耗一半所需时间为360 s。
2012西北大学理科录取分数线(陕西)小编为方便您今年的报考工作,特意为您收集整理了2010年的高考录取分数线,更多更详细的高考资讯,尽在高考频道。
如果您有问题,可以随时联系我们。
我们新增了高考满分作文频道,欢迎您进入。
本页内容主要有2012年陕西地区西北大学理科高考分数线信息。
为您作为今年的高考报考提供尽所能及的帮助。
谢谢您的访问!最后,预祝各位考生在今年的高考中能够取得优异成绩。
西北大学在陕西地区录取分数线--文科专业类型平均分最高分最低分录取批次过程装备与控制工程574 591 -- 第一批金融学598 620 -- 第一批电气信息类581 597 -- 第一批物联网工程577 590 -- 第一批数学与应用数学581 594 -- 第一批地质学类589 598 -- 第一批地质学类589 598 -- 第一批地理信息系统572 582 -- 第一批法学577 592 -- 第一批信息管理与信息系统589 596 -- 第一批资源环境与城乡规划管理580 588 -- 第一批环境科学类575 605 -- 第一批生物工程572 581 -- 第一批光信息科学与技术578 589 -- 第一批城市规划582 590 -- 第一批生物科学类571 584 -- 第一批文物保护技术580 588 -- 第一批食品科学与工程577 593 -- 第一批电子科学与技术578 596 -- 第一批计算机科学与技术580 593 -- 第一批管理科学586 595 -- 第一批能源化学工程579 594 -- 第一批软件工程575 602 -- 第一批化工与制药类573 586 -- 第一批数学类573 598 -- 第一批资源勘查工程580 594 -- 第一批物理学类571 581 -- 第一批勘查技术与工程581 593 -- 第一批化学类576 601 -- 第一批经济学599 617 -- 第一批查看:2013陕西高考分数线 2012陕西高考分数线专题:全国历年高考理科分数线汇总全国历年高考文科分数线汇总西北大学介绍:西北大学雄踞古都西安,领略秦汉雄风,弘扬盛唐文明,是一所学科门类齐全,教学与科研并重的全国重点综合大学、国家“211工程”重点建设院校、国家西部地区“一省一校”计划重点建设院校,教育部和陕西省共建高校。
西北大学考研专业西北大学是中国的一所知名综合性大学,提供各种研究生专业供学生选择。
在考研的选择上,西北大学提供了多个专业方向,如人文社会科学、理学、工程学、农学、医学等等。
下面我将简要介绍一些西北大学考研专业。
人文社会科学类专业是西北大学考研的一个热门方向。
这个类别涵盖了文学、哲学、法学、教育学、经济学,等等。
学生可以选择修读自己感兴趣的学科,探索该学科的深度研究。
此外,西北大学的人文社会科学类专业也注重培养学生的批判性思维和研究能力,培养他们成为有独立思考能力和创新能力的学者和研究人员。
理学类专业也是西北大学考研中的一大亮点。
学生可以选择学习数学、物理学、化学、地理学、计算机科学等领域的专业。
西北大学的理学类专业注重培养学生的科学研究能力和解决实际问题的能力。
学生可以在丰富的实验室设施和导师指导下进行研究,并在学术领域做出重要贡献。
工程学类专业是西北大学考研中的另一个重要方向。
学生可以选择学习机械工程、电子工程、材料工程、土木工程等领域的专业。
西北大学注重培养学生的工程实践能力和工程项目管理能力。
学生可以参与实际工程项目,并通过实践来提高自己的工程技能和实践能力。
除了以上三个专业方向,西北大学还提供了农学、医学、管理学等专业供学生选择。
学生可以根据自己的兴趣和职业发展规划来选择适合自己的专业。
考研是一个具有挑战性的过程,而选择适合自己的专业也是至关重要的。
西北大学提供了多个专业方向供学生选择,学生可以根据自己的兴趣、优势和职业规划来做出明智的选择。
无论选择哪个专业,西北大学都将提供丰富的学术资源和优质的教育环境,帮助学生取得学术和职业上的成功。
)2013年西北大学826物理化学考研试题
回忆版)
(回忆版
物理化学考研试题(
选择填空和往年的差不多,关键是把每章节的所有知识点熟记,这些知识点每年都会考到,不是选择就填空,都会出现的,教大家个方法,就是把近几年的真题选择填空考到的知识点做个总结,大家伙就知道重点了。
问答题(名词解释):稀溶液,荧光和磷光的区别,电化学中有一个(大概是江轮和海轮关于腐蚀方面的)都是最基本的概念,课后复习题有。
证明题:热力学一个(常见的公式证明),动力学(对峙,平行证明几级反应,稳态法,假设法)
大题都是最常见的,不会考的太偏,要熟练的掌握,重点章节都有:热力学(不可逆绝热反应求基本的热力学常数),相图(标相态,画冷却曲线,三相平衡线),化学平衡,热力学统计(今年悲催的出了个8分的大题,很简单的公式套用,可是楼主么抓住,很大的一个教训),电化学(常见的),动力学。
(C) (101.325 /3) kPa (D) (2/3)×101.325 kPa
133
9. 在T,p时,理想气体反应C2H6(g) =H2 (g) + C2H4(g)的K c / K x为:
(A) RT(B) 1/(RT) (C) RT/p(D) p/(RT)
10. 设某分子的一个能级的能量和简并度分别为ε1 = 6.1×10-21 J,g1 = 3,另一个
能级的能量和简并度分别为ε2= 8.4×10-21J,g2= 5,计算在300 K时,这两个能级上分布的粒子数之比(N1/N2):
(A) 3 (B) 2 (C) 1.046 (D) 0.184
11. 电池电动势与温度的关系为:
E/V = 1.01845 - 4.05×10-5(t/℃- 20) - 9.5×10-7(t/℃- 20)2 298 K 时,电池可逆放电,则:
(A) Q > 0 (B) Q < 0 (C) Q = 0 (D) 不能确定
12. 已知Λ∞m(H2O, 291K)= 4.89×10-2 S⋅m2⋅mol-1,此时(291 K)纯水中的:
m(H+) = m(OH-) = 7.8×10-8mol·kg-1,则该温度下纯水的电导率为:
(A) 3.81×10-9 S·m-1(B)3.81×10-6 S·m-1
(C)7.63×10-9 S·m-1(D)7.63×10-6 S·m-1
13. 已知下列两个电极反应的标准电极电位为:
Cu2++ 2e-─→ Cu(s) φ1θ= 0.337 V
Cu++ e-─→ Cu(s) φ2θ= 0.521 V
由此可算得Cu2++ e-─→Cu+的φθ值为:
(A) 0.184 V(B) 0.352 V(C) -0.184 V (D) 0.153 V
14.对应电池:Ag(s)|AgCl(s)|KCl(aq)|Hg2Cl2(s)|Hg(l)的化学反应是:
(A)2Ag(s)+Hg22+(aq) = 2Hg(l) +2Ag+
(B)2Hg+2Ag+ = 2Ag +Hg22+
(C)2AgCl+2Hg = 2Ag +Hg2Cl2
(D)2Ag+Hg2Cl2 = 2AgCl +2Hg
15.如果规定标准氢电极的电极电势为1 V,可逆电极电极电势ϕ值和电池的电
动势E值将有何变化
(A) E ,ϕ各增加1 V
(B) E ,ϕ各减少1 V
(C) E 不变,ϕ增加1 V
(D) E 不变,ϕ减少1 V
16.一级反应,反应物反应掉1/n所需要的时间是:
(A) -0.6932/k(B) (2.303/k) lg[n/(n-1)]
(C) (2.303/k) lg n(D) (2.303/k) lg(1/n)
17.在反应A→k1B→k2C,A→k3D中,活化能E1>E2>E3, C是所需
要的产物,从动力学角度考虑,为了提高C的产量,选择反应温度时,应选择:
(A) 较高反应温度(B) 较低反应温度
(C) 适中反应温度(D) 任意反应温度
18.受激物的磷光光谱是由于下述哪种原因所致:
(A) 三重态向基态的跃迁(B) 单重态到三重态的跃迁
(C) 振动模式不同(D) 核自旋跃迁
19.当某一反应物的初始浓度为0.04 mol·dm-3时,消耗一半所需时间为360 s。
134
135
8.在一个U型管中间,放用AgCl晶体组成的多孔塞,管中放浓度为0.001
mol·dm-3的KCl 溶液。
多孔塞两边放接直流电源的电极。
通电时溶液将向负极方向移动。
三、(10分)
在373 K,将 1 mol纯净的水蒸气小心加压到200 kPa,然后在这个温度和压力下变成同温同压的水,即H2O(g, 373 K, 200 kPa)→H2O(l, 373 K, 200 kPa),
试计算该变化过程的H,G和S。
已知水的标准摩尔汽化焓为40.6 kJ·mol-1,设H2O(g)可作为理想气体处理,H2O(l)的体积不会因压力变化而变化。
四、(8分)
Ag(s)可能被H2S(g)腐蚀而发生下列反应:
2Ag(s) + H2S(g) = Ag2S(s) + H2(g)
若在298 K和100 kPa条件下,将Ag(s)置于等体积混合的H2(g)与H2S(g)的混合气中,试问:
(1)用计算说明Ag(s)是否会被腐蚀成Ag2S(s)。
(2)混合气
中,H2S(g)的含量低于多少,Ag(s)才不被腐蚀?
298K 时的热力学数据为:
物质Ag2S(s)H2S(g)
θ/(kJ·mol-1) -40.26 -33.02
f G m
五、(10分)
在298 K时,有电池Pt(s) | H2(pθ) | HI(m) | AuI(s) | Au(s),已知当HI浓度m1= 1.0×10-4mol·kg-1时(γ±≈1),E1= 0.97 V;m2= 3.0 mol·kg-1时,E2= 0.41 V;电极Au+ | Au(s)的标准电极电势φθ(Au+/Au) = 1.68 V。
试求:
(1)HI溶液浓度为3.0 mol·kg-1时的平均离子活度因子γ±;
(2)AuI(s)的活度积常数K$ap。
六、(12分)下列是二元凝聚体系的相图。
136
(1)将相图中下列相区的相数、相态、自由度填入下表
相区相数相态自由度f*=C-Φ+1
2
3
5
6
7
9
(2)画出物系点R 降温至S 点的步冷曲线(3)欲制
取不稳定化合物,问温度及浓度如何控制?(4)图中
三条水平线分别代表那些相平衡共存。
七、(10分)
在540℃时,将二甲醚气体引入一真空刚性反应器内,二甲醚分解的计量方程为:CH3OCH3(g)==== CH4(g)+H2(g)+CO(g)
根据实验测定,该反应的半衰期与二甲醚的起始压力无关,反应基本能进行到底。
在该温度下不同时刻测定的容器总压如下:
t / s 390 777 1587 3155 ∞
p 总/ kPa 40.8 48.8 62.4 77.9 93.1
求该反应的级数,速率系数和半衰期。
八、(9分)
某药物分解30%即为失效,若放置在3℃的冰箱中,保存期为两年。
某人购回此药物,因故在室温(25℃)下搁置了两周,试通过计算说明此药物是否已经失效。
已知该药物分解百分数与浓度无关,且分解活化能为E a=130.0 kJ·mol-1。
九、(8分)
在1000 K时,实验测得气相反应C2H6(g)→2CH3·(g)的速率常数的表示式为:k/ s-1= 2.0×1017exp(-363 800 J·mol-1/RT),设这时k B T/h= 2.0×1013s-1。
试计算
(1)反应的半衰期;
(2)C2H6(g)分解反应的活化熵r≠S m。
十、(9分)
设CHCl3(g)在活性碳上的吸附服从Langmuir吸附等温式。
在298K时,当
137
CHCl3(g)的压力为5.2 kPa及13.5 kPa时,平衡吸附量分别为0.0692 m3/kg和0.0826 m3/kg(已换算成标准状态),求:
(1)CHCl3(g)在活性碳上的吸附系数α;
(2)活性炭的饱和吸附量V m;
(3)若CHCl3(g)分子的截面积为0.32 nm2,求活性炭的比表面积。