2018安徽省化学奥林匹克竞赛(初赛)试题
- 格式:pdf
- 大小:1.03 MB
- 文档页数:6
一、制备PbS 纳米粒子的方法如下:EDTA 为乙二胺四乙酸,它是一种弱酸,简写成H 4Y ,EDTA 二钠简写成Na 2H 2Y ,它们可以与Pb 2+及其它许多金属离子形成稳定的配离子。
⑴ 从平衡的观点解释增大酸度对PbY 2-的影响。
⑵ 为什么不用硫化氢气体直接通入硝酸铅溶液来制备PbS 纳米粒子?⑶ 为什么用Na 2H 2Y 而不用H 4Y 来制备PbY 2-?⑷ 在医学上可以用形成PbY 2-来治疗人体的铅中毒,临床上是在葡萄糖输液中加入适量CaH 2Y 代替Na 2H 2Y 给病人输液治疗。
请说明这种取代的理由。
(2001安徽29)二、CH2N2有七种同分异构体,其中有一种命名为重氮甲烷。
试画出重氮甲烷的两种路易斯结构式(即成键电子对用短线“-”表示,孤电子用黑点表示“· ”)___;在有机反应中重氮甲烷是重要的试剂之一,这是利用它的___性质(用化学反应方程式表示)。
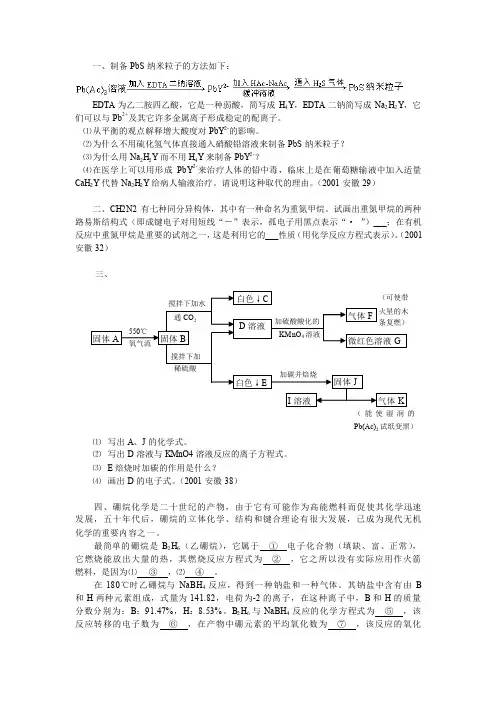
(2001安徽32)三、⑴ 写出A 、J 的化学式。
⑵ 写出D 溶液与KMnO4溶液反应的离子方程式。
⑶ E 焙烧时加碳的作用是什么? ⑷ 画出D 的电子式。
(2001安徽38)四、硼烷化学是二十世纪的产物,由于它有可能作为高能燃料而促使其化学迅速发展,五十年代后,硼烷的立体化学、结构和键合理论有很大发展,已成为现代无机化学的重要内容之一。
最简单的硼烷是B 2H 6(乙硼烷),它属于 ① 电子化合物(填缺、富、正常),它燃烧能放出大量的热,其燃烧反应方程式为 ② ,它之所以没有实际应用作火箭燃料,是因为⑴ ③ ,⑵ ④ 。
在180℃时乙硼烷与NaBH 4反应,得到一种钠盐和一种气体。
其钠盐中含有由B 和H 两种元素组成,式量为141.82,电荷为-2的离子,在这种离子中,B 和H 的质量分数分别为:B :91.47%,H :8.53%。
B 2H 6与NaBH 4反应的化学方程式为 ⑤ ,该反应转移的电子数为 ⑥ ,在产物中硼元素的平均氧化数为 ⑦ ,该反应的氧化白色↓ C D 溶液固体JI 溶液气体K(能使湿润的Pb(Ac)2试纸变黑)白色↓E加碳并焙烧固体A固体B550℃ 氧气流搅拌下加水通CO 2搅拌下加 稀硫酸气体F微红色溶液G火星的木条复燃)KMnO 4溶液加硫酸酸化的剂是 ⑧ ,还原剂是 ⑨ 。

全国高中生奥林匹克化学竞赛试题及答案2018可能用到的相对原子质量:H—1 C—12 N—14 O—16 Cl—35、5 K—39 Cu—64一、选择题(共36分)1、关于“舌尖上的化学”,下列说法不科学的是()A、为了身体健康,必须均衡膳食B、为预防缺碘性疾病,可食用适量海带C、为延长食品保质期,在食品中添加大力防腐剂D、为使发面食品松软可口,制作时可添加适量碳酸氢钠2、下列生活用品所含的主要材料,属于有机合成材料的是()A、铁锅B、瓷碗C、塑料盆D、玻璃杯3、二氧化锡(SnO2)可用作液晶元件电极,其中氧元素为—2价,则锡元素的化合价为()A、+1B、+2C、+3D、+44、实验室用高锰酸钾制取氧气的部分操作如图1所示,其中正确的是()5、下列化学式表示的物质是某化学肥料的主要成分,其中属于复合肥料的是()A、KNO3B、K2CO3C、CO(NH2)2D、Ca(H2PO4)26、下列保护自然资源的措施错误的是()A、为防止空气污染,应加强工业废气处理B、为节约用水,用工业废水直接浇灌农田C、为节约化石燃料,应开发和使用新能源D、为防止铁制品生锈,常在其表面覆盖保护层7、用分子观点解释“干冰升华”,下列说法错误的是()A、分子不停地运动B、分子间隔变大C、分子体积急剧增大D、分子本身不发生改变8、下列事实和解释相符的是()A、铜丝作导线——铜有良好的导电性B、盐酸清除铁锈——盐酸能与铁反应C、汽油清洗油污——汽油起乳化作用D、活性炭净水——活性炭能与水中杂质反应9、某物质的分子模型如图2所示,下列说法错误的是()A、该物质属于有机物B、该物质的化学式为CH4C、该物质的1个分子中含有5个原子D、该物质中碳、氢元素质量比为1:410、实验室用蔗糖配制50、0g溶质的质量分数为10%的蔗糖溶液,下列说法错误的是()A、用托盘天平称取5、0g蔗糖B、用量程为10mL的量筒量取所需的水C、溶解蔗糖时,使用的玻璃仪器有烧杯、玻璃棒D、将配制好的溶液装入细口瓶中,塞好瓶塞并贴上标签11、鉴别下列物质所用的方法或试剂,错误的是()A、硬水和软水——观察颜色B、纯铝和硬铝——比较硬度C、碳酸钠和氯化钠——稀盐酸D、羊毛纤维和合成纤维——点燃闻气味12、将铁丝、铜丝分别伸入盛有同种试剂的两支试管中,下列试剂能迅速比较出铁、铜金属活动性强弱的是()A、蒸馏水B、稀硫酸C、硫酸钠溶液D、氢氧化钠溶液二、非选择题(共64分)13、(15分)多角度认识物质,能帮助我们更全面了解物质世界。

2018年全国高中化学竞赛(初赛)模拟考试1(word含答案)高中化学竞赛初赛模拟试卷(01)(时间:3小时满分:100分)题号1 2 3 4 5 6 7 8 9 10 11 12满分6 12 9 678 10 10 69 5 12H 1.008 相对原子质量He4.003Li 6.941Be9.012B10.81C12.01N14.01O16.00F19.00Ne20.18Na 22.99Mg24.31Al26.98Si28.09P30.97S32.07Cl35.45Ar39.95K 39.10Ca40.08Sc44.96Ti47.88V50.94Cr52.00Mn54.94Fe55.85Co58.93Ni58.69Cu63.55Zn65.39Ga69.72Ge72.61As74.92Se78.96Br79.90Kr83.80Rb 85.47Sr87.62Y88.91Zr91.22Nb92.91Mo95.94Tc[98]Ru101.1Rh102.9Pd106.4Ag107.9Cd112.4In114.8Sn118.7Sb121.8Te127.6I126.9Xe131.3Cs 132.9Ba137.3La-LuHf178.5Ta180.9W183.8Re186.2Os190.2Ir192.2Pt195.1Au197.0Hg200.6Tl204.4Pb207.2Bi209.0Po[210]At[210]Rn[222]Fr [223]Ra[226]Ac-LaRf Db Sg Bh Hs Mt DsLa系La138.9Ce140.1Pr140.9Nd144.2Pm144.9Sm150.4Eu152.0Gd157.3Tb158.9Dy162.5Ho164.9Er167.3Tm168.9Tb173.0Lu175.0 第一题(6分)锦上添花:(根据已有内容的规律进行增补)1.填分子式:(1)①C2H6②C8H18③________ ④C80H162(2)①________ ②MgO ③SO3④CuSO42(3)①Fe2O3②③Na2O2④FeSO4·7H2O ⑤CuSO4·5H2O ⑥2.填化学方程式:①2Na+2H2O=2NaOH+H2↑②2C+SiO2=Si+CO↑③2H2S+O2=2S+2H2O ④____________________________。
中国化学会2004年全国高中学生化学竞赛(省级赛区)试题答案(2004年9月12日 9:00 - 12:00共计3小时) 题 号1 2 3 4 5678910111213总 满分 4 4 6 15 769868999 100 得分评卷人z 竞赛时间3小时。
迟到超过半小时者不能进考场。
开始考试后1小时内不得离场。
时间到,把试卷(背面朝上)放在桌面上,立即起立撤离考场。
z 试卷装订成册,不得拆散。
所有解答必须写在指定的方框内,不得用铅笔填写。
草稿纸在最后一页。
不得持有任何其他纸张。
z 姓名、报名号和所属学校必须写在首页左侧指定位置,写在其他地方者按废卷论。
z 允许使用非编程计算器以及直尺等文具。
第1题(4分) 2004年2月2日,俄国杜布纳实验室宣布用核反应得到了两种新元素X 和Y 。
X 是用高能48Ca 撞击靶得到的。
经过100微秒,X 发生α-衰变,得到Y 。
然后Y 连续发生4次α-衰变,转变为质量数为268的第105号元素Db 的同位素。
以X 和Y 的原子序数为新元素的代号(左上角标注该核素的质量数),写出上述合成新元素X 和Y 的核反应方程式。
Am 24395答案: +Ca = Am 243954820288115+3n (2分)不写3n 不得分。
答291115不得分。
288115 = 284113 + 4He (2分) 质量数错误不得分。
4He 也可用符号α。
(答下式不计分:284113-44He = 268105或268105Db )(蓝色为答案,红色为注释,注释语不计分,下同)第2题(4分)2004年7月德俄两国化学家共同宣布,在高压下氮气会发生聚合得到高聚氮, 这种高聚氮的N-N 键的键能为160 kJ/mol (N 2的键能为942 kJ/mol),晶体结构如图所示。
在这种晶体中,每个氮原子的配位数为 ;按键型分类时,属于 晶体。
这种固体的可能潜在应用是 ,这是因为: 。
答案: 3 原子晶体炸药(或高能材料)高聚氮分解成N2释放大量能量。

2018年中国化学奥林匹克竞赛(安徽赛区)初赛试题一、本题包括15小题,每小题2分,共30分。
每小题仅有1个选项符合题意。
1.某水溶液含0.5mol/L-1的Na+,1.0mol/L-1的Mg2+和NO3-,则NO3-的浓度应为A.1.5mol/L B. 2.0mol/L C. 2.5mol/L D. 3.0mol/L2. SO2是大气中的有害气体,但在生物体内存在SO2生成系统。
内源性SO2在心血管生理和病理调节中起重要作用,表明SO2可能是又一种新型气体信号分子。
下列对大气中SO2的有关说法,错误的是A.可用碘量法检测其含量 B. O的氧化数为-1 C.只含极性键D.是酸雨的来源之一3.化学与生活密切相关。
下列说法正确的是A.PM2.5是指粒子直径大于2.5u m的可吸入悬浮颗粒物B.开发全降解CO2塑料,可缓解日益严重的白色污染C.燃煤中加入CaO可以减少酸雨的形成及温室气体的排放D.可燃冰是我国目前推广使用的清洁燃料4.中国科学院科研团队研究表明,在常温常压和可见光侠,基于LDH(一种固体催化剂)合成NH3的原理示意图如右,下列说法错误的是A.该过程将太阳能转化为化学能B.该过程中,涉及极性键和非极性键的断裂与形成C.氧化剂与还原剂的物质的量之比为3﹕1D.原料气N2可以通过分离液态空气获得5.检测SO2含量是否达到排放标准的反应原理可以表示为:SO2 + H2O2 + BaCl2 = BaSO4 + 2HCl 。
N A表示阿伏伽德罗常数的值,下列说法中正确的是A.17g H2O2中含有非极性键数目为0.5molB.0.1mol BaCl2晶体中所含为微粒总数为0.1N AC.25时,pH=1 的HCl溶液中含有H+的数目为0.1N AD.生成2.33g BaSO4沉淀时,转移的电子数目为0.01N A6.在ClO3-几何构型中,O-Cl-O的键角应为A.109.5︒B.小于109.5︒C.大于109.5︒D.120︒7.当甲基胺在过量氧气中完全燃烧时,1.00 mol 甲基胺消耗氧气的物质的量为A.2.25 mol B.2.50 mol C.3.00 mol D.4.50 mol8.我国在CO2催化加氢制取汽油方面取得突破性进展,CO2转化过程示意图如下:下列说法正确的是A.反应①的产物中含有水B.反应②属于加成反应C.汽油主要是C5和C11的烃类混合物D.图中a的名称是2—甲基戊烷CuSO4溶液10.一定条件下进行反应:COCl2(g) Cl2(g) + CO(g),向2.0L恒容密闭容器中充入1.0molCOCl2,经过一段时间后达到平衡。

2004年全国中学生化学竞赛(安徽赛区)初赛试题一、本题包括25小题,每小题2分,共50分。
每小题有1个或2个选项符合题意。
若该题只有1个选项符合题意,多选或错选均不得分。
若该题有2个选项符合题意,选对1个得1分,选对2个得2分;选错1个,该题不得分。
1.下列卤素互化物中,最不稳定的是(A)ClI3(B)ClF3(C)BrF3(D)ICl32.下列各结构式中,最有可能的N2OLewis结构式为(A)N=N=O —O (C)N—(D)N=O=N3.下列各金属碳化物中,与水反应能生成C3H4的是(A)Be2C (B)Na2C3(C)Mg2C3(D)A14C34.在一定温度下,某浓度的硝酸与金属锌反应,生成NO2和NO的物质的量之比为1:3 则要使1摩金属锌完全反应,需要HNO3的物质的量为(A)0.8 (B)2.4 (C)2.6 (D)2.85.在恒温条件下,有甲、乙两容器,甲容器为体积不变的密闭容器,乙容器为一个带有理想活塞(即无质量、无摩擦力的刚性活塞)的体积可变的密闭容器,两容器起始状态完全相同,都充有C气体,若发生可逆反应C(g) A(g)+B(g),经一段时间后,甲、乙两容器反应都达到平衡。
下列说法中正确的是(A)平均反应速度:乙>甲(B)平衡时nc(甲)>nc(乙)(C)平衡时C的转化率:乙>甲(D)平衡时A的物质的量甲>乙6.对手由CrO42—转化为Cr2O72—的下列各叙述中,正确的是(A)这是Lewis酸碱反应(B)这是氧化还原反应(C)加酸,该反应向右移动(D)加酸,该反应向左移动7.在水溶液中,KHSO3(aq)的电荷平衡式为(A)[H3O+]十[K+]=[OH—]+[HSO3—]+[SO32—](B) [H3O+]十[K+]=[OH—]+[HSO3—]+2[SO32—](C) [H3O+]十[K+]=[OH—]+[HSO3—]+1/2[SO32—](D) [H3O+]十2[K+]=[OH—]+[HSO3—]+2[SO32—]8.下列各组离子中,能在强碱性溶液中共存,且在滴加盐酸过程中会生成气体和沉淀的是(A)Na+、CrO2—、SO42—、CO32—(B)NH4+、A1O2—、SO42—、CO32—(C)K+、A1O2—、SO42—、HCO3—(D)K+、ZnO2—·、SO42—、CO32—9.已知Al和Ga是同族元素,且都是两性元素,并知A1(OH)3的碱性比Ga(OH)3大。



2018年第32届中国化学奥林匹克(初赛)试题答案与解析 第1题(8分)根据所给条件按照要求书写化学反应方程式(要求系数为最简整数比。
1-1 氮化硅可用作 LED 的基质材料,它可通过等离子法用 SiH 4 与氨气反应制得。
1-2 将擦亮的铜片投入装有足量的浓硫酸的大试管中,微热片刻,有固体析出但无气体产生, 固体为 Cu 2S 和另一种白色物质的混合物。
1-3 在 50o C 水溶液中,单质碲与过量 NaBH 4 反应制备碲氢化钠,反应过程中析出硼砂[Na 2B 4O 5(OH)4·8H 2O] 1-4 天然气的无机成因十分诱人。
据称,地幔主成分之一的橄榄石与水和二氧化碳反应,可生成甲烷。
橄榄石以 Mg 2SiO 4 和 Fe 2SiO 4 表示,反应后变成蛇纹石[Mg 3Si 2O 5(OH)4]和磁铁矿。
第2题(8分)2-1 195K ,三氧化二磷在二氯甲烷中与臭氧反应生成 P 4O 18,画出 P 4O 18 分子的结构示意图。
2-2 CH 2SF 4 是一种极性溶剂,其分子几何构型符合价层电子对互斥理论(VSEPR)模型。
画出CH 2SF 4 的分子结构示意图(体现合理的成键及角度关系)。
2-3 2018 年足球世界比赛用球使用了生物基元三元乙丙橡胶(EPDM)产品 Keltan Eco 。
EPDM 属三元共聚物,由乙烯、丙烯、及第三单体经溶液共聚而成。
2-3-1 EPDM 具有优良的耐紫外光、耐臭氧、耐腐蚀等性能。
写出下列分子中不可用于制备 EPDM 的第三单体(可能多选,答案中含错误选项不得分) 2-3-2 合成高分子主要材料分为塑料、纤维和橡胶三大类,下列高分子中与 EPDM 同为橡胶的是: F 聚乙烯 G 聚丙烯氰 H 反式聚异戊二烯 I 聚异丁烯 第3题(12分)为纪念门捷列夫发现元素周期表 150 周年,国际纯粹和应用化学联合会将 2019 年设为“国际化学元素周期表年”。


2018年中国化学奥林匹克竞赛(安徽赛区)初赛试题一、本题包括15小题,每小题2分,共30分。
每小题仅有1个选项符合题意。
1.某水溶液含0.5mol/L-1的Na+,1.0mol/L-1的Mg2+和NO3-,则NO3-的浓度应为A.1.5mol/L B. 2.0mol/L C. 2.5mol/L D. 3.0mol/L2. SO2是大气中的有害气体,但在生物体内存在SO2生成系统。
内源性SO2在心血管生理和病理调节中起重要作用,表明SO2可能是又一种新型气体信号分子。
下列对大气中SO2的有关说法,错误的是A.可用碘量法检测其含量 B. O的氧化数为-1 C.只含极性键D.是酸雨的来源之一3.化学与生活密切相关。
下列说法正确的是A.PM2.5是指粒子直径大于2.5u m的可吸入悬浮颗粒物B.开发全降解CO2塑料,可缓解日益严重的白色污染C.燃煤中加入CaO可以减少酸雨的形成及温室气体的排放D.可燃冰是我国目前推广使用的清洁燃料4.中国科学院科研团队研究表明,在常温常压和可见光侠,基于LDH(一种固体催化剂)合成NH3的原理示意图如右,下列说法错误的是A.该过程将太阳能转化为化学能B.该过程中,涉及极性键和非极性键的断裂与形成C.氧化剂与还原剂的物质的量之比为3﹕1D.原料气N2可以通过分离液态空气获得5.检测SO2含量是否达到排放标准的反应原理可以表示为:SO2 + H2O2 + BaCl2 = BaSO4 + 2HCl 。
N A表示阿伏伽德罗常数的值,下列说法中正确的是A.17g H2O2中含有非极性键数目为0.5molB.0.1mol BaCl2晶体中所含为微粒总数为0.1N AC.25时,pH=1 的HCl溶液中含有H+的数目为0.1N AD.生成2.33g BaSO4沉淀时,转移的电子数目为0.01N A6.在ClO3-几何构型中,O-Cl-O的键角应为A.109.5︒B.小于109.5︒C.大于109.5︒D.120︒7.当甲基胺在过量氧气中完全燃烧时,1.00 mol 甲基胺消耗氧气的物质的量为A.2.25 mol B.2.50 mol C.3.00 mol D.4.50 mol8.我国在CO2催化加氢制取汽油方面取得突破性进展,CO2转化过程示意图如下:下列说法正确的是A.反应①的产物中含有水B.反应②属于加成反应C.汽油主要是C5和C11的烃类混合物D.图中a的名称是2—甲基戊烷CuSO4溶液10.一定条件下进行反应:COCl2(g) Cl2(g) + CO(g),向2.0L恒容密闭容器中充入1.0molCOCl2,经过一段时间后达到平衡。
反应过程中测得的有关数据见下表:下列说法正确的是A.保持其它条件不变,升高温度,平衡时c(Cl2)=0.22mol/L ,则反应的ΔH<0B.若在2L恒容绝热(与外界没有热交换)密闭容器进行该反应,化学平衡常数不变C.保持其它条件不变,起始向容器中充入1.2 mol COCl2、0.60Cl2 mol和0.60 mol CO,反应达到平衡前的速率:v(正)>v(逆)D.保持其它条件不变,起始向容器中充入1.0Cl2 mol和0.80 mol CO,达到平衡时,Cl2的转化率小于60% 11、短周期元素W、X、Y、Z的原子序数依次增大,四种元素的原子最外层电子数总和为17。
W原子的最外层电子数是其内层电子数的2倍,X、Y的简单离子的电子层结构相同,Z的单质为淡黄色固体,且Z 能与X形成多种化合物。
下列说法正确的是A.原子半径:Y>Z>X>W B.简单氢化物的稳定性:X<ZC.非金属性:Z<W D.Y的某种氧化物能与W的氧化物相互反应得到单质X12.实验室根据侯氏制碱原理制备少量NaHCO3固体的四个主要步骤中,不能实现实验目的的是13.常温下,下列各组离子在指定溶液中可以大量共存的是A.pH=1的溶液中:Ba2+、Cu2+、Cl-、NO3-B.由水电离产生的c(H+)=10-13mol/L的溶液中:K+、Mg2+、CH3COO—、AlO2—C.c(Fe3+)=1mol/L的溶液中:H+、NH4+、NO3—、SO42—D.澄清透明的溶液中:Fe3+、Mg2+、SCN—、Cl—14.利用一种微生物可将废水中苯酚的化学能直接转化为电能,装置如图所示。
电池工作时,下列说法正确的是A.a为正极,发生氧化反应B.b极上的电极反应为:2NO3— + 12H+ - 10e- = N2 ↑+ 6H2OC.中间室的Cl-向左室移动D.左室消耗苯酚(C6H5OH)9.4g时,用电器通过2.4mol电子15.柔红酮是一种医药中间体,其结构简式如图所示。
下列说法正确的是A.每个柔红酮分子含有2个手性碳原子B.柔红酮分子中所有碳原子都在同一个平面上C.1mol柔红酮最多可与2molBr2发生取代反应D.柔红酮不能发生氧化和加成反应二、本题包括10小题,每小题2分,共20分。
每小题有1个或2个选项符合题意。
16.已知某溶液中可能含有Cl—、CO32-、Na+、NH4+等离子中的几种(忽略水的电离)。
进行如下实验:取样,加入足量盐酸,有气泡产生,再加入AgNO3溶液,有白色沉淀生成;另取一份样,加入足量NaOH溶液,微热,产生的气体使湿润的红色石蕊试纸变蓝,下列判断正确的是A.可能含有Cl-B.一定不含Na+C.一定含有Cl—、CO32-D.一定含有CO32-、NH4+17.下列离子方程式书写正确的是A.氢氧化钠溶液与少量二氧化硫气体反应:SO2 + 2OH- =SO32- + H2OB.往NH4HCO3溶液中加过量的NaOH溶液并加热:NH4+ + OH- = NH3 ↑+ H2OC.往酸性碘化钾溶液中滴加适量的双氧水:3I- + 2H+ + H2O2 = I3- +2H2OD.氯化铝溶液与足量氨水反应:Al3+ + 4NH3•H2O = AlO2- + 4NH4+ + 2H2O18.某多元化合物晶体中,一种元素的原子三维堆积方式为:••• •••CCBACCABCCBACCABCC••• •••其它元素的原子占有晶体的空隙中。
试指出该晶体的堆积周期应为A. ••• •••CCBACCABCC••• •••B. ••• •••CBACCABC••• •••C. ••• •••CBACCABCC••• •••D. ••• •••CCBACCABC••• •••19.化合物,下列说法正确的是A.a、b、c互为同分异构体B.b的二氯代物有三种C.a、b均不能发生加聚反应D.上述只有c的所有原子可能处于同一平面21.下列说法正确的是A.常温下,向0.1mol/L 的醋酸溶液中加水稀释,溶液中c(H +)/c(CH 3COOH)增大B.反应N 2(g )+ 3H 2(g )2NH3(g )(ΔH<0)达平衡后,降低温度,正反应速率增大、逆反应速率减小,平衡向正反应方向移动C.镀锌铁板是利用了牺牲阳极的阴极保护法来达到防止腐蚀的目的D.电解精炼铜时,阳极泥中含有Zn 、Fe 、Ag 、Au 等金属22.1894年,Fenton 发现采用Fe 2+和H 2O 2混合溶液,能产生具有高反应活性和强氧化性的羟基自由基(•OH ),从而氧化降解有机污染物,称为Fenton 反应。
电Fenton 法采用惰性电极电解法,右图为其中一个电极的反应机理,其中含有Fenton 反应。
下列说法错误的是A.右图所在的惰性电极应与外接电源的负极相连B.羟基自由基(•OH )的电子式为C. Fenton 反应:Fe 2+ + H 2O 2 = Fe 3+ + OH - + •OHD.右图所在的惰性电极每消耗22.4L O 2(标准状况),理论上在外电路中转移4mol e -23、将NaOH 溶液滴加到己二酸(H 2X )溶液中,混合溶液的pH 与离子浓度变化的关系如图所示。
下列叙述错误的是A. K a1(H 2X )的数量级为10—6B. 曲线N 表示pH 与2(HX )lg (H X)c c -的变化关系C. NaHX 溶液中(H )(OH )c c +->D. 当混合溶液呈中性时,2(Na )(HX )(X )(OH )(H )c c c c c +---+>>>= 24、有机物Z 是制备药物的中间体,合成Z 的路线如下图所示:下列有关叙述正确的是A.X 分子中所有原子处于同一平面B.X 、Y 、Z 均能和NaOH 溶液反应C.可用NaHCO 3溶液鉴别Y 和ZD.1molY 跟足量H 2反应,最多消耗3molH 2 25.下列实验操作正确的是A.称量时,将氢氧化钠固体放在滤纸上称量B.可用氯化铁溶液除去试管内难以刷去的铜迹C.分液时,分液漏斗中下层液体下口放出,上层液体也从下口放出D.石油的蒸馏实验中,加热之前先接通冷却水,停止加热后,仍要继续通冷却水一段时间 三、本题包括3小题,共26分26.(10分)写出下列反应的化学方程式或离子方程式。
(1)硫化汞溶于王水,生成一氧化氮和单质硫(2)酸性介质中,铋酸钠氧化Cr3+(3)酸性介质中,氯酸(HClO3)将单质磷(P4)氧化成磷酸(4)酸性介质中,联氨(N2H4)与AgNO3溶液反应,产物中有两种单质(5)向[Ag(S2O3)2]3-溶液中通入氯气,有白色沉淀生成27.(8分)(1)根据钒的电势图判断在酸性溶液中,1.0mol/LVO2+分别与等浓度Fe2+、Sn2+反应时的终点产物,写出相应的离子方程式。
(已知)(2)已知碱性介质中,P的元素电势图(V):通过计算判断P4在碱性介质中能否稳定存在。
28.(8分)比较下列两组化合物的熔沸点,并解释原因。
(1)CH3CH2OH和CH3OCH3(2)O3和SO2三、本题包括3小题,共50分29.(30分)写出下列反应产物30.(8分)(1)写出CH3Br + NaOH →(B)的结构简式(2)写出(A)的结构简式31.(12分)写出下面反应产物,并解释上述反应中哪一个是主要产物,并解释。
(2)写出上述反应中哪一个是主要产物,并解释。
四、本题包括2小题,共24分32.(10分)某多元化合物(含结晶水)是液流电池中解决阳极电解质和阴极电解质被污染的有用材料。
该化合物中一些元素的质量百分数为:金属(M):21.67%,硫(S):13.64%,氧(O):61.26%。
该化合物在水溶液中与氯化钡的盐酸溶液反应,产生白色沉淀。
试推算出该化合物的化学式。
33.(14分)2017年Chem.Mater报导了某金属锂的硼氢化物不仅具有通常的高储氢密度,还有一些其它的应用的性质。
该化合物属立方晶系,晶胞参数为a=959.3pm,其晶胞图如下(提示:有一个Li+掩在晶胞上部阴离子中):(1)试写出该金属硼化物的化学式(最简单正整数比)和阴离子化学式。