分子荧光法测定水杨酸乙酰水杨酸1
- 格式:docx
- 大小:18.51 KB
- 文档页数:4

一、实验目的1. 了解乙酰水杨酸(阿司匹林)的制备原理和方法;2. 掌握重结晶、熔点测定、抽滤等基本操作;3. 了解乙酰水杨酸的应用及安全性。
二、实验原理乙酰水杨酸(阿司匹林)是一种非甾体抗炎药,具有解热、镇痛、抗炎等作用。
其制备原理是水杨酸与乙酸酐在浓硫酸催化下发生酯化反应,生成乙酰水杨酸。
三、实验材料与仪器1. 实验材料:水杨酸、乙酸酐、浓硫酸、饱和碳酸氢钠溶液、盐酸、活性炭、蒸馏水、无水乙醇、干燥剂等;2. 仪器:圆底烧瓶、烧杯、玻璃棒、抽滤瓶、布氏漏斗、滤纸、温度计、熔点测定仪、电子天平等。
四、实验步骤1. 准备工作:将水杨酸、乙酸酐、浓硫酸、饱和碳酸氢钠溶液、盐酸、活性炭等试剂及蒸馏水、无水乙醇、干燥剂等实验材料准备好,并将仪器清洗干净。
2. 制备乙酰水杨酸:(1)在圆底烧瓶中加入2.0g干燥的水杨酸;(2)加入5ml新蒸的乙酸酐;(3)逐滴滴加5滴浓硫酸,充分摇动;(4)水杨酸溶解后,水浴加热,保持瓶内温度在85-90℃之间,并缓慢摇动,维持5-10min;(5)溶液逐渐出现微弱的褐色,取出圆底烧瓶,室温冷却;(6)加入50ml水,搅拌,之后在冰水浴中冷却,并用玻璃棒摩擦瓶壁;(7)室温冷却无晶体析出,冰水浴冷却出现大量白色晶体;(8)抽滤,冷水洗涤几次,抽干粗产品置于100ml烧杯中;(9)缓慢加入25ml饱和NaHCO3溶液,不断搅拌;(10)固体大部分溶解,并产生大量气体,溶液上漂浮有白色不溶物质;(11)用无颈漏斗过滤,将滤液转移至100ml烧杯中;(12)缓慢加入15ml 4mol/L的盐酸,边加边搅拌,然后置于冷水浴中;(13)加盐酸有大量气泡产生,在冷水浴中有白色晶体析出;(14)抽滤,并用冷水洗涤2-3次,抽干;(15)将晶体转移到表面皿上,干燥25min,称量。
3. 熔点测定:(1)取少量乙酰水杨酸晶体,加入盛有5ml水的试管中;(2)加入少量活性炭,充分搅拌;(3)将溶液过滤,取滤液滴在熔点测定仪的玻璃棒上;(4)观察乙酰水杨酸的熔点。

一、实验目的1.通过本实验了解乙酰水杨酸(阿斯匹林)的制备原理和方法;2.进一步熟悉重结晶、熔点测定、抽滤等基本操作;3.了解乙酰水杨酸的应用价值。
二、实验原理早在18世纪,人们已从柳树皮中提取了水杨酸,并注意到它可以作为止痛,退热和抗炎药,不过对肠胃刺激较大。
19世纪末,人们终于成功地合成了可以替代水杨酸的有效药物—乙酰水杨酸,直到目前,阿司匹林仍然是一个广泛使用的具有解热止痛作用治疗感冒的药物。
有关报道表明,人们正在发现它的某些新功能。
水杨酸可以止痛,常用于治疗风湿病和关节炎。
它是一种具有双官能团的化合物,一个是酚羟基,一个是羧基,羧基和羟基都可以发生酯化,而且还可以形成分子内氢键,阻碍酰化和酯化反应的发生。
乙酰水杨酸商品名为阿斯匹林,亦称醋柳酸,为常用的退热镇痛药。
用于治疗感冒、发热、头痛、牙痛、关节痛和风湿病,且能抑制血小板凝集,预防术后血栓形成,心肌梗塞。
副作用少。
制备乙酰水杨酸最常用的方法是将水杨酸与乙酸酐作用,通过乙酰化反应,使水杨酸分子中酚羟基上的氢原子被乙酰基取代,生成乙酰水杨酸。
为了加速反应的进行,通常加入少量浓硫酸作催化剂,浓硫酸的作用是破坏水杨酸分子中羧基与酚羟基间形成的氢键,从而使酰化作用较易完成。
在生成乙酰水杨酸的同时,水杨酸分子之间也可发生缩合反应,生成少量的聚合物。
其反应式如下:主反应:副反应:这样得到的是粗制乙酰水杨酸,混有反应副产物和尚未作用的原料,催化剂等,必须经过纯化处理才能得到纯品。
乙酰水杨酸能与碳酸氢钠反应生成水溶性钠盐,而副产物聚合物不能溶于碳酸氢钠,这种性质上的差别可用于乙酰水杨酸的纯化。
可能存在于最终产物中的杂质是水杨酸本身,这是由于乙酰化反应不完全或由于产物在分离步骤中发生分解造成的。
它可以在各步纯化过程和产物的重结晶过程中被出去。
与大多数酚类化合物一样,水杨酸可与三氯化铁形成深色络合物,乙酰水杨酸因酚羟基已被酰化,不再于三氯化铁发生颜色反应,因此杂质很容易被检出。

乙酰水杨酸实验报告一、引言乙酰水杨酸是一种常见的药物成分,常被用于缓解疼痛和降低发热。
它是一种酯化合物,由水杨酸与乙酸酐反应而成。
在本次实验中,我们将学习分离和纯化乙酰水杨酸的方法,并通过合适的实验来验证结果。
二、实验方法1. 购买乙酸酐和水杨酸,在实验室中按照所需比例混合,生成乙酰水杨酸。
2. 将混合物加热,以提高反应速率。
3. 将反应混合物冷却,直至乙酰水杨酸逐渐结晶。
4. 将结晶物通过过滤器分离,并在干燥器中风干。
5. 使用红外光谱法确定乙酰水杨酸的纯度。
三、实验结果经过反应和分离纯化,我们得到了乙酰水杨酸的结晶物。
通过红外光谱法的分析,我们确认了乙酰水杨酸的纯度。
四、实验讨论乙酰水杨酸结晶的过程并不总是完全协同的。
此外,在结晶过程中,可能会产生一些杂质。
这是因为反应滞后和结晶条件的变化可能导致结晶物中的杂质。
为了提高纯度,我们可以尝试多次结晶,或使用其他纯化方法,如再结晶或柱层析。
红外光谱分析是确定物质纯度的一种常用方法。
通过红外光谱,我们可以观察到物质中化学键的振动频率。
对于乙酰水杨酸,我们可以观察到酰基化合物中乙酰基的特征峰。
比较实验所得的光谱与标准乙酰水杨酸的光谱,我们可以确定其纯度。
实验报告中也需要对实验过程中可能遇到的问题进行讨论。
可能的问题包括操作失误、反应温度和时间的变化以及结晶的不完全。
这些问题都需要被注意,并尝试找到解决方法。
五、结论通过本次实验,我们成功合成了乙酰水杨酸,并通过红外光谱法确定了其纯度。
实验过程中也讨论了可能遇到的问题和纯化方法。
这个实验不仅给我们提供了化学反应和纯化技术的实践经验,还增进了对乙酰水杨酸的了解。
要注意,乙酰水杨酸是一种常用的药物成分,但在使用过程中也需要遵循医生的建议和正确使用方法。
本实验仅用于学术研究和教育目的,不得用于药物生产或其他非法用途。
六、参考文献1. Johnson, D.; Heldt-Hansen, H. "Quantitative Rice Assay for Determination of Acetylsalicylic Acid (Aspirin) Utilizing Percutaneous Permeation in Human and Hairless Rat Skin". Journal of Pharmaceutical Sciences. 1996, 85(1): 76-80.2. Swerdin, L. L. "Comparison of two methods for determination of acetylsalicylic acid in tablets". Journal of Pharmaceutical and Biomedical Analysis. 1993, 11(11-12): 1165-1167.3. Hu, M. "Bioavailability of fused deposition modeling 3D printed tablets: Effect of geometry, layer height, and infill density". International Journal of Pharmaceutics. 2019, 567: 118487.。


一、教学要求:1、通过本实验了解乙酰水杨酸(阿斯匹林)的制备原理和方法。
2、进一步熟悉重结晶、熔点测定、抽滤等基本操作。
3、了解乙酰水杨酸的应用价值。
二、预习内容:1、重结晶操作2、抽虑操作三、实验操作流程:冷却70度左右浓硫酸摇匀抽滤水杨酸,醋酸酐粗产物20min15min洗涤乙酸乙酯加热趁热过滤冷却洗涤乙酰水杨酸沸石抽滤回流干燥测熔点三、实验原理:乙酰水杨酸即阿斯匹林(aspirin),是19世纪末合成成功的,作为一个有效的解热止痛、治疗感冒的药物,至今仍广泛使用,有关报道表明,人们正在发现它的某些新功能。
水杨酸可以止痛,常用于治疗风湿病和关节炎。
它是一种具有双官能团的化合物,一个是酚羟基,一个是羧基,羧基和羟基都可以发生酯化,而且还可以形成分子内氢键,阻碍酰化和酯化反应的发生。
阿斯匹林是由水杨酸(邻羟基苯甲酸)与醋酸酐进行酯化反应而得的。
水杨酸可由水杨酸甲酯,即冬青油(由冬青树提取而得)水解制得。
本实验就是用邻羟基苯甲酸(水杨酸)与乙酸酐反应制备乙酰水杨酸。
反应式为:OOOHOH浓HSO24CHCOOH(CHCO)O3++32OHOCOCH3副反应:OOHOHHO2+2COOHOHOOOOOCOCH3OHOH+COOHOCOCH3OHOO表1 主要试剂和产品的物理常数名称分子量 m.p.或b.p. 水醇醚水杨酸 138 158(s) 微易易醋酐 102.09 139.35(l) 易溶 ? 乙酰水杨酸 180.17 135(s) 溶、热溶微四、实验步骤:在50mL圆底烧瓶中,加入干燥的水杨酸7.0g(0.050mol)和新蒸的乙酸酐10ml(0.100mol)(思考题1),再加10滴浓硫酸,充分摇动(思考题2)。
水浴加热,水杨酸全部溶解,保持瓶内温度在70?左右(思考题3),维持20min,并经常摇动。
稍冷后,在不断搅拌下倒入100ml冷水中,并用冰水浴冷却15min,抽滤,冰水洗涤(思考题4),得乙酰水杨酸粗产品。
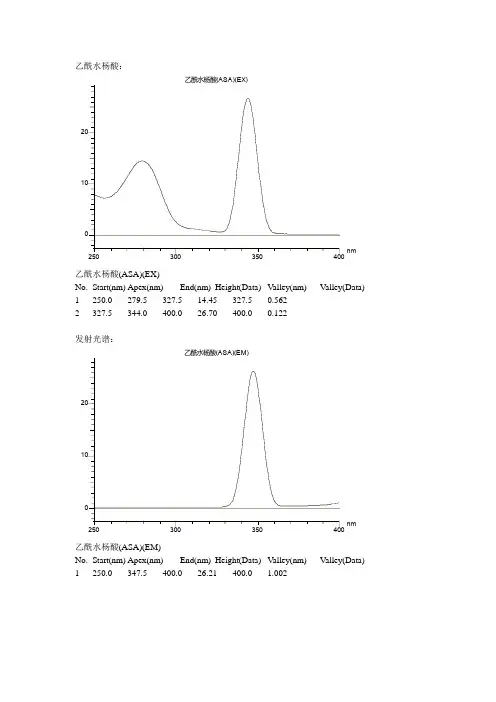
乙酰水杨酸:250350nm乙酰水杨酸(ASA)(EX)01020乙酰水杨酸(ASA)(EX) No. Start(nm) Apex(nm) End(nm) Height(Data) Valley(nm) Valley(Data)1 250.0 279.5 327.5 14.45 327.5 0.562 2 327.5 344.0 400.0 26.70 400.0 0.122发射光谱:250350nm乙酰水杨酸(ASA)(EM)01020乙酰水杨酸(ASA)(EM) No. Start(nm) Apex(nm) End(nm) Height(Data) Valley(nm) Valley(Data)1 250.0 347.5 400.0 26.21 400.0 1.002水杨酸的激发光谱:250350nm水杨酸(SA)(EX)0102030水杨酸(SA)(EX)No. Start(nm) Apex(nm) End(nm) Height(Data) Valley(nm) Valley(Data)1 250.0 255.0 285.5 10.71 285.5 1.7632 285.5 300.5 400.0 35.67 400.0 0.133发射光谱:250300350400nm水杨酸(SA)(EM)0102030405060708090 100水杨酸(SA)(EM)No. Start(nm) Apex(nm) End(nm) Height(Data) Valley(nm) Valley(Data)1 250.0 303.0 320.0 36.03 320.0 0.777乙酰水杨酸的标准曲线:Standard Calibration2010ug/mlStd.No. 344.0/347.0 Conc (ug/ml) diff RD t1 25.95 0.080 -0.065 -0.2467 -0.4993Comment:2 26.14 0.160 0.058 0.222 0.4492Comment:3 26.45 0.400 0.150 0.5701 1.154Comment:4 26.55 0.800 -0.143 -0.5454 -1.104Samp.No. 344.0/347.0 Conc (ug/ml)1 29.93 4.271Calibration type: 1st orderForce curve through zero: NoMin Conc (ug/ml): 0.080Max Conc (ug/ml): 0.800A0: -27.731A1: 1.0692R: 0.91582R2: 0.83873Lower concentration limit (ug/ml) : 0.000Upper concentration limit (ug/ml) : 1000.000水杨酸标准曲线:-0.10.10.20.30.40.50.60.70.80.91.11.21.3ug/mlStandard Calibration0102030 4050Std.No. 300.0/303.0 Conc (ug/ml) diff RD t 1 39.59 0.160 -0.084 -0.1968 -0.5092 Comment:2 42.61 0.400 0.247 0.5792 1.498 Comment:3 43.04 0.800 -0.072 -0.1695 -0.4385 Comment:4 45.06 1.200 -0.091 -0.2129 -0.5507Samp.No. 300.0/303.0 Conc (ug/ml) 1 47.85 1.636 Calibration type: 1st order Force curve through zero: No Min Conc (ug/ml): 0.160 Max Conc (ug/ml): 1.200 A0: -7.4015 A1: 0.18888 R: 0.93297 R2: 0.87043Lower concentration limit (ug/ml) : 0.000 Upper concentration limit (ug/ml) : 1000.000。

荧光分析法测定药品中的羟基苯甲酸异构体含量一.实验目的1.学习荧光分析法的基本原理和操作;2.熟悉荧光分析法进行多组分含量的测定方法。
二.实验原理1、荧光分析法原理:当被测物质受到光照后,被测物分子吸收了具有特征频率的辐射能,分子从基态上升到激发态,分子在较高能级的激发态时,它可能处于激发态中各种振动状态的一种。
然而由于分子通过与溶剂分子、同类分子或其他分子的碰撞,而失去振动能级,降低至激发态时的最低振动能级,在此过程中并不发光。
但当分子从激发态的最低振动能级,即第一电子激发态的最低振动能级跃迁至基态的各个不同的振动能级时,则以光的形式辐射出能量,所辐射出的光既是荧光。
2、激发光谱和发射光谱:激发光谱:荧光是光致发光,因此必须选择合适的激发光波长,这可以从它们的激发光谱曲线来确定。
绘制激发光谱曲线时,选择荧光的最大发射波长为测量波长,改变激发光的波长,测量荧光强度的变化。
以激发波长为横坐标、荧光强度为纵坐标作图,即得到荧光化合物的激发光谱。
激发光谱的形状与吸收光谱的形状极为相似,经校正后的真实激发光谱与吸收关顾不仅形状相同,而且波长位置也一样。
这是因为物质分子吸收能量的过程就是激发过程。
发射光谱:发射光谱简称荧光光谱。
如果将激发光波长固定在最大激发波长处,然后扫描发射波长,测定不同发射波长处的荧光强度,即得到荧光光谱。
3、试验方法机理:邻- 羟基苯甲酸(亦称水杨酸)和间- 羟基苯甲酸分子组成相同,均含一个能发射荧光的苯环,但因其取代基的位置不同而具有不同的荧光性质。
在pH=12 的碱性溶液中,二者在310nm附近紫外光的激发下均会发射荧光;在pH=5.5的近中性溶液中,间-羟基苯甲酸不发荧光,邻-羟基苯甲酸因分子内形成氢键增加分子刚性而有较强荧光,且其荧光强度与pH=12时相同。
利用此性质,可在pH=5.5 时测定二者混合物中邻-羟基苯甲酸含量时,间-羟基苯甲酸不干扰。
另取同样量混合物溶液,测定pH=12 时的荧光强度,减去 pH=5.5时测得的邻-羟基苯甲酸的荧光强度,即可求出间-羟基苯甲酸的含量。

第41卷第2期吉林师范大学学报(自然科学版)Vol.41ꎬNo.2㊀2020年5月JournalofJilinNormalUniversity(NaturalScienceEdition)Mayꎬ2020收稿日期:2020 ̄02 ̄27基金项目:国家青年自然科学基金项目(51609100)ꎻ吉林省科技发展计划项目(20160101287JC)第一作者简介:孙艳涛(1979 )ꎬ女ꎬ吉林省辽源市人ꎬ教授ꎬ博士ꎬ硕士生导师.研究方向:色谱与光谱分析.doi:10.16862/j.cnki.issn1674 ̄3873.2020.02.011荧光法测定水杨酸片中水杨酸的含量孙艳涛1ꎬ李美锡1ꎬ刘仕聪1ꎬ李㊀林1ꎬ刘㊀洋2(1.吉林师范大学化学学院ꎬ吉林四平136000ꎻ2.吉林师范大学物理学院ꎬ吉林四平136000)摘㊀要:利用荧光法测定水杨酸片中水杨酸的含量.用甲醇作为水杨酸的溶剂ꎬ对溶液的酸碱性㊁稳定性及其线性范围等条件进行了考察.结果表明ꎬ水杨酸含量在(0.387~1.935)ˑ10-8mol L-1范围内具有良好的线性关ꎬ水杨酸片中水杨酸的含量为1.636ˑ10-8mol L-1.关键词:荧光法ꎻ水杨酸ꎻ含量测定中图分类号:O65㊀㊀文献标志码:A㊀㊀文章编号:1674 ̄3873 ̄(2020)02 ̄0083 ̄06㊀㊀水杨酸(其结构如图1所示)是一种天然的消炎药ꎬ可以祛角质㊁杀菌㊁消炎等ꎬ因而在消炎等需求的用药及化妆品中都含有适量的水杨酸.复方水杨酸片㊁阿司匹林㊁复方乙酰水杨酸片及尼美舒利等含水杨酸的制剂作为医院的处方药应用广泛[1 ̄6].文献报道制剂中水杨酸含量的测定方法主要有荧光光谱法ꎬ电位滴定法ꎬ紫外 ̄可见分光光度法ꎬ库伦滴定法及高相液相色谱法[7 ̄11].荧光分光光度测定法具有灵敏度高㊁选择性强㊁用量少和方法简便等优点[12 ̄13]ꎬ常用于有机物和无机物的定性定量分析.本实验利用荧光光谱法考察了水杨酸片中水杨酸的含量.OHO OH图1㊀水杨酸的结构式Fig.1㊀Molecularstructureofsalicylicacid1㊀实验1.1㊀仪器与试剂1.1.1㊀仪器PELS ̄55型荧光光谱仪ꎬpHS ̄3C数字酸度计ꎬShimadzuUV ̄2550型紫外分光光度计ꎬSK5200H超声波清洗器ꎬBT125D十万分之一电子天平ꎬ可调式移液器.1.1.2㊀试剂水杨酸片ꎬ水杨酸标准品ꎬ甲醇(色谱纯)ꎬ冰醋酸(分析纯)ꎬ氯仿(分析纯)ꎬ实验用水(二次蒸馏水).48吉林师范大学学报(自然科学版)第41卷1.2㊀配制溶液1.2.1㊀样品溶液的配制准确称取水杨酸片粉末0.00210g于10mL的容量瓶中ꎬ用甲醇定容ꎬ超声15minꎬ配制成1.522ˑ10-6mol L-1的水杨酸片溶液.1.2.2㊀标准品溶液的配制准确称取水杨酸标准品0.00267g于10mL的容量瓶中ꎬ用甲醇定容ꎬ超声15minꎬ配制成1.935ˑ10-6mol L-1的水杨酸标准品溶液ꎬ使用时适当稀释.1.3㊀设置参数1.3.1㊀二维荧光光谱参数将激发光谱范围设置为310~600nmꎬ发射和激发的狭缝均设为15.0nmꎬ荧光波长设为301nmꎬ扫描速度设为1000nm min-1.1.3.2㊀三维荧光光谱参数激发波长设置为200~400nmꎬ发射波长设置为310~600nmꎬ发射和激发的狭缝均设为15.0nmꎬ扫描步长设为10nmꎬ扫描次数设为20次ꎬ扫描速度设为1000nm min-1[13].1.4㊀优化条件1.4.1㊀溶剂的考察准确移取4份30μL水杨酸标准溶液ꎬ分别加入甲醇㊁1%醋酸 ̄甲醇溶液㊁氯仿和1%醋酸 ̄氯仿不同溶剂ꎬ总体积为3.5mL.1.4.2㊀酸度的考察准确移取20μL水杨酸标准溶液和10μL不同pH值的缓冲液ꎬ配制1.1056ˑ10-5mol L-1的水杨酸标准溶液.配制三组平行样ꎬ考察荧光强度随溶液酸度的变化情况.1.4.3㊀稳定性的考察分别准确移取2份20μL水杨酸标准溶液配制成浓度为1.1056ˑ10-5mol L-1的水杨酸溶液.在密封㊁避光和干燥条件下ꎬ考察其荧光强度在48h内的变化情况.1.5㊀绘制标准曲线分别准确移取100㊁300㊁500㊁700㊁900和1000μL的水杨酸标准溶液ꎬ用甲醇稀释配制成3mL一系列不同浓度的水杨酸标准溶液并进行检测ꎬ绘制纵坐标为荧光强度(F)ꎬ横坐标为浓度(c)的标准曲线.2㊀结果与讨论2.1㊀溶剂的选择水杨酸易溶于醇类试剂ꎬ实验考察了四种溶剂分别是甲醇㊁1%醋酸 ̄甲醇㊁氯仿和1%醋酸 ̄氯仿.图2为上述不同溶剂中水杨酸的二维荧光光谱.从图2可知不同溶剂中水杨酸的激发和发射光谱形状略有不同ꎬ以甲醇作为溶剂ꎬ从图2(A)中可知水杨酸的荧光强度为725ꎻ以氯仿作溶剂ꎬ从图2(C)中观察到水杨酸的最大发射波长发生蓝移ꎬ且其荧光强度为240ꎻ以1%醋酸 ̄甲醇和1%醋酸 ̄氯仿作为溶剂的水杨酸最大发射波长发生红移ꎬ荧光强度分别为177和128.由此可知ꎬ使用甲醇作溶剂ꎬ水杨酸的荧光性质稳定ꎬ强度较大.2.2㊀二维荧光光谱利用紫外分光光度计测得303nm为水杨酸的最大吸收波长ꎬ将激发波长设为303nmꎬ在300~600nm范围内绘制水杨酸的发射光谱ꎬ确定430nm为其最大发射波长.将发射波长设置为430nmꎬ在200~430nm范围内绘制水杨酸的激发光谱ꎬ确定其具有两个激发波长分别为210nm和303nm.再分别以210nm和303nm作为激发波长ꎬ绘制其发射波长ꎬ确定其最大发射波长分别为405nm和398nmꎬ结果见图3.最终选择荧光强度最大的发射波长405nm作为测量波长.第2期孙艳涛ꎬ等:光法测定水杨酸片中水杨酸的含量㊀㊀(A)甲醇ꎻ(B)1%醋酸 ̄甲醇ꎻ(C)氯仿ꎻ(D)1%醋酸 ̄氯仿图2㊀不同溶剂中水杨酸的二维荧光光谱Fig.2㊀Two ̄dimensionaldiagramofsalicylicacidinthedifferentsolvents(Ex1=303nmꎬEx2=210nmꎬEm1=405nmꎬEm2=398nm)图3㊀水杨酸的二维图Fig.3㊀Two ̄dimensionaldiagramofsalicylicacid2.3㊀三维荧光光谱三维荧光光谱图具有高的选择性ꎬ由于其坐标比二维的平面图多一个ꎬ故可用于多组份混合物的分析[14].水杨酸的三维荧光光谱如图4所示ꎬ其激发波长有两个ꎬ分别为303nm和210nmꎬ对应的发射波长分别为405nm和398nmꎬ与二维荧光光谱所得信息一致.58吉林师范大学学报(自然科学版)第41卷图4㊀水杨酸的三维图Fig.4㊀Three ̄dimensionaldiagramofsalicylicacid2.4㊀酸度的影响实验考虑了溶液酸度对水杨酸的影响.图5为15种不同pH条件下的水杨酸溶液的荧光变化趋势ꎬ每组数据平行测定三组.图中可以看出酸性越强水杨酸的荧光强度越弱ꎬ碱性越强荧光强度越强ꎬ但显碱性的溶液中出现了白色絮状物ꎬ证明其性质有所改变ꎬ因此实验选择在中性条件下进行测定.图5㊀不同pH下水杨酸的荧光强度Fig.5㊀FluorescenceintensityofsalicylicacidatdifferentpHvalues代表性酸度条件下(分别为pH=2.3㊁pH=7.0㊁pH=13.0)水杨酸的三维荧光光谱图如图6所示.㊀68第2期孙艳涛ꎬ等:光法测定水杨酸片中水杨酸的含量(A)pH=2.3㊁(B)pH=7.0㊁(C)pH=13.0图6㊀代表性酸度条件下水杨酸的三维荧光光谱图Fig.6㊀Three ̄dimensionalfluorescencespectrographofsalicylicacidunderrepresentativeacidityconditions2.5㊀稳定性的影响以甲醇作水杨酸的溶剂ꎬ在密封㊁避光㊁干燥条件下保存ꎬ考察其48h内的稳定性ꎬ从图7可看出水杨酸在48h内的稳定性良好.图7㊀水杨酸的稳定性Fig.7㊀Stabilityofsalicylicacid2.6㊀标准曲线从水杨酸的标准曲线(如图8)得知ꎬ在(0.387~1.935)ˑ10-8mol L-1的浓度范围内ꎬ水杨酸浓度与其强度呈良好的线性关系ꎬ线性方程为y=386.61x-33.553ꎬ相关系数R2=0.9912.图8㊀水杨酸的标准曲线Fig.8㊀Standardcurveofsalicylicacid2.7㊀含量测定将水杨酸片的荧光强度带入标准曲线方程ꎬ经计算可求出水杨酸片中水杨酸的含量是1.636ˑ10-8mol L-1.7888吉林师范大学学报(自然科学版)第41卷3㊀结㊀论本实验采用甲醇作为水杨酸的溶剂ꎬ对溶液的酸碱性㊁稳定性及其线性范围等条件进行考察.水杨酸在(0.387~1.935)ˑ10-8mol L-1范围内具有良好的线性关系ꎬ利用荧光法测定水杨酸片中水杨酸的含量为1.636ˑ10-8mol L-1.参㊀考㊀文㊀献[1]李本淳ꎬ王丹.HPLC法测定复方水杨酸苯甲酸搽剂中水杨酸和苯甲酸的含量[J].中国药物评价ꎬ2017ꎬ34(4):255 ̄257. [2]韩迎春ꎬ赵丽华ꎬ龚时琼ꎬ等.荧光测定阿司匹林肠溶片中水杨酸实验的绿色化[J].实验室科学ꎬ2018ꎬ21(4):4 ̄7.[3]马延.经久不衰的阿司匹林[J].生命世界ꎬ2013(2):84 ̄93.[4]邓雅晨ꎬ梁建英.复方乙酰水杨酸片含量测定学生实验方法的改进[J].教育教学论坛ꎬ2013(34):266 ̄268.[5]李彩兰.尼美舒利的临床应用与进展[J].医学信息(中旬刊)ꎬ2010ꎬ5(6):1531 ̄1532.[6]JANDAMꎬRUELLANDE.Magicalmysterytour:Salicylicacidsignalling[J].EnvironmentalandExperimentalBotanyꎬ2015ꎬ117 ̄128. [7]李蕾ꎬ陈江敏.荧光分光光度法测定阿司匹林中游离水杨酸 PEG1500 ̄OP ̄(NH4)2SO4 ̄H2O双水相体系萃取分离[J].理化检验(化学分册)ꎬ2008(1):58 ̄60.[8]贝琦华ꎬ李祎ꎬ刘逸韬ꎬ等.电位滴定法测定尼美舒利含量能力验证结果分析[J].中国药事ꎬ2019ꎬ33(3):290 ̄294.[9]王慧.紫外 ̄可见分光光度法测定复方苯甲酸软膏中水杨酸的含量[J].北方药学ꎬ2014ꎬ11(1):10 ̄10.[10]高从ꎬ杨宁ꎬ黄力.库仑滴定法测定水杨酸醇溶液中水杨酸的含量[J].中国医院药学杂志ꎬ2014ꎬ34(6):494 ̄496.[11]SUNLJꎬPANZQꎬXIEJꎬetal.ElectrocatalyticactivityofsalicylicacidonAu@Fe3O4nanocompositesmodifiedelectrodeanditsdetectionintomatoleavesinfectedwithBotrytiscinerea[J].JournalofElectroanalyticalChemistryꎬ2013:127 ̄132.[12]段沅杏ꎬ贺兵ꎬ李干鹏ꎬ等.食品中正二氢愈疮酸含量的高效液相色谱荧光法测定[J].云南化工ꎬ2011ꎬ38(1):42 ̄47.[13]王堃ꎬ陈瑾ꎬ赵春晓ꎬ等.荧光分光光度法测定斯达舒中铝的含量[J].中国民族民间医药ꎬ2018ꎬ27(8):34 ̄36.[14]孙艳涛ꎬ王丽秋ꎬ赵磊ꎬ等.甘草次酸的荧光光谱研究[J].时珍国医国药ꎬ2013ꎬ24(3):621 ̄622.[15]于晓娟.微囊藻抑制 AgBiO3应急处置与酵母菌生态抑制法的研究[D].上海:上海交通大学ꎬ2011.DeterminationofsalicylicacidinsalicylicacidtabletsbyfluorescencespectrometrySUNYan ̄tao1ꎬLIMei ̄xi1ꎬLIUShi ̄cong1ꎬLILin1ꎬLIUYang2(1.CollegeofChemistryꎬJilinNormalUniversityꎬSiping136000ꎬChinaꎻ2.CollegeofPhysicsꎬJilinNormalUniversityꎬSiping136000ꎬChina)Abstract:Useingfluorescencespectrometrytodeterminationthesalicylicacidinsalicylicacidtablets.Usingmethanolasasolventforsalicylicacid.Theacidalkalinitystabilityandlinearrangeofsolutionwereinvestigated.Salicylicacidhasagoodlinearrelationshipintherangeof(0.387~1.935)ˑ10-8mol L-1.Determinationofsalicylicacidinsalicylicacidtabletsbyfluorescencewas1.636ˑ10-8mol L-1.Studentshavemasteredtheroutinetreatmentmethodofdrugsampleandthebasicoperationoffluorescenceinstrumentthroughexperimentꎬfurtherunderstandingofthequalitativeandquantitativeprinciplesofdeepfluorescencespectrometry.Keywords:fluorescencemethodꎻsalicylicacidꎻdeterminationofcontent(责任编辑:林险峰)。

实验荧光法测定乙酰水杨酸和水杨酸一、目的要求1、掌握用荧光法测定药物中乙酰水杨酸和水杨酸的方法。
2、掌握RF-5301型荧光仪的操作方法。
二、原理通常称为ASA的乙酞水杨酸(阿司匹林)水解即生成水杨酸(SA),而在阿司匹林中,都或多或少存在一些水杨酸。
用氯仿作为溶剂,用荧光法可以分别测定它们。
加少许醋酸可以增加二者的荧光强度。
在1,醋酸一氯仿中,乙酞水杨酸和水杨酸的激发光谱和荧光光谱如图1.图1 在1,醋酸一氯仿中,乙酞水杨酸和水杨酸的激发光谱和荧光光谱为了消除药片之间的差异,可取几片药片一起研磨,然后取部分有代表性的样品进行分析。
三、仪器与试剂仪器 RF-5301型荧光仪,石英皿;容量瓶:1000mL 2只,100mL 8只,50mL 10只;l0mL吸管2支。
试剂乙酰水杨酸贮备液:称取0.4000g 乙酰水杨酸溶于1,醋酸一氯仿溶液中,用1,醋酸一氯仿溶液定容于1000mL容量瓶中;水杨酸贮备液:称取0.750g水杨酸溶于1,醋酸一氯仿溶液中,并用其定容于1000mL容量瓶中;醋酸;氯仿。
四、实验步骤1、绘制ASA和SA的激发光谱和荧光光谱将乙酰水杨酸和水杨酸贮备液分别稀释100倍(每次稀释10倍,分二次完成)。
用该溶液,分别绘制ASA和SA的激发光谱和荧光光谱曲线,并分别找到它们的最大激发波长和最大发射波长。
2、制作标准曲线(1) 乙酞水杨酸标准曲线在5只50mL容量瓶中,用吸量管分别加入4.00µg/mLASA溶液2、4、6、8、l0mL,用1,醋酸一氯仿溶液稀释至刻度,摇匀。
分别测量它们的荧光强度。
(2) 水杨酸标准曲线在5只50mL容量瓶中,用吸量管分别加入7.50µg/mL SA溶液2、4、6、8、l0mL,用1,醋酸一氯仿溶液稀释至刻度,摇匀。
分别测量它们的荧光强度。
、阿司匹林药片中乙酰水杨酸和水杨酸的测定 3将5片阿司匹林药片称量后磨成粉末,称取400.0mg用1,醋酸一氯仿溶液溶解,全部转移至100mL容量瓶中,用1,醋酸一氯仿溶液稀释至刻度。
水杨酸的测定原理
水杨酸的测定原理是基于其与酚酞钠(或菲儿明)反应生成溶液呈现颜色变化的特性。
该反应可以用于水杨酸含量的定量分析。
测定水杨酸的方法通常采用分光光度法。
首先,将待测样品中的水杨酸与酚酞钠(或菲儿明)溶液进行反应,生成呈红色或粉色的化合物。
然后,使用分光光度计在特定波长下测定反应产物的吸光度。
根据比尔-朗伯定律,物质溶液中溶质的摩尔吸光度与其浓度成正比。
因此,在已知标准溶液中进行一系列反应并测定其吸光度,可以建立水杨酸浓度与吸光度之间的标准曲线。
然后,通过测定待测样品的吸光度,可以根据标准曲线确定水杨酸的浓度。
该方法的优点是简单、准确且灵敏。
一般来说,测定结果的相对误差可以控制在2%以内。
然而,该方法也存在一些限制,比如对试剂的纯度有一定要求,且样品中可能存在干扰物质。
因此,在实际应用中,可能需要进行一定的前处理和样品净化步骤,以确保测定结果的准确性。
荧光光度法测定阿司匹林中乙酰水杨酸的含量一、实验目的1.掌握用荧光法测定药物中的乙酰水杨酸含量的方法。
2.掌握970CRT 型荧光分光光度计的操作方法。
3.加深对荧光光度法原理的理解。
二、实验原理1.荧光光度法原理(1)常温下,处于基态的分子吸收一定的紫外可见光的辐射能成为激发态分子,激发态分子通过无辐射跃迁至第一激发态的最低振动能级,再以辐射跃迁的形式回到基态,发出比吸收光波长长的光而产生荧光。
在稀溶液中,当实验条件一定时,荧光强度I F 与物质的浓度c 成线性关系:即Kc I F (这是荧光光谱法定量分析的理论依据)。
(2)荧光光谱激发光谱:固定测量波长(选最大发射波长),化合物发射的荧光强度与照射光波长的关系曲线。
激发光谱曲线的最高处,处于激发态的分子最多,荧光强度最大。
荧光强度波长发射光谱:固定激发光波长(选最大激发波长), 化合物发射的荧光强度与发射光波长关系曲线。
固定发射光波长进行激发光波长扫描,找出最大激发光波长,然后固定激发光波长进行荧光发射波长扫描,找出最大荧光发射波长。
激发光波长和发射荧光波长的选择是本实验的关键。
2. 荧光光度法测定阿司匹林中乙酰水杨酸的含量通常称为ASA 的乙酰水杨酸(阿司匹林)水解即生成水杨酸(SA )(如下式)。
而在阿司匹林中或多或少存在一些水杨酸,用醋酸—氯仿作为溶剂,然后用荧光法可以分别测定其含量,少许醋酸还可以增加二者的荧光强度(本次实验只测定阿司匹林中乙酰水杨酸的含量)。
在1%的乙酸—氯仿中乙酰水杨酸的激发光谱和荧光光谱如图所示:(为了消除药片之间的差异,可以取几片一起研磨,然后取部分由代表性的样品进行分析)三、仪器与试剂:仪器:970CRT 型荧光分光光度计及附件;容量瓶:1000mL 2只,100 mL 2只,50mL 8只;l0mL 吸管2支;铁架台;研钵;称量瓶;玻璃棒;烧杯;定量滤纸;电子天平。
试剂:冰醋酸;氯仿;乙酰水杨酸;阿司匹林;丙酮。
一、实验目的1. 了解乙酰水杨酸(阿司匹林)的制备原理和方法;2. 熟悉并掌握重结晶、熔点测定、抽滤等基本操作;3. 探究乙酰水杨酸的应用价值。
二、实验原理乙酰水杨酸,即阿司匹林,是一种常用的解热、镇痛、抗炎药物。
它是由水杨酸与醋酸酐进行酯化反应而得到的。
实验中,水杨酸与醋酸酐在浓硫酸的催化下发生酯化反应,生成乙酰水杨酸。
反应式如下:C7H6O3 + C4H6O3 → C9H8O4 + C2H4O2三、实验材料与仪器1. 实验材料:- 水杨酸(C7H6O3)- 醋酸酐(C4H6O3)- 浓硫酸(H2SO4)- 水浴锅- 烧杯- 滤纸- 玻璃棒- 抽滤瓶- 精密天平- 熔点仪2. 实验仪器:- 圆底烧瓶(100mL)- 滴液漏斗- 冰水浴- 烧杯- 玻璃棒- 抽滤瓶- 精密天平- 熔点仪四、实验步骤1. 在100mL圆底烧瓶中加入干燥的水杨酸2.0g和新蒸的乙酸酐5mL,再逐滴滴加5滴浓硫酸,充分摇动。
2. 水杨酸溶解,溶液无色。
3. 将圆底烧瓶放入水浴锅中,保持瓶内温度在85-90℃之间,并缓慢摇动,维持5-10min。
4. 溶液逐渐出现微弱的褐色。
5. 取出圆底烧瓶,室温冷却。
6. 加入50mL水,搅拌,之后在冰水浴中冷却。
7. 用玻璃棒摩擦瓶壁,室温冷却无晶体析出,冰水浴冷却出现大量白色晶体。
8. 抽滤,冷水洗涤几次,抽干粗产品。
9. 将粗产品置于100mL烧杯中,缓慢加入25mL饱和NaHCO3溶液,不断搅拌。
10. 固体大部分溶解,并产生大量气体,溶液上漂浮有白色不溶物质。
11. 用无颈漏斗过滤,将滤液转移至100mL烧杯中,缓慢加入15mL 4mol/L的盐酸,边加边搅拌,然后置于冷水浴中。
12. 加盐酸有大量气泡产生,在冷水浴中有白色晶体析出。
13. 抽滤,并用冷水洗涤2-3次,抽干。
14. 将晶体转移到表面皿上,干燥25min,称量。
15. 取少量的乙酰水杨酸晶体,加入盛有5mL水的试管中,加入熔点仪测定熔点。
分子荧光法测定水杨酸和乙酰水杨酸
一、实验目的
1、学习荧光分析法的基本原理。
2、掌握应用分子荧光法测定乙酰水杨酸、水杨酸的分析方法。
3、了解F-3501型荧光分光光度计的主要结构及工作原理,掌握其正确的使用方法。
二、实验原理
某些物质经紫外光或波长较短的可见光照射后,会发射出较入射波长更长的荧光。
荧光光谱反映了物质的特性,建立在测量荧光光谱基础上的分析方法称为荧光分析法。
当进行荧光测定时,总要选择不同波长的光波进行测定,即一个为激发光——物质所吸收的光;另一个为物质吸收后发出的光称为发射光或荧光。
对同一物质而言,在稀溶液(即A = abc < 0.05)中,荧光的强度F与该物质的浓度C 有以下关系:
F = 2.3φabcI0
式中φ为荧光过程的量子效率,a为荧光分子的吸光系数,b为试样的吸收光程,I0为入射光的强度。
当I0及b 不变时,上式变为:
F= KC
其中,K为常数。
荧光分析法具有灵敏度高(一般超过分光光度法2~3个数量级)、取样少、方法快速等特点,现已成为食品、生物医药、天然产品、农业、环境保护、化工等领域中的重要分析方法之一。
但由于许多物质本身不会发生荧光,故在使用范围上受到一定的限制。
乙酰水杨酸(ASA,即阿司匹林)水解能生成水杨酸(SA),而在乙酰水杨酸中,或多或少都存在着水杨酸。
由于两者都有苯环,也有一定的荧光效率,因而在以三氯甲烷为溶剂的条件下,可用荧光法进行测定。
从乙酰水杨酸和水杨酸的激发光谱和荧光光谱中可以发现:乙酰水杨酸和水杨酸的激发波长和发射波长均不同,利用此性质,可在各自的激发波长和发射波长下分别测定。
三、仪器与试剂
1、仪器
F-3501型荧光分光光度计、电子天平、离心机、真空泵、石英比色皿、移液管、棕色容量瓶、比色管、烧杯、砂芯抽滤装置、量筒、洗耳球、洗瓶等。