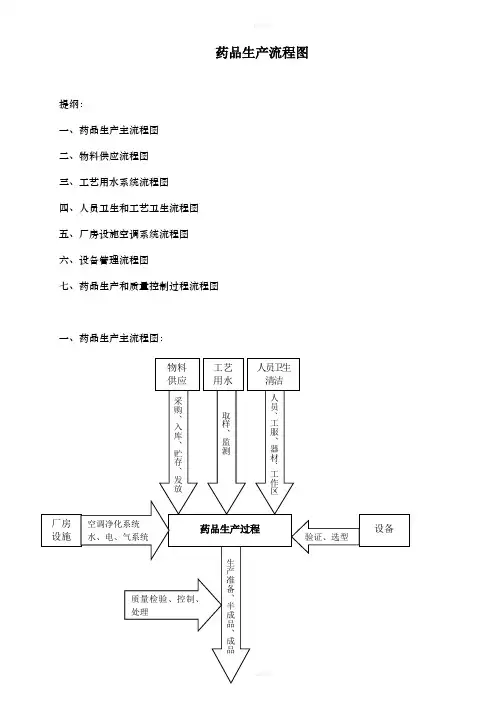
药品生产流程图
- 格式:docx
- 大小:522.38 KB
- 文档页数:8

生产案例二维生素C发酵维生素C在国外,1938年开始工业化生产,主要用作保健品及食品添加剂。
一般采用采用莱氏化学法。
生产流程图如下:在国内,开始工业化生产有30多年历史,主要作为药用。
采用自行开发的发酵法,分为发酵,提取,转化三个步骤。
1、发酵过程:2、提取过程:3、转化过程:莱氏法的优点是生产工艺成熟,总收率能到达60%〔对D-山梨醇计〕,优级品率为100%,但生产中为使其它羟基不受影响,需用丙酮保护,使反响步骤增多,连续操作有困难,且原料丙酮用量大,苯毒性大,劳动保护强度大,并污染环境。
由于存在上述问题,莱氏法工艺已逐步被两步发酵法所取代。
两步发酵法也是以葡萄糖为原料,经高压催化氢化、两步微生物〔黑醋菌、假单孢杆菌和氧化葡萄糖酸杆菌的混合菌株〕氧化,酸〔或碱〕转化等工序制得维生素C。
这种方法系将莱氏法中的丙酮保护和化学氧化及脱保护等三步改成一步混合菌株生物氧化。
因为生物氧化具有特异的选择性,利用适宜的菌将碳上羟基氧化,可以省去保护和脱保护两步反响。
此法的最大特点是革除了大量的有机溶剂,改善了劳动条件和环境保护问题,近年来又去掉了动力搅拌,大大地节约了能源。
我国已全部采用两步发酵法工艺,淘汰了莱氏法工艺。
第一节L-山梨糖的制备一、菌种制备黑醋菌是一种小短杆菌,属革兰氏阴性菌〔G-〕,生长温度为30~36℃,最适温度为30~33℃。
培养方法:将黑醋菌保存于斜面培养基中,每月传代一次,保存于0~5℃冰箱内。
菌种从斜面培养基移入三角瓶种液培养基中,在30~33℃振荡培养48h,合并入血清瓶内,糖量在100mg/ml以上,镜检菌体正常,无杂菌,可接入生产。
二、发酵液制备种子培养分为一、二级种子罐培养,都以质量浓度为16%~2021D-山梨醇投料,并以玉米浆、酵母膏、泡敌、碳酸钙、复合维生素B、磷酸盐、硫酸盐等为培养基,在pH5.4~5.6下于12021温30min灭菌,待罐温冷却至30~34℃,用微孔法接种。

项目名称:新药生产的申报与审批
许可依据:《药品管理法》、《药品管理法实施条例》、《药品注册管理办法》
申报资料:
1、提交<药品注册申请表〉纸质原件一式四份及电子版一份
按〈药品注册管理办法〉附件一、附件二和附件三的要求提交申报资料四套,包括原件二套,复印件一套及综述资料复印件一套.
办理程序:申请人向省局药品注册处提出注册申请,按要求提交〈药品注册申请〉及申报资料;省局进行形式审查并决定是否受理;省局对受理的注册申请进行现场核查、抽取3批样品注册检验并进行初步资料审查,符合要求的上报国家局药审中心进行技术审评;经审评符合要求的,由药审中心通知国家局药品认证中心进行生产现场检查,并抽取1批样品(生物制品抽取3批)进行检验。
均符合要求的,国家局发给新药证书.申请人已持有《药品生产许可证》并具备生产条件的,同时发给药品批准文号。
办理时限:205(175)日,其中:
省局受理、现场核查及资料初审:35日
国家局技术审评:150日,获准进入特殊审批程序的品种:120日
国家局审批:20日
收费标准:3500元
新药生产的申报与审批流程图。


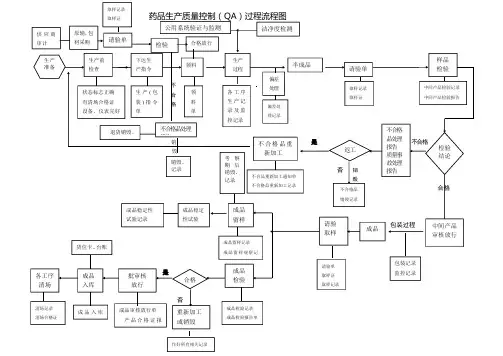
不合格销是不合格毁否销毁合格包装过程是否药品生产质量控制(QA)过程流程图生产准备生产前检查下达生产指令生产过程偏差处理样品检验检验结论返工成品成品留样生产(包装)指令单各工序生产记录及监控记录偏差处理记录半成品请验单取样记录取样证中间产品检验记录中间产品检验报告中间产品审核放行请验取样请验单取样证取样记录成品稳定性试验成品稳定性试验记录成品检验成品检验记录成品检验报告单成品留样记录成品留样观察记批审核放行合格成品入库成品审核放行单产品合格证报重新加工或销毁作好所有相关记录成品入库不合格品处理报告质量事故处理报告不合格品销毁记录不合格品重新加工不合品重新加工通知单不合格品重新加工记录状态标志正确有清场合格证设备、仪表完好领料领料单各工序清场清场记录清场合格证包装记录监控记录货位卡、台账洁净度检测公用系统验证与监测考察期后销毁、记录供应商审计原辅,包材采购请验单取样记录取样证检验合格放行不合格品处理报告退货销毁、销毁、记录文件产品质量标准省级以上药品检验报告单组织机构代码证税务登记证书应为合法有效版本审计:公司每年对所选择供应商进行审计(现场审计、非现场审计)并出具公司质量部的审计报告,具体按供应商审计管理标准内容进行。
每年未应制定出下年度的合格供应商目录,并受权人签字确认,分发至物料部门采购部门,质量部存档1.按以上目录内先择相应0购入材料的供应商,并签定购销合同及质量保证协议书同货存档,再进行采购。
1采购到位的合法材料,在进入库前进行初验,填写初验记录。
合格后进行待验区,做好状态标示及货位卡,填写请验单,请验质量部。
2.取样员取样应填写取样单、取样证、带好取样器具取样,并做好取样记录,填好货位卡的取样量。
物料部门应在取样前后做好取样车使用记录。
取过样的物料应放至最上层,生产时应先出。
1.取样后按时效进行分样检验(检验原始记录、检验台账(合格与不合格)、试剂领用、配制记录(毒剧试剂的领用、配制、销毁记录)、标准品、液领用、配制记录、标定复标记录、检验仪器使用记录、检定菌传代与使用销毁记录)并出具报告单(一式三份)。



青霉素生产工艺流程图
首先是青霉素的发酵过程。
在青霉素的生产中,青霉菌是生产
青霉素的关键微生物。
青霉菌在适宜的温度、pH值和培养基条件下
进行发酵,产生青霉素。
在发酵过程中,需要对发酵罐内的温度、
酸碱度、氧气供给等参数进行严格控制,以保证青霉菌的正常生长
和青霉素的合成。
接下来是青霉素的分离提取过程。
在发酵结束后,需要将发酵
液进行分离,提取目标产物。
分离提取的方法主要包括离心、过滤、溶剂萃取等,通过这些方法可以将青霉素从发酵液中提取出来,并
去除杂质。
然后是青霉素的精制过程。
在青霉素的精制过程中,需要对提
取得到的青霉素进行进一步的纯化和结晶,以得到高纯度的青霉素
成品。
精制过程中的关键步骤包括结晶、洗涤、干燥等,通过这些
步骤可以得到符合药品质量标准的青霉素制剂。
青霉素生产工艺流程图的设计和实施对于青霉素的生产具有重
要意义。
合理的工艺流程图可以提高青霉素的产量和质量,降低生
产成本,保证青霉素的安全性和有效性。
因此,在青霉素生产工艺
流程图的设计中,需要充分考虑青霉素生产的各个环节,合理安排工艺参数,优化生产过程。
总的来说,青霉素生产工艺流程图涉及到发酵、分离提取和精制等多个环节,每个环节都对青霉素的产量和质量有着重要影响。
合理设计和严格执行青霉素生产工艺流程图,可以有效提高青霉素的生产效率和质量,为临床的抗菌治疗提供更多的支持。
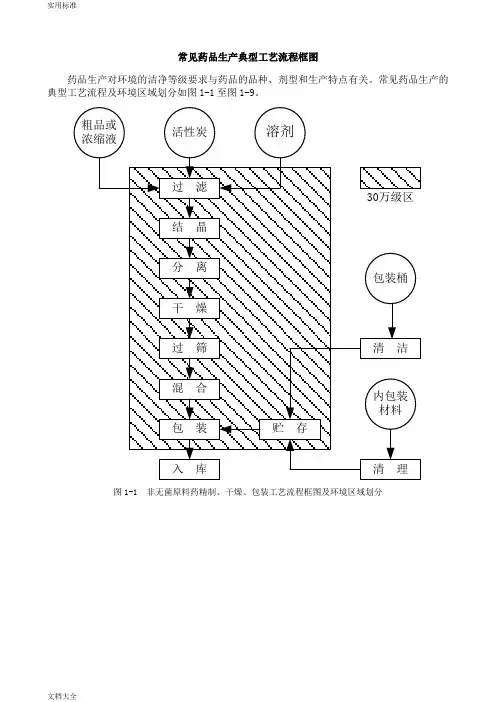
常见药品生产典型工艺流程框图
药品生产对环境的洁净等级要求与药品的品种、剂型和生产特点有关。
常见药品生产的典型工艺流程及环境区域划分如图1-1至图1-9。
图1-1 非无菌原料药精制、干燥、包装工艺流程框图及环境区域划分
图1-2 无菌原料药精制、干燥、包装工艺流程框图及环境区域划分
图1-3 片剂生产工艺流程框图及环境区域划分
图1-4 硬胶囊剂生产工艺流程框图及环境区域划分
图1-5 压制法软胶囊剂生产工艺流程框图及环境区域划分
图1-6 可灭菌小容量注射剂生产工艺流程框图及环境区域划分
图1-7 可灭菌大容量注射剂生产工艺流程框图及环境区域划分
图1-8 注射用无菌分装产品生产工艺流程框图及环境区域划分
图1-9 注射用冷冻干燥制品生产工艺流程框图及环境区域划分。
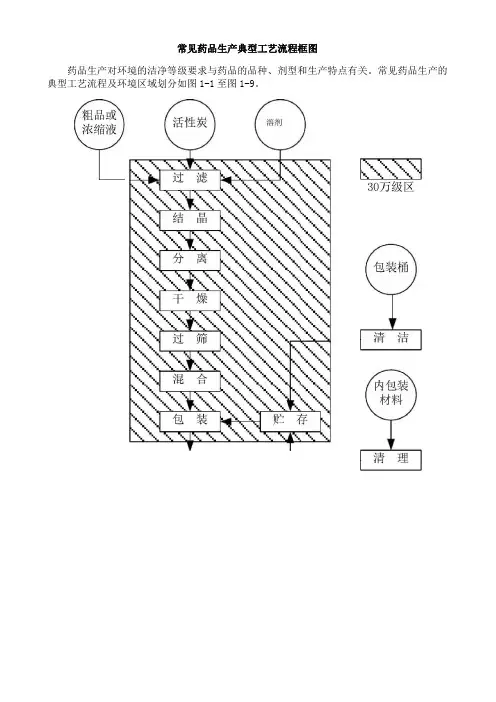
常见药品生产典型工艺流程框图药品生产对环境的洁净等级要求与药品的品种、剂型和生产特点有关。
常见药品生产的典型工艺流程及环境区域划分如图1-1至图1-9。
粗品 瓶塞 活性炭 溶剂纯水纸箱 标签抗生素 浓缩液玻璃瓶 或铝瓶注射用 水100级1万级z ■精洗 干燥灭菌 10万级;冷却清洗 无菌过滤喷雾干燥分离30装瓶 结晶 过筛 过滤混合干燥 入库贴签 过滤装箱 过滤 粗洗 图1-2 无菌原料药精制、干燥、包装工艺流程框图及环境区域划分原辅料筛玻璃瓶干、整粒包衣液混 冲模燥崩解剂 润湿剂润滑剂 崩解剂包装 材料内包装 材料,包衣压片冷却 分装 30万级其他包 装容器直接法包装 粉 精洗 干燥法粗筛冷却 入库消 粗洗430万级区空心胶囊内包装材料胶皮回收废油液质检图1-5 压制法软胶囊剂生产工艺流程框图及环境区域划分10万级区1万级区酸碱处理隔离膜输液瓶原辅料离子交换乙醇浸泡瓶外清洗+煮沸化过滤--A清洗I-A清洗注射用水ESS330万级区1万级区清洁剂清洗、称量<1浓配MK过滤粗滤,士清洗务庭灌装(放膜却上塞翻ES3 10万级区精洗2精洗左口至~p|~ln~n100级区A力口盖滤包装V纸箱贴签V标签灭菌玻璃瓶 胶塞轧 铝盖白蜡纸盖纸箱冻干用 原料 分装用 原料10万级酸碱处理擦洗消毒 产擦洗消毒 洗饮用水洗纯化水洗干干燥灭菌二无菌过滤 :检查灌装冷却冻干加塞 M 轧 灭菌 三:1:+:;:工彳>*々 斗|分.装干燥灭菌7Z3ZZ / d 注射用水洗上/硅化/封蜡 检 目目 1万级贴签 .(标签装盒100级入库 < 装箱—胶塞非无菌原料药西林瓶酸碱处理饮用水洗W干燥灭菌H灭菌过滤纯化水洗,注射用水洗』定 3 定量灌装:,:托盘注入:胶塞塞半:::冷冻干燥却:・冷冻干燥・:■粉碎过筛■: •:胶塞全压塞分装到容器铝盖轧盖•:,密封10万级区:•:生物洁净室A:管制抗生素玻璃瓶冻结法B:托盘冻结法。