化学综合计算
- 格式:ppt
- 大小:121.00 KB
- 文档页数:9

有关化学方程式和溶液的综合计算1、写出反应的化学方程式2、在对应化学式下写出相对原子质量(化学计量数×原子质量)3、在对应下面写物质质量4、计算:M1÷m1=M2÷m2。
(利用这个等式可计算出各物质的质量)例:Fe+CuSO4=FeSO4+Cu56 152 645.6g x56÷5.6g=64÷x x=6.4g如要求计算反应后所得溶液的溶质质量分数则:反应后所得溶液质量=原溶液质量+溶解物质的质量-反应生成气体或沉淀的质量所以题:反应后所得溶液的溶质质量分数=(反应后溶质质量÷反应后所得溶液质量)×100%如下中考计算题2011年100g某硫酸铜溶液恰好与5.6g铁完全反应。
求:(1)生成铜的质量。
(2)反应后所得溶液的溶质质量分数。
(计算结果精确到0.1%)解:设生成铜的质量为x,生成FeSO4的质量为yFe+CuSO4=FeSO4+Cu56 152 645.6g y x56:5.6g=64:x x=6.4g56:5.6g=152:y y=15.2g反应后所得溶液的溶质质量分数为:15.2g/(100g+5.6g-6.4g)×100%=15.3%答:生成铜的质量为6.4g,反应后所得溶液的溶质质量分数为15.3%。
2012年(1)天然气主要成分甲烷的化学式为CH4,按下列要求进行计算:①甲烷的相对分子质量为:②甲烷中碳、氢两种元素的质量比为。
(2)10g氢气在多少克氯气中燃烧,同时生成多少克氯化氢气体?(假设恰好完全反应)解:(1)①16 ②3:l(2)解:设消耗氯气的质量为x,生成氯化氢气体的质量为y答:消耗氯气的质量为355g;生成氯化氢气体的质量为365g。
2013年将8.1g氧化锌固体放入100g稀硫酸中,恰好完全反应.试计算:①可生成硫酸锌多少克?②所用稀硫酸的溶质质量分数是多少?解:①设生成的硫酸锌的质量为x,稀硫酸中溶质的质量为y。


第47讲 化学平衡常数的综合计算[复习目标] 1.了解压强平衡常数的含义,了解平衡常数与速率常数的关系。
2.掌握平衡常数和平衡转化率计算的一般方法。
考点一 压强平衡常数及相关计算1.气体的分压p (B)相同温度下,当某组分气体B 单独存在且具有与混合气体总体积相同的体积时,该气体B 所具有的压强,称为气体B 的分压强,简称气体B 的分压,符号为p (B),单位为Pa 或kPa 或MPa 。
气体B 的分压p (B)=气体总压p ×B 的体积分数=气体总压p ×B 的物质的量分数。
2.压强平衡常数对于有气体参与的化学反应,写平衡常数表达式时,用平衡时各气体的分压代替浓度,计算所得到的平衡常数称为压强平衡常数(K p )。
如:a A(g)+b B(g)c C(g)+d D(g),K p =p c (C )·p d (D )p a (A )·p b (B )[p (X):X 在平衡体系中物质的量分数(或体积分数)×总压强]。
3.常用的四个公式公式备注反应物的转化率 n (转化)n (起始)×100%=c (转化)c (起始)×100%①平衡量可以是物质的量、气体的体积; ②某组分的体积分数,也可以是物质的量分数生成物的产率 实际产量理论产量×100%平衡时混合物组分的百分含量平衡量平衡时各物质的总量×100%某组分的体积分数 某组分的物质的量混合气体总的物质的量×100%4.列三段式法计算压强平衡常数例 一定温度和催化剂条件下,将1 mol N 2和3 mol H 2充入压强为p 0的恒压容器中,测得平衡时N 2的转化率为50%,计算该温度下的压强平衡常数(K p )。
答案163p 20解析 N 2(g)+3H 2(g)2NH 3(g)起始/mol 1 3 0 转化/mol 0.5 1.5 1 平衡/mol 0.5 1.5 1平衡时p (N 2)=0.53p 0、p (H 2)=1.53p 0、p (NH 3)=13p 0。

题型专攻(六)化学反应速率、化学平衡的综合计算1.化学平衡常数(1)意义:化学平衡常数K 表示反应进行的程度,K 越大,反应进行的程度越大。
K >105时,可以认为该反应已经进行完全。
K 的大小只与温度有关。
(2)化学平衡常数表达式:对于可逆化学反应m A(g)+n B(g)p C(g)+q D(g)在一定温度下达到化学平衡时,K =c p (C )·c q (D )c m (A )·c n (B )。
另可用压强平衡常数表示:K p =p p (C )·p q (D )p m (A )·p n (B )[p (C)为平衡时气体C 的分压]。
(3)依据化学方程式计算平衡常数①同一可逆反应中,K 正·K 逆=1。
②同一方程式中的化学计量数等倍扩大或缩小n 倍,则新平衡常数K ′与原平衡常数K 间的关系是K ′=K n 或K ′=nK 。
③几个可逆反应方程式相加,得总方程式,则总反应的平衡常数等于各分步反应平衡常数之积。
2.转化率、产率及分压的计算反应物转化率=反应物的变化量反应物的起始量×100%产物的产率=生成物的实际产量生成物的理论产量×100%分压=总压×物质的量分数3.常用的气体定律同温同体积:p (前)∶p (后)=n (前)∶n (后)同温同压强:ρ(前)ρ(后)=M (前)M (后)=V (后)V (前)=n (后)n (前)1.[2021·全国甲卷,28(2)改编]二氧化碳催化加氢制甲醇,有利于减少温室气体二氧化碳。
二氧化碳加氢制甲醇的总反应可表示为:CO 2+3H 2(g)CH 3OH(g)+H 2O(g)ΔH =-49kJ·mol-1合成总反应在起始物n (H 2)n (CO 2)=3时,在不同条件下达到平衡,设体系中甲醇的物质的量分数为x (CH 3OH),在t =250℃下的x (CH 3OH)~p 、在p =5×105Pa 下的x (CH 3OH)~t 如图所示。
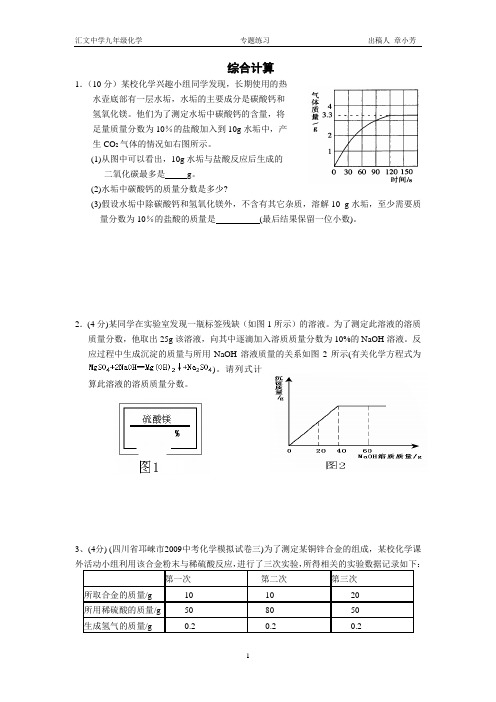
综合计算1.(10分)某校化学兴趣小组同学发现,长期使用的热水壶底部有一层水垢,水垢的主要成分是碳酸钙和氢氧化镁。
他们为了测定水垢中碳酸钙的含量,将足量质量分数为10%的盐酸加入到10g水垢中,产生CO2气体的情况如右图所示。
(1)从图中可以看出,10g水垢与盐酸反应后生成的二氧化碳最多是g。
(2)水垢中碳酸钙的质量分数是多少?(3)假设水垢中除碳酸钙和氢氧化镁外,不含有其它杂质,溶解10 g水垢,至少需要质量分数为10%的盐酸的质量是(最后结果保留一位小数)。
2.(4分)某同学在实验室发现一瓶标签残缺(如图1所示)的溶液。
为了测定此溶液的溶质质量分数,他取出25g该溶液,向其中逐滴加入溶质质量分数为10%的NaOH溶液。
反应过程中生成沉淀的质量与所用NaOH溶液质量的关系如图2所示(有关化学方程式为)。
请列式计算此溶液的溶质质量分数。
3、(4分) (四川省邛崃市2009中考化学模拟试卷三)为了测定某铜锌合金的组成,某校化学课外活动小组利用该合金粉末与稀硫酸反应,进行了三次实验,所得相关的实验数据记录如下:第一次第二次第三次所取合金的质量/g 10 10 20所用稀硫酸的质量/g 50 80 50生成氢气的质量/g 0.2 0.2 0.2(1) 试计算该铜锌合金中含锌的质量分数。
(2)所用合金与稀硫酸恰好完全反应时所得溶液中溶质的质量分数。
4. 某化学兴趣小组的同学对一批铁样品(含有杂质,杂质不溶于水,也不与稀硫酸反应)进行分析,甲、乙、丙三位同学分别进行实验,其中只有一位同学所用的稀硫酸与铁样品恰好完(1).同学所用的稀硫酸与铁样品恰好完全反应 (2)计算样品中的铁的质量分数是多少?(3)计算恰好完全反应后所得溶液中溶质的质量分数?(烧杯质量为25.4克)5、为测定某Na 2CO 3样品(混有NaCl )中Na 2CO 3的质量分数,某同学设计了以下方案:称取 样品11.8 g 于烧杯中,加20g 水完全溶解后,向其中加入150g CaCl 2溶液,恰好完全反应, 过滤得到10 g 沉淀,试通过计算确定:(1)样品中Na 2CO 3的质量分数(精确到0.1%); (2)该同学过滤所得溶液中溶质的质量分数。

化学式综合计算——质量分数计算一、单选题(共6道,每道12分)1.20 g某赤铁矿中含5 g氧化铁,则该赤铁矿中氧化铁的纯度为( )A.15%B.20%C.25%D.35%答案:C解题思路:试题难度:三颗星知识点:混合物相关量计算2.磁铁矿的主要成分是Fe3O4,某磁铁矿50 g,经分析含Fe3O435g,已知其他杂质不含铁元素,则该磁铁矿中铁的质量分数为( )(O-16,Fe-56)A.25.4%B.50.7%C.60.2%D.70.3%答案:B解题思路:试题难度:三颗星知识点:混合物中元素质量分数的计算3.石灰石的主要成分是碳酸钙(CaCO3),取一块石灰石样品测得其含碳酸钙75%,则该石灰石样品中含钙元素(其他成分不含钙元素)的质量分数为( )(C-12,O-16,Ca-40)A.25%B.30%C.40%D.75%答案:B解题思路:试题难度:三颗星知识点:混合物中元素质量分数的计算4.硝酸铵(NH4NO3)是一种常用的化学肥料。
现有一不纯的硝酸铵样品,经分析,样品中氮元素的质量分数为31.5%(其他杂质不含氮元素),则这种样品中硝酸铵的质量分数为( ) (H-1,N-14,O-16)A.60%B.75%C.80%D.90%答案:D解题思路:要求样品中硝酸铵的质量分数,即求硝酸铵的纯度。
设硝酸铵的纯度为x,根据样品中氮元素的质量分数=硝酸铵的纯度×硝酸铵中氮元素的质量分数,,故选D。
试题难度:三颗星知识点:根据混合物中某元素的质量分数求物质纯度5.人尿中含氮0.93%,若这些氮只存在于尿素[CO(NH2)2]中,则人尿中含尿素的质量分数为( )(H-1,C-12,N-14,O-16)A.1.99%B.1.00%C.0.20%D.0.02%答案:A解题思路:要求人尿中CO(NH2)2的质量分数即求CO(NH2)2的纯度,设CO(NH2)2的纯度为x,根据人尿中氮元素的质量分数=CO(NH2)2的纯度×CO(NH2)2中氮元素的质量分数,,故选A。
有关物质的量浓度的综合计算1.物质的量浓度、质量分数、溶解度间的换算由定义出发,运用公式:c =n V 、质量分数=溶质的质量溶液的质量×100%进行推理,注意密度的桥梁作用,不要死记公式。
(1)物质的量浓度(c )与溶质质量分数(w )的换算体积为V mL ,密度为ρ g·cm -3的溶液,含有摩尔质量为M g·mol -1的溶质m g ,溶质的质量分数为w ,则溶质的物质的量浓度c 与溶质的质量分数w 的关系是:c =n V =m M V =m MV =1 000ρw V MV=1 000ρw M ,反之,w =cM 1 000ρ。
(2)物质的量浓度(c )与溶解度(S )的换算若某饱和溶液的密度为ρ g·cm -3,溶质的摩尔质量为M g·mol -1,溶解度为S g ,则溶解度与物质的量浓度的表达式分别为:S =100cM 1 000ρ-cM,c =n V =S /M 100+S 1 000ρ= 1 000ρS M (100+S )。
2.溶液稀释和混合的计算(1)溶液稀释定律(守恒观点)①溶质的质量在稀释前后保持不变,即m 1w 1=m 2w 2。
②溶质的物质的量在稀释前后保持不变,即c 1V 1=c 2V 2。
③溶液质量守恒,m (稀)=m (浓)+m (水)(体积一般不守恒)。
(2)同溶质不同物质的量浓度的溶液的混合计算①混合后溶液体积保持不变时,c 1V 1+c 2V 2=c 混×(V 1+V 2)。
②混合后溶液体积发生改变时,c 1V 2+c 2V 2=c 混V 混,其中V 混=m 混ρ混。
(3)溶质相同、质量分数不同的两溶液混合定律(教师用书独具)①等质量混合两溶液等质量混合时(无论ρ>1 g·cm-3还是ρ<1 g·cm -3),混合后溶液中溶质的质量分数w =12(a %+b %)。
②等体积混合a .当溶液密度大于1 g·cm -3时,必然是溶液浓度越大,密度越大,如H 2SO 4、HNO 3、HCl 、NaOH 等多数溶液等体积混合后,质量分数w >12(a %+b %)。
2025届高三高考化学一轮复习基础训练——化学综合计算一、单选题1.N A 为阿伏加德罗常数的值。
下列说法正确的是( )A .18 g H 218O 含有的中子数为10N AB .0.1 mol·L -1HCl 溶液中含有的H +数为0.1N AC .71 g Cl 2与56g Fe 完全反应转移的电子数为2N AD .3.9 g Na 2O 2中含有的共价键的数目为0.1N A2.用A N 表示阿伏加德罗常数的值,下列说法正确的是A .常温常压下,22g 38C H 中所含非极性键数目为2A NB .标准状况下,A N 个溴分子的体积为1LC .标准状况下,22.4L 3CH Cl 中含有的Cl -数为A ND .28g 24C H 与2N 的混合气体含A N 个分子3.NH 4NO 3受撞击时会发生爆炸:432224NH NO 3N 2NO 8H O =↑+↑+。
设A N 为阿伏加德罗常数的值,下列说法正确的是A .1431L1mol L NH NO -⋅溶液中含4NH +数目为A NB .1molN 2中含π键数目为A NC .标准状况下,22.4LH 2O 中含电子数为A 10ND .每生成0.2molNO 2,该反应中转移电子数为A 1.2N4.我国学者首次发现非水相氮还原过程中的多米诺效应。
如图所示,一旦完成反应①,反应②③将自发完成,设A N 为阿伏加德罗常数的值。
下列说法正确的是A .完成反应①时,转移的电子数为A NB .完成反应②时,每消耗2.24L 2N ,此时生成3Li N 的个数为0.2A NC .完成反应③时,每消耗0.3mol H +,此时生成N—H 键的总数为0.3A ND .等物质的量的Li +和H +的电荷数均为A N5.用A N 表示阿伏加德罗常数,下列叙述正确的是A .标准状况下,211.2LH O 含有的分子数为A 0.5NB .常温常压下,A N 个2CO 分子占有的体积为22.4LC .5.6g 铁与足量氯气充分反应,转移电子数为A 0.2ND .常温常压下,1.4g 氮气含有的氮原子数为A 0.1N6.设A N 为阿伏加德罗常数的值。
2023年中考化学二轮复习:综合计算题一.计算题(共25小题)1.(2023•灞桥区校级一模)实验室用68g过氧化氢溶液和2g二氧化锰制取氧气,实验中非气态物质的总质量随时间变化如图所示。
回答下列问题:(1)生成氧气的质量是g。
(2)计算过氧化氢溶液中溶质的质量分数。
(写出计算过程)2.(2022•滨州)化学兴趣小组的同学们要测定某过氧化氢溶液的溶质质量分数。
他们称取50.0g过氧化氢溶液放入盛有2.0g二氧化锰的烧杯(烧杯质量为76.0g)中。
待完全反应后,称量反应后物质连同烧杯的质量为126.4g(氧气逸出带出的水分忽略不计)。
请计算回答。
(1)反应后产生氧气的质量是g。
(2)该过氧化氢溶液的溶质质量分数是多少?3.(2022•德昌县模拟)2022年1月10日,西昌西站正式通车,这也标志着大凉山正式迈入“动车时代”,列车轨道建设中采用的焊接常用铝和氧化铁在高温条件下反应,生成单质铁和氧化铝。
现在施工人员用800g含杂质20%的氧化铁来进行焊接,求最后生成铁的质量是多少?4.(2022•湖北)为了解决能源与环境问题,我国研发出一种新型催化剂,可促进CO2转化为清洁燃料CH4,其反应的化学方程式为:CO2+4H2CH4+2H2O。
理论上22gCO2可以转化为多少克CH4?(请根据化学方程式计算并写出过程)5.(2022•锦州)小明欲测定某胃药主要成分NaHCO3的质量分数。
他取10g该胃药研碎后放入烧杯中,加入90g水后充分搅拌,再向其中滴加稀盐酸至恰好完全反应,共用去稀盐酸33g(药品中的其他成分既不溶于水,也不与稀盐酸反应)。
反应后烧杯内物质的总质量为128.6g。
(提示:NaHCO3+HCl=NaCl+H2O+CO2↑)请计算:(1)生成CO2的质量。
第1页(共37页)。
中考化学专题复习二:综合计算图像型计算题1、某校九年级综合实践活动小组用34g 一定溶质质量分数的过氧化氢溶液和二氧化锰来制取氧气,最后所得气体的物质的量与时间的关系如右图所示。
请计算:(要求写出解题过程) (1)所用溶液中含过氧化氢的物质的量是多少?(2)所用过氧化氢溶液的溶质质量分数为多少?2.某校九年级综合实践活动小组用一定量的溶质质量分数为10%的过氧化氢溶液和二氧化锰来制取氧气,最后所得气体质量与时间的关系如右图所示(1)完全反应后生成氧气的质量为 g 。
(2) 完全反应后生成氧气的物质的量为 mol 。
(3)所用溶液中含过氧化氢的物质的量是多少?(要求写出解题过程)3、碳酸钠和氯化钠的混合物14 g ,常温下溶解在足量的水中。
向溶液中逐滴加入氯化钙溶液,其中碳酸钠与氯化钙反应生成碳酸钙沉淀和氯化钠。
加入氯化钙溶液的质量与生成碳酸钙沉淀的物质的量的关系如图。
(1)图象中表示恰好完全反应的点是____;(2)恰好完全反应时生成CaCO 3沉淀 的物质的量是__________mol ;参加反应 的碳酸钠的物质的量是多少mol ;(过程)(3)原混合物中碳酸钠的质量是多少g 。
根据质量守恒定律进行计算1.取一定质量分数的过氧化氢溶液34g 于烧杯中,加入3g 二氧化锰,完全反应后,称得烧杯内剩余物质的总质量是33.8g ,请根据要求回答下列问题:(1)生成氧气的质量是______________ g 。
(2)所取溶液中过氧化氢的物质的量是多少?(写出计算过程)2.实验室一瓶放置已久的烧碱,因与空气中的CO 2反应生成Na 2CO 3而变质。
为测定该瓶烧 碱中NaOH 含量,某同学取烧碱样品5.0g ,溶于水,配制成20g 溶液;在该溶液中加入20g 稀硫酸(足量)充分搅拌到不再放出气泡为止,称量溶液为39.56g 。
请计算:( Na 2CO 3 + H 2SO 4 → Na 2SO 4 + CO 2↑+ H 2O )① 反应过程中放出的CO 2的物质的量 ,这些CO 2的中含 CO 2分子。