高考热点—NA的相关计算
- 格式:pptx
- 大小:135.39 KB
- 文档页数:20

化学关于钠的计算题目
钠是化学元素,其符号为Na,原子序数为11,原子量为
22.98977。
下面我将从多个角度回答有关钠的计算题目。
1. 计算钠的摩尔质量:
钠的摩尔质量可以通过其原子量来计算,原子量为
22.98977g/mol。
因此,钠的摩尔质量为22.98977克/摩尔。
2. 计算钠的摩尔数:
如果已知钠的质量,可以通过以下公式计算钠的摩尔数:
摩尔数 = 质量 / 摩尔质量。
假设有5克的钠,那么摩尔数为5g / 22.98977g/mol = 0.217摩尔。
3. 计算钠的原子数:
钠的原子数可以通过其摩尔数乘以阿伏伽德罗常数来计算,阿伏伽德罗常数约为6.022 x 10^23。
假设有0.5摩尔的钠,那么原子数为0.5摩尔 x 6.022 x 10^23个/摩尔 = 3.011 x 10^23个。
4. 计算钠化合物的物质的量:
如果需要计算钠化合物的物质的量,可以根据化学方程式中钠的系数与反应物的摩尔数之间的关系来计算。
希望以上回答能够全面解答你关于钠的计算题目。
如果有其他问题,欢迎继续提问。
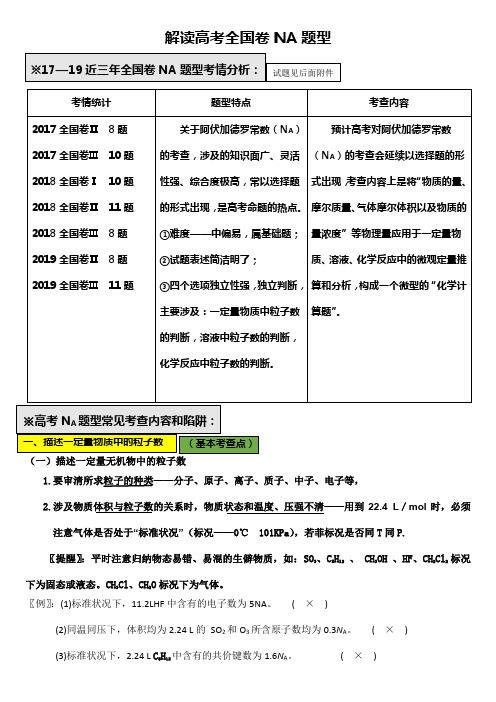
解读高考全国卷NA题型(一)描述一定量无机物中的粒子数1.要审清所求粒子的种类——分子、原子、离子、质子、中子、电子等,2.涉及物质体积与粒子数的关系时,物质状态和温度、压强不清——用到22.4 L/mol时,必须注意气体是否处于“标准状况”(标况——0℃ 101KPa),若菲标况是否同T同P.〖提醒〗:平时注意归纳物态易错、易混的生僻物质,如:SO3、C5H12、 CH3OH 、HF、CH2Cl2标况下为固态或液态。
CH3Cl、CH2O标况下为气体。
〖例〗:(1)标准状况下,11.2LHF中含有的电子数为5NA。
(×)(2)同温同压下,体积均为2.24 L的SO2和O3所含原子数均为0.3N A。
(×)(3)标准状况下,2.24 L C5H12中含有的共价键数为1.6N A。
(×)3.如:①已知质量求原子数:O 2和O 3混合气体 求原子数; NO 2和N 2O 4混合气体 求原子数;N 2、CO 、C 2H 4 混合气体 求原子数或气体体积; CO 2和N 2O 混合气体 求原子数或气体体积; NO 和C 2H 6混合气体 求分子数或气体体积;H 2SO 4和H 3PO 4、CaCO 3和KHCO 3、NaHCO 3和MgCO 3式量相等关系。
例:(1)28 g 乙烯和CO 的混合气体中含有分子数目__1_N A 。
(2)46 g NO 2和N 2O 4的混合物中含有原子数目__3__N A 。
(3)0.25 mol CO 2和SO 2的混合气体中,含有氧原子数目__0.5__N A 。
(4)常温常压下,28 g CO 和N 2的混合气体的分子数为N A ,原子数为2NA 。
( √ ) ②稀有气体为单原子分子;③描述含同位素原子的分子的物质中的分子数、原子数、质子数、中子数、电子数时,注意同位素原子的原子量、是否含中子。
如:D 2O 、H 37Cl 、14CO ,氕(H)例:(1)20 gD 2O 中含有质子数_10__N A ,中子数_10_N A 。

高考中有关“NA”问题的解析及归纳阿伏加德罗常数是物质的量的标准,1mol任何粒子的粒子数叫做阿伏加德罗常数,也就是0.012kg12c中所含有的碳原子数,其符号为n a,通常用6.02×1023mol-1这个近似值来表示。
该知识点一直备受高考的青睐。
此类题目多以选择题的形式出现,涉及的内容主要是通过阿伏加德罗常数与粒子数的关系进行相互转化或进行正误判断。
解答时要正确理解相关物理量的内涵,把握好各物理量的运用范围和使用条件,在分析和计算的基础上进行判断。
例1.(2010年四川,7题). n a表示阿佛加德罗常数的值,下列说法正确的是()a.标准状况下,22.4l二氯甲烷的分子数约为na个。
b.盛有so2的密闭容器中含有n a个氧原子,则so2的物质的量为0.5mol.c.17.6g丙烷中所含有的极性共价键为4n a个.d.电解精炼铜时,若阴极得到电子数为2n a个,则阳极质量减少64g.解析:气体摩尔体是单位物质的量的气体所占的体积积,其研究对象是气体,可有公式pv=nrt计算,气体摩尔体积的数值不是固定不变的,它取决于气体所处的温度和压强,常用的单位有l/mol 和m3/mol。
例如在0℃和101kpa(标准状况)的条件下,气体的摩尔体积约为22.4l/mol;在25℃和101kpa的条件下,气体摩尔体积约为24.5l/mol。
选项a中二氯甲烷在标准状况下是液体,故a错;b选项:由so2的分子式可知1mol二氧化硫中含有2mol 氧原子,n a个氧原子的物质的量为1mol,故b正确。
c选项:一个丙烷分子含有8个c—h极性共价键两个c—c非极性共价键而题目要求计算的是极性共价键,丙烷的物质的量为17.6g÷44g/mol=0.4mol,所含有的极性共价键为0.4×8=3.2mol即3.2n a个,故c错。
d选项中电解精炼铜时阳极为粗铜,粗铜中常含有锌、镍、银、金等杂质,电解时比铜活泼的锌、镍等杂质也失电子,以离子状态进入溶液;银、金等杂质在电解时不溶解,而以小粒状态由阳极上落下,形成所谓的阳极泥。

NA在高考化学中的常见形式■甘肃省玉门市第一中学王凯阿伏伽德罗常量是物理学和化学中的一个重要常量,它的数值为:一般计算时取6.02×1023或6.022×1023,正式的定义是0.012千克碳-12中包含的碳12的原子的数量。
在物理中,阿伏伽德罗常数(符号:NA或L)的定义是一个比值,是一个样本中所含的基本单元数(一般为原子或分子)N与它所含的物质量n(单位为摩尔)间的比值,公式为NA=N/n。
因此,它是联系一种粒子的摩尔质量(即一摩尔时的质量)及其质量间的比例常数。
阿伏伽德罗常量(NA)是学生学习和理解物质的量的有关知识的重要工具,因此,也是高考中的重点内容,但常有学生反映在做此题时不知题目要考查哪些知识点,思维混乱,不易做对,得分不高。
我就高考中NA常见考查形式总结如下,希望对大家有所帮助。
一、考查盐类水解例1:设NA为阿伏伽德罗常数的值,下列叙述正确的是()。
A.100mL l mol•L-1的Na2C03溶液中含有的离子总数为0.3N A。
B.1L1mol/L的NH4CL(aq)中NH4+数目小于N A。
解析:CO32-在水中会发生水解,生成HCO3-和H2CO3,因此阴离子数目会增多,离子总数会大于0.3N A,A错。
NH4+在水中的一部分发生水解,生成一水合氨,因此NH4+数目小于N A,B对。
二、考查氧化还原反应中电子转移的数目例2:设N A表示阿伏伽德罗常数的值,下列说法正确的是()。
A.2.4g镁在二氧化碳中燃烧所转移的电子总数为0.2N A。
B.7.1g Cl2与足量NaOH(aq)反应时转移的电子总数为0.2N A。
解析:2.4g镁与二氧化碳反应,镁的化合价从0价变为+2价,因此0.1mol镁失去0.2mol的电子,A选项正确。
7.1g Cl2与足量NaOH(aq)反应,氯的化合价从0价变为+1价和-1价,是歧化反应,0.1mol氯气转移0.1mol电子,因此B错。


五年高考化学真题分类汇总专题12-有关N A 的计算1.(2017新课标2)阿伏加德罗常数的值为N A 。
下列说法正确的是A .1L0.1mol 1L -NH 4Cl 溶液中,4NH +的数量为0.1N AB .2.4gMg 与H 2SO 4完全反应,转移的电子数为0.1N AC .标准状况下,2.24LN 2和O 2的混合气体中分子数为0.2N AD .0.1molH 2和0.1molI 2于密闭容器中充分反应后,其分子总数为0.2N A2.(2017新课标3)N A 为阿伏加德罗常数的值。
下列说法正确的是A .0.1mol 的11B 中,含有0.6N A 个中子B .pH=1的H 3PO 4溶液中,含有0.1N A 个H +C .2.24L (标准状况)苯在O 2中完全燃烧,得到0.6N A 个CO 2分子D .密闭容器中1molPCl 3与1molCl 2反应制备PCl 5(g ),增加2N A 个P-Cl 键 3.(2017海南)N A 为阿伏加德罗常数的值。
下列叙述错误的是A .1mol 乙烯分子中含有的碳氢键数为4N AB .1mol 甲烷完全燃烧转移的电子数为8N AC .1L0.1molL −1的乙酸溶液中含H +的数量为0.1N AD .1mol 的CO 和N 2混合气体中含有的质子数为14N A4.(2018年新课标1)N A 是阿伏加德罗常数的值,下列说法正确的是A .16.25gFeCl 3水解形成的Fe(OH)3胶体粒子数为0.1N AB .22.4L (标准状况)氨气含有的质子数为18N AC .92.0g 甘油(丙三醇)中含有羟基数为1.0N AD .1.0molCH 4与Cl 2在光照下反应生成的CH 3Cl 分子数为1.0N A5.(2018年新课标2)N A 代表阿伏加德罗常数的值。
下列说法正确的是A .常温常压下,124gP 4中所含P—P 键数目为4N AB .100mL1molL −1FeCl 3溶液中所含Fe 3+的数目为0.1N AC .标准状况下,11.2L 甲烷和乙烯混合物中含氢原子数目为2N AD .密闭容器中,2molSO 2和1molO 2催化反应后分子总数为2N A6.(2019新课标2)已知N A 是阿伏加德罗常数的值,下列说法错误的是A .3g 3He 含有的中子数为1N AB .1L0.1molL −1磷酸钠溶液含有的34PO -数目为0.1N AC .1molK 2Cr 2O 7被还原为Cr 3+转移的电子数为6N AD .48g 正丁烷和10g 异丁烷的混合物中共价键数目为13N A7.(2019新课标3)设N A 为阿伏加德罗常数值。
高考化学一轮重点专题阿伏加德罗常数(N A)的计算与判断阿伏加德罗常数(N A)的考查涉及的化学知识很多,如物质中粒子数,化学键数,溶液中的粒子数,化学反应中粒子数的变化等,是高考命题专家特别关注的考点,全国卷对该考点的考查一直保持着较高频率。
命题点(一)考查气体摩尔体积的使用条件及物质的状态[解题方略]“二看一注意”突破摩尔体积与状态问题陷阱[典例1]N A为阿伏加德罗常数的值,下列说法正确的是________(填序号)。
①22.4 L(标准状况)氩气含有的质子数为18N A。
②在标准状况下,22.4 L HF中含有的原子数为2N A。
③标准状况下,2.24 L CCl4含有的共价键数为0.4N A。
④常温常压下,22.4 L Cl2中含有的分子数为N A。
⑤标准状况下,18 g H2O所含的氧原子数目为N A。
⑥常温常压下,40 g SO3中含2N A个原子。
[对点训练]1.N A为阿伏加德罗常数的值,下列说法正确的是()A.常温常压下,9.5 g羟基(—18OH)中所含的中子数为5N AB.标准状况下,2.24 L C6H12中含有的氢原子数为1.2N AC.1 mol N2与足量H2在一定条件下充分反应生成1.12 L NH3,转移的电子数为0.15N A D.25 ℃,1大气压下,22.4 L CH3Cl中含有的H原子数目为3N A命题点(二)考查一定量的混合物中粒子的数目[解题方略]一定混合物中分子、原子数目的判断①等质量的最简式相同的物质含有的原子数相同,如NO2与N2O4,C2H4与C3H6,O2与O3。
②等质量的摩尔质量相同的物质含有的分子数相同,如N2与CO,CO2与N2O,H2SO4与H3PO4。
③等物质的量的CO2与SO2中氧原子数相同。
[典例2]设N A为阿伏加德罗常数的值,下列说法不正确的是________(填序号)。
①标准状况下,2.24 L N2和O2的混合气体中分子数为0.2N A。
钠及其化合物[考纲要求] 1.知道Na 及其氧化物的性质。
2.能利用Na 及其氧化物分别与水反应的化学方程式进行相关计算。
3.能规范解答以Na 及其氧化物为载体的实验探究、框图推断题。
4.了解Na2CO3和NaHCO3的性质。
5.能正确鉴别Na2CO3和NaHCO3,并能用实验的方法实现它们之间的相互转化。
6.从原子的核外电子排布,理解ⅠA 族元素(单质、化合物)的相似性和递变性。
7.了解碱金属的主要物理性质和化学性质及其应用。
8.了解碱金属及其化合物的典型计算。
9.记住Na 、K 等重要金属元素的焰色反应。
考点一 钠的性质及应用1.钠的物理性质颜色:银白色,有金属光泽;密度:ρ(H2O)>ρ(Na)>ρ(煤油); 熔点:低于100 ℃;硬度:质地柔软,可以用小刀切割。
2.从钠原子的原子结构认识钠的化学性质——还原性Na――――――――→O2、Cl2、H2O 、H +等Na +1(1)与非金属单质(如O2、Cl2)的反应O2⎩⎨⎧常温:4Na +O2===2Na2O 点燃:2Na +O2=====△Na2O2Cl2:2Na +Cl2=====点燃2NaCl(2)与水反应①离子方程式:2Na +2H2O===2Na ++2OH -+H2↑。
②与滴加酚酞的水反应的现象及解释(3)与盐酸反应离子方程式:2Na +2H +===2Na ++H2↑。
3.钠的制取及保存(1)制取:化学方程式为2NaCl(熔融)=====电解2Na +Cl2↑。
(2)保存:密封保存,通常保存在石蜡油或煤油中。
4.钠的用途(1)制取Na2O2等化合物。
(2)钠、钾合金(液态)可用于原子反应堆的导热剂。
(3)用作电光源,制作高压钠灯。
(4)冶炼某些金属金属钠具有强的还原性,熔融状态下可以用于制取金属,如4Na +TiCl4=====熔融4NaCl +Ti 。
说明 工业上在850 ℃,钠与熔融状态的KCl 反应可以制取金属钾:Na(l)+KCl(l)=====850 ℃NaCl(l)+K(g),反应发生是因为在反应温度下,体系中只有钾是气体,能从体系中逸出,利于反应正向进行,即在反应温度下,为熵增反应,该反应不能说明金属钠的还原性强于金属钾! 深度思考1.钠能否保存在CCl4中?答案 否,因为CCl4的密度比钠的大。
有关阿伏伽德罗常数N A的计算题型特点考情分析命题趋势关于阿伏加德罗常数(N A)的考查,涉及的知识面广、灵活性强、综合度极高,常以选择题的形式出现,是高考命题的热点。
2018,全国卷Ⅱ,11T2018,全国卷Ⅰ,10T2017,全国卷Ⅲ,10T2016,全国卷乙,8T预计高考对阿伏加德罗常数的考查会延续选择题的形式,内容上与物质的量、摩尔质量、气体摩尔体积以及物质的量浓度形成联系,构成一个微型的“化学计算题”。
考查的化学核心素养是宏观辨识与微观探析。
分值:6分[解题思维]1.分析已知物理量与物质的量的关系——正确进行换算的前提(1)已知某种物质的质量或物质的量时,则这些数据不受外界条件限制;(2)已知数据是体积时,要关注外界条件是不是标准状况、这种物质是不是气体;(3)已知数据是物质的量浓度或pH时,要关注题目是否给出了溶液的体积。
2.准确把握物质的微观结构和物质变化过程中微粒数目的变化——正确判断微粒数目的前提(1)清楚物质结构中相关微粒之间的数目关系;(2)熟悉物质变化过程中微粒数目的变化关系。
[真题剖析]考向1.气体摩尔体积的适用条件及物质的聚集状态判断正误,正确的划“√”,错误的划“×”。
(1)(2018·全国卷Ⅰ)22.4 L(标准状况)氩气含有的质子数为18N A。
()(2)(2017·全国卷Ⅲ)2.24 L(标准状况)苯在O2中完全燃烧,得到0.6N A个CO2分子。
()(3)(2016·江苏卷)常温常压下,22.4 L Cl2中含有的分子数为N A。
()(4)(2016·四川理综)标准状况下,5.6 L CO2气体中含有的氧原子数为0.5N A。
()答案(1)√(2)×(3)×(4)√误区防错辨“两状”,突破气体与状况陷阱考向2.物质的量或质量与状况判断正误,正确的划“√”,错误的划“×”。
(1)(2018·全国卷Ⅱ)常温常压下,124 g P4中所含P—P键数目为4N A。
专题20N A有关的计算1.【2016年4月浙江省选考】设N A为阿伏加德罗常数的值,下列说法正确的是( ) A.1mol FeI2与1mol Cl2反应时转移的电子数为3N AB.2g H O与D O的混合物中所含中子、电子数目均为N AC.273K、101kPa下,28g乙烯与丙烯混合物中含有C—H键的数目为5N AD.pH=1的H2SO4溶液10L,含H+的数目为2N A【答案】B2.【2015年10月浙江省普通高校招生选考】设N A为阿伏加德罗常数的值,下列说法正确的是( )A.N A个氧分子与N A个氢分子的质量之比为8∶1B.100mL1.0mol·L-1FeCl3溶液与足量Cu反应,转移的电子数为0.2N AC.标准状况下,11.2L CCl4中含有C—Cl键的数目为2N AD.N A个D2O分子中,含有10N A个电子【解析】A、N A个氧分子与N A个氢分子均为1mol,而等物质的量的物质的质量之比等于摩尔质量之比,故氧气和氢气的质量之比为32:2=16:1,故A错误;B、溶液中氯化铁的物质的量n=cV=1mol/L×0.1L=0.1mol,而反应后Fe3+变为+2价,故0.1mol氯化铁转移0.1mol电子即0.1N A个,故B错误;C、标况下,四氯化碳为液态,故不能根据气体摩尔体积来计算其物质的量,故C错误;D、重水中含10个电子,故N A个重水分子中的电子为10N A个,故D正确;故选D。
3.【浙江省2017届高三4月普通高校招生选考】设N A为阿伏加德罗常数的值,下列说法正确的是A.标准状况下,2.24L乙醇中碳氢键的数目为0.5N AB.1L0.1mol·L-1碳酸钠溶液中含有的氧原子数为0.4N AC.0.1mol KI与0.1mol FeCl2在溶液中反应转移的电子数为0.1N AD.0.1mol乙烯和乙醇的混合物完全燃烧所消耗的氧分子数为0.3N A【答案】D4.【2017年下半年浙江省普通高校招生选考】设N A为阿伏伽德罗常数的值,下列说法不.正确..的是A.含0.2mol H2SO4的浓硫酸和足量的镁反应,转移电子数大于0.2N AB.25℃时,pH=3的醋酸溶液1L,溶液中含H+的数目小于0.001N AC.任意条件下,1mol苯中有C—H键的数目一定为6N AD.a mol的R2+(R的核内中子数为N,质量数为A)的核外电子数为a(A-N-2)N A【解析】A.0.2mol H2SO4与镁反应,若生成氢气,转移0.4mol电子,若生成二氧化硫,转移0.4mol电子,因此含0.2mol H2SO4的浓硫酸和足量的镁反应,转移电子数一定大于0.2N A,故A正确;B.25℃时,1L pH=3的醋酸溶液中c(H+) =0.001mol/L,溶液中含H+的数目等于0.001N A,故B错误;C.苯的化学式为C6H6,1mol苯中有C—H键的数目一定为6N A,故C正确;D.R2+(R的核内中子数为N,质量数为A)的核外电子数为A-N-2,则a mol的R2+的核外电子数为a(A-N-2)N A,故D正确;故选B。