金属元素中Al的代表方法
- 格式:doc
- 大小:21.00 KB
- 文档页数:1

金属的晶体结构与晶格常数导语: 金属是一种重要的物质,它们具有许多独特的性质,这些性质与其晶体结构和晶格常数有密切关系。
本文将探讨金属的晶体结构和晶格常数对其性质的影响。
一、金属的晶体结构金属的晶体结构是指金属内原子的排列方式。
一般而言,金属具有紧密堆积的结构,其中原子之间存在共享电子。
金属的晶体结构通常可以分为三类:面心立方(fcc)、体心立方(bcc)和简单立方(sc)。
1. 面心立方(fcc)面心立方是指金属晶体中每个晶胞的角和面上都有原子存在。
面心立方晶体结构的最典型代表是铜(Cu),银(Ag)和金(Au)。
这种结构的晶胞内有四个原子,每个原子都与六个相邻原子相接触。
2. 体心立方(bcc)体心立方是指金属晶体中每个晶胞的体心位置有一个原子。
体心立方晶体结构的典型代表是铁(Fe)和钨(W)。
这种结构的晶胞内有两个原子,每个原子都与八个相邻原子相接触。
3. 简单立方(sc)简单立方是指金属晶体中每个晶胞的角上都有一个原子。
简单立方晶体结构的典型代表是铝(Al)和锶(Sr)。
这种结构的晶胞内只有一个原子。
二、金属的晶格常数晶格常数是指晶体中单位晶胞的长度。
晶格常数不仅受金属元素种类的影响,还受温度、外界压力等因素的影响。
1. 晶格常数的测定晶格常数的测定可以通过多种方法进行,如X射线衍射、电子衍射和中子衍射等。
这些方法可以通过测量衍射图案的位置和强度来确定晶格常数。
2. 缺陷对晶格常数的影响晶格常数受到晶体中存在的缺陷的影响。
晶体缺陷包括点缺陷、线缺陷和面缺陷。
点缺陷是指晶体中原子位置的偶尔出现的缺失或替代,线缺陷是晶体中一条原子排列错位的行,面缺陷是晶体中断开或错位的面。
这些缺陷会引起晶体结构的畸变,从而影响晶格常数的数值。
三、金属晶体结构和晶格常数对性质的影响1. 密堆度和空隙率金属的晶体结构和晶格常数影响了其密堆度和空隙率。
密堆度是指晶体中实际占有的原子体积与整个晶胞体积的比值。
空隙率是指晶体中空隙的体积与晶胞体积的比值。

美国金属材料牌号表示方法简介一、美国有色金属的牌号表示方法1. 某些有色金属及合金的牌号表示方法美国有色金属牌号中涉及的标准比较多,主要有如下几种:ANSI 美国国家标准AMS 航天材料规格(美国航空工业最常用的一种材料,由SAE制定)ASTM 美国材料与试验协会标准MIL 美国军用标准QQ 美国联邦政府标准RWMA 美国电阻焊接机制造商协会标准SAE 美国机动车工程师协会标准1975 年起美国又采用了铝业协会(AA )、铜业发展协会(CDA )表示方法。
美国材料与试验协会和美国机动车工程师还共同研究制定了“金属和合金统一数字编号系统(UNS 系统)”。
合金元素字母代号及名称、某些有色金属及合金的牌号表示方法见下列各表。
合金元素字母代号及名称某些有色金属及合金的牌号s2. UNS 编号系统UNS 是“UNIFIED NUMBERING SYSTEM ”(统一编号系统)的缩写。
这是由美国机动车工程师学会(SAE )和美国材料与试验协会(ASTM )于1967 年共同开始设计的一种简便的编号系统,其目的在于代替或补充现行各标准组织的材料牌号系统和各生产厂的商品名称。
目前该编号系统已在SAE 和ASTM 标准中形成文件加以详细说明。
其SAE 标准号为T1086 ;ASTM 标准号为E527 。
名称为“金属和合金编号推荐方法(UNS )”。
该UNS 编号系统便于读者了解许多相似牌号之间的关系和对照使用各种材料的编号。
但要说明的是,具有同一UNS 编号的金属材料,并不表示他们的化学成分完全相同,只能是相似。
此外,相应标准在不断修订,其化学成分也可能有改变。
由于UNS 编号系统基本上是反映美国的状况,目前UNS 编号数量还有限,加上各国的资源、合金化特点、要求等方面情况不同,所以,除美国以外的其他许多国家的牌号,尚不能在UNS 编号系统中找到相同或相似的牌号。
UNS 系统共分18 大类。
编号由前置字母和五位数组成。
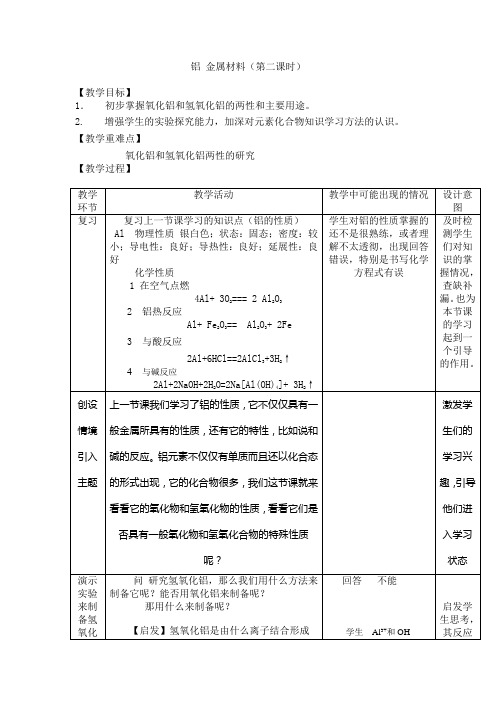
铝金属材料(第二课时)
【教学目标】
1.初步掌握氧化铝和氢氧化铝的两性和主要用途。
2.增强学生的实验探究能力,加深对元素化合物知识学习方法的认识。
【教学重难点】
氧化铝和氢氧化铝两性的研究
【教学过程】
【板书】
氢氧化铝制取:不溶于水的白色胶状物质
AlCl3 + 3NH3.H2O = Al(OH)3 +3 NH4Cl
性质:
Al(OH)3 + H+ = Al3+ + 3H2O
Al(OH)3 + OH- = [Al(OH)4]-
性质
Al2O3 + 6H+ = 2Al3+ + 3H2O
Al2O3 + 2OH- + 3H2O = [Al(OH)4]-
【教学反思】
本节课主要采取实验、探究、启发教学方法,让学生对铝的化合物性质能认识得更深入、更透彻,增强学生的实验探究能力。
在课堂环节中注重学生的主体地位,教师引导学生参与课堂教学中,但学生对 [Al(OH)4]-比较陌生,因此在理解和书写化学方程式是可能有点困难,多做点课后习题进行练习。
【课堂作业】
在m mL b mol·L-1 AlCl3溶液中,加入等体积a mol·L-1的NaOH溶液。
(1)当a≤3b时,生成Al(OH)3沉淀的物质的量是________mol。
(2)当a、b满足________条件时,无沉淀生成。
(3)当a、b分别满足______________条件时,有沉淀生成且溶液中无Al3+存在,生成Al(OH)3沉淀的物质的量是________。

比较元素金属性强弱的八种方法元素的金属性是指元素的原子失电子能力,判断元素金属性强弱,主要可从以下几方面来判断。
一、依金属活动顺序表判断金属活动顺序表中,一般位置越后的金属,金属性越弱,原子的还原性越弱。
例外:金属活动性:Sn>Pb,但元素的金属性:Pb > Sn。
二、依元素周期表判断1.同一周期,从左到右:原子的还原性逐渐减弱,氧化性逐渐增强;其对应的离子的氧化性逐渐增强,还原性逐渐减弱。
2.同一主族,从上到下:原子的还原性逐渐增强,氧化性逐渐减弱;其对应的离子的氧化性逐渐减弱,还原性逐渐增强。
三、根据金属原子失电子吸收的能量判断元素的原子或离子得到或失去电子时必然伴随着能量的变化,就金属原子失电子而言,在一定条件下,失电子越容易,吸收的能量越少,失电子越难,吸收的能量越多,故根据金属原子在相同条件下失电子时吸收能量的多少可判断金属元素的金属性强弱四、根据元素的最高价氧化物水化物的碱性强弱判断如碱性:LiOH<NaOH<KOH<RbOH,则有还原性大小关系为:Li<Na<K<Rb。
再如:NaOH为强碱,Mg(OH)2为中强碱,Al(OH)3为两性氢氧化物,则金属性强弱顺序为:Na> Mg>Al。
五、根据金属单质与水或酸反应置换出氢的难易判断与水反应越易、越剧烈的金属单质,其原子越易失电子,该金属活泼性越强,如Na与冷水剧烈反应,Mg与热水反应,与冷水不反应,Al与热水反应很慢,则金属性:Na> Mg>Al。
Fe 与盐酸反应放出氢气,Cu与稀盐酸不反应,则金属性:Fe>Cu。
六、依电化学中电极来判断1.就原电池而言:负极金属是电子流出的极,正极金属是电子流人的极,其还原性:负极>正极2.就电解而言:电解过程中离子放电情况为:阴极:Ag+>Hg2+>Fe3+>Cu2+(氧化性) ,则元素金属性与之相反。

第五讲 表示物质的符号 答案1.元素符号:通常用该元素的拉丁文的 第一个字母大写 来表示。
例:磷的拉丁文名称Phosphorum ,它的元素符号是 P ;氮的拉丁文名称Nitrogenium 它的元素符号是 N ;氢的拉丁文名称Hydrogenium ,它的元素符号是 H 。
思考:那如果两个元素符号的拉丁文的第一个字母相同怎么办?例:氦的拉丁文名称Helium ,它的元素符号是 He ;钠的拉丁文名称Natrium ,它的元素符号是 Na 。
元素名称 氢 氦 锂 铍 硼 碳 氮 氧 氟 氖 核电荷数 1 2 3 4 5 6 7 8 9 10 元素符号 H He Li Be B C N O F Ne 元素名称 钠 镁 铝 硅 磷 硫 氯 氩 钾 钙 核电荷数 11 12 13 14 15 16 17 18 19 20 元素符号NaMgAlSiPSClArKCa元素名称 锰 铁 铜 锌 溴 银 碘 钡 汞 铅 核电荷数 25 26 29 30 35 47 53 56 80 82 元素符号 Mn Fe Cu Zn Br Ag I Ba Hg Pb 碳 锰 钙 镁 氯 汞 钠 C MN CA Ma CL Hg Ne √ Mn Ca Mg Cl √ Na2.元素符号表示的意义: ①宏观 一种元素②微观 这种元素的原子③宏观 某种物质 ( 对于原子构成的单质 )例:氢元素符号H 的意义:① 氢元素 ;② 一个氢原子 。
Fe 的意义:① 铁元素 ;② 一个铁原子 ;③ 铁这种物质 。
思考:有人说,“2N ”既表示两个氮原子,也表示两种氮元素,你同意吗? 不同意;元素不讲个数3.元素符号周围数字的意义: H 2中的2表示 1个氢分子种有2个氢原子 。
2H 中的2表示 2个氢原子 。
2O 2中的2表示 2个氧分子 、 1个氧分子中有2个氧原子 。
4.元素周期表的建立者 门捷列夫 。
周期表中 原子序数 = 核电荷数 = 质子数 。

铝的最高价氧化物对应的水化物
铝元素最高价氧化物:Al₂O₃(三氧化二铝),铝元素最高价氧化物水化物:Al(OH)₃(氢氧化铝,显两性)。
铝是一种金属元素,元素符号为Al,是一种银白色轻金属。
有延展性。
商品常制成棒状、片状、箔状、粉状、带状和丝状。
铝简介
在潮湿空气中能形成一层防止金属腐蚀的氧化膜。
铝粉在空气中加热能猛烈燃烧,并发出眩目的白色火焰。
易溶于稀硫酸、硝酸、盐酸、氢氧化钠和氢氧化钾溶液,难溶于水。
相对密度2.70。
熔点660℃。
沸点2327℃。
铝元素在地壳中的含量仅次于氧和硅,居第三位,是地壳中含量最丰富的金属元素。
航空、建筑、汽车三大重要工业的发展,要求材料特性具有铝及其合金的独特性质,这就大大有利于这种新金属铝的生产和应用。
应用极为广泛。
铝跟金化学反应以铝跟金化学反应为题,首先需要了解铝和金的化学性质。
铝是一种常见的金属元素,具有良好的导电性和导热性,同时也具有一定的化学活性。
金则是一种贵金属,具有良好的耐腐蚀性和稳定性。
在常温下,金不会与大多数物质发生反应。
然而,在一定的条件下,铝和金也可以发生化学反应。
这种反应主要是铝与金的氧化反应,即铝与金氧化物反应生成相应的金属产物和氧化物。
铝和金的氧化反应可以通过加热铝金属与金氧化物在高温下进行。
在这个过程中,铝金属会与金氧化物发生反应,产生金属金和铝氧化物。
这个反应的化学方程式可以表示为:2Al + 3Au2O3 → 6Au + Al2O3这个化学方程式表示了铝与金氧化物反应后生成的产物。
其中,左边的2Al代表2个铝原子,3Au2O3代表3个金氧化物分子。
右边的6Au代表6个金原子,Al2O3代表铝氧化物。
这个反应是一个氧化还原反应,其中铝原子失去电子成为Al3+离子,被氧化。
而金氧化物中的金离子则接受这些电子,被还原成金原子。
铝和金的氧化反应在实际应用中有一定的意义。
例如,这个反应可以用于提取金属金。
在炼金过程中,可以通过加热铝与金氧化物反应,将金离子还原成金原子,从而分离出金属金。
这种方法可以在实验室中进行,也可以应用于工业生产中。
铝和金的氧化反应还可以应用于材料科学领域。
由于铝和金反应后生成的铝氧化物具有良好的氧化性能和热稳定性,可以作为一种重要的材料。
铝氧化物在高温下具有较高的熔点和硬度,因此可以用于制备耐高温材料。
同时,铝氧化物也具有良好的绝缘性能和导电性能,可以应用于电子器件中。
铝和金之间的化学反应主要是铝与金氧化物的氧化还原反应。
这个反应可以用于提取金属金,也可以应用于材料科学领域。
通过了解铝和金的化学性质,我们可以更好地理解这个反应的过程和应用。
mxene制备方程式
MXene是一种新型的二维材料,具有优异的电化学性能和储能性能,
在能量存储领域有广阔的应用前景。
现将MXene的制备方法归纳如下:1. MAX相合成
MXene的制备离不开MAX相的合成,其中M代表过渡金属元素,A
代表主族元素(如Al,Si),X代表C和N。
MAX相的制备一般采用
高温固相反应法,具体反应方程式如下:
M(s)+ X2(g)+ MAX(s)→MX(s)+ MgX2(s)
4 M(s)+ 2 X2(g)+ 3 A2O3(s)→2 MAX(s)+ 6 MO(s)
2. 氟化反应
将制备好的MAX相样品切成薄片,并在氢氟酸和硝酸的混合溶液中浸泡,经过氢氟酸的脱氧氟化反应和硝酸的脱氧反应后,得到MXene。
反应方程式如下:
MAX(s)+ n[H+](aq)+ 2 nF-(aq)→Mn+X2F2(s)+ nA+(aq)3. 水解反应
将制备好的MXene样品在酸性环境中进行水解反应得到层状的MXene,反应方程式如下:
Mn+X2F2(s)+ (2n+1)H2O(l)→M(OH)2nX2(s)+ 2nHF(aq)
4. 清洗和离子交换
将制备好的MXene样品进行多次的清洗和离子交换,去除杂质和离子,获得高质量的MXene材料。
总之,MXene的制备过程虽然繁琐,但是能够获得优异的电化学性能
和储能性能,对于能量存储领域能够做出重大贡献。
高中化学al知识点总结一、原子结构与元素周期律1. 原子组成:原子由原子核和核外电子组成。
原子核包含质子和中子,质子带正电,中子不带电。
核外电子围绕原子核运动,形成电子云。
2. 原子序数与质量数:原子序数等于核内质子数,也等于核外电子数,决定了元素的化学性质。
质量数等于质子数与中子数之和。
3. 电子排布:电子按照能量级和亚层排布在原子周围,遵循奥布特原理、泡利不相容原理和洪特规则。
4. 元素周期表:元素按照原子序数递增排列,分为s区、p区、d区和f区元素。
周期表中的元素按照周期和族分类,具有相似的化学性质。
5. 元素周期律:元素的性质随着原子序数的增加呈现周期性变化。
同一族的元素具有相似的化学性质,同一周期的元素化学性质从左到右逐渐变化。
二、化学键与分子结构1. 化学键的形成:化学键是由原子间相互作用形成的,主要包括离子键、共价键和金属键。
2. 离子键:正负离子通过静电吸引力形成的化学键。
通常在活泼金属和活泼非金属之间形成。
3. 共价键:两个或多个非金属原子通过共享电子对形成的化学键。
共价键可以是单键、双键或三键。
4. 分子的几何结构:分子中原子的排列方式决定了分子的几何形状,如VSEPR理论可以预测分子的空间构型。
5. 分子间力:分子间存在着范德华力、氢键等非共价相互作用力,影响物质的物理性质。
三、化学反应原理1. 化学反应的类型:包括合成反应、分解反应、置换反应、还原-氧化反应等。
2. 化学反应速率:反应速率受反应物浓度、温度、催化剂等因素的影响。
速率定律和阿累尼乌斯方程描述了反应速率与这些因素的关系。
3. 化学平衡:可逆反应达到动态平衡时,正逆反应速率相等。
平衡常数K描述了平衡时反应物和生成物的浓度关系。
4. 酸碱理论:布朗斯特-劳里酸碱理论认为凡是能够提供质子的物质都是酸,能够接受质子的物质都是碱。
5. 氧化还原反应:氧化还原反应中,物质间发生电子转移。
氧化剂获得电子被还原,还原剂失去电子被氧化。
al的分子量导言:al的分子量是指铝(Aluminum)原子的相对分子质量。
在化学领域,了解元素的分子量对于研究物质的性质和反应过程非常重要。
本文将介绍al的分子量的计算方法、应用以及一些有关al的分子量的有趣信息。
一、al的分子量的计算方法:1. 元素的相对原子质量:铝的相对原子质量是26.98。
2. 计算方法:根据al的相对原子质量,将其单位由原子转换为克/摩尔即可得到分子量。
因此,al的分子量为26.98 g/mol。
二、al的分子量的应用:1. 化学实验:在化学实验中,al的分子量可以用于计算反应物和生成物的摩尔比例,从而方便量取和计算溶液的浓度。
2. 药物研究:al的分子量对于药物研究和开发也是至关重要的。
了解药物分子的分子量可以对其药代动力学、药效学等进行分析和评估,为药物设计和研发提供基础数据。
3. 材料科学:在材料科学领域,了解al的分子量可以帮助科学家研究和设计新型材料,探索其结构、性质和应用。
4. 日常生活:al广泛应用于日常生活中,如食品包装、建筑材料、航空航天等。
了解其分子量有助于了解材料的性能和用途。
三、有趣的al的分子量相关信息:1. 铝的发现:铝是一种常见的金属元素,由于其抗腐蚀、导电、轻盈等特性,广泛用于各种领域。
它是1825年由弗里德里希·奥斯卡·威勒发现的。
2. 抗氧化性质:铝具有较好的抗氧化性质,这使得它成为一种常用的包装材料。
铝箔常用于食品包装中,可以保持食物的新鲜和温度。
3. 铝的轻盈性:铝是一种相对轻盈的金属,其密度为2.7 g/cm³。
这使得它成为航空航天领域的重要材料,用于制造飞机、火箭等。
4. 铝合金:由于铝本身的柔软性,常常与其他金属进行合金化,以增加其强度和硬度。
铝合金在汽车、航空器和其他运输工具中得到广泛应用。
结论:al的分子量是26.98 g/mol,计算方法基于铝的相对原子质量。
了解al的分子量对于化学实验、药物研究、材料科学以及日常生活中的应用都具有重要意义。
金属元素中Al的代表方法
1、Alt代表的是钢中的全铝含量;
2、Als代表的是钢中的酸溶铝含量。
3、钢中的铝,分酸溶铝和酸不溶铝,酸不溶铝Alo=Alt一Als
4、测定铝含量时,用化学分析是用酸溶解,金属铝、氮化铝、硫化铝一般能溶于酸中,称为酸溶铝,而氧化铝及尖晶石等常不溶于酸称为酸不溶铝。
我们平时测量的铝一般都是酸溶铝。
但是一般不要求进行这方面的测量,只有一些特钢才有这方面的要求。
5、一般要求酸溶铝与全铝的比值大于90%。
Alt、Als含量相差越大,说明夹杂物越多。
6、sol-Al,可能是指溶胶铝。