菌株鉴定
- 格式:docx
- 大小:2.51 MB
- 文档页数:4

细菌基因组的提取:1 快速微量提取法A.取1.5ml菌体培养物于一灭菌Ep管中,12000rpm离心1min, 丢去上清夜,收集菌体。
B.加入400ul裂解液(40mM Tris-醋酸,20mM醋酸钠,1mM EDTA,1%SDS,pH7.8)混匀,置于37℃水浴1hr。
C.然后加入200ul 5mol/L的氯化钠溶液,混匀后于13000rpm离心15min。
D.取上清液,用苯酚抽提2次,氯仿抽提1次。
E.加两倍体积无水乙醇,1/10体积醋酸钾(3M ,pH8.0),-20度保存1小时后,13000rpm离心15min,弃上清液,沉淀用70%乙醇洗2次;置于室温干燥后,溶于50ul TE溶液中,置4℃保存备用。
2 蛋白酶/SDS法制备先用10ml含适当抗生素的GBM过夜培养Delftia sp.,第二天4000rpm离心10min收集菌体,用Washing TE (50mmol/LTris-HCl pH8.0,10mmol/LEDTA pH8.0)洗菌体2次,之后将菌体充分悬浮在5ml 1×TE缓冲液中,先后加入0.5ml 5mg/L的蛋白酶、0.5ml 10% SDS,轻轻混匀后50℃放置3h~5h,接着用等体积的Tris饱和苯酚抽提2次,苯酚/氯仿/异戊醇抽提一次,氯仿抽提一次后,乙醇沉淀DNA,用自动移液器吸管头将絮状DNA沉淀块吸附到Ep 管中,70%乙醇洗2次,干燥后溶于适当1×TE或ddH2O中。
3(1) 细菌培养:细菌接种于5ml液体培养基中,37℃摇床(300rpm)培养过液。
(2) 细菌收集:取1ml培养物于1.5ml EP管中,室温8000rpm离心5min,弃上清,沉淀重新悬浮于1ml TE(pH8.0)中(用ddH2O也行)。
(3) 菌体裂解:加入6μl 50mg/ml的溶菌酶,37℃作用2h。
再加2mol/LNaCl50μl,10%SDS 110μl,20mg/ml的蛋白酶K 3μl,50℃作用3h或37℃过夜。
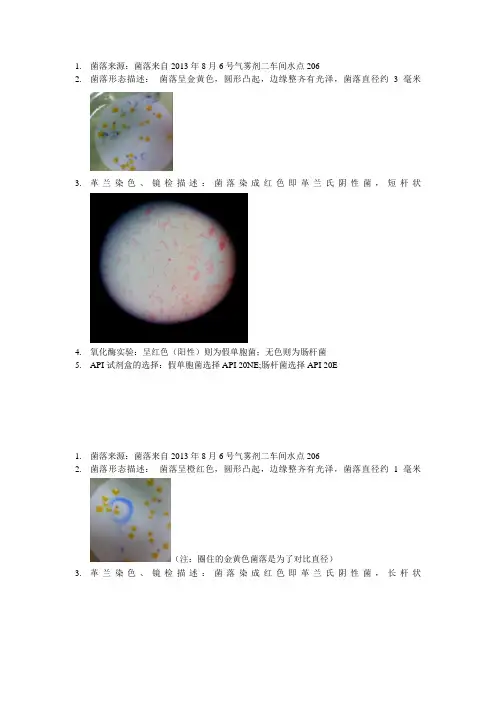
1.菌落来源:菌落来自2013年8月6号气雾剂二车间水点206
2.菌落形态描述:菌落呈金黄色,圆形凸起,边缘整齐有光泽,菌落直径约3毫米
3.革兰染色、镜检描述:菌落染成红色即革兰氏阴性菌,短杆状
4.氧化酶实验:呈红色(阳性)则为假单胞菌;无色则为肠杆菌
5.API试剂盒的选择:假单胞菌选择API 20NE;肠杆菌选择API 20E
1.菌落来源:菌落来自2013年8月6号气雾剂二车间水点206
2.菌落形态描述:菌落呈橙红色,圆形凸起,边缘整齐有光泽,菌落直径约1毫米
(注:圈住的金黄色菌落是为了对比直径)
3.革兰染色、镜检描述:菌落染成红色即革兰氏阴性菌,长杆状
4.氧化酶实验:呈红色则为假单胞菌;无色则为肠杆菌
5.API试剂盒的选择:假单胞菌选择API 20NE;肠杆菌选择API 20E
若镜检为紫色,球形,则做触媒实验,触媒实验为阴性(不产生气泡),API试剂盒选用API Staph;触媒实验为阴性则判断非葡萄球菌。
若镜检为紫色,芽孢状
,API 试剂盒则选用API CHB/E
若镜检为较大形态的球状
,API 试剂盒则选择API C AUX。


菌种鉴定方法大全一、金开瑞菌种鉴定服务简介在细菌/真菌的16/18SrDNA中有多个区段保守性,根据这些保守区可以设计出细菌/真菌通用引物,扩增出细菌/真菌的16/18SrDNA片。
因此,16/18SrDNA可以作为细菌/真菌群落结构分析最常用的系统进化标记分子。
该鉴定手段试用于单种鉴定或者少量混杂菌种鉴定。
金开瑞拥有多种配套的通用菌种鉴定引物,实验周期短,可以帮您快速实现菌种鉴定。
服务流程引物设计合成—PCR扩增16/18S rDNA/ITS—PCR产物纯化—测序,序列比对分析客户提供基因组DNA:要求基因组DNA的浓度≥100 ng/μl,总体积≥20 μl,且无明显降解;平板或斜面:经菌种分离后带有单菌落的新鲜平板或斜面。
最终交付测序结果,BLAST比对得到细菌种属名称服务内容及说明服务名称服务周期(工作日)原核生物/16SrDNA5-7真核生物/18SrDNA5-7真菌ITS序列分析5-7二、菌种鉴定方法介绍(1)常规鉴定常规鉴定内容有形态特征和生理生化特征。
形态特征包括显微形态和培养特征;理化特性包括营养类型、碳氮源利用能力、各种代谢反应、酶反应等。
(2)BIOLOG碳源自动分析鉴定BIOLOG鉴定系统以微生物对不同碳源的利用情况为基础,检测微生物的特征指纹图谱,建立与微生物种类相对应的数据库。
通过软件将待测微生物与数据库参比,得出鉴定结果。
该系统已获美国FDA认可,已逐步应用于食品和饮品企业、环保、海洋生物/水产品、制药、农业微生物、生物治理、化妆品、临床等领域的微生物鉴定试验中。
BIOLOG是一种微生物菌种快速鉴定系统,涉及革兰氏阴性菌、革兰氏阳性菌、厌氧菌、酵母、丝状真菌在内近2000种微生物。
(3)分子生物学鉴定应用分子生物学方法从遗传进化角度阐明微生物种群之间的分类学关系,是目前微生物分类学研究普遍采用的鉴定方法。
CICC拥有微生物菌种分类鉴定的分子生物学实验室,配有PCR仪、高速冷冻离心机、电泳仪、HPLC、凝胶成像系统、紫外控温分析系统等先进仪器设备,以及DNAMAN、BIOEDIT、CLUSTALX、TREEVIEW等序列分析软件。

菌种鉴定方法及步骤菌种鉴定是指通过对菌株样本进行系统学、形态学、生理学和生化学等各方面的观察与检测,以确定其属、种分类地位的过程。
菌种鉴定方法及步骤如下:2.制备纯培养物:分离并得到纯培养菌株,避免混杂的现象。
3.形态学观察:观察菌株的形态特征,包括菌落形态、菌落颜色、菌丝生长特征等。
4.微观形态学观察:观察菌株的细胞形态、孢子形态、菌丝形态等。
5.分类地位确定:通过对菌株的形态特征进行比对和研究,确定其属、种分类的地位。
1.生长条件观察:观察菌株在不同的生理因素(如温度、pH值、氧气含量等)下的生长情况。
2.营养需求观察:观察菌株在不同营养物质(如碳源、氮源等)的利用情况,以及对不同抗生素和化学物质的敏感性。
3.生化特征检测:进行生化试验,如氧化酶试验、氧化发酵试验、内酯酶试验等,以检测菌株的生化特征。
4.产物检测:检测菌株的代谢产物,如抗生素、酶等,以判断其代谢途径和功能。
1.提取菌株基因组DNA:通过细菌培养物提取菌株的基因组DNA。
2.PCR扩增:使用特异性引物进行PCR扩增,选择适当的靶基因进行扩增。
3.DNA测序及分析:对扩增的DNA产物进行测序,利用生物信息学方法对测序结果进行分析和比对。
4.基因序列比对:将测序结果与数据库中已知菌种的基因序列进行比对,以确定菌株的分类地位。
四、传统鉴定方法的优缺点1.优点:传统鉴定方法操作简单,成本低廉;不需要复杂设备,适用于一般实验室进行菌株鉴定。
2.缺点:传统鉴定方法对菌株鉴定仅限于形态学、生理学和生化学等方面的观察,鉴定结果存在一定的主观性和局限性;需要较长的时间才能得到鉴定结果。
五、分子生物学鉴定方法的优势1.高精确性:分子生物学鉴定方法通过对菌株的基因序列进行比对,可得到较高的精确性,减少了主观性和局限性。
2.快速性:分子生物学鉴定方法在提取DNA和PCR扩增等步骤后,可以迅速得到鉴定结果,节省了时间。
3.可靠性:分子生物学鉴定方法的结果具有较高的可靠性,有助于解决传统鉴定方法在分类地位判断方面的困难。

菌种检定操作规程
《菌种检定操作规程》
一、目的
菌种检定操作规程旨在规范菌种检定过程,确保检定结果准确可靠,保障实验室菌种质量。
二、适用范围
本规程适用于各类实验室对菌种进行检定的操作。
三、设备和试剂
1. 必备设备:无菌工作台、培养箱、平板计数器等。
2. 必备试剂:琼脂培养基、生理盐水、甘油等。
四、菌种检定操作流程
1. 取样准备:将待检菌种进行悬浮液制备或直接取样,保证单一菌种在接种时的质量。
2. 培养基接种:将取样溶液均匀涂敷于琼脂培养基表面,将琼脂培养基放入培养箱进行培养。
3. 孵化:将接种后的琼脂培养基置于培养箱中,进行相应的温度和时间的培养。
4. 菌落计数:使用平板计数器对菌落进行计数,记录结果。
5. 结果分析:根据计数结果,对菌种进行鉴别和鉴定。
五、结果确认与报告
1. 只有经过两名以上实验人员的确认,结果方可出具。
2. 将检定结果填写在检定记录表上,并进行备份存储。
六、质量控制
1. 定期对实验室设备和试剂进行检验、校正。
2. 定期进行内部质量控制,对检定结果进行复核和比对。
七、附则
1. 对于异常情况的处理:出现异常结果时,要及时进行排查并记录处理过程。
2. 本规程未尽事宜,由实验室主管负责进行详细规定。
以上即为《菌种检定操作规程》的内容,希望各实验室严格按照此规程进行菌种检定工作,确保实验室菌种质量及检定结果的准确性。


细菌鉴定的方法和步骤
细菌鉴定是通过一系列方法和步骤来确定细菌菌种的过程。
以下是常用的细菌鉴定方法和步骤:
1. 收集样品:从目标环境或感染部位收集细菌样品,如血液、尿液、唾液、食物等,以便后续实验。
2. 培养:将细菌样品接种到适当的培养基上,提供足够的营养物质和环境来促进细菌的生长。
3. 纯化:将单个细菌菌落分离出来,并通过连续的传代培养使其得到纯化,以避免不同细菌种类的混杂。
4. 形态观察:观察细菌在固体培养基上的形态特征,如菌落的形状、颜色、大小等,以及在显微镜下的细胞形态,如形状、大小、结构等。
5. 染色:将细菌样品进行染色,如革兰氏染色、抗酸染色等,以便观察不同细菌的染色特征。
6. 生理生化试验:进行一系列生理生化试验,如代谢产物的产生、酶活性、氧需求等,以确定细菌的代谢特征。
7. 耐受性检测:测试细菌对温度、pH值、氧气和抗生素等环境因素的耐受性,以进一步确认鉴定结果。
8. 分子生物学分析:利用分子生物学技术,如PCR、序列分析等,通过对细菌的基因组或特定基因进行分析,来确定细菌的物种。
9. 鉴定结果:根据以上步骤的结果和参考文献,将细菌归类到已知的菌属或菌种中,最终得出细菌的鉴定结果。
需要注意的是,细菌鉴定是一个复杂的过程,通常需要准备鉴别试剂和设备,以及具备相关实验操作的技术和经验。


菌种鉴定篇一:菌种鉴定中国工业微生物菌种保藏管理中心CICC是我国唯一的国家级工业微生物菌种保藏管理中心,有近三十年菌种分类鉴定的历史,拥有先进的生物科学仪器和从事分类鉴定的专业化人员队伍。
CICC承担全国工业微生物菌种的委托鉴定工作,所提供的菌种鉴定与评价技术服务获得“国家工商总局(SCIC)经营许可”,为国内科研机构、大专院校和生产企业等提供微生物菌种鉴定服务,涉及细菌、酵母、放线菌和丝状真菌等多类微生物。
菌种鉴定手段包括形态学观察、生理生化特性鉴定、 BIOLOG碳源自动分析鉴定、分子生物学鉴定、API细菌数值鉴定、功能性分析及功能基因、RAPD、SSCP、TLC薄层层析、全细胞脂肪酸分析鉴定、(G+C)mol%测定、DNA/DNA同源性测定等。
鉴定项目序号服务项目菌种类别1 纯菌种鉴定(包含形态、理化、分子)细菌、酵母、放线菌、丝状真菌2 功能基因鉴定(pheS、gryA、atpD等)乳杆菌、芽胞杆菌、双歧杆菌3 产品微生物解析――4 产品污染菌种鉴定――5 菌群分析及纯种分离――6 细胞壁化学组分分析(氨基酸)细菌、放线菌7 细胞壁化学组分分析(糖)细菌、放线菌8 DNA(G+C )mol%含量细菌、放线菌9 DNA/DNA杂交细菌、酵母、放线菌、丝状真菌 10 脂肪酸分析细菌、放线菌11 其它――鉴定手段(1)常规鉴定常规鉴定内容有形态特征和理化特性。
形态特征包括显微形态和培养特征;理化特性包括营养类型、碳氮源利用能力、各种代谢反应、酶反应和血清学反应等。
(2)BIOLOG碳源自动分析鉴定BIOLOG鉴定系统以微生物对不同碳源的利用情况为基础,检测微生物的特征指纹图谱,建立与微生物种类相对应的数据库。
通过软件将待测微生物与数据库参比,得出鉴定结果。
该系统已获美国FDA认可,已逐步应用于食品和饮品企业、环保、海洋生物/水产品、制药、农业微生物、生物治理、化妆品、临床等领域的微生物鉴定试验中。

菌种质量鉴定的标准
菌种质量鉴定的标准是根据相关规定和标准来评估菌种的纯度、活力、稳定性以及一致性。
以下是一般菌种质量鉴定的标准:
1. 纯度:菌种应为单一菌株,不含其他菌株、杂质和异种菌。
纯度可通过传统的细菌培养和观察、鉴别试验、形态学特征、生理生化指标等方法进行评估。
2. 活力:菌种应具有良好的生长和繁殖能力,保持一定的活力和稳定性。
活力可通过菌种在适宜的培养基上生长繁殖情况、生长速度、菌体形态等进行评估。
3. 稳定性:菌种应在传代培养过程中保持稳定性,即具有相对稳定的遗传特性和生理特性,并且不易发生突变。
稳定性可通过连续传代培养、基因测序、酶活性测定等方法进行评估。
4. 一致性:同一批次的菌种应具有一致的性状和功能特性。
一致性可通过对同一批次菌种进行多次培养和鉴定,观察其生长情况、形态特征、代谢产物等进行评估。
综上所述,菌种质量鉴定的标准主要包括纯度、活力、稳定性和一致性等方面的评估。
这些标准有助于确保菌种质量的稳定性和可靠性,保证其在科研、生产和应用中的可信度和有效性。
怎样鉴定菌种的质量菌种生产是食用菌栽培的重要一环,没有优良菌种,就得不到优质高产。
因此,菌种在扩大培养或实际使用时,必须做好菌种鉴定工作。
菌种鉴定概括为两方面:一是鉴定所持菌种是否所需要的菌种,二是鉴定菌种的质量。
鉴别是否所需要的菌种就要检查菌种的标签,向供应单位查询清楚才可确认。
菌种质量鉴定要从菌种的纯度、长势、菌龄、色泽、均匀度、出菇快慢、菇的质量、产量等方面进行。
从外观观察,要求菌丝体生长健壮、均匀、菌丝体从菌种块发出,渐向瓶底伸展,直至长满整瓶。
菌丝体颜色正常,不同种类食用菌的颜色有差异,有光感,有些品种长到菌种成熟时会出现小菇体或扭结,未见杂菌污染。
如果瓶底或壁部菌丝生势弱,或菌丝体生长不到瓶底部,可能是水分过多、或制种时拌料不均匀所至。
若位于瓶颈的菌丝体特别旺盛,呈棉絮状,颜色不正常,这可能是鬼伞或根霉菌污染。
看到瓶底或其他部位有黄、绿色斑点,可能是青霉、曲霉污染。
菌丝体收缩,离瓶壁,菌丝体颜色加深,有时看到“菌珠”或底部出现褐色粘状物,应是菌种老化。
菌丝体不能向瓶底方向伸展、培养料松散,应是水分不足造成的。
当打开菌种瓶观察,应闻到各种食用菌特有的香味,棉塞干爽无异物。
剔去菌种面层的菌皮,内部的培养物松软结块状为良好菌种。
如果不见异物,也估计不是水分的影响,但菌种不能发生发展,则应检查培养料的酸碱度是否合适。
如果原菌种块已萌发,但伸展不开,且有异味,挑开培养料,面层有粘胶状感觉,多是细菌感染。
菌种的质量更要求检验其产生子实体的能力,因此要做好出菇试验,观察播种后菌丝萌发时间、培养料的结块时间,小菇体或扭结出现时间,菌丝体分布情况等;记录第一批收菇时间、产量、质量等;第一批与第二批菇相隔时间,第一批菇占总产量的比率等,都是评价菌种质量的参数。
新菌种鉴定的区别
新菌种鉴定是指通过一定的方法和技术,对未知的微生物进行分类和鉴定,确定其分类地位和名称的过程。
新菌种鉴定的主要区别在于鉴定的对象和鉴定的方法。
首先,新菌种鉴定的对象是未知的微生物,而不是已经被鉴定过的微生物。
这些未知的微生物可能来自不同的环境,如土壤、水体、生物体等,也可能是人工合成的微生物。
其次,新菌种鉴定的方法也与传统的菌种鉴定方法有所不同。
传统的菌种鉴定主要依赖于形态学、生理学和生化特征等方面的观察和分析,而新菌种鉴定则需要借助现代分子生物学技术,如 16S rRNA 基因序列分析、全基因组测序等,来确定微生物的分类地位和名称。
此外,新菌种鉴定还需要考虑到微生物的生态习性、地理分布、进化关系等因素,以便更好地理解其生物学特征和生态适应性。
总之,新菌种鉴定是一项复杂而重要的工作,需要综合运用多种方法和技术,以确保鉴定结果的准确性和可靠性。
菌种的保藏名词解释菌种的保藏对于微生物学研究非常重要,确保菌种的保存和传播。
本文将解释与菌种保藏相关的几个名词,包括:菌种、保藏、菌种鉴定、冻存和保存条件等。
菌种是指一种细菌、真菌或其他微生物,经过世界各地科研机构和鉴定中心确认后,被正式命名并分配了唯一的编号。
菌种通常由科学家从自然环境中分离和培养得来,通过研究和实验验证后确立其存在和性质。
菌种的命名和编号非常重要,可以确保科学研究的准确性和可靠性。
保藏是指将菌种保存并保持其活性和纯度的过程。
保藏通常通过冻存和保存在冷冻设备中来实现,如液氮罐或超低温冰箱。
通过冻存,菌种可以长期保存,并在需要时重新培养。
保藏的目的是防止菌种的丧失、污染和变异,从而保证后续研究的可重复性。
菌种鉴定是指对菌种进行识别和分类的过程。
菌种鉴定的目的是确认菌株的身份和性质,包括其学名、分类和特性。
鉴定菌种的方法包括形态学观察、生理生化特性分析、生物分子检测等。
菌种鉴定的准确性对于后续的科学研究和应用非常重要,可以避免误用和混淆。
冻存是指将菌种保存在极低温度下以确保其存活和保持活性的过程。
冻存的主要方法是将菌种培养物添加适当的保护剂后,冷冻在低温条件下。
常用的保护剂包括甘露醇、甘油和蔗糖等,它们可以防止细胞水分的蒸发和结冰对细胞造成的伤害。
冻存使菌种可以在无菌条件下长期保存,并在需要时快速恢复培养。
保存条件是指在保存和传播菌种时需要注意的环境和条件。
为了保持菌种的活力和纯度,保存过程中需要严格控制温度、湿度和光照等条件。
一般来说,菌种保存的温度应低于冰点,湿度应保持在相对较低的水平,以减少细菌和真菌的生长。
此外,保存过程中需要定期检查,并确保保存容器的密封和标签的完整性。
总结起来,菌种的保藏是科学研究和应用的基础,通过冻存和合理的保存条件,可以确保菌种的长期保存和可重复使用。
菌种的鉴定和保藏是微生物学研究中不可或缺的环节,为科学家提供了准确和可靠的研究对象。
对菌种保藏名词的了解,有助于更好地理解菌种的重要性和保存工作的必要性。
菌种的分类鉴定:4.1形态特征(麦芽汁琼脂)编号形态特征Y1菌落由白色到奶油色,无光泽,软而平滑或部分有皱纹。
边缘呈波纹,凸起,色黄,中心凹,奶油色,室温放一月后,培养物由奶油色变浅褐色。
细胞呈圆卵圆椭圆,大小不等。
单个,成双,偶尔成短链,多边芽殖。
(意大利酵母)Y2菌落呈浅奶油色,菌落平滑或部分有皱纹,无光泽,边缘呈黄色,大波纹状。
细胞圆形卵形椭圆形,大小不等,多边芽殖。
地生酵母)Y328℃3d后,细胞圆形椭圆形,单个或成双,两端芽殖,培养物奶油状,奶油色到浅褐色,平滑,稍平坦,光亮,边缘偶尔波纹,无真菌丝。
(酿酒酵母二菌种的分类鉴定:4.1形态特征(麦芽汁琼脂)编号形态特征Y1菌落由白色到奶油色,无光泽,软而平滑或部分有皱纹。
边缘呈波纹,凸起,色黄,中心凹,奶油色,室温放一月后,培养物由奶油色变浅褐色。
细胞呈圆卵椭圆,大小不等。
单个,成双,偶尔成短链,多边芽殖。
(意大利酵母)Y2菌落呈浅奶油色,菌落平滑或部分有皱纹,无光泽,边缘呈黄色,大波纹状。
细胞圆形卵形椭圆形,大小不等,多边芽殖。
(地生酵母)Y3 28℃3d后,细胞圆形椭圆形,单个或成双,两端芽殖,培养物奶油状,奶油色到浅褐色,平滑,稍平坦,光亮,无真菌丝。
4.菌种的分类鉴定4.1形态特征(麦芽汁琼脂)编形态特征Y1菌落由白色到奶油色,无光泽,软而平滑或部分有皱纹。
边缘呈波纹,凸起,色黄,中心凹,奶油色,室温放一月后,培养物由奶油色变浅褐色。
细胞呈圆卵椭圆,大小不等。
单个,成双,偶尔成短链,多边芽殖。
(意大利酵母)y2菌落呈浅奶油色,菌落平滑或部分有皱纹,无光泽,边缘呈黄色,大波纹状。
细胞圆形卵形椭圆形,大地生酵母)Y328℃3d后,细胞圆形椭圆形,单个或成双,两端芽殖,培养物奶油状,奶油色到浅褐色,平滑,稍平坦,光亮,边缘偶尔波纹,无真菌丝(酿酒酵母。
菌种鉴定的原理
菌种鉴定的原理是通过对菌株的形态学、生理生化特征以及分子生物学特征进行分析和比较,来确定菌株属于哪个菌种。
首先,形态学鉴定是通过观察菌株的形态特征,如菌落形状、色素产生、孢子形态等来判断其属于的菌种。
其次,生理生化特征鉴定是通过菌株在特定环境条件下的生长和代谢特性来识别其菌种归属。
这包括菌株对不同碳源、氮源的利用能力,产酶能力,耐受温度和pH的能力等。
最后,分子生物学特征鉴定是通过分析菌株的核酸序列,如16S rRNA基因序列,来比较其与已知菌种的基因序列的相似性,从而确定其种属关系。
这些方法常常被结合使用,以增加鉴定的准确性和可靠性。
抗酸染色法抗酸染色法acid-fast staining method1882年由埃利希(F、Ehrlich)首创并经F、齐尔(Ziehl)改进而创造出得细菌染色法。
简介其中最具代表性得为对结核菌得齐尔-尼尔森(Ziehl-Neelsen)染色法与齐尔-加贝特(Ziehl-Gabbet)染色法。
用石炭酸复红染色后,用盐酸乙醇分色,再用美蓝进行对比染色,即不再脱色而呈现石炭酸复红得红色。
抗酸染色得原理分枝杆菌得细胞壁内含有大量得脂质,包围在肽聚糖得外面,所以分枝杆菌一般不易着色,要经过加热与延长染色时间来促使其着色。
但分枝杆菌中得分枝菌酸与染料结合后,就很难被酸性脱色剂脱色,故名抗酸染色。
齐-尼氏抗酸染色法就是在加热条件下使分枝菌酸与石炭酸复红牢固结合成复合物,用盐酸酒精处理也不脱色。
当再加碱性美兰复染后,分枝杆菌仍然为红色,而其她细菌及背景中得物质为蓝色。
抗酸染色一般步骤用玻片夹夹持涂片标本,滴加石炭酸复红2-3滴,在火焰高处徐徐加热,切勿沸腾,出现蒸汽即暂时离开,若染液蒸发减少,应再加染液,以免干涸,加热3-5分钟,待标本冷却后用水冲洗。
3%盐酸酒精脱色30秒~1分钟;用水冲洗。
用碱性美兰溶液复染1分钟,水洗,用吸水纸吸干后用油镜观察。
抗酸染色得染液配制1、石炭酸复红碱性复红酒精饱与溶液10mL5%石炭酸90mL2、3%盐酸酒精浓盐酸3mL95%酒精97mL3、吕氏美兰液美兰酒精饱与液30mL氢氧化钾(1:10000) 100mL细菌鞭毛染色得方法目前,细菌鞭毛染色方法根据染色剂得不同,可分为碱性复红法、副品红法、结晶紫法、维多利亚蓝B法、镀银染色法与荧光蛋白染色法6类,前5类方法得媒染剂成分中均含有单宁酸,染色原理通常就是采用不稳定得胶体溶液做媒染剂,并使其沉淀于鞭毛上而使“鞭毛肿胀(tarandfeather)”,鞭毛直径加粗,进一步染色后即可在油镜下观察。
ﻫﻫ1、碱性复红法与副品红法1926年由Gray首创,其媒染液成分包括20%丹宁酸水溶液2、0ml,硫酸钾铝饱与水溶液5ml,饱与氯化汞水溶液2ml,3%碱性复红乙醇(95%)溶液0、4ml,临用前混合,且需过滤后方可使用。
菌株鉴定姓名摘要:pUC载体系列质粒较小,约为2.7 kb,是E.coli最常用的理想质粒克隆载体。
当pUC19质粒载体导入到E.coli DH5α后,在IPTG存在下,在含有生色底物X-gal的培养基上形成蓝色菌落。
另外质粒pUC19携带有氨苄青霉素抗性基因(Amp r),质粒pUC19进入E.coli DH5α后,通过α-互补作用,在MAC培养基平板上转化子利用β-半乳糖苷酶分解培养基中的乳糖产生有机酸,pH降低,培养基中的中性红指示剂变红,转化子的菌落变成红色。
不含pUC19质粒的E.coli DH5α利用培养基中的有机碳源,不使培养基pH降低,在不含有氨苄青霉素的MAC培养基上形成白色菌落。
本实验就是利用这些实验原理进行相应的菌株鉴定实验,其目的是更好地掌握培养基菌落生长情况及菌落颜色的原理,熟悉菌株鉴定的实验步骤,同时学会观察培养基中菌落的颜色特征。
通过此次实验,我们达到了预期目的,取得了很好的实验效果。
关键词:pUC19质粒、E.coli DH5α、氨苄青霉素抗性基因(Amp r)、LB培养基、MAC培养基1.引言质粒是染色体外的遗传因子,广泛存在于原核生物中,在部分真核生物中也存在。
细胞内自然存在的质粒通常不能作为基因工程操作的载体,需要对其进行改造,如根据载体必备的条件插入结构元件和删除质粒上非功能的DNA片段。
标记基因是载体所必需的结构元件,按其用途可将标记基因分为选择标记基因和筛选标记基因。
选择标记基因用于鉴别目标载体的存在,用于挑选成功转化载体的宿主细胞。
筛选标记主要用来区别重组质粒与非重组质粒,将具有特殊表型的重组质粒挑选出来。
α-互补是E.coli最常用的筛选标记,其原理是:β-半乳糖苷酶基因(LacZ)N端多肽和C端多肽单独存在时都无β-半乳糖苷酶活性,当两者存在于同一个细胞即可进行互补而形成完整β-半乳糖苷酶活性。
在pUC系列质粒载体上插入了β-半乳糖苷酶的调控序列和β-半乳糖苷酶N端146个氨基酸的编码序列,并在这个编码区域中引人多克隆位点,但不破坏LacZ的阅读框架,即不影响其正常功能。
而这类载体对应的宿主菌如E.coli DH5α的染色体上整合有β-半乳糖苷酶C端序列的遗传信息。
当质粒载体导入到相应宿主菌后,载体上合成的β-半乳糖苷酶N端多肽可以与宿主细胞染色体编码的C 端多肽片段互补形成完整的蛋白质,即表现出β-半乳糖苷酶活性。
在乳糖或其结构类似物IPTG存在下,可以诱导β-半乳糖苷酶的合成。
在含有生色底物X-gal的培养基上形成蓝色菌落。
pUC载体系列质粒较小,约为2.7kb,是E.coli最常用的理想质粒克隆载体。
它们由以下结构元件构成:①来自于E.coli质粒ColE1的松弛型复制起始点。
在含有氯霉素的培养基中细胞生长停止后,该复制子仍能继续复制,由此可得到大量质粒DNA。
②氨苄青霉素抗性基因(Amp r)。
③E.coliβ-半乳糖苷酶基因(LacZ)的启动子及编码β-半乳糖苷酶N端的DNA 序列。
④多克隆位点(MCS)区段,包含十几个单一限制性内切酶识别位点,使目的DNA 片段可定向插入。
质粒载体pUC18和pUC19的结构基本相同,只是在LacZ基因的启动子后面多克隆位点的限制性核酸内切酶以互为相反方向排列。
在载体pUC18中,EcoRⅠ位点紧接于启动子Plac 下游,而载体pUC19的Hin dⅢ位点紧接于Plac下游,它们共有13个单一限制性核酸内切酶位点。
质粒pUC19携带有氨苄青霉素抗性基因(Amp r),没有导入质粒pUC19的受体细胞,在含有氨苄青霉素(Amp)培养基上不生长。
质粒pUC19进入E.coli DH5α后,通过α-互补作用,形成完整的β-半乳糖苷酶。
在麦康凯培养基平板上,转化子利用β-半乳糖苷酶分解培养基中的乳糖产生有机酸,pH降低,培养基中的中性红指示剂变红,转化子的菌落变成红色。
不含质粒的E.coli DH5α,没有β-半乳糖苷酶活性,不能利用培养基中的乳糖产生有机酸,而是利用培养基中的有机碳源,不使培养基pH降低,在不含有氨苄青霉素的麦康凯培养基上形成白色菌落。
2.材料和方法2.1材料和试剂实验菌株:E.coli DH5α和E.coli DH5α(pUC19)实验材料:LB固体培养基、氨苄青霉素母液实验试剂:150mL LB固体培养基、200mL MAC固体培养基、IPTG母液(储存浓度为500mM)、X-gal母液(储存浓度为40mg/mL)、Amp母液(储存浓度为100mg/mL)、实验仪器:高压蒸汽灭菌锅、微量移液器、200μL黄色枪头、EP管架、接种环、恒温培养箱、酒精灯、火柴、记号笔2.2方法2.2.1M平板、M+Amp平板、LB平板与LB+Amp平板的制作(1)1组、10组制作M平板①从高压蒸汽灭菌锅里取出已经灭菌完成的盛有200mL MAC固体培养基的三角瓶。
②待其融化冷却至55~60℃左右,无菌操作,倒平板,最终每组制得10~12个平板。
③待平板凝固后标记,待用。
(2)2组、3组制作M+Amp平板①从高压蒸汽灭菌锅里取出已经灭菌完成的盛有200mL MAC固体培养基的三角瓶。
②待其融化冷却至55~60℃左右,无菌操作,用微量移液器向培养基中加入Amp母液200μL(终浓度为100μg/mL)。
③无菌操作,倒平板,最终每组制得10~12个平板。
④待平板凝固后标记,待用。
(3)4组、5组、6组制作LB平板①从高压蒸汽灭菌锅里取出已经灭菌完成的盛有150mL LB固体培养基的三角瓶。
②待其融化冷却至55~60℃左右,无菌操作,用微量移液器向培养基中加入IPTG母液150μL(终浓度为0.5mM),X-gal母液150μL(终浓度为40μg/mL)。
③无菌操作,倒平板,最终每组制得8~10个平板。
④待平板凝固后标记,待用。
(4)7组、8组、9组制作LB+Amp平板①从高压蒸汽灭菌锅里取出已经灭菌完成的盛有150mL LB固体培养基的三角瓶。
②待其融化冷却至55~60℃左右,无菌操作,用微量移液器向培养基中加入IPTG母液150μL(终浓度为0.5mM),X-gal母液150μL(终浓度为40μg/mL)。
③无菌操作,用微量移液器向培养基中加入Amp母液150μL(终浓度为100μg/mL)。
④无菌操作,倒平板,最终每组制得8~10个平板。
⑤待平板凝固后标记,待用。
2.2.2 分配M平板、M+Amp平板、LB平板与LB+Amp平板全班分配四种制作好的平板,每个小组分配得到每种平板各2个,共计8个平板。
2.2.3划线接种、培养和观察记录无菌操作,对8个平板进行划线接种,E.coli DH5α菌株和E.coli DH5α(pUC19)菌株分别接种M平板、M+Amp平板、LB平板与LB+Amp平板。
接种后将培养基置于37℃恒温培养箱培养24~48小时。
观察记录培养基中菌株的生长情况。
3.结果实验结果由图一所示。
接种E.coli DH5α菌株的MAC培养基中有白色菌落产生(图1);接种E.coli DH5α菌株的MAC+Amp培养基中没有菌落产生(图2);接种E.coli DH5α菌株的LB+IPTG+X-gal培养基中有白色菌落产生(图3);接种E.coli DH5α菌株的LB+IPTG+X-gal+Amp 培养基中没有菌落产生(图4);接种E.coli DH5α(pUC19)菌株的MAC培养基中有红色菌落产生(图5);接种E.coli DH5α(pUC19)菌株的MAC+Amp培养基中有红色菌落产生(图6);接种E.coli DH5α(pUC19)菌株的LB+IPTG+X-gal培养基中有蓝色菌落产生(图7);接种E.coli DH5α(pUC19)菌株的LB+IPTG+X-gal+Amp培养基中有蓝色菌落产生(图8)。
1 2 3 45 6 7 8图一各个培养基中菌落的生长情况图1:MAC培养基接种E.coli DH5α菌株图2:MAC培养基接种E.coli DH5α(pUC19)菌株图3:MAC+Amp培养基接种E.coli DH5α菌株图4:MAC+Amp培养基接种E.coli DH5α(pUC19)菌株图5:LB+IPTG+X-gal培养基接种E.coli DH5α菌株图6:LB+IPTG+X-gal培养基接种E.coli DH5α(pUC19)菌株图7:LB+IPTG+X-gal+Amp培养基接种E.coli DH5α菌株图8:LB+IPTG+X-gal+Amp培养基接种E.coli DH5α(pUC19)菌株质粒pUC19携带有氨苄青霉素抗性基因(Amp r),导入质粒pUC19的E.coli DH5α菌株可以在含有氨苄青霉素(Amp)培养基上生长(如图6、图8所示)。
质粒pUC19进入E.coli DH5α后,通过α-互补作用,形成完整的β-半乳糖苷酶。
在MAC培养基平板上,转化子利用β-半乳糖苷酶分解培养基中的乳糖产生有机酸,pH降低,培养基中的中性红指示剂变红,转化子的菌落变成红色(如图5、图6所示)。
没有导入质粒pUC19的E.coli DH5α菌株,不携带氨苄青霉素抗性基因(Amp r),在含有氨苄青霉素(Amp)培养基上不生长(如图2、图4所示)。
另外E.coli DH5α菌株没有β-半乳糖苷酶活性,不能利用培养基中的乳糖产生有机酸,而是利用培养基中的有机碳源,不使培养基pH降低,因此在不含有Amp的MAC培养基上形成白色菌落(如图1所示)。
β-半乳糖苷酶基因(LacZ)N端多肽和C端多肽单独存在时都无β-半乳糖苷酶活性,当两者存在于同一个细胞即可进行互补而形成完整β-半乳糖苷酶活性。
在pUC系列质粒载体上插入了β-半乳糖苷酶的调控序列和β-半乳糖苷酶N端146个氨基酸的编码序列,并在这个编码区域中引人多克隆位点,但不破坏LacZ的阅读框架,即不影响其正常功能。
而这类载体对应的宿主菌E.coli DH5α的染色体上整合有β-半乳糖苷酶C端序列的遗传信息。
当质粒载体导入到E.coli DH5α菌株后,载体上合成的β-半乳糖苷酶N端多肽可以与宿主细胞染色体编码的C端多肽片段互补形成完整的蛋白质,即表现出β-一半乳糖苷酶活性。
在IPTG 存在下,可以诱导β-半乳糖苷酶的合成。
在含有生色底物X-gal的培养基上形成蓝色菌落(如图7、图8所示)。
没有导入质粒pUC19的E.coli DH5α菌株,在含有IPTG和X-gal的LB培养基上形成白色菌落(如图3所示)。
4.讨论此次实验的重点是对培养基中有无菌落以及菌落颜色形成的原因的掌握,尤其是蓝白菌落和红白菌落形成的原因。
这些实验原理掌握好便可以对实验结果进行准确地分析。
本实验操作过程中无菌操作很重要,这样可以保证培养基上菌种的单一,从而保证实验结果的准确性。