高中化学 化学键.ppt
- 格式:ppt
- 大小:2.71 MB
- 文档页数:109
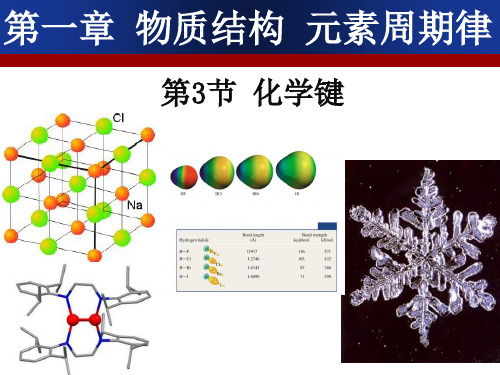




化学键百科名片编辑本段成键原因:①原子相互得失电子形成稳定的阴、阳离子。
②离子间吸引与排斥处于平衡状态。
③体系的总能量降低。
存在范围:离子键存在于大多数强碱、盐及金属氧化物中。
2、一个离子可以同时与多个带相反电荷的离子互相吸引成键,虽然在离子晶体中,一个离子只能与几个带相反电荷的离子直接作用(如NaCl中Na+可以与6个Cl-直接作用),但是这是由于空间因素造成的。
在距离较远的地方,同样有比较弱的作用存在,因此是没有饱和性的。
化学键的概念是在总结长期实践经验的基础上建立和发展起来的,用来概括观察到的大量化学事实,特别是用来说明原子为何以一定的比例结合成具有确定几何形状的、相对稳定和相对独立的、性质与其组成原子完全不同的分子。
开始时,人们在相互结合的两个原子之间画一根短线作为化学键的符号;电子发现以后,1916年G.N.路易斯提出通过填满电子稳定壳层形成离子和离子键或者通过两个原子共有一对电子形成共价键的概念,建立化学键的电子理论。
量子理论建立以后,1927年 W.H.海特勒和F.W.伦敦通过氢分子的量子力学处理,说明了氢分子稳定存在的原因,原则上阐明了化学键的本质。
通过以后许多人,特别是L.C.鲍林和R.S.马利肯的工作,化学键的理论解释已日趋完善。
化学键在本质上是电性的,原子在形成分子时,外层电子发生了重新分布(转移、共用、偏移等),从而产生了正、负电性间的强烈作用力。
但这种电性作用的方式和程度有所不同,所以又可将化学键分为离子键、共价键和金属键等。
离子键是原子得失电子后生成的阴阳离子之间靠静电作用而形成的化学键。
离子键的本质是静电作用。
由于静电引力没有方向性,阴阳离子之见的作用可在任何方向上,离子键没有方向性。
只有条件允许,阳离子周围可以尽可能多的吸引阴离子,反之亦然,离子键没有饱和性。
不同的阴离子和阳离子的半径、电性不同,所形成的晶体空间点阵并不相同。
共价键是原子间通过共用电子对(电子云重叠)而形成的相互作用。
