物理化学课件吉布斯函数计算
- 格式:ppt
- 大小:1.38 MB
- 文档页数:11

吉布斯自由能计算吉布斯自由能(Gibbs Free Energy)是一个非常重要的热力学概念,用于描述化学体系的稳定性及反应的可逆性。
它是由美国化学家约西亚·威拉德·吉布斯(Josiah Willard Gibbs)于1873年提出的,并在之后的研究中被广泛应用于化学和物理学领域。
G=U-TS其中,G的单位是焓(Joules),U是内能的单位,T是温度的单位,S是熵的单位。
吉布斯自由能的物理意义是描述系统在恒定温度和压力下能够做的非体积功。
根据吉布斯自由能的定义,我们可以得出吉布斯自由能的两个重要特征:1.可以通过吉布斯自由能判断系统的稳定性。
当吉布斯自由能变化ΔG小于零时,说明系统处于稳定状态,反应是自发进行的;当ΔG大于零时,说明系统处于不稳定状态,反应不会自发进行;当ΔG等于零时,说明系统处于平衡状态,反应达到化学平衡。
2.可以通过吉布斯自由能判断反应是否可逆。
根据热力学的第二定律,自发反应的方向是使吉布斯自由能变小的方向。
当ΔG小于零时,反应是可逆的;当ΔG大于零时,反应是不可逆的;当ΔG等于零时,反应处于平衡状态,可以通过微小的扰动来使反应向其中一方向进行。
吉布斯自由能的计算通常需要知道系统的内能、温度和熵的数值。
内能可以通过热力学实验或计算方法得到,温度可以通过温度计等仪器测量,而熵则是根据熵定义的物理常数进行计算。
对于化学反应体系,吉布斯自由能的计算可以通过以下几个步骤来完成:1.确定反应的化学方程式,并确定反应物和生成物的摩尔数。
2.根据已知反应物和生成物的内能,计算ΔU(生成物的内能-反应物的内能)。
3.根据已知反应物和生成物的熵,计算ΔS(生成物的熵-反应物的熵)。
4.根据已知的温度,将ΔU和ΔS代入吉布斯自由能的定义式中,计算ΔG。
5.根据计算得到的ΔG值,判断反应的稳定性以及可逆性。
吉布斯自由能的计算在热力学研究和化学工程实践中具有重要的应用价值。
它可以帮助科学家和工程师判断化学反应的可行性、优化化学工艺以及预测物质的相变等。

吉布斯函数,即吉布斯自由能(G)。
ΔG=ΔH-TΔS
式中H为焓;T为热力学温度;S为熵。
在恒温恒压和理想状态下,一个化学反应能够做的最大有用功等于反应后吉布斯自由能的减少;而反应自发性的正确标志也正是它产生有用功的能力。
因此,从某一反应的吉布斯自由能变量ΔG可以判断反应能否自发进行;ΔG<0时,反应在恒温恒压下可以产生有用功,因而反应是自发的;ΔG>0 时,反应是非自发的;ΔG=0 时,反应体系处于平衡状态。
从公式ΔG=ΔH-TΔS 看,化学反应的推动力(ΔG)依赖于两个量:①形成或断开化学键所产生的能量变化(ΔH);②体系无序性变化与温度的乘积。
这个公式后来被称为吉布斯方程。
它是化学中最有用的方程之一。
自吉布斯方程为化学界普遍接受后,人们终于从本质上辨明了化学反应的推动力。
过去一切有关的含糊不清的概念得到了澄清。

![吉布斯函数[分享]](https://uimg.taocdn.com/029f1ad15ebfc77da26925c52cc58bd6318693d9.webp)
吉布斯自由能(2009-04-09 10:35:19)转载标签:分类:科技探索自由能标准状况化学势等压吉布斯宇宙杂谈吉布斯自由能又叫吉布斯函数,是热力学中一个重要的参量,常用 G 表示,它的定义是:其中 U 是系统的内能,T 是温度,S 是熵,p 是压强,V 是体积,H 是焓。
吉布斯自由能的微分形式是:其中是化学势。
一个重要的推论是。
也就是说每个粒子的平均吉布斯自由能等于化学势。
目录[隐藏]∙ 1 物理意义∙ 2 生成吉布斯自由能∙ 3 范特霍夫等温公式∙ 4 吉布斯自由能与熵和焓o 4.1 推导o 4.2 相变∙ 5 吉布斯自由能与平衡常数∙ 6 吉布斯自由能与电化学∙7 参阅[编辑] 物理意义吉布斯自由能的物理含义是在等温等压过程中,除体积变化所做的功以外,从系统所能获得的最大功。
换句话说,在等温等压过程中,除体积变化所做的功以外,系统对外界所做的功只能等于或者小于吉布斯自由能的减小。
数学表示是:如果没有体积变化所做的功,即 W=0,上式化为:也就是说,在等温等压过程前后,吉布斯自由能不可能增加。
如果发生的是不可逆过程,反应总是朝着吉布斯自由能减少的方向进行。
特别地,吉布斯自由能是一个广延量,单位摩尔物质的吉布斯自由能就是化学势μ,也就是说。
具体推导如下:假设,代入热力学第一定律的微分形式:现在假想保证原来物体属性的情况下,切掉体系的一小部分dN。
这时,dT,dp,dg 这些强度量的变化为零。
所以必然有。
[编辑] 生成吉布斯自由能由于自由能的绝对值很难求出,同时它又是一个状态函数,所以实际应用时,就采用各种物质与稳定单质的相对值,即生成吉布斯自由能,全称标准摩尔生成吉布斯自由能变。
它是由处于标准状况下的稳定单质生成一摩尔标准状况下的化合物的吉布斯自由能变,用符号表示。
通过生成吉布斯自由能,我们能算出标准反应自由能。
标准反应自由能是指在标准状况下,标况下的反应物生成标况下的生成物所需要的能量变化,即用生成物的生成吉布斯自由能与各自的化学计量系数相乘后减去的反应物的生成吉布斯自由能与各自的化学计量系数相乘后的乘积。



物理化学中气体的吉普斯自由能计算公式吉布斯自由能又叫吉布斯函数,(英Gibbs free energy,Gibbs energy or Gibbs function; also known as free enthalpy)是热力学中一个重要的参量,常用G表示。
它的定义是G = U − TS + pV = H − TS,其中U是系统的内能,T是温度(绝对温度,K),S是熵,p是压强,V是体积,H是焓。
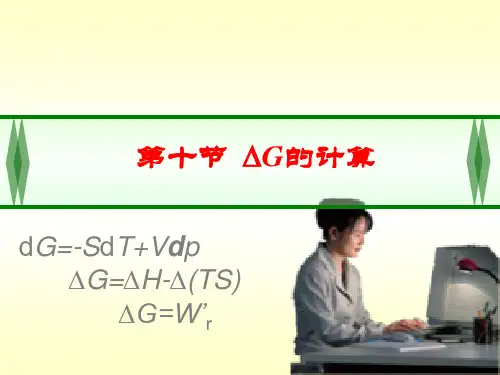
吉布斯自由能的微分形式是dG = − SdT + Vdp + μdN其中μ是化学势,也就是说每个粒子的平均吉布斯自由能等于化学势。
补充ΔG=ΔH-TΔS (Kj/mol)G叫做吉布斯自由能。
因为H、T、S均为状态函数,所以G为状态函数。
1876年美国著名数学物理学家,数学化学家吉布斯在康涅狄格科学院学报上发表了奠定化学热力学基础的经典之作《论非均相物体的平衡》的第一部分。
1878年他完成了第二部分。
这一长达三百余页的论文被认为是化学史上最重要的论文之一,其中提出了吉布斯自由能,化学势等概念,阐明了化学平衡、相平衡、表面吸附等现象的本质。
任何体系内发生的相变化或者化学反应,必定是一个自发进行的不可逆过程。
根据热力学第二定律,这个过程发生的结果必定是使得体系的熵值增大。
而吉布斯自由能判据就是这个熵判据的在恒温恒压条件下一种常用的特殊形式。
对于一个不处于平衡态的任意封闭体系而言,它与环境存在着能量交换。
这种非绝热的特性使得外界的能量输入对反应体系内熵值的影响不能忽略,因此判断反应是否自发进行的时候,我们需要将反应体系与环境一起作为一个总体进行熵值的计算,再用总熵的变化量判断反应进行的方向。
吉布斯是这个家族的第七代,他生于康涅狄格州的纽黑文,父亲是耶鲁大学神学院的教授,少时入霍普金斯学校学习,被同学描述为腼腆而孤独。
1854年入耶鲁学院学习。
并于1858年以很优秀的成绩毕业,并在数学和拉丁文方面获奖。
1863年吉布斯以使用几何方法进行齿轮设计的论文在耶鲁学院获得工程学博士学位,这也使他成为美国的第一个工程学博士。


吉布斯函数公式
1 杰拉德·吉布斯函数
杰拉德·吉布斯函数(Gibbs function)是统计力学中一项重要的概念,它有助于学者们进一步研究热力学。
在数学上,它可以用一个表达式来表示:
G = H - TS
其中,G代表杰拉德·吉布斯函数,H代表系统恒定状态的泛函,T代表时间和热量,S代表熵,并结合热力学的定理而成。
2 应用
杰拉德·吉布斯函数在热力学中有着重要的意义。
它主要用于热力学平衡和非平衡状态下探究和分析热力学系统信息,并由此定义出热力学性质和变化的模型,能够以此解释相关物质系统的状态变化。
此外,杰拉德·吉布斯函数的应用还涉及物质的变化和相关的平衡性等,比如在材料学中,了解不同材料之间的相互作用;在反应物动力学中,了解反应体系的热力学性质;在气体动力学中,了解气体变化的热力学表现等等。
3 特殊情况
在某些特殊情况下,杰拉德·吉布斯函数能够更快更准确地判断系统的物理性质,使得系统的平衡性和变化表现得更加清楚。
比如,当以G = 0.4作为杰拉德·吉布斯函数的标准时,表明两个反应物的热力学参数符合预期,说明系统可以达到平衡状态,而其他数值又低于或者高于这个标准,则表明系统变化倾向不稳定,可能因为其他外部因素,导致系统变化产生波动。
4 结论
因此,杰拉德·吉布斯函数对于判断系统的物理性质十分重要,它的应用非常的广泛,可以解释物质和反应系统的热力变化并建立相应的模型,同时还可以快速准确地分析系统的变化特性,为热力学的研究提供了有效的依据。

吉布斯自由能又叫做吉布斯函数,是热力学中一个重要的参量,常用G表示,它的定义是:G = U − TS + pV = H − TS,其中U是系统的内能,T是温度,S是熵,p是压强,V是体积,H是焓。
吉布斯自由能的微分形式是:dG = − SdT + Vdp + μdN,其中μ是化学势,也就是说每个粒子的平均吉布斯自由能等于化学势。
定义:ΔG=ΔH-TΔS (kJ/mol)G叫做吉布斯自由能。
因为H、T、S均为状态函数,所以G为状态函数。
∆G叫做吉布斯自由能变,可作为恒温、恒压过程自发与平衡的判据。
热力学第一定律表达式:Q=∆U+WU是热力学能(亦称为内能),H是焓,Q为热量,W为功量定义焓:H=U+pV,相应的比焓:h=u+pv范特霍夫等温公式吉布斯自由能随温度和压强变化很大。
为了求出非标准状况下的吉布斯自由能,可以使用范特霍夫等温公式:ΔG = ΔG0 + RT·ln J其中,ΔG0是同一温度、标准压强下的吉布斯自由能,R是气体常数,J是反应商。
温度的变化在ΔG0的使用上表现出来,不同的温度使用不同的ΔG0。
非标准状况的ΔG0需要通过定义式(即吉布斯等温公式)计算。
压强或浓度的变化在J的表达上表现出来。
反应进行的方向:定义吉布斯自由能G=H-TS。
因为H、T、S均为状态函数所以G为状态函数。
吉布斯自由能改变量-ΔG=-(G2-G1)>=W非。
表明状态函数G是体系所具有的在等温等压下做非体积功的能力。
反应过程中G的减少量-ΔG是体系做非体积功的最大限度。
这个最大限度在可逆途径得到实现。
反应进行的方向和方式可以由ΔG进行判断:-ΔG>W非反应以不可逆方式自发进行-ΔG=W非反应以可逆方式进行-ΔG<W非不能进行若反应在等温等压下进行,不做非体积功,即W非=0则ΔG<0 反应以不可逆方式自发进行ΔG=0 反应以可逆方式进行ΔG>0 不能进行可见等温等压下体系的吉布斯自由能减小的方向是不做非体积功的化学反应进行的方向。