无机化学-配位化学基础-配合物的命名
- 格式:ppt
- 大小:789.50 KB
- 文档页数:15
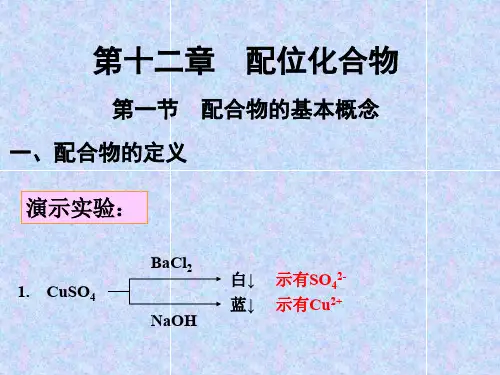

无机化学中的配位化学理论是研究配合物形成、结构和性质的学科。
配合物是指由两个或多个离子或分子间的配位键结合而成的复合物,其中一个离子或分子起着配位中心的作用,其他则作为配体。
配位键一般由金属离子或原子与一个或多个配体的配位作用形成。
配位化学理论是无机化学领域一个重要的分支,它能够解释许多无机化学现象和化学反应。
一、配位化学的历史配位化学是早期化学家研究无机化合物所产生的。
18世纪末,Bergman首次提出了“配位”的概念,认为金属离子可以和一些特定的分子或离子发生化学反应,在这种反应中所产生的化合物称为配合物。
19世纪中叶,水合物和铜酰胺的合成让配合物变得更加重要。
20世纪初,单位配合数的概念被提出,并在1930年代得到广泛应用。
1952年,Jørgensen首次提出了“配位键”的概念,为配位化学理论的快速发展奠定了基础。
此后,人们逐渐深入研究了配合物的结构和性质,配位化学理论也得到了更为深刻的认识。
二、配位键的形成配位化学的核心是配位键的形成。
配位键可以分为共价性和离子性两种。
共价式键通常存在于过渡金属配合物中,它由金属离子的未满足配位电子对与配体的配位电子对相互重叠形成。
而离子式键则通常存在于铜、银和金等含d10电子的金属配合物中,它由金属离子的正电荷和配体的负电荷静电作用形成。
此外,还有一种类似氢键的键,即氢键型配位键,它主要存在于氢氧根、氨、水和羟基等配体中。
三、配位环境的影响配合物的结构和性质取决于配位环境,即最内层的配体、次内层的离子和周围溶剂的影响。
其中,配体的种类、数量和配位位置是影响配合物结构的关键因素。
次内层的离子通过配位作用能够改变配合物的电荷和几何构型。
而溶剂分子也能与金属离子配位形成溶剂合金属离子,并影响配合物的物理化学性质。
此外,温度、压力、电场等外部因素也会影响配合物的性质。
四、配合物的分类配合物可以根据金属离子的性质、配体的性质和功能进行分类。
根据金属离子的性质,配合物可以分为过渡金属配合物、主族金属配合物和内过渡金属配合物。

无机化学大一知识点归纳无机化学是研究无机物质的组成、性质、结构和反应的一门化学学科。
下面是大一无机化学知识点的归纳:1.元素和元素周期表-元素是组成物质的基本单位,由原子构成。
-元素周期表是一种将元素按照一定规律排列的表格,包含元素的原子序数、原子量、元素符号等信息。
2.原子结构-原子由质子、中子和电子构成。
-质子位于原子核中,带有正电荷。
-中子位于原子核中,不带电荷。
-电子围绕原子核运动,带有负电荷。
3.化学键-离子键:由正负电荷的离子相互吸引而形成的键。
-共价键:由共享电子对形成的键。
-金属键:由金属原子之间的电子云共享形成的键。
4.化合物的命名和化学式-无机化合物通常由元素符号和下标表示。
-以电负性较低的元素为中心,其他元素按一定规则命名。
-阴离子添加前缀“亚”或“次”。
5.分子、离子和化学平衡-分子是两个或两个以上原子共用电子对形成的物质。
-离子是由失去或获得电子而带电荷的原子或原子团。
-化学平衡是指反应物和生成物在化学反应中达到一定比例的状态。
6.配位化学-配位化学研究由配位子与中心金属离子或原子形成的配合物。
-配位子是一种带有孤对电子的离子或分子,能形成与金属离子配位的化合物。
7.酸碱中和反应-酸是能提供H+离子的物质,碱是能提供OH-离子的物质。
-酸碱反应是指酸和碱在适当条件下生成盐和水的反应。
8.氧化还原反应-氧化是指物质失去电子;还原是指物质获得电子。
-氧化还原反应包括氧化剂和还原剂之间的电子转移。
9.配位数和配位几何-配位数是指配位物与中心离子相结合时的配位键数目。
-配位几何是指配位物形成的平面、三维结构。
10.键合理论-价键理论:电子通过共享方式存在于分子中。
-晶体场理论:金属和配位物的结合由于静电相互作用。
这些知识点是大一无机化学的基础,并为进一步学习无机化学提供了基础。
熟悉这些知识点将有助于理解物质的性质和化学反应的原理。







配位化学知识点总结配位化学是无机化学的一个重要分支,它研究的是金属离子或原子与配体之间通过配位键形成的配合物的结构、性质和反应。
以下是对配位化学知识点的总结。
一、配位化合物的定义与组成配位化合物,简称配合物,是由中心原子(或离子)和围绕它的配体通过配位键结合而成的化合物。
中心原子通常是金属离子或原子,具有空的价电子轨道,能够接受配体提供的电子对。
常见的中心原子有过渡金属离子,如铜离子(Cu²⁺)、铁离子(Fe³⁺)等。
配体是能够提供孤对电子的分子或离子。
配体可以分为单齿配体和多齿配体。
单齿配体只有一个配位原子,如氨(NH₃);多齿配体则有两个或两个以上的配位原子,如乙二胺(H₂NCH₂CH₂NH₂)。
在配合物中,中心原子和配体组成内界,内界通常用方括号括起来。
方括号外的离子则称为外界。
例如,Cu(NH₃)₄SO₄中,Cu(NH₃)₄²⁺是内界,SO₄²⁻是外界。
二、配位键的形成配位键是一种特殊的共价键,是由配体提供孤对电子进入中心原子的空轨道形成的。
配位键的形成条件是中心原子有空轨道,配体有孤对电子。
例如,在 Cu(NH₃)₄²⁺中,氨分子中的氮原子有一对孤对电子,铜离子的价电子层有空轨道,氮原子的孤对电子进入铜离子的空轨道,形成配位键。
三、配合物的命名配合物的命名遵循一定的规则。
对于内界,先列出中心原子的名称,然后依次列出配体的名称。
配体的命名顺序是先阴离子,后中性分子;先简单配体,后复杂配体。
在配体名称之间用“·”隔开,配体的个数用一、二、三等数字表示。
如果有多种配体,用罗马数字表示其价态。
例如,Co(NH₃)₅ClCl₂命名为氯化一氯·五氨合钴(Ⅲ)。
四、配合物的空间结构配合物的空间结构取决于中心原子的杂化轨道类型和配体的空间排列。
常见的杂化轨道类型有 sp、sp²、sp³、dsp²、d²sp³等。
配位化学基础配位化学是在无机化学基础上发展起来的一门具有很强交叉性的学科,配位化学旧称络合物化学,其研究对象是配合物的合成、结构、性质和应用。
配位化学的研究范围,除最初的简单无机加和物外,已包括含有金属-碳键的有机金属配位化合物,含有金属-金属键的多核蔟状配位化合物即金属簇合物,还包括有机配体与金属形成的大环配位化合物,以及生物体内的金属酶等生物大分子配位化合物。
一、配合物的基本概念1.配合物的定义及构成依据1980年中国化学会无机化学命名原则,配合物可以定义为:由可以给出孤对电子或多个不定域电子的一定数目的离子或分子(统称为配体)和具有接受孤对电子或多个不定域电子的空位的原子或离子(统称为中心原子),按一定的组成和空间构型所形成的化合物。
结合以上规定,可以将定义简化为:由中心原子或离子和几个配体分子或离子以配位键相结合而形成的复杂分子或离子,统称为配体单元。
含配体单元(又称配位个体)的化合物称为配位化合物。
配体单元可以是配阳离子,配阴离子和中性配分子,配位阳离子和阴离子统称配离子。
配离子与与之平衡电荷的抗衡阳离子或阴离子结合形成配位化合物,而中性的配位单元即时配位化合物。
但水分子做配体的水合离子也经常不看成配离子。
配位化合物一般分为内界和外界两部分,配体单元为内界,抗衡阳离子或阴离子为外界,而含中性配位单元的配位化合物则无外界。
配合物的内界由中心和配体构成,中心又称为配位化合物的形成体,多为金属,也可以是原子或离子,配体可以是分子、阴离子、阳离子。
2.配位原子和配位数配位原子:配体中给出孤对电子与中心直接形成配位键的原子配位数:配位单元中与中心直接成键的配位原子的个数配位数一般为偶数,以4、6居多,奇数较少配位数的多少和中心的电荷、半径及配体的电荷、半径有关:一般来说,中心的电荷高、半径大有利于形成高配位数的配位单元,如氧化数为+1的中心易形成2配位,氧化数为+2的中心易形成4配位或6配位,氧化数为+3的易形成6配位。
无机化学中的配位化学与配合物合成无机化学作为化学学科的重要分支,研究的是不含碳-碳键的化合物。
其中,配位化学是无机化学中重要的分支之一,研究的是金属离子与配体之间相互作用的规律,通过这种相互作用,可以形成配合物。
本文将介绍配位化学及其在无机化学中的应用,以及如何合成配合物。
一、配位化学1.配位物的概念配位物指的是由金属阳离子和配体共同组成的化合物。
其中,金属离子作为中心原子,接受来自配体的电子对形成配位键,并形成一个立体结构,这种配位键可以是共价键也可以是离子键。
2.配体的概念配体是指那些可以向中心金属离子提供电子对并形成配位键的分子或离子。
常见的配体有水分子、氯离子、氨分子等。
3.配位子数一般来说,一个金属离子可以形成若干个配位键,这个数目被称为配位子数,一般简写为CN。
例如,对于六配位金属离子Mx+,其配位子数就是6。
4.配合物的形成与稳定性金属离子与配体之间形成的配位键是通过配位作用实现的。
由于金属离子与配体之间的配位作用可以使金属离子周围的电子云扭曲,从而影响其反应性和化学性质等。
此外,配合物也受到晶体场效应和配体场效应的影响。
这些效应都会影响配合物的稳定性。
二、配合物的制备1.传统的合成方法传统的配合物合成一般采用溶剂热法、常温下的反应或者微波合成等方式,其具体过程与反应机理多种多样。
例如,对于五配位配合物,常见的合成方法包括水热法和溶剂挥发法等。
2.生物合成法生物合成法是一种新兴的配合物合成方法,其使用生物体(例如细菌和酵母等)来代替传统的化学反应条件。
通过这种方法,可以制备出具有特殊活性的配合物。
同时,生物合成法也具有环保、能源节约和经济性等优点,因此在未来的配合物合成领域有着广泛的应用前景。
三、配位化学在无机化学中的应用1.催化作用由于配合物具有容易失去或吸收配位子的特性,使得其在催化作用方面应用广泛。
例如,某些铂族元素的配合物可以作为催化剂用于加氢反应、链转移反应和环化反应等。
大学无机化学教案中的配位化学与配合物合成在大学无机化学教学中,配位化学是一个重要的内容。
配位化学研究的是金属离子与配体之间的相互作用,以及由此形成的配合物的性质与合成方法。
本文将探讨大学无机化学教案中的配位化学与配合物合成的相关内容。
一、配位化学的基本概念配位化学是研究金属离子与配体之间的相互作用的学科。
在配位化学中,金属离子被称为中心离子,而与中心离子结合形成配合物的分子或离子被称为配体。
配体通常是具有可提供一个或多个孤对电子的分子或离子,通过这些孤对电子与中心离子形成配位键。
配位化学的基本概念包括配位数、配位键、配位体、配位效应等。
配位数指的是一个中心离子周围配体的数目,常见的配位数有2、4、6等。
配位键是指配体与中心离子之间的化学键,通常是通过配体的孤对电子与中心离子形成的。
配位体是指配体分子或离子中能够提供孤对电子的原子或基团。
配位效应是指不同的配体对中心离子的配位能力不同,从而导致不同的配位数和配位几何构型。
二、配合物的合成方法配合物的合成方法有多种,常见的包括溶液法、固相法、气相法等。
其中,溶液法是最常用的合成方法之一。
溶液法合成配合物的步骤一般包括以下几个方面:1. 选择合适的中心离子和配体。
在合成配合物之前,需要选择合适的中心离子和配体。
中心离子的选择通常基于所需的化学性质和应用领域,而配体的选择则取决于其与中心离子之间的配位能力。
2. 配体的配位反应。
在溶液中,将中心离子与配体混合,通过配位反应形成配合物。
配位反应的条件包括温度、溶剂、反应时间等。
3. 配合物的分离与纯化。
合成的配合物通常需要进行分离与纯化,以去除杂质和未反应的物质。
常用的分离与纯化方法包括结晶、萃取、溶剂蒸发等。
4. 配合物的表征与性质研究。
合成的配合物需要进行表征与性质研究,以确定其化学结构和性质。
常用的表征方法包括红外光谱、核磁共振、元素分析等。
三、配合物合成的应用配合物合成在无机化学中具有广泛的应用。
配合物的性质与结构可以通过合成方法的选择和配体的设计来调控,从而实现特定的功能和应用。