2019版高考数学一轮复习 专题讲座三课件 文
- 格式:ppt
- 大小:516.00 KB
- 文档页数:12


第3讲 氧化还原反应【2019·备考】【2019·备考】最新考纲:最新考纲:1.1.1.理解氧化还原反应的本质。
理解氧化还原反应的本质。
理解氧化还原反应的本质。
2.2.2.了解氧化还原反应在生产、生活中的应用。
了解氧化还原反应在生产、生活中的应用。
了解氧化还原反应在生产、生活中的应用。
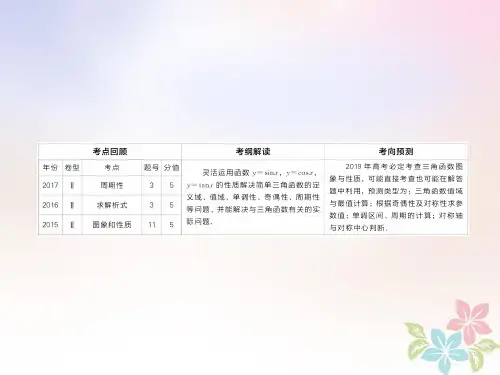
最新考情:氧化还原反应考查一是在选择题某选项中出现,主要考查电子转移数目、氧化还原反应基本概念,如2017年12D 12D、、2015年3A 3A,,4C 4C,,11A 11A、、2014年6D 等;二是填空题某空中出现,主要考查电子守恒的应用,如2015年18题、题、20142014年20题;三是考查新情境下氧化还原反应型离子方程式的书写,涉及氧化还原反应方程式配平、氧化还原产物的判断,这是高考命题的重点,每年均有考查。
考点一 氧化还原反应的相关概念及表示方法[知识梳理知识梳理] ]1.1.氧化还原反应的本质和特征氧化还原反应的本质和特征氧化还原反应的本质和特征2.2.相关概念及其关系相关概念及其关系相关概念及其关系实例:实例:反应4HCl(4HCl(浓浓)+MnO 2=====△MnCl 2+Cl 2↑+↑+2H 2H 2O 中,氧化剂是MnO 2,氧化产物是Cl 2,还原剂是HCl HCl,还原产,还原产物是MnCl 2;生成1 mol Cl 2时转移电子的物质的量为2__mol 2__mol,被氧化的,被氧化的HCl 的物质的量是2__mol 2__mol。
提醒:氧化还原反应概念间的关系:熟记六个字:“升、失、氧;降、得、还”提醒:氧化还原反应概念间的关系:熟记六个字:“升、失、氧;降、得、还”[[元素化合价升高元素化合价升高((降低降低))、失(得)电子,发生氧化电子,发生氧化((还原还原))反应反应]]。
3.3.氧化还原反应中电子转移的表示方法氧化还原反应中电子转移的表示方法氧化还原反应中电子转移的表示方法 (1)(1)双线桥法双线桥法双线桥法实例:实例:请标出Cu 与稀硝酸反应中电子转移的方向和数目:与稀硝酸反应中电子转移的方向和数目:(2)(2)单线桥法单线桥法单线桥法实例:实例:请标出Cu 与稀硝酸反应中电子转移的方向和数目:与稀硝酸反应中电子转移的方向和数目:4.4.氧化还原反应与四种基本反应类型间的关系氧化还原反应与四种基本反应类型间的关系氧化还原反应与四种基本反应类型间的关系提醒:①一定属于氧化还原反应的是置换反应。



第一节 任意角、弧度制及任意角的三角函数2019考纲考题考情1.角的有关概念(1)从运动的角度看,角可分为正角、负角和零角。
(2)从终边位置来看,角可分为象限角与轴线角。
(3)若β与α是终边相同的角,则β用α表示为β=2k π+α,k ∈Z 。
2.弧度与角度的互化 (1)1弧度的角长度等于半径长的弧所对的圆心角叫做1弧度的角。
(2)角α的弧度数如果半径为r 的圆的圆心角α所对弧的长为l ,那么角α的弧度数的绝对值是|α|=l r。
(3)角度与弧度的换算①1°=π180rad ;②1 rad = ⎛⎪⎫180π°。
(4)弧长、扇形面积的公式设扇形的弧长为l ,圆心角大小为α(rad),半径为r ,则l =|α|r ,扇形的面积为S =12lr =12|α|·r 2。
3.任意角的三角函数(1)定义:设α是一个任意角,它的终边与单位圆交于点P (x ,y ),那么sin α=y ,cos α=x ,tan α=yx(x ≠0)。
(2)几何表示:三角函数线可以看作是三角函数的几何表示。
正弦线的起点都在x 轴上,余弦线的起点都是原点,正切线的起点都是点(1,0)。
如图中有向线段MP ,OM ,AT 分别叫做角α的正弦线,余弦线和正切线。
1.区分两个概念(1)第一象限角未必是锐角,但锐角一定是第一象限角。
(2)不相等的角未必终边不相同,终边相同的角也未必相等。
2.一个口诀三角函数值在各象限的符号:一全正、二正弦、三正切、四余弦。
3.三角函数定义的推广设点P (x ,y )是角α终边上任意一点且不与原点重合,r =|OP |,则sin α=y r,cos α=x r ,tan α=y x。
一、走进教材1.(必修4P 10A 组T 7改编)角-225°=________弧度,这个角在第________象限。
答案 -5π4二2.(必修4P 15练习T 2改编)设角θ的终边经过点P (4,-3),那么2cos θ-sin θ=________。




