第一节化学能与热能
- 格式:doc
- 大小:27.50 KB
- 文档页数:3


第一节化学能与热能1.1化学键与化学反应中能量的变化一、知识要点I.前言内容煤、石油和天然气等化石燃料或它们的制品的燃烧所产生的热能从何而来?与化学物质及化学反应有什么关系?石灰石经高温煅烧生成生石灰,高温提供的热能在分解反应中起什么作用?实验:往一片棉花里加入两药匙的过氧化钠,然后滴加几滴水,观察现象。
为什么棉花可以燃烧?【归纳小结】物质在发生化学反应的同时都还伴随着能量的变化,这些能量变化通常又表现为的变化。
(除此之外还有的反应表现为还有、的变化)II、化学能与热能的相互转化一、化学能转化成热能【实验一】镁条与盐酸的反应能量的变化实验步骤:在试管里加入2-3 mL 6 mol/L 的盐酸,再插入镁条,立即用手触摸试管外壁,感受其温度,并用温度计测量溶液的温度,做好记录,当反应进行到大量气泡冒出时,再用手触摸试管外壁感受其温度,并用温度计测量溶液的温度,做好记录。
注意事项:镁与稀酸和弱酸反应现象不明显,常常需要加热,所以要选择强酸且浓度不要太低。
尽量使用纯度好的镁条,反应前要用砂纸,这样进行实验时,用手触摸才能明显感觉到反应放热,用温度计测量效果会更好。
实验现象:试管外壁和溶液的温度,反应后比反应前高,有大量气泡逸出。
实验结论:铝与盐酸反应产生H2,并放出热量。
该反应是放热反应方程式:Mg+2HCl == MgCl2+H2【实验二】B a(O H)2 ·8H2O 与NH4Cl 反应中的能量变化【投影实验】实验步骤实验现象得出结论1、将晶体混合后立即用玻璃棒快速搅拌混合物有刺激性气味的气体产生,该气体能使湿润的紫色石蕊试纸变蓝有气生成2、用手触摸烧杯下部感觉烧杯变凉反应3、用手拿起烧杯烧杯下面的带有几滴水的玻璃片(或小木板)粘到了烧杯底部反应热量使体系温度降低,使水结成冰4、将粘有玻璃片的烧杯放在盛有热水的烧杯上一会儿再拿起玻璃片脱离上面烧杯底部冰融化5、反应完后移走烧杯上的多孔塑料片,观察反应物混合物成糊状有水生成注意事项:这个实验成功的关键是在短时间内反应充分进行,使体系温度快速降低,将玻璃片上的水凝固。



第一节化学能与热能化学变化与生产、生活息息相关,化学变化过程中往往相伴有能量的变化,这些能量的变化往往以热量的形式表现出来,我们研究化学反应中的热效应,对化工生产有着重要的意义。
化工设备中热交换器、余热锅炉、热风炉等差不多上为了综合利用热效应、提高产品产率、降低成本、制造效益,因此,研究化学反应中的反应热,对化工生产适宜条件的选择和设备设计以及对热能的合理利用都有重要意义。
能源作为一种商品与国家战略、全球政治和实力紧密地交错在一起。
能源问题是涉及人类生活和世界进展的社会热点,随着社会的进展和人们生活水平的提高,对能源的需求量越来越大,而它对周围的环境也产生越来越大的阻碍。
在能源日趋紧张的今天,研究化学反应的反应热,如燃烧热、中和热等,对充分利用能源,提高能源利用率将有十分重要的意义。
电能是现代社会中应用最广泛、使用最方便、污染最小的一种二次能源,形形色色的各种电池(如干电池、燃料电池等)在工业生产、国家建设和日常生活中都有着广泛的应用。
这些电池差不多上将化学能转变成电能的装置。
我们明白,化学反应往往需要在一定的条件下进行。
例如,H2和N2化合生成NH3的反应,就需要在高温、高压和有催化剂存在的条件下进行。
可见,研究化学反应的条件对日常生活、工农业生产和科学研究等具有重要的意义。
什么缘故一个反应的进行需要如此或那样的条件呢?这就要从以下两个方面来认识:一个是反应进行的快慢,即化学反应速率问题;一个是反应进行的程度,也确实是化学反应限度而题。
这两个问题不仅是今后学习化学所必需的基础理论知识,也是选择化工生产适宜条件时所必须遵循的化学变化规律。
在本章里,我们将学习化学反应速率和化学平稳的有关知识,然后将运用化学反应速率和化学平稳等有关理论,分析一些简单的化工生产的实际问题。
第一节化学能与热能700多年前,闻名的意大利旅行家马克·波罗到过中国,看见中国人烧煤炼铁,这是他生平第一次看到煤做燃料,马克·波罗在他的游记里记载了这件新奇事。

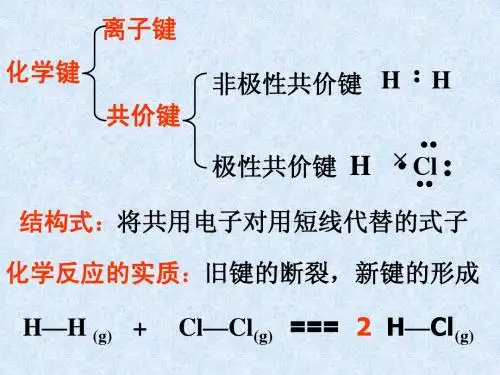
第二章化学反应与能量第一节化学能与热能一、化学键与化学反应中能量变化的关系1.化学反应中能量变化的原因——微观角度(1)化学反应的实质原子的重新组合,即反应物中旧化学键的断裂和生成物中新化学键的形成过程。
(2)化学反应中能量变化的原因①原因②实例断裂1mol H—H键(H—H―→2H)吸收436kJ能量,形成1mol H—H键(2H―→H—H)放出436kJ能量;断裂4mol C—H键(CH4―→C+4H)吸收1660kJ能量,形成1mol C—H键(C+H―→C—H)放出415kJ能量。
③结论化学反应中能量变化的主要原因是化学键的断裂和形成。
2.化学反应中能量变化的决定因素——宏观角度结论:化学反应中的能量变化决定于反应物的总能量与生成物的总能量的相对大小。
点拨物质具有的能量越低,断开其中的化学键需要的能量越多,该物质越稳定;物质具有的能量越高,断开其中的化学键需要的能量越少,该物质越不稳定。
二、化学能与热能的相互转化1.两个基本自然规律——“质量守恒”和“能量守恒”(1)质量守恒定律:自然界中的物质发生转化时总质量保持不变。
(2)能量守恒定律:不同形式的能量发生转换时总能量保持不变。
2.吸热反应和放热反应(1)定义吸热反应:吸收热量的化学反应;放热反应:放出热量的化学反应。
类型比较放热反应吸热反应定义放出热量的化学反应吸收热量的化学反应成因反应物具有的总能量大于生成物具有的总能量反应物具有的总能量小于生成物具有的总能量图示与化学键强弱的关系生成物分子成键时释放的总能量大于反应物分子断键时吸收的总能量生成物分子成键时释放的总能量小于反应物分子断键时吸收的总能量(2)实验探究①铝和稀盐酸的反应实验现象有气泡产生;用温度计测量,水银柱上升离子反应2Al +6H +===2Al 3++3H 2↑实验结论活泼金属与酸反应是放热反应②Ba(OH)2·8H 2O 和氯化铵反应实验现象闻到刺激性气味,烧杯壁发凉;玻璃片和烧杯黏结在一起,混合物呈糊状化学反应Ba(OH)2·8H 2O +2NH 4Cl===BaCl 2+2NH 3↑+10H 2O 实验结论该反应是吸热反应③盐酸与氢氧化钠反应实验现象混合后溶液温度比原两种溶液的温度高离子反应H ++OH -===H 2O实验结论酸碱中和反应是放热反应3.中和热酸和碱发生中和反应生成1_mol水时所释放的热量。

第一节 化学能与热能一.化学键与化学反应中能量变化的关系(微观解释)键能:拆开1mol 共价键所需的能量叫键能。
单位:kJ/mol 。
1mol H 2中含有1molH -H ,在250C 101kPa 条件下,断开1molH -H 重新变为H 原子要吸收436kJ 的能量,而由2molH 形成1molH -H 要 的能量。
旧化学键断裂 (吸收能量E 1) E 1 > E 2 反应 能量 (放出能量E 2) E 2 > E 1 反应 能量新化学键形成〖例题〗:键能:H -H 436kJ/mol 、Cl -Cl 243kJ/mol 、H -Cl 键会放出431kJkJ/mol试推测氢气和氯气反应生成氯化氢的反应是吸收热量还是放出热量?二、化学能与热能的相互转化(宏观解释)物质内部含有化学键,因而物质内部都储存有化学能...。
不同物质由于组成、结构不同,因而所包含的化学能不同..。
化学反应在发生过程中是吸收能量还是放出能量,取决于反应物和生成物总能量的相对大小。
如图:反应物总能量>生成物总能量,反应 能量反应物总能量<生成物总能量,反应 能量计算公式: 反应热(△H)=反应物键能总和—生成物键能总和2. 常见的放热反应和吸热反应 (1) 常见的放热反应:① 所有的中和反应② 所有的燃烧反应③ 大多数的化合反应④活波金属与水或酸的反应(2) 常见的吸热反应:①大多数分解反应②2NH 4Cl(s)+Ba(OH)2。
8H 2O=BaCl 2+2NH 3↑+10H 2O ③4CO 2+C=△2CO3.中和热:在稀溶液中,强酸和强碱发生中和反应生成1mol 水时的反应热。
注意:(1)强酸和强碱的稀溶液反应,其中和热相等,约是57.3kJ/mol 。
H +(aq)+OH -(aq)=H 2O(l) △H = -57.3kJ/mol(2)对于强酸和弱碱,或弱酸和强碱的稀溶液反应,中和热一般低于57.3kJ/mol ,因为弱电解质的电离是吸热的。


化学能与热能的相互转化一、化学能1、定义:将其它形式的能量储存在化学物质中,使化学物质具有的能量。
2、特点:⏹不同的物质的化学能不同⏹同一物质,量不同储存的化学能不同⏹不能直接测定⏹人摄取的化学能,转化为新物质的化学能及其它形式的能二、化学反应中的能量变化:化学反应伴随能量变化是化学反应的一大特征1、化学键与化学反应中能量变化的关系(微观)(1)键能:断裂1mol化学键要吸收的能量。
(2)键能的大小与物质稳定性的关系:物质化学性质越活拨,键能越小(3)关系:反应物键能总和>生成物键能总和→吸热反应反应物键能总和<生成物键能总和→放热反应2、化学键与化学反应中能量变化的关系,从键能角度分析:E (断裂):化学键断裂需吸收的能量 E (形成):化学键形成所释放的能量例(1)若E (断裂) >E (形成) ,则该反应需能量(2)若E (断裂) <E (形成) ,则该反应会能量键能:键能越大,说明要使该化学键断裂需要吸收的能量越多,即表示该化学键越牢固。
键能越大,说明形成该化学键时放出的能量越多,即含有该键的物质所蕴藏的能量(化学能)越低。
综上所述,键能越大,含有该化学键的物质的化学能就越低,物质越稳定。
练习:(1)某物质较活泼,即该物质所蕴藏的能量较(即所含化学能),该物质较,该物质中的化学键断裂,化学键的键能较。
(2)为什么“化学反应必然伴随着能量的变化” 呢?3、化学反应过程是吸收能量还是放出能量决定于反应物的总能量与生成物总能量的相对大小。
E(反应物):反应物的总能量E(生成物):生成物的总能量例(1)若E(反应物)>E(生成物),该反应能量;(2)若E(反应物)<E(生成物),该反应能量。
反应物的能量之和E反(断开化学键K断)生成物的能量之和E生(生成化学键K成)例(1)若E反> E生,放出能量。
(2)若E反< E生,吸收能量。
或者(1)若K断> K成,吸收能量。
(2)若K断< K成,放出能量。

第一节 化学能与热能【学习目标】1、理解化学反应中能量的变化; 2、熟练掌握化学能与热能的相互转化。
【自主学习】【精讲点拨】一、 化学键与化学反应中能量变化的关系 1、 化学键断裂与形成角度旧键断裂: 能量新建形成: 能量⑴化学反应的本质: ⑵断裂化学键 能量,形成化学键 能量。
是化学反应中能量变化的主要原因。
2、 物质本身能量角度化学反应时吸收能量还是放出能量取决于 。
⑴E (反应物) > E (生成物),反应 能量,为 反应。
⑵E (反应物) < E (生成物),反应 能量,为 反应。
二、 化学能与热能的相互转化 1、 吸热反应与放热反应2、常见的吸、放热现象【练习达标】1、下列说法正确的是 ( )A 、 物质发生化学反应都伴随着能量变化B 、 伴有能量变化的物质变化都是化学变化C 、 在一个化学反应中,反应物的总能量与生成物的总能量一定相同D 、在一个化学反应中,反应物的总能量一定高于生成物的总能量2、对放热反应:A +B===C +D ,以下说法一定正确的是(EA 、EB 、EC 、ED 分别表示物质A 、B 、C 、D 所具有的能量)( )A .EA>EB B .EA>EB +EC C .EA +EB>EC +ED D .EA +EB<EC +ED 3、下列变化中属于吸热反应的是( )①液态水汽化 ②将胆矾加热变为白色粉末 ③浓硫酸稀释 ④氯酸钾分解制氧气 ⑤生石灰跟水反应生成熟石灰化学反应A.①④ B.②③ C.①④⑤ D.②④4、下列反应中属吸热反应的是()A、镁与盐酸反应放出氢气B、氢氧化钠与盐酸的反应C、硫在空气或氧气中燃烧D、Ba(OH)2•8H2O与NH4Cl反应5、下列各图中,表示正反应是吸热反应的图是()6、一种“即食即热型快餐”适合外出旅行时使用。
其内层是用铝箔包裹的、并已加工好的真空包装食品,外层则是分别包装的两包化学物质,使用时拉动预留在外的拉线,使这两种化学物质反应,此时便可对食物进行加热,这两包化学物质最合适的选择是( )A.浓硫酸与水B.生石灰与水C.熟石灰与水D.氯化钠与水7、已知金刚石在一定条件下转化为石墨是放热的。
第一节 化学能与热能第二课时 化学能与热能的相互转化目标定位:1.通过实验和生活实践,了解化学能和热能的相互转化。
2.理解吸热反应和放热反应以及中和热的概念。
3.举例说明常见的吸热反应和放热反应。
学习重点:识记常见的吸热反应和放热反应。
学习难点:判断常见的吸热反应和放热反应。
知识链接:一:化学能与热能:1. 定律和 定律是两条基本的自然定律。
化学能是能量的一种形式,它可以转化为其他形式的能量,如 和 等,在转化时,也要遵守 定律。
2.化学反应中的能量变化,通常表现为 的变化,即 或者 。
下面我们通过几个实验来认识和感受化学能与热能的相互转化:【自主探究三】认真阅读《学习的艺术》第24--25页“中和热的测定”,回答下列问题:1.什么是中和热?2.如果要通过实验来测定盐酸与氢氧化钠反应的中和热,你认为在设计实验装置和操作时应注意哪些问题?你准备如何设计并进行实验?请与大家讨论,交流。
(1)烧杯间填满碎泡沫塑料的作用是(2)环形玻璃搅拌棒的作用是(3)实验中氢氧化钠稍过量的原因是(4)实验中如果把盐酸换成等物质的量的醋酸,测出的结果会 ,原因是(5)实验中如果把盐酸换成等物质的量的硫酸,测出的结果会 ,原因是 归纳总结:【一】吸热反应和放热反应的判断:反应过程中放出热量的反应为放热反应,吸收热量的反应为吸热反应。
常见的放热反应有哪些?常见的吸热反应有哪些?1.根据实例判断。
2.根据生成物和反应物总能量的相对大小判断:3.根据生成物和反应物的相对稳定性判断:【二】溶解过程中的热效应:一些物质溶于水,也会有吸热和放热现象。
如浓硫酸、氢氧化钠固体等溶于水会放热;硝酸铵固体、氯化铵固体等溶于水要吸热;氯化钠、酒精等溶于水,热效应不大。
【三】物质“三态”变化过程中的热效应:特别提醒:一个反应是放热反应还是吸热反应与其是否需要加热无关,需要加热的反应不一定是吸热反应,不需要加热的反应也不一定是放热反应。
如氢气、一氧化碳等大多数气体需要点燃才能进行燃烧属放热反固态 ( ) ( ) 液态 气态 ( ) ( )应,Ba(OH)2·8H2O和NH4Cl属吸热反应但在常温下就能进行。
第一节化学能与热能
第二课时化学能与热能的相互转化
目标定位:
1.通过实验和生活实践,了解化学能和热能的相互转化。
2.明白得吸热反应和放热反应以及中和热的概念。
3.举例讲明常见的吸热反应和放热反应。
学习重点:识记常见的吸热反应和放热反应。
学习难点:判定常见的吸热反应和放热反应。
知识链接:
一:化学能与热能:
1. 定律和定律是两条差不多的自然定律。
化学能是能量的一种形式,它能够转化为其他形式的能量,如和等,在转化时,也要遵守定律。
2.化学反应中的能量变化,通常表现为的变化,即或者。
下面我们通过几个实验来认识和感受化学能与热能的相互转化:
【自主探究三】认真阅读«学习的艺术»第24--25页〝中和热的测定〞,回答以下咨询题:
1.什么是中和热?
2.假如要通过实验来测定盐酸与氢氧化钠反应的中和热,你认为在设计实验装置和操作时应注意哪些咨询题?你预备如何设计并进行实验?请与大伙儿讨论,交流。
〔1〕烧杯间填满碎泡沫塑料的作用是
〔2〕环形玻璃搅拌棒的作用是
〔3〕实验中氢氧化钠稍过量的缘故是
〔4〕实验中假如把盐酸换成等物质的量的醋酸,测出的结果会,缘故是
〔5〕实验中假如把盐酸换成等物质的量的硫酸,测出的结果会,缘故是
归纳总结:
【一】吸热反应和放热反应的判定:反应过程中放出热量的反应为放热反应,吸取热量的反应为吸热反应。
常见的放热反应有哪些?常见的吸热反应有哪些?
1.依照实例判定。
2.依照生成物和反应物总能量的相对大小判定:
3.依照生成物和反应物的相对稳固性判定:
【二】溶解过程中的热效应:一些物质溶于水,也会有吸热和放热现象。
如浓硫酸、氢氧化钠固体等溶于水会放热;硝酸铵固体、氯化铵固体等溶于水要吸热;氯化钠、酒精等溶于水,热效应不大。
【三】物质〝三态〞变化过程中的热效应:
固态
〔〕
〔〕液态气态
〔〕
〔〕
专门提醒:一个反应是放热反应依旧吸热反应与其是否需要加热无关,需要加热的反应不一定是吸热反应,不需要加热的反应也不一定是放热反应。
如氢气、一氧化碳等大多数气体需要点燃才能进行燃烧属放热反应,Ba〔OH〕2·8H2O和NH4Cl属吸热反应但在常温下就能进行。
二:化学能与热能相互转化的应用:
化学反应相伴着的变化是化学反应的差不多特点之一。
化学物质中的化学能通过反应转化为,是人类生存和进展的动力之源;而转化为又是人类进行化学科学研究和制造新物质不可或缺的条件和途径。
经典例题:
例1:以下表达中正确的选项是〔〕
A.需要加热的反应差不多上吸热反应
B.放热反应不需加热或点燃等条件即可发生
C.化学能只能以热能的形式开释
D.燃烧反应差不多上放热反应
例2:〔双选〕石墨和金刚石差不多上碳元素的单质,石墨在一定条件下可转化为金刚石,12g石墨完全转化为金刚石时,要吸取E kJ能量。
以下讲法中正确的选项是〔〕
A.石墨不如金刚石稳固
B.金刚石不如石墨稳固
C.等质量的石墨与金刚石完全燃烧,金刚石放出的热量多
D. 等质量的石墨与金刚石完全燃烧,石墨放出的热量多巩固训练:
〔〕1.以下物质加入水中显著放热的是
A.生石灰
B.酒精
C.固体氯化钠
D.固体硝酸钾
〔〕2.以下化学反应确信是放热反应的是
A.氧化还原反应
B.离子反应
C.复分解反应
D.缓慢氧化
〔〕3.以下反应既是氧化还原反应又是吸热反应的是
A.铝片与盐酸的反应
B. Ba〔OH〕2·8H2O和NH4Cl的反应
C.灼热的碳与二氧化碳的反应
D.甲烷在氧气中的燃烧反应
〔〕4.以下讲法中正确的选项是
A.绿色植物进行光合作用时,太阳能转化为化学能
B.生物能是与化学反应无关的一种能源
C.白炽灯工作时电能全部转化为光能
D.葡糖糖在人体内的氧化是放热反应
〔〕5.1.5L1mol/L的硫酸溶液与2.00L1mol/L的氢氧化钠溶液完全反应放出114.6kJ热量,那么可推算出该条件下酸与碱反应的中和热为
A.57.3kJ/mol
B.114.6kJ/mol
C.171.9kJ/mol
D.229.2kJ/mol
〔〕6.在相同状况下,同一化学键断裂需要吸取的能量等于形成该化学键放出的能量,以下讲法正确的选项是
A.电解熔融的Al2O3 能够制得金属铝和氧气,该反应是一个放出能量的反应
B.水分解产生氢气和氧气时放出能量
C.在相同状况下,反应:2SO2 + O2 ===2 SO3是一个放出能量的反应,那么2 SO3===2SO2 + O2是一个吸取能量的反应
D.氯化氢分解成氢气和氯气时放出能量
〔〕7.〝生物质〞是指由植物或动物生命体衍生得到的物质的总称。
作为人类解决能源危机重要途径之一的〝生物质能〞,要紧指用树木,庄稼,草类等植物直截了当或间接提供的能量。
古老的刀耕火种,烧柴做饭,烧炭取暖等粗放用能方式正在被现代科学技术所改变。
〔〕⑴下面有关〝生物质能〞的讲法,不正确的选项是
A.利用生物质能确实是间接利用太阳能。
B.生物质能源是可再生的能源。
C.生物质能源是解决农村能源的要紧途径。
D.生物质能的缺点是严峻污染环境。
〔〕⑵沼气是有机废弃物〔树叶,秸秆,草类及垃圾,粪便等〕在隔绝空气的条件下发酵分解而成的气体,要紧成分是甲烷。
农村沼气池中发酵后的池底剩余物是专门好的沤肥。
以下有关结论中,错误的选项是
A.沼气是一种清洁的能源
B.使用沼气作能源能够爱护森
林
C.使用沼气给人民生活带来了不便
D.使用沼气是对化学能的充分利用课后反思:。