配合物的基本概念
- 格式:pdf
- 大小:94.58 KB
- 文档页数:2

配合物的基本概念一、 配位化合物及其组成配位化合物1. 中心离子:中心(中央)离子(或原子)也称为络合物形成体,是配合物的核心部分,位于络离子(或分子)的中心。
2. 配位体:是在中心离子周围的阴离子或分子,简称配体,其中直接与中心离子结合的原子叫配位原子。
单基配位体配位体按所含配位原子的数目多基配位体3. 配位数:与中心离子直接结合的配位原子数目。
影响配位数大小的因素:4. 配离子的电荷:等于中心离子和配位体总电荷的代数和。
配离子 电荷5. 配位化合物的定义:凡含有配位离子(或配位分子)的化合物叫配位化合物。
二、 配位化合物的命名配位化合物的命名遵循一般无机物命名原则,命名配位化合物时,不论配离子是阴离子还是阳离子,都是阴离子名称在前,阳离子名称在后。
其中配位个体的命名顺序为:配位体数(汉字)――配位体名称(如有不同配位体时,阴离子在先,分子在后)――“合”字――中心离子名称及其氧化数(在括号内以罗马字说明)四氯合铂(II )酸六氨合铂(II )有的配体在与不同的中心离子结合时,所用配位原子不同,命名时应加以区别。
如: 六异硫氰酸根合铁(III)酸钾 硝酸一氯一硫氰根二乙二胺合钴(III ) +])([23NH Ag 1021+=⨯+++243])([NH Zn 2042+=⨯++-36][AlF 3)1(63-=-⨯++463])([63CS N Fe K ∙32]))(([NO en CN S CoCl ∙三硝基三氨合钴(III ) 硫酸一亚硝酸根五氨合钴(III) ])()([332NH NO Co ∙453]))(([SO NH ONO Co ∙。




配合物一、介绍配合物是由一个或多个中心金属离子与周围的配体形成的化合物。
配合物在化学和生物领域中具有重要的应用。
本文将介绍配合物的基本概念、分类、配位键以及其在化学和生物学中的应用。
二、配合物的基本概念1. 配体:配体是与金属离子通过配位键相连的分子或离子。
配体可以是阳离子、阴离子或中性分子。
2. 配位键:配位键是配体中的一个或多个原子与金属离子之间形成的化学键。
配位键可以是共价键或离子键。
3. 配合物的化学式:配合物的化学式通常以金属离子作为中心,配体写在金属离子周围,并用括号括起来。
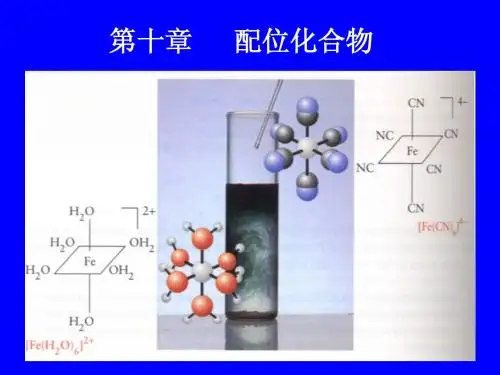
例如,[Fe(H2O)6]2+代表铁离子与六个水分子形成的配合物离子。
三、配合物的分类1. 根据配体的性质:配合物可以根据配体的性质分为无机配合物和有机配合物。
无机配合物通常由无机配体组成,如水分子、氨分子等。
有机配合物则由有机配体组成,如有机胺、有机酸等。
2. 根据配位键的数量:配合物可以根据配位键的数量分为单核配合物和多核配合物。
单核配合物是指一个金属离子与一个配体形成配合物,而多核配合物则是指一个金属离子与多个配体形成配合物。
3. 根据配位键的类型:配合物可以根据配位键的类型分为配位键只有金属离子和配体之间的共价键配合物(如钌烯配合物)、配位键只有金属离子和配体之间的离子键配合物(如六氰合铁配合物)以及配位键同时存在共价键和离子键的配合物(如铂阴离子配合物)。
四、配合物的配位键形成机制配位键的形成机制可以通过以下几种方式实现:1. 配位键通过配体的配位效应形成。
配体中的原子或离子发生配位效应,通过与金属离子形成化学键,从而形成配位键。
2. 配位键通过酸碱反应形成。
当金属离子作为酸时,它可以接受一个或多个配位键,与配体形成配合物。
当金属离子作为碱时,它可以损失一个或多个配位键,从而形成配合物。
3. 配位键通过配体之间的配位效应形成。
在多核配合物中,配体之间可以通过配位键相互连接,形成配合物的骨架结构。
五、配合物在化学中的应用1. 催化剂:很多配合物可以作为催化剂,在化学反应中起到催化作用。




配合物的基本概念第五章配位化合物配位化合物简称配合物,又称络合物,是一类非常广泛和重要的化合物。
随着科学技术的发展,它在科学研究和生产实践中显示出越来越重要的意义,配合物不仅在化学领域里得到广泛的应用,并且对生命现象也具有重要的意义。
例如,在植物生长中起光合作用的叶绿素,是一种含镁的配合物;人和动物血液中起着输送氧作用的血红素,是一种含有亚铁的配合物;维生素B12是一种含钴的配合物;人体内各种酶(生物催化剂)的分子几乎都含有以配合状态存在的金属元素。
因此学习有关配合物的基本知识,对学习医学来说也是十分必要的。
第一节配合物的基本概念一、配合物的定义如果在硫酸铜溶液中加入氨水,首先可得到浅蓝色碱式硫酸铜[Cu (OH)2]SO4沉淀,继续加入氨水,则沉淀溶解而得到深蓝色溶液。
显然由于加入过量的氨水,NH3分子与Cu2+离子间已发生了某种反应。
经研究确定,在上述溶液中生成了深蓝色的复杂离子[Cu(NH3)4] 2+。
从溶液中还可结晶出深蓝色[[Cu(NH3)4]SO4晶体。
这说明CuSO4溶液与过量氨水发生了下列反应:或离子方程式已知NaCN,KCN有剧毒,但是亚铁氰化钾(K4[Fe(CN)6])和铁氰化钾(K3[Fe(CN)6])虽然都含有氰根,却没有毒性,这是因为亚铁离子或铁离子与氰根离子结合成牢固的复杂离子,失去了原有的性质。
由一个阳离子(如Cu2+或Fe3+)和几个中性分子(如NH3)或阴离子(如CN-)以配价键结合而成的,具有一定特性的复杂粒子,其带有电荷的叫配离子或络离子,其不带电荷的叫配合分子或络合分子。
配合分子或含有配离子的化合物叫配合物。
例如:[Cu(NH3)4]SO4,K4[F e(CN)6],K3[Fe(CN)6],K2[HgI4],[Ag(NH3)2]NO3,[Pt(NH3)2C L4],[Co(NH3)5(H2O)]CL3等都是配合物。
二、配合物的组成(一)中心离子中心离子也称配合物的形成体,它是配合物的核心部分,位于配离子(或分子)的中心,一般都是带正电荷的,具有空的价电子轨道的阳离子。
配合物的基本概念
一、 配位化合物及其组成
配位化合物
1. 中心离子:中心(中央)离子(或原子)也称为络合物形成体,是配合物的核心部分,位于络离子(或分子)的中心。
2. 配位体:是在中心离子周围的阴离子或分子,简称配体,其中直接与中心离子结合的原子叫配位原子。
单基配位体
配位体按所含配位原子的数目
多基配位体
3. 配位数:与中心离子直接结合的配位原子数目。
影响配位数大小的因素:
4. 配离子的电荷:等于中心离子和配位体总电荷的代数和。
配离子 电荷
5. 配位化合物的定义:凡含有配位离子(或配位分子)的化合物叫配位化合物。
二、 配位化合物的命名
配位化合物的命名遵循一般无机物命名原则,命名配位化合物时,不论配离子是阴离子还是阳离子,都是阴离子名称在前,阳离子名称在后。
其中配位个体的命名顺序为:
配位体数(汉字)――配位体名称(如有不同配位体时,阴离子在先,分子在后)――“合”字――中心离子名称及其氧化数(在括号内以罗马字说明)
四氯合铂(II )酸六氨合铂(II )
有的配体在与不同的中心离子结合时,所用配位原子不同,命名时应加以区别。
如: 六异硫氰酸根合铁(III)酸钾 硝酸一氯一硫氰根二乙二胺合钴(III ) +
])([23NH Ag 1021+=⨯+++243])([NH Zn 2042+=⨯++-36][AlF 3)1(63-=-⨯++463])([63CS N Fe K ∙
3
2]))(([NO en CN S CoCl ∙
三硝基三氨合钴(III ) 硫酸一亚硝酸根五氨合钴(III) ]
)()([332NH NO Co ∙4
53]))(([SO NH ONO Co ∙。