农杆菌转化法基本操作与理论课件
- 格式:ppt
- 大小:467.50 KB
- 文档页数:5


农杆菌转化法详细过程
一、质粒的构建
1、结合胞外表达载体DNA片段:根据需要,挑选合适的质粒载体,通常是常用的pUC18或pUC19,然后从受体DNA片段中提取事先选择好的促进脱附酶及其他酶结合位;
2、PCR扩增:使用上述质粒模板进行PCR扩增,以获得清洁的受体片段;
3、克隆:把扩增片段和质粒模板克隆到同一质粒中,然后克隆到载体存储库中,以创建定向载体用于后续研究。
二、原核转化
1、准备转化粒菌:在装满氯化物的快速离心管中,将转化菌株(一般为质粒转录系) 用冰凉的悬浮液制成2X数量的悬淋液;
2、增加plasmid 质粒:在用有抗生素控制的细菌方法中,增加转换用材料,如plasmid质粒,磷酸二钙和CaC1₂,以及可能的其他试剂;
3、原核转化:将上述的悬浮液(AP出水液)添加到悬淋液中,然后加入CaC1₂和磷酸二钙,用低频超声处理混合液使其充分作用10分钟;
4、选择转化的细胞:将处理过的转化液投入加有抗生素的培养基中,然后将这些细胞培养到辅助抗生素中,以选择转化的细胞,在抗生素抑制剂中,该细胞会死亡;
5、筛选和鉴定:原核基因转换后,体外状态选择一般会获得若干转换抗性的菌株,最终进行PCR、测序或其他方法以鉴定突变体,以确定该菌株具有最终突变基因。


农杆菌转化法原理农杆菌转化法是一种常用的植物基因转化技术,其原理是利用农杆菌在植物体内引起植物细胞的转化,使外源基因被导入植物细胞内,从而实现对植物基因的改造。
这项技术在农业生产和基因工程领域有着广泛的应用,为改良作物品种、提高农作物产量、抗病虫害等方面提供了有力的技术支持。
农杆菌转化法的原理主要包括以下几个关键步骤:1. 农杆菌感染植物细胞。
首先,将含有外源基因的质粒DNA导入到农杆菌的Ti质粒中,然后将农杆菌与植物组织接触,使其感染植物细胞。
农杆菌通过其特殊的毛状附着器将Ti质粒转移到植物细胞内。
2. 植物细胞内基因导入。
农杆菌感染植物细胞后,Ti质粒中的外源基因会被转移到植物细胞内。
这些外源基因可以是对抗病虫害、提高产量或改良品质的基因,通过农杆菌的介导,成功导入到植物细胞内。
3. 外源基因整合到植物基因组。
一旦外源基因进入植物细胞内,它们会与植物细胞的染色体发生重组,将外源基因整合到植物基因组中。
这样,外源基因就成为植物细胞的一部分,可以被遗传到后代植物中。
4. 外源基因表达。
一旦外源基因整合到植物基因组中,它们就会开始在植物细胞内进行表达。
外源基因的表达可以使植物获得新的性状,比如抗病虫害、耐逆境等,从而实现对植物性状的改良。
农杆菌转化法的原理简单清晰,通过这种方法可以实现对植物基因的改造,为农业生产提供了重要的技术手段。
在实际应用中,农杆菌转化法已经成功应用于多种作物,如水稻、小麦、玉米、大豆等,为作物的抗病虫害、耐逆境等性状的改良提供了有效途径。
总的来说,农杆菌转化法作为一种重要的植物基因转化技术,其原理清晰,操作简单,成功率高,因此在农业生产和基因工程领域有着广泛的应用前景。
随着技术的不断进步和完善,相信农杆菌转化法将会为农业生产和作物改良带来更多的机遇和挑战。

农杆菌转化实验步骤
农杆菌转化实验步骤
农杆菌转化是一种常用的基因转移技术,可以将外源DNA导入植物细胞。
下面是农杆菌转化实验的基本步骤:
1. 制备农杆菌:首先,选择适合的农杆菌株,常用的是农杆菌株Agrobacterium tumefaciens。
接种农杆菌于适宜的培养基中,培养至合适的生长期。
2. 构建质粒:在进行转化实验前,需要构建包含目标基因的质粒。
质粒可以通过常规的分子生物学技术,如PCR扩增、限制性酶切和连接等方法来获得。
3. 准备细菌:将构建好的质粒转化到农杆菌中。
通常采用电穿孔或热激方法,使质粒能够进入农杆菌内。
4. 感染植物:选择适当的植物愈伤组织或幼苗作为接受体,将其暴露在含有农杆菌的培养基中。
农杆菌会侵入植物细胞,并将质粒转移
到植物基因组中。
5. 抗生素筛选:转化后的细菌通常在培养基中含有特定抗生素。
将被转化的植物细胞接种于含有抗生素的选择培养基中,该抗生素能够选择出已转化的细胞。
只有具备目标基因的细胞能够生长并形成抗性。
6. 再生植物:选定抗生素抗性的植物细胞,进一步培养和处理以促进其发育和增殖。
通过激素处理和适当的培养条件,可以使其分化成完整的植株。
7. 验证转化:最后,通过分子生物学技术,如PCR和Southern blot 分析,来确认转化的植物是否成功地获得了外源基因,以及其在植物细胞中的表达。
农杆菌转化实验是一种常用且有效的方法,可用于植物基因工程及改良研究。
通过以上步骤,可以成功将目标基因导入植物细胞中,以获得具有所需性状的转基因植物。

农杆菌感受态制备与转化普通农杆菌感受态制备与转化:方案一1. 挑单菌落于2ml YEP培养基(含Rif20mg/ml)中28℃过夜活化。
2. 取2ml过夜菌液接种于50ml YEP培养基中28℃生长至OD600约等于0.5左右(4hr)。
3. 5k rpm离心5分钟。
4. 在10ml 0.15M NaCl中悬浮细胞。
5. 5 krpm离心5分钟,悬浮细胞于20ml冰预冷的CaCl2。
如不是马上使用,可以将之按200ul分裝储存于-80℃待用。
6. 加1ug DNA于200ul感受态细胞中,冰上放置30分钟。
7. 液氮中冷冻1分钟。
8. 37℃水浴溶化细胞。
9. 加1ml YEP培养基,28℃摇床培养2-4hr(低速)。
10.离心1分钟,悬浮细胞在100ul YEP培养基中。
11.涂板,28℃培养2-3天。
电转农杆菌感受态细胞制备与转化方案二1. 挑取单克隆接种于2mlYEP(含50mg/l链霉素)液体培养基,28℃,250rpm,振荡培养过夜。
(如用5mlYEP,需培养36h)2. 将菌液按1:100转移至200mlYEP(含50mg/l链霉素)培养液中,28℃,250rpm,振荡培养至OD=0.3(约4~5h)。
3. 转入50ml的无菌离心管,4℃,4000rpm离心10min,弃上清。
4. 用20ml冰浴的HEPES(1mM,PH-7.0)重悬。
5. 4℃,4000rpm离心10min,弃上清。
6. 重复4、5步骤2~3次。
7. 用2ml冰浴的10%甘油重悬。
8. 每管100ul1.5ml无菌的Eppendorf管中,-70℃保存。
1mM HEPES的配制:称取0.119gHEPES(MW 238.3)粉末,加水溶解,定容至500ml,用NaOH调pH至7.0,灭菌后待用。
注:HEPES需现用现配。
电击法转化农杆菌感受态细胞1. 取出农杆菌感受态细胞于冰上冻融。
2. 加2μl质粒DNA于100μl感受态细胞中,用枪头轻轻搅拌混匀。

农杆菌转化法的原理
农杆菌转化法是一种利用外源DNA和农杆菌介导的在细胞内表达的方法。
该方法最早由美国生物化学家Herbert Boyer于1973年提出,并于1977年被用于创造第一个基因突变植物。
自此,农杆菌转化技术在分子生物学、分子遗传学、细胞生物学等领域取得了巨大成功,成为近十几年来生物技术发展中最重要的技术之一。
农杆菌转化法的原理是将外源DNA片段植入特定的农杆菌中,然后让农杆菌介导将外源DNA片段植入到宿主细胞中,以达到改变宿主基因的目的。
具体而言,首先需要在细胞中引入一种叫做“质粒”的载体,它可以携带外源DNA片段,然后在细胞中的特定位置,利用农杆菌提供的一些促进基因转移的酶将质粒植入细胞中。
农杆菌转化法为研究植物基因组提供了一种灵活、可靠、快速且高效的方法,可以用来改变植物的遗传特性,控制植物的生长发育状态,以及提高植物的产量和质量。
而且,农杆菌转化技术还可以用来为研究人员提供精确的模型,以更好地理解植物的基因表达和调控机制。
此外,农杆菌转化法还可以用于制造生物材料和医药,以及制造其他用途的产品。
因此,农杆菌转化法在生物技术领域具有重要的应用价值,是生物技术发展中最重要的技术之一。

农杆菌转化法的过程农杆菌转化法(Agrobacterium-mediated transformation)是一种广泛应用于农业科学和生物技术研究的基因转化方法。
该方法利用一种土壤细菌,农杆菌(Agrobacterium tumefaciens)将外源基因转移到植物细胞中。
农杆菌转化法具有转化效率高、适用广泛、转基因稳定等优点,已被广泛应用于农作物和果树的遗传改良、抗病抗虫育种等领域。
1.细胞培养首先,需要从植物中获得要进行基因转化的组织细胞(通常是幼苗的果荚或子叶)。
这些组织细胞被培养在含有植物生长激素的富营养培养基中,使其加速分裂和生长。
2.农杆菌培养将农杆菌菌株(通常是含有外源基因的农杆菌株)培养在液体培养基中。
培养基中含有特定的营养物质和抗生素,以促进菌株的生长和维持菌株稳定。
3.动态系统将培养好的植物细胞和农杆菌菌液混合,形成动态系统。
混合液中的植物组织和农杆菌菌株会发生暂时性的融合并进入植物细胞。
4.感染阶段通过共培养或注射等方式,使动态系统中的农杆菌菌株进入植物细胞。
农杆菌会通过特定的受体识别和感染植物细胞。
5.DNA传递一旦农杆菌菌株感染了植物细胞,它会将其含有外源基因的DNA片段传递给植物细胞。
这个DNA片段通常是携带目标基因和选择标记基因的载体。
选择标记基因可以使得转化后的植物细胞在包含选择抗生素的培养基上存活。
6.培养和筛选转化后的植物细胞被转移到含有选择抗生素的培养基中,使得只有携带外源基因的细胞可以生长和分裂。
这样就可以筛选出带有目标基因的转化植物细胞。
7.植株再生将筛选出的转化细胞培养到适当的大小和形态后,再将其转移到含有特定激素的培养基中,以促使其分化为整个植株。
经过适当的培养和生长,就可以获得转基因植物。
总结来说,农杆菌转化法通过将植物细胞和农杆菌菌株进行共培养,使农杆菌将外源基因传递到植物细胞中,然后通过筛选和培养,最终获得转基因植物。
这种方法在农业科学和生物技术研究中具有广泛的应用前景。
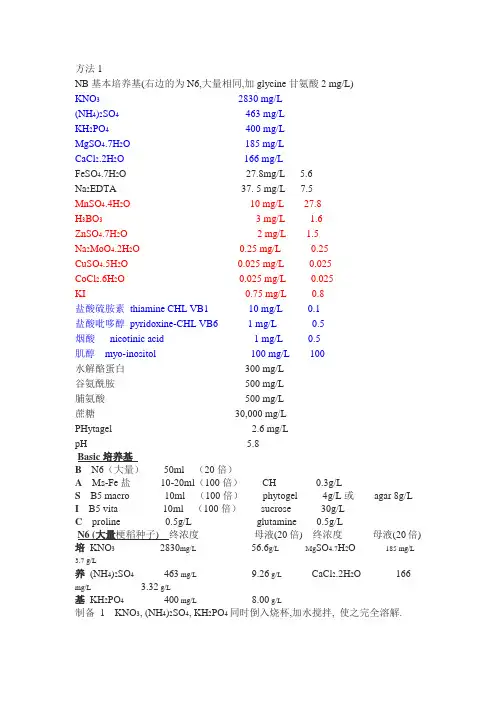
方法1NB基本培养基(右边的为N6,大量相同,加glycine甘氨酸2 mg/L)KNO3 2830 mg/L(NH4)2SO4 463 mg/LKH2PO4 400 mg/LMgSO4.7H2O 185 mg/LCaCl2.2H2O166 mg/LFeSO4.7H2O 27.8mg/L 5.6Na2EDTA 37. 5 mg/L 7.5MnSO4.4H2O 10 mg/L 27.8H3BO3 3 mg/L 1.6ZnSO4.7H2O 2 mg/L 1.5Na2MoO4.2H2O 0.25 mg/L 0.25CuSO4.5H2O 0.025 mg/L 0.025CoCl2.6H2O 0.025 mg/L 0.025KI 0.75 mg/L 0.8盐酸硫胺素thiamine CHL VB1 10 mg/L 0.1盐酸吡哆醇pyridoxine-CHL VB6 1 mg/L 0.5烟酸nicotinic acid 1 mg/L 0.5肌醇myo-inositol 100 mg/L 100水解酪蛋白300 mg/L谷氨酰胺500 mg/L脯氨酸500 mg/L蔗糖30,000 mg/LPHytagel 2.6 mg/LpH 5.8Basic培养基B N6(大量)50ml (20倍)A Ms-Fe盐10-20ml(100倍)CH 0.3g/LS B5 macro 10ml (100倍)phytogel 4g/L或agar 8g/L I B5 vita 10ml (100倍)sucrose 30g/LC proline 0.5g/L glutamine 0.5g/LN6 (大量梗稻种子) 终浓度母液(20倍) 终浓度母液(20倍)培KNO32830mg/L56.6g/L Mg SO4.7H2O185 mg/L 3.7 g/L养(NH4)2SO4463 mg/L9.26 g/L CaCl2.2H2O 166 mg/L 3.32 g/L基KH2PO4400 mg/L8.00 g/L制备1 KNO3, (NH4)2SO4, KH2PO4同时倒入烧杯,加水搅拌, 使之完全溶解.2 Mg SO4.7H2O 先溶于加了100ML水的烧杯中溶解后再缓慢倒入1中,边倒边搅, 不能有沉淀.3 CaCl2.2H2O的配制同Mg SO4.7H2O4 配好后放于棕色瓶4℃保存MS(大量籼稻种子)终浓度母液(20倍) 终浓度母液(20倍)培KNO31900 mg/L38g/L Mg SO4.7H2O 370 mg/L7.4 g/L养NH4NO3 1650 mg/L33 g/L CaCl2.2H2O 440 mg/L8.8 g/L基KH2PO4170 mg/L 3.4 g/L制备1 KNO3, NH4NO3, Mg SO4.7H2O同时倒入烧杯,加水搅拌2 KH2PO4先溶于加了100ML水的烧杯中溶解后再缓慢倒入1中,边倒边搅,3 CaCl2.2H2O同KH2PO44 配好后放于棕色瓶4℃保存Ms(大量花药用)终浓度母液(20倍) 终浓度母液元素KNO32830mg/L56.6g/L Mg SO4.7H2O 370 mg/L7.4 g/L培养(NH4)2SO4 231 mg/L 4.62 g/L CaCl2.2H2O 160 mg/L3.2 g/L基KH2PO4641 mg/L12.82 g/L制备1 KNO3, (NH4)2SO4, KH2PO4同时倒入烧杯,加水搅拌2 Mg SO4.7H2O 先溶于加了100ML水的烧杯中溶解后再缓慢倒入1中,边倒边搅,不能有沉淀.CaCl2.2H2O的配制同Mg SO4.7H2O3 配好后放于棕色瓶4℃保存YM脓杆菌培养基KH2PO4 0.5g/L Mannitol 10g/L L-Glutamine2g/LNaCl 0.2g/L M g SO40.2g/L Yeast extract0.3g/LAgar 15g/L PH=7.0诱导愈伤、继代培养基basic+2,4-D(2mg/L) PH=5.8共培养培养基液体:N6(大)+Fe+B5(micro)+B5(vita)+ sucrose(前四项与basic相同)+ 肌醇2g/L+ CH500mg/L+phytogel+0.1%AS固体:N6(大)+Fe+B5(micro)+B5(vita)+ sucrose(前四项与basic相同) + 肌醇2g/L+ CH500mg/L+2,4-D (2mg/L)+ phytogel +0.1%ASPH=5.5 加2,4-D前后都要调PH值.灭完菌,温度降下来后加AS筛选培养基诱导愈伤+cef(300mg/L)+hyg(50mg/ml) PH=5.5一筛,二筛的cef,hyg的浓度依次逐渐下降分化1: basic+KT(4mg/L)+NAA(0.25mg/L)+cef(300mg/L)+hyg(50mg/L)培养2: basic+KT(0.5mg/L)+NAA(0.25mg/L)+6-BA(2mg/L)+cef(300mg/L)+hyg(50mg/L)基PH=5.8分化培养基NB培养基:6-BA,2.5mg,NAA,0.25mg,KT,0.5mg壮苗培养基(生根)sucrose 30g/L N6 25ml/L MS-Fe盐10ml/LB5vita 10ml/L agar 7g/LMS-Fe盐(必须单独配制,否则会沉淀,用鳌合铁)终浓度母液(100倍)FeSO4.7H2O 27.8mg/L 2.78g/LNa-EDTA 37.5mg/L 3.75g/L制备1 FeSO4.7H2O溶解于水, Na-EDTA溶解于热水,将两者混合定容,于微波炉中加热,煮沸,颜色变深,冷却到室温,补水, 棕色瓶4℃保存2,4-D母液(1g/ml) 用无水乙醇溶解2,4-D后缓慢加入到H2O中,搅拌,如产生沉淀,则重配.配好后4℃保存NAA母液(1g/ml) 用1N KOH 溶解NAA,用水稀释定容, 4℃保存PAA母液(1g/ml) 用无水乙醇溶解加H2O搅拌,定容,4℃保存6-BA母液(1g/ml) 用HCl溶解, 加少量HCl后,用玻棒研磨成糊状,再加HCl使之完全溶解AS(乙酰丁香酮)用DMSO直接溶解定容19.62mg/ml,分装到无菌小管KT 母液(5mg/ml)用1NKOH溶解,用水稀释定容到10ml,过滤灭菌后分装到EP管中,冰冻保存B5 vitamin终浓度母液(100倍) 终浓度母液(100倍)肌醇100mg/L 10g/l Nico-acid 1mg/l0.1g/lpyrido(B6) 1 mg/L 0.1 g/l thiamin(B1) 10 mg/L1 g/l棕色瓶4℃保存(每次配100ml为好), 肌醇在配培养基时,加入到培养基中B5(micro)KI 0.75mg/L H3BO3 3.0mg/L MnSO4 10mg/L ZnSO4 2.0mg/LNa2MnO4.2H2O 0.25mg/LCuSO40.025mg/L CoCl20.025mg/L程序1.种子去皮,挑成熟完整健康的种子2.用70%乙醇清洗浸泡2-3分钟,洗3-4次,用0.1%升汞浸泡20-40分钟3.无菌水洗3至4次4.置于虑纸上吹干,吹3小时以上5.摆放到诱导愈伤培养基上,黑暗中培养15-20天,直到长出黄色较大的愈伤6.剥下愈伤,转至继代培养基上,黑暗培养2周7.共培养。

农杆菌转化法原理及过程
农杆菌转化法是一种常用的基因转化方法,广泛应用于植物基因工程中。
其原理是利用农杆菌中的 Ti 质粒将目的基因导入植物细胞中。
农杆菌是一种革兰氏阴性土壤细菌,它能够感染大多数双子叶植物和少数单子叶植物。
在感染过程中,农杆菌会将其 Ti 质粒上的 T-DNA(转移 DNA)片段整合到植物基因组中。
T-DNA 上含有多个基因,其中包括生长素和细胞分裂素合成基因,这些基因能够促使植物细胞分裂和生长,从而形成肿瘤。
在基因转化过程中,首先需要将目的基因插入到 Ti 质粒上的 T-DNA 区域中,构建成重组质粒。
然后,将重组质粒导入农杆菌中,使其能够携带目的基因。
接下来,将携带目的基因的农杆菌感染植物细胞,可以通过注射、浸泡或共培养等方式进行。
在感染过程中,农杆菌会将 T-DNA 片段导入植物细胞中,并整合到植物基因组中。
最后,通过筛选和鉴定,获得含有目的基因的转化植株。
农杆菌转化法具有操作简单、转化效率高、适用范围广等优点,是植物基因工程中最常用的方法之一。
但是,该方法也存在一些局限性,如对于某些植物种类转化效率较低、可能引起植物基因组的突变等。
因此,在实际应用中需要根据具体情况选择合适的转化方法。

农杆菌转化法又名农杆菌Boletus介导转化法。
农杆菌是普遍存在于土壤中的一种革兰氏阴性细菌,它能在自然条件下趋化性地感染大多数双子叶植物和裸子植物的受伤部位(受伤处的细胞会分泌大量酚类化合物,从而使农杆菌移向这些细胞),并诱导产生冠瘿瘤或发状根农杆菌转化法。
根癌农杆菌和发根农杆菌中细胞中分别含有Ti(Tumour including)质粒和Ri质粒,其上有一段T-DNA(Transferring DNA),农杆菌通过侵染植物伤口进入细胞后,可将T-DNA插入到植物基因组中,并且可以通过减数分裂稳定的遗传给后代,这一特性成为农杆菌介导法植物转基因的理论基础。
我们将目的基因插入到经过改造的T-DNA区,借助农杆菌的感染实现外源基因向植物细胞的转移与整合,然后通过细胞和组织培养技术,再生出转基因植株。
农杆菌介导法起初只被用于双子叶植物中,近年来,农杆菌介导转化在一些单子叶植物(尤其是水稻)中也得到了广泛应用。
本段步骤1、获取目的基因。
用限制酶切割下目的基因。
2、基因表达载体的构建。
将目的基因与载体(大多数选用质粒)用DNA连接酶连接起来。
3、将目的基因导入受体细胞。
将含目的基因的重组质粒导入农杆菌(农杆菌为受体细胞)。
4、目的基因的检测与鉴定。
用DNA分子杂交技术/分子杂交技术/抗原-抗体杂交/个体生物学水平鉴定(这个方法需要导入重组后的细胞的植物体,详见第五步) 几种方法进行检验(根据要求选取不同方法)。
5、最后将成功表达的细胞导入植物体内,对植物体进行个体生物学水平鉴定。
整个转基因体系的建立步骤大致可以归纳为:目的载体的构建---载体的农杆菌转化---农杆菌与植株共培养---转化植株的筛选---转化植株的鉴定。
在每一步中都涉及到很多的方法与技术。
目的载体的构建,包括目的基因的克隆,载体的酶切,连接,以及测序分析。
载体的农杆菌转化,目前有很成熟的方法,试验中应注意热激和冷激的时间。
农杆菌与植株的共培养,即为植株转化实验,在溶液中加入促进植株愈伤生长的激素能一定程度提高转化率。
农杆菌转化法过程农杆菌转化法是一种常用的基因工程技术,用于将外源基因导入植物细胞中。
下面将详细介绍农杆菌转化法的过程。
我们需要准备一株带有所需外源基因的农杆菌。
这个外源基因可以是来自同一物种的不同个体,也可以是来自不同物种的基因。
通过将外源基因插入到农杆菌的载体中,并利用细菌的复制机制使其扩增,最终得到大量带有外源基因的农杆菌。
接下来,我们需要准备待转化的植物材料。
通常情况下,可以使用植物的离体组织,如叶片、茎段或种子等。
这些组织通常需要经过一定的前处理,如表面消毒和切割等,以提高转化效率。
然后,将农杆菌和植物材料进行共培养。
首先将农杆菌培养物与植物材料接触,使其充分吸附在植物细胞表面。
然后,将植物材料转移到含有适当培养基的培养皿中,并在适当的条件下进行培养。
培养基通常含有一些必需的营养物质和激素,以促进植物细胞的再生和分化。
在培养过程中,农杆菌会通过其特殊的转运系统将外源基因导入植物细胞中。
这个转运系统包括几个关键的基因,它们共同参与了农杆菌转化的过程。
其中最重要的是T-DNA区域,它是农杆菌载体中的一个特殊片段,负责将外源基因导入植物细胞。
当外源基因成功导入植物细胞后,我们需要进行筛选和鉴定。
一种常用的筛选方法是利用选择性培养基,其中含有抗生素或其他毒性物质。
只有带有外源基因的植物细胞才能在这样的培养基上生长,而未转化的细胞则会死亡。
我们需要对转化后的植物进行进一步的分析和验证。
这包括检测外源基因的存在和表达,以及评估转化植株的性状和遗传稳定性等。
这些分析可以通过PCR、南方杂交、蛋白质表达分析等技术手段来完成。
总结起来,农杆菌转化法是一种可靠、高效的基因工程技术,广泛应用于植物遗传改良和基因功能研究等领域。
通过合理设计实验方案和选择适当的材料,可以实现外源基因的稳定导入和表达,为植物的改良和创新提供了有力的工具和手段。
农杆菌介导转化法的概述完整版农杆菌介导转化法(Agrobacterium-mediated transformation)是生物技术领域中常用的一种基因转化技术,它是利用植物病原细菌农杆菌(Agrobacterium tumefaciens 或 Agrobacterium rhizogenes)在哺乳动物细胞和植物细胞之间转移DNA的过程.Ti质粒在不同的农杆菌株中具有普遍性,主要包含两个部分,一部分是右边界(RB)和左边界(LB)之间的T-DNA区域,另一部分是辅助基因的区域。
T-DNA区域是真正起作用的区域,它包含多个基因,其中最重要的是含有颠倒重复序列的两个直接重复序列(Direct Repeat,DR)以及插入块(Insert)。
在农杆菌内部,T-DNA区域通过辅助基因的编码产物,如细菌激素合成生物合成酶(enzymes),被剪切出来。
剪切后的T-DNA区域携带着颠倒重复序列的两个直接重复序列(DR),与全身黑素瘤疫斑细菌的Direct Repeat(DR)高度相似,它作为单链向外产生(unidirectional)的。
Ti质粒上还存在两个移去片段(Removal Sequences)的辅助基因,它们能够结合T-DNA的两个断点,从而使T-DNA脱离质粒。
1.选择合适的农杆菌菌株:选择具有较高转化效率且对目标植物亲和性强的农杆菌株。
2.制备适宜的载体:选择合适的Ti质粒载体,可根据需要进行修饰和改造,添加目标基因、标记基因和选择基因等。
3.构建转化质粒:将目标基因和其它所需基因与农杆菌Ti质粒进行重组,得到构建好的转化质粒。
4.培养农杆菌:将重组后的质粒转化到农杆菌中,然后利用适宜的培养基进行培养和增殖,以形成菌液。
5.感染植物细胞:将培养好的农杆菌菌液与目标植物细胞接触,通过创伤组织或利用组织培养等方式实现细菌进入植物细胞内部。
6.培养转化物:将感染的组织培养在适宜的培养基上,培养一段时间,以使转化进行进一步发展,形成完整的植株。
农杆菌瞬时转化法:一、本氏烟草的种植⑴配制基质中各成分比例如下,花卉营养土:蛭石:沙土=2:1:1,22℃16h/8h (光/暗)70%湿度(扣透明白盒2周保湿)⑵将基质浇透水后,烟草种子采用移液器点播在基质中,每盆播1,2粒种子,2-3天浇一次水。
二、农杆菌注射烟草叶片1、3周烟草(4 leaves stage),选取生长状态良好,健壮的烟草叶片植株(年轻的、完全展开的4周大小)进行农杆菌侵染。
转化前将浇透水,转化后要控制浇水2、农杆菌准备:预培养:接种克隆至5ml LB+Antibiotics培养:用1mL预培养液接种至50ml LB+abtibiotics +Acetosyringon(final 20 µM)含Rif (100 mg/mL)、Str (100 mg/mL)和Kan (50mg/mL)三种抗生素的YEB液体培养基活化农杆菌((GV3130))。
检测菌液生长到指数后期 OD600=0.6,4000rpm,室温离心10min收获菌液3、配悬浊液:混匀后于4°C保存;4、重悬液(经常15ml)(10 mM MES-KOH,pH 5.6, 10 mM MgCl2, 100 μM acetosyringone乙酰丁香酮)重悬至OD600=1,(可以洗涤2次)5、同时也将同样培养的含有P19的农杆菌同样悬浮并调整悬浮液的浓度为OD600=16、根据实验设计,将以上三类农杆菌0.7:0.7:1.0体积混合,室温下静置3-4h,7、注射前烟草放在白色日光灯下1h,让气孔充分张开8、Agroinfiltration 注射:重悬菌体,用1 mL注射器(去针头)吸取菌液;避开叶脉,用注射器针在叶片上开小孔后,左手抵住叶片正面,右手轻轻将注射管口垂直压在叶片反面,右手拇指缓慢均匀用力推压,观察菌液在叶片表皮下缓慢移动,直至侵染整个叶片。
(一个植株可以注射2个叶片,不要用子叶)塑料薄膜覆盖,22℃、3天后撕取叶片下表皮于激光共聚焦显微镜下观察。