实验一二重组质粒DNA提取双酶切鉴定凝胶电泳紫外分光法
- 格式:ppt
- 大小:361.50 KB
- 文档页数:55


质粒 DNA 的提取、定量、酶切与PCR 鉴定一、实验目的1.学习并掌握用碱裂解法提取质粒 DNA 的方法;2.学习并掌握了解质粒酶切鉴定的方法;3.学习并掌握紫外吸收检测 DNA 浓度和纯度的原理和方法;4.学习并掌握 PCR 基因扩增的实验原理和操作方法;5.学习并掌握水平式琼脂糖凝胶电泳的原理和使用方法。
二、实验原理1.PCR(多聚酶链式反应 )在 DNA 聚合酶催化下,可以 DNA 为模板,以特定引物为延伸起点,以 dNTP 为原料,通过变性、退火、延伸等步骤,在体外(缓冲液中)复制DNA ,使目的 DNA 按 2n方式呈指数形式扩增。
PCR一次循环的具体反应步骤为:A. 变性:加热反应系统至95℃,使模板 DNA 在高温下完全变性,双链解链。
B. 退火:逐渐降低溶液温度,使合成引物在低温( 35-70℃, 一般低于模板 Tm 值的 5℃左右),与模板DNA 互补退火形成部分双链。
C. 延伸:溶液反应温度升至中温72℃,在Taq 酶作用下,以dNTP 为原料,引物为复制起点,模板 DNA 的一条单链在解链和退火之后延伸为一条双链。
2.质粒 DNA 的提取与制备(1). 碱裂解法:染色体 DNA 与质粒 DNA 的变性与复性存在差异:A. 高碱性条件下,染色体DNA 和质粒 DNA 均变性;B. 当以高盐缓冲液调节其pH 值至中性时,变性的质粒DNA 复性并保存在溶液中,染色体 DNA 不能复性而形成缠连的网状结构,可通过离心形成沉沉淀去除。
(2). 离心层析柱:A. 硅基质膜在高盐、低 pH 值状态下可选择性地结合溶液中的质粒DNA ,而不吸附溶液中的蛋白质和多糖等物质;B.通过去蛋白液和漂洗液将杂质和其它细菌成分去除;C.低盐,高 pH 值的洗脱缓冲液将纯净质粒 DNA 从硅基质膜上洗脱。
3.质粒 DNA 的定量分析(紫外分光光度法):A.物质在光的照射下会产生对光的吸收效应,且其对光的吸收是具有选择性;B.各种不同的物质都具有其各自的吸收光谱 :DNA 分对波长 260nm 的紫外光有特异的吸收峰蛋白质对波长 280nm 的紫外光有特异的吸收峰碳水化合物对 230nm 的紫外光有特异的吸收峰C. A260/A280 及 A260/A230 的比值可以反应DNA 的纯度;A260/A280=1.8DNA 纯净A260/A280<1.8表示样品中含蛋白质(芳香族)或酚类物质A260/A280>1.8含 RNA 杂质,用 RNA 酶去除。

实验一、质粒DNA的提取及检测【实验目的】1、掌握碱裂解法提取质粒的原理和步骤2、掌握琼脂糖凝胶电泳检测DNA的方法和技术3、学会PCR操作的基本技术第一部分质粒DNA的提取一、实验原理:碱裂解法提取质粒是根据共价闭合环状质粒DNA与线性染色体DNA在拓扑学上的差异来分离它们。
在pH值介于12.0~12.5这个狭窄的范围内,线性的DNA双螺旋结构解开而被变性,尽管在这样的条件下,共价闭环质粒DNA的氢键会被断裂,但两条互补链彼此相互盘绕,仍会紧密地结合在一起。
当加入pH4.8的乙酸钾高盐缓冲液恢复pH至中性时,共价闭合环状的质粒DNA的两条互补链仍保持在一起,因此复性迅速而准确,而线性的染色体DNA的两条互补链彼此已完全分开,复性就不会那么迅速而准确,它们缠绕形成网状结构,通过离心,染色体DNA与不稳定的大分子RNA,蛋白质-SDS复合物等一起沉淀下来而被除去。
二、仪器与试剂1、仪器恒温摇床、台式离心机2、试剂溶液I、溶液Ⅱ、溶液Ⅲ、无水乙醇、TE缓冲液、胰RNA酶、酚、氯仿三、实验步骤1、将2mL含相应抗生素(Amp:50μg/mL)的LB液体培养基加入到试管中,接入含pUC19质粒的大肠杆菌,37℃振荡培养过夜。
2、取1.5mL培养物倒入微量离心管中,4000r/min离心2min。
3、吸去培养液,使细胞沉淀尽可能干燥。
4、将细菌沉淀悬浮于100μL溶液I中,充分混匀,室温放置10 min。
5、加200μL溶液Ⅱ(新鲜配制),盖紧管皿,混匀内容物,将离心管放冰上5min。
6、加入150μL溶液Ⅲ(冰上预冷),盖紧管口,颠倒数次使混匀。
冰上放置15min。
7、12000r/min,离心15min,将上清转至另一离心管中。
8、向上清中加入等体积酚:氯仿(1:1)(去蛋白),反复混匀,12000r/min,离心5min,将上清转移到另一离心管中。
9、向上清加入2倍体积无水乙醇,混匀后,室温放置5~10min。

实验七重组质粒DNA的提取及酶切鉴定【实验原理】分离制备质粒DNA的方法很多,其中常用的方法有碱裂解法、煮沸法、SDS法、羟基磷灰石层析法等。
在实际操作中可以根据宿主菌株类型、质粒分子大小、碱基组成和结构等特点以及质粒DNA的用途进行选择。
本实验采用SDS碱裂解法提取重组质粒DNA,十二烷基磺酸钠(SDS)是一种阴离子表面活性剂,它既能使细菌细胞裂解,又能使一些蛋白质变性。
限制性内切酶能特异地结合于一段被称为限制性酶识别序列的DNA序列之内或其附近的特异位点上,并切割双链DNA。
限制性内切酶识别序列长度一般为4~8个呈回文序列的特异核苷酸对。
由于限制性内切酶的切割特性不同,分子生物学中主要用到Ⅱ型限制性内切酶(切割位置在识别序列内部)。
对质粒进行酶切,通过跑胶观察片段大小,从而鉴定质粒。
【实验步骤】本次实验所用的质粒提取试剂盒为天根的质粒小提试剂盒,操作步骤按说明书进行。
1. 吸附柱中加500ul 平衡液(BL),12000rpm离心1min ,弃收集管中的液体。
2.取1.5ml菌液至2ml离心管中,12,000rpm离心1min,弃上清。
3. 加250ul solution Ⅰ(P1),vortex。
4. 加250 solution Ⅱ(P2),上下颠倒混匀。
操作时间不能超过5min 注:此步骤不宜超过5 min。
5. 加350 solution Ⅲ(P3),立即颠倒混匀几次。
12000rpm离心10min。
6. 吸取上清加入吸附柱中,尽量不要吸出沉淀12000rpm离心1min ,弃收集管中的液体。
注:此时4℃离心不利于沉淀沉降。
7. 加入600μL漂洗液(PW)于离心吸附柱中,12000rpm离心1min ,倒掉废液。
8. 重复上一步,9. 空管离2min。
将吸附柱放入1.5ml离心管中,在超净台中晾5min。
10. 将700 μl的Rinse B加入Spin Column中,12,000 rpm离心30 sec,弃滤液。
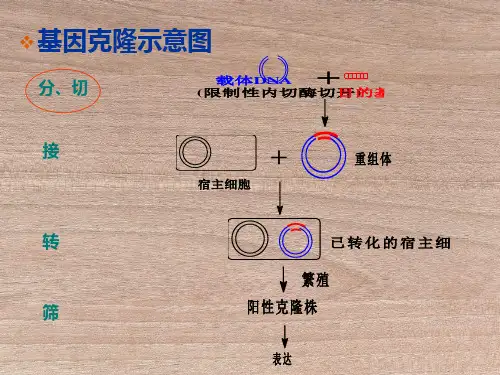



题目:目的基因双酶切和电泳纯化胶回收一.实验目的:1.学习双酶切法获取目的基因片段的原理和方法;2.练习DNA琼脂糖凝胶电泳的原理和方法。
3.学习核酸琼脂糖胶回收的原理和方法。
二.实验原理1. 限制性核酸内切酶:生物体内能识别并切割特异的双链DNA序列的一种内切核酸酶。
由于这种切割作用是在DNA分子内部进行的,故名限制性内切酶(简称限制酶)。
2. 切割序列:(1)Bam HⅠ切割识别序列后产生两个互补的粘性末端:5'⋯ G↓GATCC ⋯3' → 5'⋯G GATCC ⋯3'3'⋯ CCTAG↑G ⋯5' → 3'⋯CCTAG G ⋯5'(2)Eco RⅠ切割识别序列后产生两个互补的粘性末端:5'⋯G↓AATTC ⋯3' → 5'⋯ G AATTC ⋯3'3'⋯CTTAA↑G ⋯5' → 3'⋯ CTTAA G ⋯5'3. 为什么要选择表达载体质粒pET-28a?pET原核表达质粒是最有效的原核表达系统之一。
目的基因被克隆到pET质粒载体上,受噬菌体T7强转录及翻译信号控制;表达由宿主细胞提供的T7RNA聚合酶诱导。
宿主菌带有受lacUV5控制的T7RNA聚合酶基因,可以通过IPTG来启动表达。
充分诱导时,几乎所有的细胞资源都用于表达目的蛋白;诱导表达后仅几小时,目的蛋白通常可以占到细胞总蛋白的50%以上。
4.限制性内切酶的选择:选择BamHI 、NotI两个位点由于实验中须将质粒pEGFP-N3上所需的目的基因切下并连接到载体质粒pET-28a上,所以选择的限制酶需满足以下几个要求:一.选择两种在质粒pEGFP-N3和载体质粒pET-28a上都有酶切位点的限制性酶切酶,以保证切下的目的基因和载体质粒分别都有两个不同的末端,这样可以防止:(1)质粒和目的基因的自身环化;(2)质粒与质粒、目的基因与目的基因相互自身连接;(3)质粒与目的基因反向连接)二.两种限制性内切酶的酶切位点需满足:(1)不破坏目的基因;(2)在质粒pEGFP-N3和载体质粒pET-28a上都有且只有一个酶切位点;(3)在载体质粒上的切割位点距离尽量短些,并且不破坏载体质粒的启动子等关键序列。

质粒DNA的提取与鉴定实验报告1. 实验目的本实验的目的是通过提取和鉴定质粒DNA,掌握质粒DNA的提取方法并验证提取的质粒DNA的纯度和完整性。
2. 实验原理质粒DNA提取是将质粒DNA从细菌细胞中分离出来的过程。
常用的提取方法包括碱裂解法和商业试剂盒法。
本实验使用商业试剂盒法进行质粒DNA的提取。
步骤如下: 1. 培养目标细菌,并收集细菌培养物。
2. 细菌培养物离心,收集细菌沉淀。
3. 加入细胞裂解缓冲液裂解细胞膜。
4. 加入溶解剂,使细胞溶解。
5. 加入酒精,沉淀出质粒DNA。
6. 分离质粒DNA,去除其他杂质。
7. 测定质粒DNA的纯度和完整性。
3. 实验步骤3.1 培养目标细菌1.取出目标细菌的冻存管,从-80°C的冷冻库中快速解冻。
2.取出琼脂平板,用无菌技术将细菌转接到琼脂平板上,利用无菌鹤嘴锄均匀涂抹。
3.将琼脂平板倒置放置在37°C恒温培养箱中,培养一夜。
3.2 收集细菌培养物1.取出含有细菌的琼脂平板,加入适量的无菌LB培养基。
2.用无菌移液管将培养基中的细菌转移到无菌离心管中。
3.将离心管放入低速离心机中,离心5分钟,将细菌沉淀收集。
3.3 细胞裂解1.向细菌沉淀中加入适量的细胞裂解缓冲液。
2.充分混合后,放置在冰上浸泡20分钟,使细菌细胞膜裂解。
3.4 细胞溶解1.加入等体积的溶解剂,充分混合。
2.将含有细胞裂解物的离心管放入冰上浸泡5分钟。
3.5 DNA沉淀1.向离心管中加入等体积的冷酒精。
2.轻轻倾斜离心管,使酒精与溶液充分混合。
3.放置在-20°C冷冻库中沉淀20分钟。
3.6 分离质粒DNA1.将离心管放入高速离心机中,离心10分钟。
2.将上清液倒出,保留下沉淀。
3.7 测定质粒DNA的纯度和完整性1.使用纳米比色计测定质粒DNA的浓度和纯度。
2.利用琼脂糖凝胶电泳检测质粒DNA的完整性。
4. 结果与讨论根据实验结果,我们成功提取到了质粒DNA,并验证了其纯度和完整性。

农学院《分子生物学》实验指导书适用专业:园艺、农学、植物保护、农产品质量与安全、中草药栽培与鉴定贵州大学二OO 七年八月前言本实验课的目的是使学生掌握一些基本的分子生物学实验技术,提高专业技术水平。
学生通过实验掌握分子生物学的基本实验方法,验证、巩固和加深对分子生物学基本理论的理解,培养严谨的科学态度和分析问题,解决问题的能力,培养从事科学研究的基本素养。
为了使学生更好地理解和深刻地把握这些知识,设置了以下实验项目:实验一质粒DNA的提取与分离(验证性实验,学时数3)实验二质粒DNA的酶切(验证性实验,学时数3)实验三酶切片段的琼脂糖凝胶电泳分析(验证性实验,学时数2)实验四PCR技术在农业中的应用(综合性实验,学时数10)通过本课程的相关实验,让学生熟悉进行分子生物学研究的基本仪器设备和规范的操作方法,使学生学习并掌握质粒DNA提取的原理和操作步骤;了解质粒酶切鉴定原理;掌握应用琼脂糖凝胶电泳的原理及操作方法,并对PCR的扩增结果及DNA的质量进行检测。
掌握应用PCR技术对植物进行DNA水平遗传多样性检测及分析的方法。
使学生学会分子生物学的基本实验方法,并在科学态度、实验技能、独立工作能力等方面获得初步的训练。
目录1、实验一:质粒DNA的提取与分离······························································页码2、实验二:质粒DNA的酶切·········································································页码3、实验三:酶切片段的琼脂糖凝胶电泳分析··················································页码4、实验四:PCR技术在农业中的应用····························································页码5、实验报告基本内容要求··············································································页码6、实验报告格式····························································································页码实验一:质粒DNA的提取与分离实验学时:3实验类型:验证性实验实验要求:必修一、实验目的从细菌菌体中提取、分离质粒DNA分子,是基因工程的基础步骤。

实验一 质粒DNA的提取纯化、限制性酶切及电泳检测内 容 提 要本实验采用碱裂解法提取细菌细胞中的质粒DNA,经酚/氯仿/异戊醇抽提和乙醇沉淀等步骤,从而得到适用于基因操作的质粒DNA。
采用分子生物学软件查找质粒DNA的酶切位点,然后利用限制性内切酶对质粒DNA进行酶切反应,酶切产物经琼脂糖凝胶电泳分离和凝胶成像系统进行分析鉴定。
本实验要求:1.通过本实验学习和掌握碱裂解法提取质粒DNA。
2.掌握质粒DNA的限制性内切酶酶切分析,了解内切酶的性质。
3.学习DNA的电泳检测。
原 理1.质粒DNA的提取把一个目的DNA片段通过重组DNA技术,进入受体细胞中去进行繁殖和表达的工具叫载体(Vector)。
质粒(Plasmid)作为携带外源基因进入细菌中扩增或表达的主要载体,广泛应用于基因操作的各个方面。
因此,质粒的分离与提取是分子生物学中最常用、最基本的实验技术。
质粒是一种染色体外的DNA分子,其大小范围从1-200kb不等。
大多数来自细菌细胞的质粒为双链、共价闭合环状的DNA分子,并以超螺旋状态存在于宿主细胞中。
质粒主要发现于细菌、放线菌和真菌细胞中,它具有自主复制和转录能力,能在子代细胞中保持恒定的拷贝数,并表达所携带的遗传信息。
质粒在细胞内的复制一般有两种类型:紧密控制型和松驰控制型。
质粒载体是在天然质粒的基础上为适应实验室操作而进行人工构建的。
与天然质粒相比,质粒载体通常带有一个或一个以上的选择性标记基因(如抗生素抗性基因)和一个人工合成的含有多个限制性内切酶识别位点的多克隆位点序列,并去掉了大部分非必需序列,使分子量尽可能减少,以便于基因工程操作。
通常所用的质粒载体有pBR322、pUC18、pUC19等,本实验提取pUC19质粒。
从细菌中分离质粒DNA 的方法都包括3个基本步骤:培养细菌使质粒扩增;收集和裂解细胞;分离和纯化质粒DNA。
本实验以碱裂解法为例,介绍质粒的抽提过程。
碱裂解法的原理是:碱性条件下,用十二烷基磺酸钠(SDS) 破坏菌体细胞壁,并使菌体蛋白质和染色体DNA变性,双链解开。
双酶切实验原理双酶切实验是一种常用的分子生物学技术,用于分析DNA序列。
它基于限制性内切酶的特异性切割DNA的原理,结合凝胶电泳技术,可以对DNA进行特异性切割和分离,从而获得所需的DNA片段。
本文将介绍双酶切实验的原理及其操作步骤。
1.双酶切实验原理。
双酶切实验的原理基于限制性内切酶对DNA的特异性切割。
限制性内切酶是一类能够识别DNA特定序列并在该序列上切割的酶,它们能够将DNA分子切割成具有特定序列的片段。
在双酶切实验中,通常会使用两种不同的限制性内切酶,它们分别识别DNA的不同序列,并在这些序列上进行切割。
通过这种双酶切割的方式,可以获得具有特定序列的DNA片段。
2.双酶切实验操作步骤。
双酶切实验的操作步骤主要包括DNA提取、酶切反应、凝胶电泳和DNA可视化等步骤。
首先,需要从样品中提取DNA。
提取的DNA可以是来自细菌、动植物或其他生物体的基因组DNA,也可以是从质粒或病毒中提取的DNA。
提取的DNA需要经过纯化和定量后,才能进行后续的操作。
接下来,将提取的DNA与两种限制性内切酶和相应的缓冲液混合,进行酶切反应。
酶切反应的条件需要根据所使用的酶的特性来确定,包括反应温度、反应时间和反应缓冲液的配制等。
酶切反应完成后,需要对反应产物进行电泳分离。
在凝胶电泳中,将酶切反应产物加载到琼脂糖凝胶上,通电进行分离。
由于DNA分子在电场中具有不同的迁移速度,可以根据DNA片段的大小进行分离和检测。
分离完成后,可以通过染色或荧光标记等方法对DNA进行可视化。
3.双酶切实验的应用。
双酶切实验在分子生物学研究中有着广泛的应用。
它可以用于分析DNA序列的特异性,鉴定基因型、进行基因工程、构建基因库等。
通过双酶切实验,可以获得特定序列的DNA片段,为后续的克隆、测序和分析提供了重要的基础。
总的来说,双酶切实验是一种重要的分子生物学技术,它基于限制性内切酶的特异性切割原理,能够对DNA进行特异性切割和分离。
质粒dna的提取实验报告实验目的:通过质粒DNA的提取实验,掌握质粒DNA的提取方法,了解质粒DNA提取的原理和步骤,并评估提取质量和纯度。
实验材料:- 大肠杆菌菌落- 磷酸盐缓冲液- 10% SDS溶液- 去离子水- 超纯酒精(乙醇或异丙醇)- 氯仿- 石英研钵- 离心管和离心机- 显微镜和比色皿- 分子生物实验器材- DNA评估工具(如凝胶电泳仪)实验步骤:1. 随机挑选一颗大肠杆菌菌落,接种至含有磷酸盐缓冲液的离心管中,用显微镜观察菌落的情况,确保菌落无杂质。
2. 加入500 μL含有磷酸盐缓冲液的离心管中,用微量移液管捞取菌落,将其完全悬浮在磷酸盐缓冲液中。
3. 加入10 μL 10% SDS溶液,翻转离心管轻轻摇匀。
4. 加入200 μL NaOH和150 μL氯仿,离心1分钟。
此时,质粒DNA会被氯仿等重物分离到有机相中,而大部分细胞膜和核酸会留在水相中。
5. 转移上清液至新的离心管中,避光加入等量的超纯酒精,轻轻摇匀。
DNA会在酒精中沉淀。
6. 离心10分钟,取出上清液。
7. 加入70%乙醇或异丙醇定居洗涤一次,离心2分钟,取出上清液。
8. 反复使用去离子水洗涤,使残留的乙醇或异丙醇彻底除去。
9. 用去离子水稀释DNA,摇匀。
10. 用凝胶电泳仪评估提取的质粒DNA的质量和纯度。
实验结果:通过凝胶电泳仪评估质粒DNA的质量和纯度,得到如下结果:- DNA带有明显的质粒带,且带的位置与预期一致。
- DNA带的强度较均匀,并且没有明显的附带杂带。
- 带的强度与浓度成正比,说明提取的质粒DNA具有较高的质量。
讨论和结论:通过本实验,成功提取到了质粒DNA,并评估了其质量和纯度。
本实验中所使用的提取方法简单快速,并且获得了满意的结果。
然而,有时由于实验步骤的疏忽或操作技巧不当,可能会导致质粒DNA提取的效果不佳,如DNA带弱、杂带多等。
因此,未来可以进一步优化实验步骤和控制实验条件,提高质粒DNA提取的效率和质量。
题目:目的基因双酶切和电泳纯化胶回收一.实验目的:1.学习双酶切法获取目的基因片段的原理和方法;2.练习DNA琼脂糖凝胶电泳的原理和方法。
3.学习核酸琼脂糖胶回收的原理和方法。
二.实验原理1. 限制性核酸内切酶:生物体内能识别并切割特异的双链DNA序列的一种内切核酸酶。
由于这种切割作用是在DNA分子内部进行的,故名限制性内切酶(简称限制酶)。
2. 切割序列:(1)Bam HⅠ切割识别序列后产生两个互补的粘性末端:5'⋯ G↓GATCC ⋯3' → 5'⋯G GATCC ⋯3'3'⋯ CCTAG↑G ⋯5' → 3'⋯CCTAG G ⋯5'(2)Eco RⅠ切割识别序列后产生两个互补的粘性末端:5'⋯G↓AATTC ⋯3' → 5'⋯ G AATTC ⋯3'3'⋯CTTAA↑G ⋯5' → 3'⋯ CTTAA G ⋯5'3. 为什么要选择表达载体质粒pET-28a?pET原核表达质粒是最有效的原核表达系统之一。
目的基因被克隆到pET质粒载体上,受噬菌体T7强转录及翻译信号控制;表达由宿主细胞提供的T7RNA聚合酶诱导。
宿主菌带有受lacUV5控制的T7RNA聚合酶基因,可以通过IPTG来启动表达。
充分诱导时,几乎所有的细胞资源都用于表达目的蛋白;诱导表达后仅几小时,目的蛋白通常可以占到细胞总蛋白的50%以上。
4.限制性内切酶的选择:选择BamHI 、NotI两个位点由于实验中须将质粒pEGFP-N3上所需的目的基因切下并连接到载体质粒pET-28a上,所以选择的限制酶需满足以下几个要求:一.选择两种在质粒pEGFP-N3和载体质粒pET-28a上都有酶切位点的限制性酶切酶,以保证切下的目的基因和载体质粒分别都有两个不同的末端,这样可以防止:(1)质粒和目的基因的自身环化;(2)质粒与质粒、目的基因与目的基因相互自身连接;(3)质粒与目的基因反向连接)二.两种限制性内切酶的酶切位点需满足:(1)不破坏目的基因;(2)在质粒pEGFP-N3和载体质粒pET-28a上都有且只有一个酶切位点;(3)在载体质粒上的切割位点距离尽量短些,并且不破坏载体质粒的启动子等关键序列。