晚期非小细胞肺癌精准治疗
- 格式:pptx
- 大小:10.56 MB
- 文档页数:68


晚期NSCLC一线靶向治疗进展[导读] 自从2004年发现EGFR基因活化突变与TKI治疗非小细胞肺癌的疗效相关以来,通过服用EGFR-TKI,越来越多的患者从中获益,推动了肺癌治疗越来越精准。
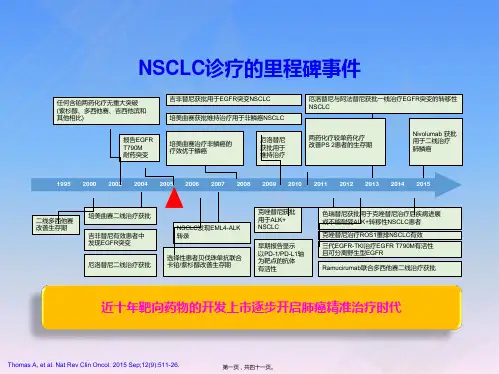
非小细胞肺癌是第一个进入精准治疗而且走得最好的实体肿瘤,EGFR-TKI是精准治疗的典范。
非小细胞肺癌中EGFR基因的突变率非常高,特别是亚裔患者EGFR突变率约50%,不吸烟者高达59.6%,吸烟者也有35.3%。
在我国,大约30%~40%的肺腺癌患者都存在EGFR敏感突变。
自从2004年发现EGFR基因活化突变与TKI治疗非小细胞肺癌的疗效相关以来,通过服用EGFR-TKI,越来越多的患者从中获益,推动了肺癌治疗越来越精准。
非小细胞肺癌是第一个进入精准治疗而且走得最好的实体肿瘤,EGFR-TKI是精准治疗的典范。
目前已经拥有针对EGFR敏感突变的靶向药有5种。
第一代有吉非替尼、厄洛替尼、埃克替尼;第二代阿法替尼、达克替尼;第三代奥希替尼。
推动肺癌治疗越来越精准的同时,更多的TKI也为临床提供了更多的选择。
而且一些临床研究也似乎为NSCLC一线治疗提供了新的可选择模式。
近10年来,肺癌EGFR一线靶向药物主要有吉非替尼、厄洛替尼、埃克替尼。
当患者接受EGFRTKI治疗后,随着时间的延长,几乎都会出现获得性耐药,最终会出现疾病进展,目前考虑EGFR-TKI获得性耐药主要相关因素为T790M二次突变及c-MET基因扩增,二者所占比例分别为50%及20%左右。
研究显示,约3.6%未经治疗的非小细胞癌患者,肿瘤组织标本中T790M突变阳性,而吉非替尼和厄洛替尼耐药的非小细胞癌患者其阳性率表答为50%。
二代TKI与一代TKI相比,其疗效的提高主要是与其血药浓度高和覆盖多个EGFR家族成员有关,但目前其耐药机制尚不明确。
奥希替尼是第三代口服不可逆的EGFR抑制剂,可抑制EGFR-TKI敏感和T790M耐药突变的药物,用于EGFRT790M突变阳性的局部晚期或转移性非小细胞肺癌的肿瘤药物。

晚期非小细胞肺癌抗血管生成药物治疗中国专家共识一、本文概述《晚期非小细胞肺癌抗血管生成药物治疗中国专家共识》旨在为中国的医疗专业人士提供一个全面、权威的指南,以便他们为晚期非小细胞肺癌(NSCLC)患者选择最适合的抗血管生成药物治疗方案。
随着医学研究的深入,抗血管生成药物在晚期NSCLC治疗中的作用日益凸显,其能够有效抑制肿瘤血管生成,从而阻断肿瘤的生长和扩散。
然而,如何选择和应用这些药物,以最大程度地提高患者的生活质量和生存期,一直是临床医生面临的挑战。
本文基于国内外最新的研究成果和临床实践,结合中国患者的具体情况,对抗血管生成药物在晚期NSCLC治疗中的应用进行了全面梳理和深入探讨。
共识内容涵盖了药物选择、剂量调整、不良反应管理等多个方面,旨在为临床医生提供科学、合理的治疗建议。
我们希望通过本文的发布,能够推动中国晚期NSCLC抗血管生成药物治疗的规范化、标准化,提高患者的治疗效果和生活质量,为我国的肺癌防治工作做出积极贡献。
我们也期待与广大医疗同仁共同学习、交流,不断完善和更新这一共识,以适应不断变化的医学环境和患者需求。
二、抗血管生成药物的作用机制与分类抗血管生成药物在晚期非小细胞肺癌(NSCLC)治疗中发挥着重要作用,其主要作用机制是通过抑制肿瘤新生血管的形成,从而切断肿瘤的营养供应,达到抑制肿瘤生长和转移的目的。
这类药物主要包括血管内皮生长因子受体(VEGFR)酪氨酸激酶抑制剂(TKI)、抗血管内皮生长因子(VEGF)单克隆抗体和多靶点酪氨酸激酶抑制剂等。
VEGFR TKI:此类药物通过抑制VEGFR的活性,阻断VEGF与VEGFR 的结合,从而抑制肿瘤新生血管的形成。
常见的VEGFR TKI包括帕唑帕尼、舒尼替尼、阿帕替尼等。
抗VEGF单克隆抗体:这些药物通过与VEGF结合,阻止其与VEGFR 的结合,从而抑制肿瘤新生血管的形成。
贝伐珠单抗是最常用的抗VEGF单克隆抗体之一,已经在晚期NSCLC的治疗中取得了显著疗效。

EGFR突变晚期非小细胞肺癌最佳一线治疗方案肺癌是全球发病率和死亡率最高的恶性肿瘤,约50%的亚洲患者和11%~16%的西方患者存在表皮生长因子受体(EGFR)敏感突变(主要包括Exon 19 Del和21 L858R);对这类患者,NCCN国际指南目前推荐一线使用表皮生长因子受体酪氨酸激酶抑制剂(EGFR-TKI)的靶向治疗。
近年来,第二代、第三代EGFR-TKI横空出世,同时众多研究表明联合EGFR-TKI和其他治疗方式(比如化疗和抗血管治疗等)的策略在一线使用也表现出良好的疗效。
在如此众多的可选方案中,探究哪种一线治疗方案是EGFR敏感突变的晚期非小细胞肺癌患者的优选,具有重要的临床意义和应用价值。
广州医科大学附属第一医院、呼吸系统疾病国家临床医学研究中心何建行教授、梁文华教授为共同通讯作者,在读硕士研究生赵毅为主要第一作者,针对“EGFR敏感突变的晚期非小细胞肺癌(NSCLC)一线治疗的最佳治疗方案”以网络荟萃分析的形式进行了深入分析。
2019年10月7日,这项研究在线发表于世界四大顶级医学期刊之一The BMJ (British Medical Journal,最新影响因子为27.604),这是BMJ正刊首次发表来自中国的肺癌治疗相关研究,是我国肺癌治疗领域的一大突破。
文章一览当前EGFR-TKI呈现“三代同堂”的盛况:一代的吉非替尼(Gefitinib)、厄洛替尼(Erlotinib)和埃克替尼(Icotinib);二代的阿法替尼(Afatinib)和达克替尼(Dacomitinib);三代的奥希替尼(Osimertinib)。
EGFR-TKI的问世极大改善了EGFR突变晚期NSCLC患者的生存预后。
而一线EGFR-TKI单药治疗一段时间后,不可避免的出现耐药,为了进一步改善患者的生存、延缓耐药的出现,在现有可行药物的基础上联合更多临床可用的治疗手段的联合治疗亦进入人们视线,比如,NEJ026研究中厄洛替尼联合贝伐单抗(Erlotinib+Bevacizumab)以及NEJ009研究中吉非替尼联合培美曲塞为基础的含铂双药化疗(Gefitinib+PbCT:gefitinib+pemetrexed based chemotherapy),较相应EGFR-TKI 单药治疗,均显示出更好的PFS生存获益。

驱动基因阴性晚期NSCLC一线免疫治疗肺癌作为发病率第一的肿瘤,严重威胁人们的健康。
近年来,肺癌的诊疗从化疗到靶向治疗再到免疫治疗,引领肿瘤的精准治疗模式。
对于驱动基因阴性晚期非小细胞肺癌( non-small-cell lung cancer,NSCLC) 患者,多种程序性死亡受体 1( programmed death 1,PD-1) 和程序性死亡配体 1( programmed death-ligand 1,PD-L1) 抑制剂取得显著疗效,在晚期 NSCLC 一线、二线治疗中获得适应证,并丰富了从单药治疗到联合治疗的格局,使得“chemo- free”有望成为可能。
免疫治疗为肺癌治疗模式带来改变的同时,也对肺癌治疗方案、生物标志物的选择和相关不良反应的治疗带来一定的挑战。
2011 年 Nature 发表的《Cancer immunotherapy comes of age》点燃了免疫治疗的燎原之火,众多研究陆续推出,主要集中于程序性死亡受体1( programmed death 1,PD-1) 、程序性死亡配体1( programmed death-ligand 1,PD-L1) 和细胞毒性 T 淋巴细胞相关抗原-4( cytotoxic T lympho- cyte-associated antigen 4,CTLA-4) 抑制剂。
自 2013年美国《科学》杂志将癌症免疫治疗评为“重大突破”以来,PD-1 /PD-L1 抑制剂作为免疫治疗中的主力军,在癌症治疗领域备受瞩目。
2014 年美国食品药品监督管理局( Federal Food and Drug Adminstra- tion,FDA) 首先批准pembrolizumab 和nivolumab 用于晚期黑色素瘤治疗,其适应证不扩大。
其中,对非小细胞肺癌( non-small-cell lung cancer,NSCLC) 治疗的不断探索:从二线到一线,从晚期到局部晚期再到早期,从单药到联合,从泛人群到精准治疗,使得免疫治疗遍地开花。

nsclc一线化疗方案非小细胞肺癌(non-small cell lung cancer, NSCLC)是最常见的肺癌类型之一。
一线化疗方案指的是首选的治疗方案,通常针对晚期NSCLC患者或手术不可行的早期患者。
本文将介绍几种常见的NSCLC一线化疗方案,以供参考。
1. 铂类化合物+非铂类化合物:铂类化合物常用的有顺铂和卡铂,非铂类化合物包括紫杉醇和吉西他滨等。
这种化疗方案适用于大多数NSCLC患者,在临床上得到广泛应用。
铂类化合物可通过与DNA结合抑制肿瘤细胞的DNA复制和转录,而非铂类化合物则主要通过阻断细胞有丝分裂阶段的微管聚合来抑制肿瘤细胞的增殖。
2. 奥西替尼:奥西替尼是一种针对表皮生长因子受体(epidermal growth factor receptor, EGFR)的酪氨酸激酶抑制剂,适用于EGFR突变阳性的NSCLC患者。
该突变型常见于亚洲非吸烟女性患者,奥西替尼可显著延长患者的生存期和缓解症状。
3. 吉非替尼:吉非替尼是一种针对肿瘤ALK基因融合的酪氨酸激酶抑制剂,适用于ALK重排阳性的NSCLC患者。
该基因重排突变主要出现在非吸烟者中,吉非替尼可有效抑制融合蛋白的活性,从而抑制肿瘤细胞的增殖。
4. 整合免疫治疗:PD-1抑制剂(如帕博利珠单抗、诺伐珠单抗、贝伐珠单抗等)和PD-L1抗体(如鲁妥珠单抗、安罗替尼等)被广泛应用于NSCLC的一线治疗中。
这些药物能够阻断肿瘤细胞与免疫细胞之间的信号通路,恢复免疫系统对肿瘤的识别和攻击能力。
5. 化疗联合放疗:对于局部进展的NSCLC患者,化疗联合放疗是常见的治疗方案之一。
放疗可以通过破坏DNA结构和抑制肿瘤细胞的生长来治疗肿瘤,并可与化疗药物协同作用,提高治疗效果。
总结起来,NSCLC一线化疗方案的选择应根据患者的具体情况、肿瘤的分期和临床指南的建议来决定。
这些化疗方案可能存在一定的副作用和风险,因此在治疗过程中需要密切监测患者的反应和提供支持性治疗。

吉非替尼治疗晚期非小细胞肺癌的疗效与生存分析共3篇吉非替尼治疗晚期非小细胞肺癌的疗效与生存分析1在今天的医学领域中,吉非替尼已经成为非小细胞肺癌治疗中的一个重要药物。
它是一种口服靶向治疗药物,能够通过抑制肺癌细胞增殖和侵袭来缓解患者的症状。
尽管吉非替尼在肺癌治疗中的作用已经有所证实,但是它在治疗晚期非小细胞肺癌患者中的疗效和生存率仍需进一步探究。
数十年来,肺癌一直是全球最常见的恶性肿瘤之一,尤其是非小细胞肺癌(NSCLC)。
NSCLC是一种病变的肺部组织类型, 肿瘤细胞的分化程度不高,生长速度较慢, 症状轻微,且不会如同小细胞肺癌那样迅速扩散到其他器官中。
由于肺癌的强烈侵袭性和迅速生长性,即使是经过正规的化疗和外科手术治疗还是有许多的患者最终无法控制病情。
因此,研究治疗NSCLC 的新疗法已经成为临床医生和研究人员的共同目标。
在晚期NSCLC的治疗中,吉非替尼作为一种口服靶向治疗药物被广泛使用。
在吉非替尼的治疗过程中,它将与患者的癌细胞内部的一些特定受体结合,从而阻碍相关的信号通路和抑制癌细胞的生长和繁殖。
而且过去的实验表明,吉非替尼不仅在晚期NSCLC患者的治疗中发挥了很大的作用,同时也能够提高患者的生存率。
一项针对吉非替尼治疗晚期NSCLC患者的研究中,研究人员对303名接受口服吉非替尼治疗的晚期NSCLC患者进行了严格的随访观察及相关数据统计。
结果表明吉非替尼可作为晚期NSCLC的首选治疗方案进行使用。
患者在接受了吉非替尼治疗后的最长生存时间达到了20个月以上,相较于传统的化疗和同类新药物治疗的患者结果正在逐渐地被证实。
值得注意的是,吉非替尼的治疗并非没有缺陷,其中部分患者存在药物耐药现象,这一点也是需要引起医生和患者的关注。
因此,在使用吉非替尼治疗晚期NSCLC之前,严格的疗效评估和有效的筛选工作非常重要,既能够保证疗效的实现,也能够预防患者出现不必要的副作用和风险。
总的来说,虽然吉非替尼在治疗NSCLC患者中的疗效还需要更进一步的研究,但是它已经被证明是在治疗晚期NSCLC患者中的一个非常有前途和有效的药物,能够带给患者生存上的希望和改善。

中国晚期非小细胞肺癌BRAF突变诊疗专家共识要点1.BRAF突变在晚期NSCLC患者中较为罕见,发生率约为1-3%。
BRAFV600E是最常见的突变亚型,约占所有BRAF突变的90%以上。
2.BRAF突变与NSCLC患者的疾病进展和预后密切相关。
患有BRAF突变的NSCLC患者通常具有较差的预后和较短的无进展生存期。
3.全面评估病情是进行治疗决策的重要基础。
包括病变部位、转移情况、患者整体健康状况等多个因素。
BRAF突变检测应在确诊NSCLC后尽早进行。
4. 对于未接受过治疗的BRAF V600E突变阳性晚期NSCLC患者,首选治疗是联合治疗方案(dabrafenib和trametinib联合应用)。
该联合治疗通过同时抑制BRAF和MEK信号通路,获得了较好的疗效和生存期延长。
5. 对于已经接受过铂类化疗的BRAF V600E阳性晚期NSCLC患者,在疾病进展后,可考虑单药替莫唑胺作为二线治疗。
替莫唑胺与dabrafenib和trametinib相比疗效相似,但其副作用更轻,适用于年龄较大或存在合并症的患者。
6.对于BRAFV600E以外的其他BRAF突变亚型,目前尚无特定的靶向治疗。
此时可考虑临床试验或个体化治疗策略。
7.BRAF突变NSCLC的治疗应始终面向个体化,需综合考虑患者的病理学、临床特征、基因检测结果和其他相关因素。
8.在BRAF靶向治疗过程中,应密切监测患者的治疗反应和不良事件发生情况。
定期进行影像学评估,监测肿瘤缩小情况以及疾病进展。
9. 靶向治疗后,应通过临床相关病理生物标志物监测患者治疗效果和病变进展。
这些标志物包括血清标志物(如CEA、Cyfra21-1等)、外周血中循环肿瘤DNA(ctDNA)的监测等。
10.针对BRAF突变NSCLC患者的精准医学治疗仍需持续研究和探索,临床相关试验是推进治疗策略的重要途径。

2024晚期RET融合阳性非小细胞肺癌治疗肺癌是我国发病率和死亡率最高的恶性肿瘤,非小细胞肺癌(NSCLC)是最常见的肺癌组织学类型。
约1%~2%的NSCLC患者存在RET融合,RET融合患者经传统治疗获益有限。
在靶向治疗方法进入临床使用前,晚期RET融合阳性NSCLC患者的系统治疗方法参考驱动基因阴性NSCLC以含粕双药化疗为主。
新型高选择性RET抑制剂普拉替尼和塞普替尼进入临床应用后,RET融合阳性NSCLC的诊疗有了突破性的进展。
但中国幅员辽阔,诊疗流程并不统一,且对靶向治疗及相关副作用的处理认知水平不一。
本文结合近期发表的《晚期RET融合阳性非小细胞肺癌诊疗中国专家共识(2023版)》,简要归纳总结晚期RET融合阳性NSCLC的诊疗流程。
1、RET基因概述RET基因位于染色体10q11.2上,已明确RET融合(重排)和RET点突变与肿瘤发生相关,NSCLC中的RET变异以融合(重排)为主,这一患者人群经传统治疗获益有限,2020年新型高选择性RET抑制剂普拉替尼和塞普替尼的相继获批和应用打破了RET融合阳性NSCLC靶向治疗的僵局,并在国内外NSCLC诊疗指南中被推荐。
普拉替尼于2021年3月获得中国国家药品监督管理局(NMPA)批准用于RET基因融合阳性的局部晚期或转移性NSCLC成人患者,成为我国首个获批的高选择性RET抑制剂。
2、需要检测RET融合的晚期NSCLC人群范围约1%~2%的NSCLC患者存在RET融合。
KIF5B是最常见的融合伴侣,约占所有RET融合的68.2%,其次为CCDC6(16.8%)和NCOA4(1.2%)o RET融合尤其多见于肺腺癌(占92.3%)、无吸烟史(63.0%~81.8%)、较年轻人群(≤60岁,72.7%)和体力状态较好的患者(功能状态评分0分,61.3%)。
获得性RET融合是其他驱动基因靶向治疗如EGFR/ALK-酪氨酸激酶抑制剂(TKI)的继发耐药机制之一。

晚期非小细胞肺癌(NSCLC)靶向治疗二三事作者:王勇来源:《健康必读·下旬刊》2020年第07期【中图分类号】R979.1 【文献标识码】A 【文章编号】1672-3783(2020)07-21--02肺癌是当前时期威胁着人類生命和健康的恶性肿瘤之一。
在所有肺癌患者中,非小细胞肺癌(NSCLC)占比是80%~85%,其中有三分之一的患者在初诊的时候,就被诊断为晚期非小细胞肺癌(NSCLC)。
对于晚期肺癌患者来说,他们已经失去了手术机会,所以靶向治疗、化疗成为该类患者的主要治疗手段。
本文以晚期非小细胞肺癌(NSCLC)靶向治疗为例,对患者靶向治疗期间,应该掌握的相关知识进行阐述,希望能够帮助到广大患者和家属。
一非小细胞肺癌是什么?在了解晚期非小细胞肺癌(NSCLC)的靶向治疗之前,我们应该知道什么是非小细胞肺癌。
简单来说,非小细胞肺癌是肺癌的一种。
在我国城市人口中,肺癌是居民死亡的主要原因,而非小细胞肺癌就是生活中非常多见的恶性肿瘤类型。
非小细胞型肺癌包括、腺癌、鳞状细胞癌、大细胞癌。
相较于小细胞癌,非小细胞癌的癌细胞生长、分裂较为缓慢,扩散转移也会相对晚一些。
但由于很多患者在初诊时,就已经被诊断为晚期非小细胞癌,所以在治疗时,部分患者的治疗手段会受到一定的限制。
除此之外,非小细胞肺癌晚期患者,会存在疲乏、体重减轻、食欲不振等症状,部分患者还可见呼吸受阻、咳嗽和咯血这类局部症状。
二晚期非小细胞肺癌(NSCLC)靶向治疗二三事(一)晚期非小细胞肺癌(NSCLC)的靶向治疗背景以往对于晚期的非小细胞肺癌患者来说,他们在癌症治疗时,一般是通过化疗缓解肺癌引起的不良症状。
但是近几年,肺癌患者的化疗效果已经出现了瓶颈期,其治疗进展不明显。
值得惊喜的是,在分子遗传学的深入研究中,人们将非小细胞肺癌划分为不同类型的分子亚型。
并且研发出疗效更具针对性的靶向治疗药物,使晚期非小细胞肺癌患者的预后得以改善。
驱动基因阴性晚期NSCLC 一线免疫治疗肺癌作为发病率第一的肿瘤,严重威胁人们的健康。
近年来,肺癌的诊疗从化疗到靶向治疗再到免疫治疗,引领肿瘤的精准治疗模式。
对于驱动基因阴性晚期非小细胞肺癌 ( non-small-cell lung cancer,NSCLC) 患者,多种程序性死亡受体 1( programmed death 1,PD-1) 和程序性死亡配体 1( programmed death-ligand 1,PD-L1) 抑制剂取得显著疗效,在晚期NSCLC 一线、二线治疗中获得适应证,并丰富了从单药治疗到联合治疗的格局,使得“chemo- free”有望成为可能。
免疫治疗为肺癌治疗模式带来改变的同时,也对肺癌治疗方案、生物标志物的选择和相关不良反应的治疗带来一定的挑战。
20n 年 Nature 发表的《Cancer immunotherapy comes of age》点燃了免疫治疗的燎原之火,众多研究陆续推出,主要集中于程序性死亡受体1( programmed death 1,PD-1) 、程序性死亡配体1( programmed death-ligand 1 PD-L1)和细胞毒性 T 淋巴细胞相关抗原-4( cytotoxic T lympho- cyte-associated antigen 4,CTLA-4) 抑制剂。
自 2013年美国《科学》杂志将癌症免疫治疗评为“重大突破”以来,PD-1/PD-L1抑制剂作为免疫治疗中的主力军,在癌症治疗领域备受瞩目。
2014 年美国食品药品监督管理局( Federal Food and Drug Adminstra- tion,FDA) 首先批准pembrolizumab 和nivolumab用于晚期黑色素瘤治疗,其适应证不扩大。
其中,对非小细胞肺癌(non-small-cell lung cancer NSCLC)治疗的不断探索:从二线到一线,从晚期到局部晚期再到早期,从单药到联合,从泛人群到精准治疗,使得免疫治疗遍地开花。
2024年洛铂联用多西他赛与顺铂联用多西他赛治疗晚期非小细胞肺癌疗效晚期非小细胞肺癌(NSCLC)是一种常见的恶性肿瘤,预后较差。
在治疗上,化疗是常用的手段之一。
洛铂与顺铂作为铂类药物,常常与多西他赛联合使用,以提高治疗效果。
本文将探讨洛铂联用多西他赛与顺铂联用多西他赛在治疗晚期非小细胞肺癌的疗效。
1. 药物作用机制洛铂和顺铂均属于铂类药物,通过干扰DNA复制和转录过程,导致肿瘤细胞死亡。
多西他赛则是一种半合成紫杉醇类药物,能够抑制肿瘤细胞的有丝分裂,从而抑制肿瘤的生长。
当这些药物联合使用时,可以发挥协同作用,提高治疗效果。
2. 洛铂联用多西他赛的疗效洛铂与多西他赛联合使用时,可以显著提高晚期NSCLC患者的生存率和生活质量。
这种联合治疗方案能够减少肿瘤的大小,减轻患者的症状,并延长其生存期。
同时,洛铂与多西他赛的联合使用还具有较低的毒性,可以减少不良反应的发生。
3. 顺铂联用多西他赛的疗效顺铂与多西他赛联合使用时,同样可以带来显著的治疗效果。
这种联合治疗方案能够抑制肿瘤的生长和扩散,提高患者的生存率。
与洛铂联用多西他赛相比,顺铂联用多西他赛在某些方面具有优势,如更好的耐受性和更低的毒性。
4. 对比两种联合治疗方案虽然洛铂联用多西他赛和顺铂联用多西他赛在治疗晚期NSCLC方面均具有一定的疗效,但两者之间存在一些差异。
在生存率和生活质量方面,两种联合治疗方案的效果相近。
然而,在毒性反应方面,顺铂联用多西他赛可能具有较低的毒性,因此更适合一些身体状况较差的患者。
此外,患者的个体差异也可能影响两种联合治疗方案的效果。
例如,某些患者可能对洛铂或顺铂的敏感性不同,从而导致不同的治疗效果。
因此,在选择联合治疗方案时,需要根据患者的具体情况进行个体化决策。
5. 结论洛铂联用多西他赛与顺铂联用多西他赛在治疗晚期非小细胞肺癌方面均具有一定的疗效。
两种联合治疗方案在生存率和生活质量方面相近,但在毒性反应方面存在差异。
吉西他滨联合顺铂节拍化疗治疗晚期非小细胞肺癌的效果评价1. 引言1.1 背景介绍肺癌是世界范围内最常见的恶性肿瘤之一,其中约85%是非小细胞肺癌(NSCLC)。
NSCLC的治疗一直是临床上的难点,尤其是晚期患者的治疗效果不佳,临床疗效和生存率较低。
吉西他滨(Gemcitabine)和顺铂(Cisplatin)是目前常用的化疗药物,其联合应用已在NSCLC 的治疗中得到广泛应用。
吉西他滨主要通过干扰DNA 合成来抑制细胞增殖,而顺铂则能够诱导细胞凋亡,二者具有协同作用,可以增强治疗效果。
近年来,有研究表明吉西他滨联合顺铂节拍化疗在晚期NSCLC的治疗中取得了一定的疗效,并且较少出现严重的不良反应。
有关该治疗方案在晚期NSCLC的疗效评价、安全性评价、生存分析以及不良反应分析的资料仍不够充分,因此本研究旨在对吉西他滨联合顺铂节拍化疗在晚期NSCLC中的治疗效果进行深入评价,为临床治疗提供更加可靠的依据。
1.2 研究目的本研究的目的是评价吉西他滨联合顺铂节拍化疗治疗晚期非小细胞肺癌的临床效果和安全性,探讨该治疗方案在临床实践中的应用前景。
具体包括评估患者的疗效情况,包括肿瘤缩小程度、生存期延长、疾病控制率等方面的指标。
也将对治疗过程中的不良反应进行详细记录和分析,以评价该治疗方案的安全性。
通过对治疗效果的评价和长期生存情况的分析,可以为临床医生提供有效的治疗策略,为晚期非小细胞肺癌患者提供更好的治疗选择。
希望通过本研究的结果,为推动吉西他滨联合顺铂节拍化疗在晚期非小细胞肺癌治疗中的应用提供科学依据,促进临床实践的进步。
1.3 研究对象晚期非小细胞肺癌是一种恶性肿瘤,预后较差,传统的化疗对其疗效有限。
寻找更有效的治疗方案显得尤为重要。
本研究选取了晚期非小细胞肺癌患者作为研究对象。
研究对象的选择主要基于以下几点考虑:晚期非小细胞肺癌患者往往病情较重,需要更有效的治疗方案来延长生存时间;由于非小细胞肺癌的发病机制复杂,不同患者对治疗的反应也会有所不同,因此需要对不同类型的患者进行个体化的治疗方案选择;研究对象的选择还考虑到了临床实践中容易观察到的临床症状和生存质量等因素,以便更全面地评估吉西他滨联合顺铂节拍化疗对晚期非小细胞肺癌的疗效和安全性。
非小细胞癌治疗方案非小细胞肺癌(NSCLC)是一种常见的恶性肿瘤,其治疗方案需要综合考虑患者的病情、病理类型、分期和个体化特点。
针对不同阶段的非小细胞肺癌,我们需要采取不同的治疗方案,以期达到最佳的治疗效果。
本文将就非小细胞肺癌的治疗方案进行详细介绍。
手术治疗是非小细胞肺癌的主要治疗方式之一。
对于早期非小细胞肺癌患者,手术切除肿瘤是首选的治疗方法。
通过手术可以彻底清除肿瘤,提高患者的生存率。
而对于晚期患者,手术治疗可能并不适用,因为肿瘤已经扩散到其他器官。
此时,放化疗联合治疗是更常见的选择。
放疗是非小细胞肺癌治疗的重要手段之一。
对于无法手术切除的患者,放疗可以有效控制肿瘤的生长,减轻症状,提高生存率。
同时,放疗也可以作为手术前后的辅助治疗手段,帮助患者提高手术的成功率。
放疗的方式包括外放疗和内放疗,医生会根据患者的具体情况进行选择。
化疗是非小细胞肺癌治疗的重要手段之一。
化疗可以通过药物的方式杀死癌细胞,阻断癌细胞的增殖,从而达到控制肿瘤生长的目的。
化疗通常是在手术或放疗后进行的,也可以作为单独的治疗手段使用。
近年来,靶向治疗和免疫治疗也成为非小细胞肺癌治疗的重要手段,可以帮助一些晚期患者获得更好的治疗效果。
在制定治疗方案时,医生需要全面评估患者的身体状况、病情分期、肿瘤的分子生物学特征等因素,因为不同的患者需要采取不同的治疗策略。
此外,患者在接受治疗的过程中也需要密切关注自身的身体状况,及时向医生反映治疗过程中出现的不适症状,以便及时调整治疗方案。
综上所述,非小细胞肺癌的治疗方案需要综合考虑多种因素,包括手术治疗、放化疗、靶向治疗和免疫治疗等多种手段。
在制定治疗方案时,医生需要根据患者的具体情况进行个体化治疗,以期达到最佳的治疗效果。
同时,患者在接受治疗的过程中也需要积极配合医生的治疗方案,保持良好的心态,提高治疗的成功率。
非小细胞癌治疗方案癌症是世界范围内面临的严重健康问题之一。
其中,非小细胞肺癌(Non-Small Cell Lung Cancer,NSCLC)被认为是最常见的一种癌症类型。
NSCLC在早期通常没有明显的症状,因此大多数患者在被确诊时已进入中晚期阶段。
为了延长生存期和提高患者的生活质量,科学家和医生们一直在努力寻找最有效的治疗方案。
治疗NSCLC的方案有很多种,其中包括手术切除、放射治疗、化疗、靶向治疗和免疫治疗等。
每一种方式都有其适应症和局限性,最佳的治疗方案通常是根据患者的具体情况和癌症的严重程度来确定的。
一般来说,手术切除是治疗NSCLC最常见的方式之一。
对于早期诊断的患者,手术切除可以消除肿瘤,同时保留肺部功能。
然而,手术对于部分患者来说可能不可行,因为肿瘤可能已扩散到其他器官。
在这种情况下,放射治疗和化疗通常会被作为替代选择。
放射治疗是利用高能射线来杀死癌细胞的一种方法。
这种治疗方式可以直接照射到肿瘤部位,以减少肿瘤的大小或停止其生长。
然而,放射治疗也可能对周围正常组织造成损伤,所以合理的剂量和治疗期限非常重要。
化疗是一种通过使用化学药物来杀死癌细胞的方法。
在NSCLC治疗中,化疗通常与手术切除或放疗联合使用,以消除可能遗留下的肿瘤细胞。
虽然化疗可以通过杀死癌细胞来减轻症状和延长生存期,但它也会对身体的健康细胞造成损害,导致一系列副作用。
因此,医生们需要根据患者的状况来权衡治疗效果和副作用。
除了传统的治疗方法外,靶向治疗已成为NSCLC治疗的一大突破。
靶向治疗通过识别和针对癌细胞上的特定变异基因或蛋白质进行干预。
这些靶向药物可以抑制癌细胞生长和扩散,并减少对正常细胞的损伤。
由于这种治疗方法的个体化特点,靶向治疗通常需要患者的肿瘤样本进行基因检测,以确定使用哪种靶向药物。
免疫治疗是近年来在NSCLC治疗中取得巨大突破的一种方法。
免疫治疗通过激活患者自身的免疫系统来攻击癌细胞。
目前,抗PD-1和抗PD-L1抗体是最常用的免疫治疗药物。