激光共聚焦显微镜技术1讲解
- 格式:doc
- 大小:143.00 KB
- 文档页数:8

简述激光共聚焦显微镜的工作原理激光共聚焦显微镜(Laser Scanning Confocal Microscope,简称LSCM)是一种高分辨率的显微镜,它具有优异的成像能力和深度探测能力。
它的工作原理基于激光光源和共聚焦技术,可以对样品进行非破坏性的三维成像和表面拓扑分析。
本文将简要介绍激光共聚焦显微镜的工作原理。
1. 激光光源激光共聚焦显微镜使用一束强度稳定、单色、相干性好的激光光源。
常用的激光光源包括氩离子激光器、氦氖激光器和二极管激光器等。
激光光源通过准直器和聚焦镜系统聚焦成一束准直的、直径极小的激光光斑。
2. 共聚焦技术激光共聚焦显微镜采用共聚焦技术,即通过聚焦光斑和探测光斑的重叠来实现高分辨率成像。
聚焦光斑从样品的一个点与探测光斑重叠之后,仅有从这个点散射回来的光能够通过探测光斑,其他来自样品其他区域的光则被阻隔掉。
这样可以消除样品其他区域的散射光对图像质量的影响。
3. 共焦平面激光共聚焦显微镜通过调节聚焦镜的位置,可以获得不同深度的共焦平面。
共焦平面是指光路中聚焦光斑和探测光斑达到最小的位置。
在共焦平面之上和之下,成像出的图像将会出现模糊和散焦现象。
调节聚焦镜的位置,可以实现在样品不同深度层面进行三维成像。
4. 探测和成像聚焦光斑扫描样品上的一个区域,样品上的荧光探针或反射光信号通过物镜收集到探测器上。
激光共聚焦显微镜常用荧光探针来标记样品的特定结构或分子,使其发出荧光信号,进而获得一幅高对比度的荧光图像。
探测器接收到的信号经过放大、滤波和转换等处理后,最终形成图像。
5. 高分辨率成像激光共聚焦显微镜具有高分辨率的成像能力。
其分辨率可以达到光学显微镜的两倍,约为200纳米级别。
激光光源的单色性和相干性,以及共聚焦技术的应用,使得激光共聚焦显微镜能够获得更清晰、更准确的显微图像。
总结起来,激光共聚焦显微镜利用激光光源以及共聚焦技术,能够实现高分辨率的三维显微成像。
通过调节聚焦镜的位置,可以获得不同深度层面的图像,更好地观察样品的内部结构。

激光共聚焦显微镜要点解析(一)激光共聚焦显微镜是80年代发展起来的一项划时代意义的高科技新产品,它是在荧光显微镜成像基础上加装了激光扫描装置,利用计算机进行图象处理,使用紫外或可见光激发荧光探针,从而得到细胞或组织内部微细结构的荧光图象,在亚细胞水平上观察例如Ca2+,pH值,膜电位等生理信号及细胞形态的变化,成为形态学,分子细胞生物学,神经科学,药理学,遗传学等领域中新一代强有力的研究工具。
一、基本原理和功能1.1 基本原理传统的光学显微镜使用的是场光源,标本上每一点的图象都会受到邻近点的衍射光或散射光的干扰;激光共聚焦显微镜利用激光束经照明针孔形成点光源对标本内焦平面上的每一点扫描,标本上的被照射点,在探测针孔处成像,由探测针孔后的光电倍增管(PMT)或冷电耦器件(cCCD)逐点或逐线接收,迅速在计算机监视器屏幕上形成荧光图象。
照明针孔与探测针孔相对于物镜焦平面是共轭的,焦平面上的点同时聚焦于照明针孔和发射针孔,焦平面以外的点不会在探测针孔处成像,这样得到的共聚焦图象是标本的光学横断面,克服了普通显微镜图象模糊的缺点。
1.2 激光共聚焦显微成像仪的图像处理功能1)“细胞CT”功能通过狭缝扫描技术将我们对细胞的研究由多层迭加影像推进到真正的平面影像水平,使图像更加清晰,从而为分子细胞生物学的深入研究拓宽了视野。
2)三维成像与细胞内部结构图像相结合的功能激光共聚焦显微成像仪可以将断层图像与三维重建图像有机的结合起来,不但能揭示细胞内部的结构和提供细胞的长、宽、厚、断层面积、细胞体积等参数,而且可以给人以三维立体的概念。
例如:可以使细胞旋转起来从而能随意观察细胞各个侧面的表面结构。
3)将形态学、生理学与分子细胞生物学的研究相互结合利用激光共聚集显微成像仪不但可以观察细胞形态的动态变化,而且用适当的荧光探针可以观察细胞内部的生物化学变化。
如细胞内游离Ca2+、pH值及其它细胞内离子的实时测定。
荧光原位杂交的杂交点观测和定量分析。

激光扫描共聚焦显微镜技术Laser Scanning Confocal Microscope——基础篇李治国细胞的内在生活显微镜的发展史没有显微镜就不可能有细胞学诞生。
1590年,荷兰眼镜制造商J 和Z.Janssen 父子制作了第一台复式显微镜。
1665年,英国人Robert Hook首次描述了植物细胞(木栓,命名为cella 。
1680年,荷兰人A.van Leeuwenhoek成为皇家学会会员,他一生中制作了200多台显微镜和400多个镜头,用设计较好的显微镜观察了许多动植物的活细胞与原生动物。
Made by A.van Leeuwenhoek (1632-1723.Magnification ranges at 50-275x.显微镜的最重要参数——分辨力显微镜物象是否清楚不仅决定于放大倍数,还与显微镜的分辨力(resolution )有关。
分辨率是指区分开两个质点间的最小距离各种显微镜的分辨能力光学显微镜(light microscopy)0.2μm电子显微镜 (Electro microscopy 0.2nm扫描遂道显微镜 (scanning tunneling microscope 0.2nm以下 1932年,德国人M.Knoll 和E.A.F.Ruska 发明电镜,1940年,美、德制造出分辨力为0.2nm 的商品电镜。
1981年,瑞士人G.Binnig 和H.RoherI 在IBM 苏黎世实验中心(Zurich Research Center)发明了扫描隧道显微镜而与电镜发明者Ruska 同获1986年度的诺贝尔物理学奖。
常用的光学显微镜(light microscopy普通光学显微镜暗视野显微镜相差显微镜偏光显微镜微分干涉显微镜荧光显微镜激光共焦扫描显微镜普通光学显微镜原理普通光学显微镜原理图1. 构成:①照明系统②光学放大系统③机械装置2. 原理:经物镜形成倒立实像,经目镜放大成虚像。

激光共聚焦显微镜技术The techniques and applications of Confocal Laser Scanning Microscopy激光共聚焦显微镜(LSCM)的发展简史1957年,Marvin Minsky提出了共聚焦显微镜技术的某些基本原理,获得了美国的专利。
1978年,阿姆斯特丹大学的G.J.Brakenhoff首次展示了改善了分辨率的共焦显微镜。
1985年,Wijnaendtsvan Resandt推出了第一台对荧光标记的材料进行光切的共焦显微镜激光共聚焦显微镜(LSCM)的发展简史☐80年代末,各家公司都推出了商品化的共焦显微镜,英国的Bio-Rad公司的MRC系列,德国Leica公司的TCS系列,Zeiss公司的LSM系列等。
☐近二十年来,从滤片型到光谱型,人们对共焦高分辨率,采集图像快速,技术的改进及应用开发不断进行,出现了很多新的技术。
如双光子,FCS,FLIM ,STED等。
共焦显微镜的优点人眼分辨率:0.2mm光学显微镜分辨率:0.25μm电子显微镜分辨率:0.2nm共焦显微镜分辨率:μm共焦显微镜的优点☐电子显微镜的缺陷:1.只能观察固定样品2.样品制备过程(固定、包埋、切片)造成的假象☐荧光显微镜的缺陷:1.可以观察活细胞或组织,但细胞或组织内结构高度重叠。
2.荧光具有强散射性,造成图像实际清晰度的大大下降。
3.荧光漂白很快,使荧光图像的拍照有困难。
4.如果荧光滤片选配不当,多荧光标记样品图像的采集很困难,且很难抑制光谱交叉。
共焦显微镜的优点☐共焦显微镜与传统显微镜的区别1.抑制图像的模糊,获得清晰的图像激光扫描共焦显微镜技术☐共焦显微镜与传统显微镜的区别2. 具有更高的轴向分辨率,并可获取连续光学切片激光扫描共焦显微镜技术共焦显微镜与传统显微镜的区别3. 增加侧向分辨率激光扫描共焦显微镜技术Fluorescent Microscope vs confocal激光扫描共焦显微镜技术激光扫描共焦显微镜技术扫描方式激光扫描共焦显微镜技术原理小结:Confocal 利用放置在光源后的照明针孔和放置在检测器前的探测针孔实现点照明和点探测,来自光源的光通过照明针孔发射出的光聚焦在样品焦平面的某个点上,该点所发射的荧光成像在探测针孔内,该点以外的任何发射光均被探测针孔阻挡。


激光共聚焦显微镜的原理和应用1. 引言激光共聚焦显微镜(Laser Scanning Confocal Microscope,简称LSCM)是一种高分辨率的显微镜技术,已经广泛应用于生物学、医学和材料科学等领域。
本文将介绍激光共聚焦显微镜的原理和应用。
2. 原理激光共聚焦显微镜通过激光束的共聚焦和通过物体的反射或荧光发射来实现图像的采集。
2.1 激光共聚焦•通过透镜来聚焦激光束•聚焦点在样本表面上产生光斑•样本反射或发射出来的光再次通过透镜,聚焦到探测器上•透镜的位置可以移动,可以扫描整个样本2.2 反射和荧光信号的采集•激光束照射到样本上,经过反射或荧光发射•光学系统收集并聚焦这些发射的光•通过探测器记录下发射光的强度和位置•通过移动透镜和探测器,可以获得样本的三维图像3. 应用激光共聚焦显微镜在许多领域都得到了广泛的应用,以下是其中的几个典型应用。
3.1 细胞生物学•可以观察细胞的形态和结构•可以追踪细胞内的生物分子运动•可以观察细胞的生物化学过程3.2 分子生物学•可以观察和定量细胞器的分布和聚集情况•可以观察和测量分子的扩散速率•可以研究蛋白质的合成和代谢过程3.3 医学研究•可以观察和诊断组织和器官的病理变化•可以研究疾病的发生和发展机制•可以评估治疗方法的有效性和副作用3.4 材料科学•可以观察材料的微观结构和表面形貌•可以研究材料的热力学和力学性质•可以评估材料的耐久性和可靠性4. 总结激光共聚焦显微镜是一种高分辨率的显微镜技术,通过激光束的共聚焦和物体的反射或荧光发射来实现图像的采集。
它在细胞生物学、分子生物学、医学研究和材料科学等领域都有着广泛的应用。
利用激光共聚焦显微镜,科研人员可以观察和研究生物和材料的微观结构、功能和相互作用,为科学研究和应用提供了强大的工具。

激光共聚焦扫描显微镜成像的基本原理激光共聚焦显微镜(LCM)是近年来发展起来的一种高分辨率荧光显微成像技术。
它通过将样品置于激光束的焦点处,利用高灵敏度的探测器记录样品发出荧光信号,从而实现对样品内部结构的高分辨率成像。
本文将详细介绍LCM的基本原理、成像途径、成像原理及优缺点等方面的内容。
一、激光共聚焦显微镜的基本原理激光共聚焦显微镜基于利用激光束在三维空间内聚焦成极小的点状光斑,对样品进行扫描成像的技术原理。
在聚焦点位置,通过聚焦光斑的极高光密度,激活样品中的荧光染料,荧光染料则针对特定的结构在荧光信号波长处发出荧光信号,被高灵敏度荧光探测器探测并记录下来,然后通过计算机处理、分析和重建,生成高质量的高分辨率图像。
与普通显微镜最大的区别在于,普通显微镜由于透过整个样品并以相位差效应成像,而激光共聚焦显微镜由于仅仅聚焦于样品表面的非常窄的一点,信号只能从聚焦点的附近探测到,而且该点在扫描过程中会不断变换位置。
换言之,成像并不是透过整个样品实现,而是在样品上面扫描得到,并聚焦于单个点上。
对于毫米量级的样品,其层面精度可以达到25nm。
二、激光共聚焦显微镜成像途径激光共聚焦显微镜的成像途径目前有两种,分别为单光子激发型和双光子激发型。
1、单光子激发型单光子成像模式是利用激光束在荧光染料上发生的单光子激发效应进行成像的一种方式。
在单光子激发光下,荧光染料的各自精细结构会发生辐射跃迁产生能量并发射荧光,同时发射时间对荧光能量的传递产生影响,可以通过荧光转移速率反映。
荧光束在被激活后,将以光子流的形式反射回来,被共聚焦显微镜探测并捕捉。
2、双光子激发型双光子成像模式使用了两次光子激发效应,产生高到对比度的图像,并最小化了样品在激发时所受的损伤输出功率。
双光子成像所需条件包括至少两个光子激发、空间和时间上的集中在样品特定区域。
在这种情况下,激光光束相互作用,将样品中转运载分子激发成放射的谐振态发生荧光发射。

激光共聚焦显微镜的原理与应用范围讲解激光共聚焦显微镜(Confocal laser scanning microscope, CLSM)是一种高分辨率的显微镜技术,它利用激光束进行点扫描,将样品的不同深度处的信息获取并合成,从而实现三维图像的获取。
本文将对激光共聚焦显微镜的原理和应用范围进行详细介绍。
首先是激光扫描。
激光束通过空气透镜和扫描镜反射,聚焦在样品上。
扫描镜以一个固定的频率和幅度来快速振动,使得激光束扫描在样品表面,形成二维扫描像。
其次是共焦原理。
共焦显微镜利用一个空孔径光阑(pinhole)来调整激光束的直径,只允许经过焦平面的光通过,其他散射光被阻挡。
这样可以消除在光路上不同深度处的散射光干扰,提高图像的纵向分辨率。
同时,由于只有通过焦平面的光才能进入探测器,所以可以采集不同深度处的信息,合成三维图像。
最后是探测技术。
通常激光共聚焦显微镜会配备一个光电探测器,并通过探测器来收集散射和荧光光信号。
散射光可以用来形成反射式图像,而荧光光信号则可以用来观察标记了特定分子或细胞的样品。
通过调整激光的波长和探测器的设置,可以实现不同特定分子和结构的成像。
1.细胞和组织成像:激光共聚焦显微镜可以提供高分辨率的细胞和组织成像。
通过荧光标记特定蛋白质或细胞结构,可以观察和研究细胞内部的生物过程和结构。
2.神经科学:激光共聚焦显微镜在神经科学中的应用得到了广泛关注。
可以观察和追踪神经元的形态和功能,研究神经网络的连接和活动,揭示神经系统的工作机制。
3.生物医学研究:激光共聚焦显微镜在生物医学研究中也扮演着重要的角色。
可以用于癌症细胞的培养和观察,研究癌症的发生和发展机制。
还可以用于研究哺乳动物早期发育过程中的细胞分化和组织形态的变化。
4.材料科学:激光共聚焦显微镜可用于对材料的表面和内部结构进行观察和分析。
可以研究纳米材料的形貌和组成,观察材料的晶体结构和缺陷。
总之,激光共聚焦显微镜是一种重要的显微镜技术,具有高分辨率、三维成像和可观察特定分子和结构的能力。


激光共聚焦显微镜工作原理
激光共聚焦显微镜(laser scanning confocal microscopy, LSCM)是一种常用的高分辨显微成像技术,其工作原理如下:
1. 激光:首先,选择合适波长的激光器产生单色的激光束,常见的波长有488nm(常用于激发荧光染料)和633nm(常用
于激发受体标记染料)等。
2. 激光聚焦:激光通过一系列透镜逐层聚焦,使得激光束的直径变窄,激光的光斑能够更加集中。
透镜组合使光束对准一个平面。
3. 共聚焦点:激光经过透镜后,由于透镜组合以及光路设定,激光束的最终焦点被限制在一个非常小的空间区域内,称为共聚焦点。
共聚焦点是激光在待观察样品中最小的光斑。
4. 扫描:共聚焦点在样品上以二维或三维方式进行扫描。
通常采用高速马达驱动镜片组件,使共聚焦点在样品表面来回扫描。
扫描方式包括线扫描和点扫描等形式。
5. 信号检测:样品中的荧光或反射光经过共聚焦点时产生的光信号由探测器收集,并转换为电信号。
常用探测器包括光电倍增管(photomultiplier tube, PMT)或光电二极管(photodiode)等。
6. 图像重建:通过对检测到的信号进行处理和计算,可以将扫描到的信号重建成具有空间分辨率的二维或三维图像。
利用激
光聚焦特性和扫描方式,可以获取样品的各种层面和不同方向的断面图像。
总之,激光共聚焦显微镜利用激光束的聚焦特性、样品的扫描和信号的检测,实现了高分辨的光学显微成像。
它可以在样品内实现特定深度的光学切片,提供空间分辨率较高的三维图像。
它在生命科学、材料科学、纳米科学等领域中广泛应用。
激光共聚焦扫描显微镜技术一、简介激光共聚焦扫描显微镜在普通光镜基础上引入共聚焦装置,该装置能够排除非焦平面及焦平面非焦点光斑信息,大大提高分辨率和图象清晰度。
在此基础上,由于计算机及相应的软件技术组合,可以对较厚样品进行连续光学切片及三维重建。
目前,激光共聚焦显微镜(LSCM)技术已广泛应用于生物医学领域。
本文对LSCM的应用原理、较普通光镜的优点及生物学应用做简单介绍。
激光共聚焦扫描显微镜是随着光学、视频、计算机等技术的迅速发展而诞生的一种高科技产品。
其组成除光学显微镜部分之外主要由激光光源、扫描装置、检测器、计算机系统(包括数据采集,处理,转换,应用软件)、图象输出设备、光学装置和共聚焦系统组成。
在生物医学等研究领域中发挥重要作用,尤其在研究和分析活细胞结构、分子、离子的实时动态变化过程,组织和细胞的光学连续切片和三维重建等方面,是传统的光学显微镜所望尘莫及的。
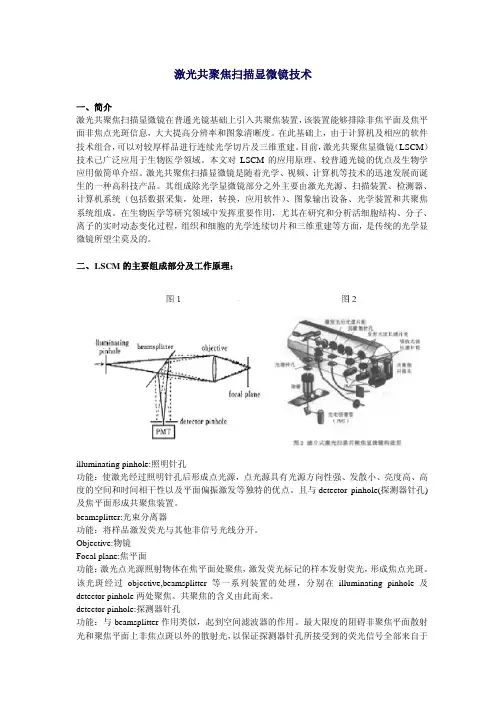
二、 L SCM的主要组成部分及工作原理:illuminating pinhole:照明针孔功能:使激光经过照明针孔后形成点光源,点光源具有光源方向性强、发散小、亮度高、高度的空间和时间相干性以及平面偏振激发等独特的优点。
且与detector pinhole(探测器针孔)及焦平面形成共聚焦装置。
beamsplitter:光束分离器功能:将样品激发荧光与其他非信号光线分开。
Objective:物镜Focal plane:焦平面功能:激光点光源照射物体在焦平面处聚焦,激发荧光标记的样本发射荧光,形成焦点光斑。
该光斑经过objective,beamsplitter等一系列装置的处理,分别在illuminating pinhole及detector pinhole两处聚焦。
共聚焦的含义由此而来。
detector pinhole:探测器针孔功能:与beamsplitter作用类似,起到空间滤波器的作用。
最大限度的阻碍非聚焦平面散射光和聚焦平面上非焦点斑以外的散射光,以保证探测器针孔所接受到的荧光信号全部来自于样品光斑焦点位置,因此样品上衍射聚集光斑和探测器针孔成像光斑包含相同信息(两点共轭)。
激光共聚焦显微镜分析技术激光共聚焦显微镜(Laser Scanning Confocal Microscopy,LSCM)是一种高分辨率的荧光显微镜技术,可以在细胞和组织水平上观察和研究样本的三维结构和功能。
其原理是利用激光束经过一组物镜后,聚焦于样本的一个点上,再通过探测器收集经过样本的反射或荧光信号,然后通过扫描样本的X、Y和Z轴移动,以获取图像的二维和三维信息。
1.高分辨率:激光共聚焦显微镜使用激光束的聚焦原理,可以获得比传统显微镜更高的分辨率。
它可以减少标记物质的模糊和混叠现象,提供更清晰、更详细的图像。
2.3D成像能力:激光共聚焦显微镜可以获取堆叠图像,从而构建三维结构。
通过扫描样本的Z轴,可以获得不同深度的切片图像,再通过软件进行堆叠和重建,得到三维结构信息。
3.实时观察:激光共聚焦显微镜可以实时观察和记录样本的变化过程。
通过快速的扫描速度和高灵敏度的探测器,可以实现对细胞和组织的实时观察,并捕捉瞬间变化的图像。
4.荧光标记:激光共聚焦显微镜可以应用于荧光标记技术,通过使用特定的荧光染料或标记抗体,可以观察和定位特定蛋白质、细胞器和细胞分子的位置和表达水平。
激光共聚焦显微镜分析技术广泛应用于细胞生物学、生物医学研究、药物发现、神经科学等领域。
它可以提供高分辨率的图像和三维结构信息,帮助研究人员深入理解生物学过程和细胞功能。
以下是几个应用激光共聚焦显微镜的案例:1.细胞和组织成像:激光共聚焦显微镜可以观察和分析细胞和组织的形态、结构和功能。
它可以用于观察细胞分裂、细胞移动、细胞器的定位和交互作用等细胞过程的研究。
2.荧光探针研究:激光共聚焦显微镜可以与特定的荧光染料或标记抗体结合使用,用于研究特定蛋白质或细胞分子的位置和表达水平。
通过荧光标记技术,可以观察和定位蛋白质在细胞内的位置和亚细胞结构。
3.三维结构重建:激光共聚焦显微镜可以通过扫描样本的Z轴,获得不同深度的切片图像,并通过软件进行三维堆叠和重建。
激光共聚焦显微镜的工作原理1. 介绍激光共聚焦显微镜(Laser Scanning Confocal Microscope, LSCM)是利用扫描光束来获取样本高分辨率图像的一种显微镜技术。
相比传统的常规荧光显微镜,激光共聚焦显微镜具有更高的分辨率、激发光功率更高、能透射更深层的样本,并且能够获取三维图像等优点。
在生物医学研究领域广泛应用于细胞和组织的观察。
激光共聚焦显微镜的工作原理基于荧光显微镜和共聚焦成像原理,通过聚焦光在样本内进行光学切片来获取样本的高分辨率图像。
2. 共聚焦成像原理共聚焦成像是激光共聚焦显微镜的核心原理。
在传统的荧光显微镜中,样本上所有的荧光都被同时激发并捕获,导致成像时无法区分特定深度的信号。
而激光共聚焦显微镜通过点对点扫描样本,只捕获焦点所在深度的信号,从而消除了深度模糊,实现了高分辨率成像。
共聚焦成像的原理基于薄光学切片和探测系统的成像区域选取。
2.1 薄光学切片在激光共聚焦显微镜中,激光通过聚焦镜头(Objective)被聚焦到样本表面或内部的一个点上,样本导致了光的散射、吸收和荧光发射等过程。
这些光经过探测系统(例如物镜、光学滤波器和光电二极管等)的收集和探测后形成图像。
为了实现共聚焦成像,光学系统需要将激光点在样本体内移动,并逐点收集图像。
在样本体内,聚焦的激光通过中心区域(称为焦点)继续向外传播,光线逐渐变得散开。
因此,在一个特定的深度上,只有处于焦点附近的光线才能被聚焦在一个点上。
而离焦点较远的光线则在探测系统中被模糊接收,形成深度模糊的图像。
为了克服深度模糊的问题,激光共聚焦显微镜将样本切成一系列薄的光学切片。
这样,每个切片内的光线都可以在探测系统中被聚焦并形成清晰的图像。
通过逐层扫描样本并获取各个切片的图像,最终可以将这些图像叠加起来,形成具有高分辨率和三维信息的样本成像。
2.2 成像区域选取在共聚焦成像过程中,为了准确地获取样本的某个深度的图像,需要通过镜头和探测系统来选取成像区域。
激光共聚焦显微镜分析技术
精确
激光共聚焦显微镜(LSCM)是一种用于观察小型生物样品的先进显微技术,它可以在不损坏样品的情况下实现高分辨率图像。
激光共聚焦显微镜的工作原理是将激光束通过多个激光器,焦距变换棱镜,准直镜和口径镜而将激光束聚至样品上。
激光共聚焦显微镜可以实现多维成像,形成三维立体图像,从而使细胞学家可以清楚地观察到一个单细胞内的复杂结构和特性。
LSCM系统组成
激光共聚焦显微镜(LSCM)由显微镜和激光源组成。
显微镜由立方体成像系统,透镜,棱镜,口径镜和准直镜组成。
立方体成像系统可以分辨和叠加激光束并将其导向棱镜,准直镜,口径镜和样品的组合。
立方体成像系统中的激光束可以发生变化和移动,从而更改样品的位置,聚焦位置和整个显微镜系统的焦距。
准直镜,棱镜和口径镜也可以更改激光束的衍射和偏折,以更改激光束的形状。
准直镜,棱镜和口径镜也可以调节激光束的强度,以调节显微图像的亮度。
激光源。
激光共聚焦荧光显微镜原理(一)激光共聚焦荧光显微镜介绍•激光共聚焦荧光显微镜是一种高分辨率、高灵敏度、非接触式的三维显微成像技术。
•它通过聚焦激光束扫描样品,利用荧光标记来获得样品内部的高分辨率三维图像。
原理解释•激光共聚焦荧光显微镜的主要组成部分包括激光源、物镜、探测器和扫描镜等。
•激光源向物镜聚焦光束,然后通过扫描镜快速扫描,即可在样品中聚焦出一个非常小的点,称为焦斑。
•接着,利用荧光标记,样品发出荧光信号,荧光信号被探测器接收,并转换为电信号。
•然后,将探测到的信号与扫描镜的位置信息对应起来,就可以获得高分辨率而具有三维信息的样品图像。
应用领域•激光共聚焦荧光显微镜广泛应用于生物学、材料学、纳米技术等领域。
•生物学领域中,可用于观察细胞、组织等生物标本的三维结构。
•材料学领域中,可用于研究材料的三维结构和成分。
•纳米技术领域中,可用于研究纳米材料的结构和制备过程。
总结•激光共聚焦荧光显微镜是一种非常重要的高分辨率三维成像技术,可用于生物学、材料学、纳米技术等领域的研究。
•它利用聚焦激光光束和荧光标记,通过快速扫描样品,获得高分辨率的三维结构信息。
•随着技术的不断发展,相信激光共聚焦荧光显微镜在更多领域的研究中将大有作为。
激光共聚焦荧光显微镜的优点•高分辨率:激光共聚焦荧光显微镜的空间分辨率可达到几十纳米级别,比传统显微镜高出数倍。
•高灵敏度:通过荧光标记,激光共聚焦荧光显微镜可实现单个分子级别的检测。
•非接触式:激光光束非常细,采用非接触式聚焦,对样品不会造成破坏。
•可观察内部结构:激光共聚焦荧光显微镜可观察到样品的内部三维结构,而传统显微镜只能看到表面结构。
激光共聚焦荧光显微镜的发展历程•激光共聚焦荧光显微镜是由德国物理学家斯特凡·海克尔(Stefan Hell)于1994年发明的。
•他通过解决光学限制的方法,将光束在空间局部化,从而实现超分辨率成像。
•2006年,海克尔因发明激光共聚焦荧光显微镜被授予诺贝尔化学奖。
激光共聚焦显微镜技术The techniques and applications of Confocal Laser Scanning Microscopy激光共聚焦显微镜(LSCM)的发展简史1957年,Marvin Minsky提出了共聚焦显微镜技术的某些基本原理,获得了美国的专利。
1978年,阿姆斯特丹大学的G.J.Brakenhoff首次展示了改善了分辨率的共焦显微镜。
1985年,Wijnaendtsvan Resandt推出了第一台对荧光标记的材料进行光切的共焦显微镜激光共聚焦显微镜(LSCM)的发展简史☐80年代末,各家公司都推出了商品化的共焦显微镜,英国的Bio-Rad公司的MRC系列,德国Leica公司的TCS系列,Zeiss公司的LSM系列等。
☐近二十年来,从滤片型到光谱型,人们对共焦高分辨率,采集图像快速,技术的改进及应用开发不断进行,出现了很多新的技术。
如双光子,FCS,FLIM ,STED等。
共焦显微镜的优点人眼分辨率:0.2mm光学显微镜分辨率:0.25μm电子显微镜分辨率:0.2nm共焦显微镜分辨率:μm共焦显微镜的优点☐电子显微镜的缺陷:1.只能观察固定样品2.样品制备过程(固定、包埋、切片)造成的假象☐荧光显微镜的缺陷:1.可以观察活细胞或组织,但细胞或组织内结构高度重叠。
2.荧光具有强散射性,造成图像实际清晰度的大大下降。
3.荧光漂白很快,使荧光图像的拍照有困难。
4.如果荧光滤片选配不当,多荧光标记样品图像的采集很困难,且很难抑制光谱交叉。
共焦显微镜的优点☐共焦显微镜与传统显微镜的区别1.抑制图像的模糊,获得清晰的图像激光扫描共焦显微镜技术☐共焦显微镜与传统显微镜的区别2. 具有更高的轴向分辨率,并可获取连续光学切片激光扫描共焦显微镜技术共焦显微镜与传统显微镜的区别3. 增加侧向分辨率激光扫描共焦显微镜技术Fluorescent Microscope vs confocal激光扫描共焦显微镜技术激光扫描共焦显微镜技术扫描方式激光扫描共焦显微镜技术原理小结:Confocal 利用放置在光源后的照明针孔和放置在检测器前的探测针孔实现点照明和点探测,来自光源的光通过照明针孔发射出的光聚焦在样品焦平面的某个点上,该点所发射的荧光成像在探测针孔内,该点以外的任何发射光均被探测针孔阻挡。
照明针孔与探测针孔对被照射点或被探测点来说是共轭的,因此被探测点即为共焦点,被探测点所在的平面即为共焦平面。
计算机以像点的方式将被探测点显示在计算机屏幕上,为了产生一幅完整的图像,由光路中的2al convention confocal d d扫描系统在样品焦平面上扫描,从而产生一幅完整的共焦图像。
只要载物台沿着Z轴上下移动,将样品新的一个层面移动到共焦平面上,样品的新层面又成像在显示器上,随着Z轴的不断移动,就可得到样品不同层面连续的光切图像。
激光扫描共焦显微镜技术激光扫描共焦显微镜的设计特点:1.点照明。
2.具有照明pinhole和探测pinhole。
3.照明pinhole和探测pinhole共轭(共焦), 共焦点即被探测点,被探测点所在的平面为共焦平面。
4.具有扫描系统——逐点扫描成像。
5.具有多个(五个)荧光通道,可同时探测多个被标记物。
6.使用AOTF(Acousto-Optical Tunable Filter )进行激光波长和强度的选择,并以极超快速控制激光开和关,从而实现任意形状感兴趣区域扫描的功能,实现了实时快速检测。
7. AOBS(Acousto-Optical Beam Splitter):更好的减少了激发光对发射荧光的干扰。
8.光谱检测器:任意选择接受光谱的波长和带宽。
AOBS(Acousto-Optical Beam Splitter)AOBS的作用☐特定波长的激发光经过AOBS后发生偏转进入光路☐样品产生的荧光直接通过AOBS到达检测器,而反射回来的激发光经过AOBS后发生偏转不能到达检测器。
☐优点:与传统的二色光分光镜相比,增大了荧光的接受率。
☐更好的阻止了激发光对发射荧光的干扰。
光谱检测器棱镜分光,光谱检测激光扫描共焦显微镜技术☐分辨率1. 光学分辨率只与物镜的数值孔径NA和检测波长有关xy分辨率比传统显微镜小1.4x传统显微镜: Rxy=0.61λ/NA (0.25 μm )Confocal: Rxy=0.4λ/NA(0.18 μm )2. 采样分辨率固定物镜倍率下,Zoom相同时,无论采样密度大小,采样面积是固定的。
理论上,固定面积下,采样密度越高,即采样点越多,图像越细腻。
但是,采样密度越高,扫描一幅图像的速度越慢,荧光强度越低,样品也越容易被淬灭。
激光扫描共焦显微镜技术☐图像亮度1.与物镜NA有关。
物镜镜像亮度与数值孔径的平方呈正比,与总放大率的平方呈反比。
L = NA 2/ M 2 , NA 大小相同,倍率越高,镜像亮度越低2. 与pinhole 大小有关。
M 2 = ( M 1 × M 2) 2Pinhole 大小的选择理论上,最佳Pinhole =Airy Disk =1实际上,应根据样品标记的实际情况来选择Pinhole 的大小3. 与激发光强度有关。
4. 与接受发射荧光波长的带宽有关激光扫描共焦显微镜技术☐光切厚度和光切步距光学切片厚度取决于: 物镜的NA 、针孔大小、发射波长等光学切片厚度=光切步距(Step Size)☐dz=Z 轴的最小移动步距: 40nm ,15 nm ,3 nm理论Z 轴分辨率:dz=0.35μm激光扫描共焦显微镜技术☐样品的最大厚度:大约1- 2mm(10X/0.4物镜)取决于: 物镜的NA 、物镜的工作距离激光的穿透力、样品的透明度Z 轴的最大移动范围(SP2 166μm 、Z-wide,8mm)(sp5 500/1500 μm, -11mm/2mm,15nm stepsize )在观察较厚的样品,如脑片时,应该选用怎样的物镜?激光扫描共焦显微镜技术☐技术指标(Leica TCS ) :1. xy 分辨率比传统显微镜小1.4x传统显微镜: Rxy=0.61λ/NA (0.25 μm )Confocal: Rxy=0.4λ/NA (0.18 μm )2. 样品的最大厚度:大约1- 2mm(10X/0.4物镜)取决于: 物镜的NA 、物镜的工作距离激光的穿透力、样品的透明度Z 轴的最大移动范围(166μm 、Z-wide 8mm sp2)(500um/1500um/3nm , Z-wide 13mm Sp5) ( 0.88λem)2 ( n ⨯√2 Ph )2 NA n -(n 2-NA 2)1/2 +3. 样品的最小光切厚度: (载物台最小移动距离为40nm,SP2)取决于: 物镜的NA、针孔大小、发射波长等Z轴的最小移动步距: 40nmZ轴的分辨率: 0.35 μm激光扫描共焦显微镜技术☐Pinhole(探测针孔)大小影响:1) 图像的亮度2) 光学切片的厚度☐Pinhole大小的选择理论上,最佳Pinhole=Airy Disk=1实际上,应根据样品标记的实际情况来选择Ph的大小。
激光扫描共焦显微镜技术4. 激光器Ar激光器: 458nm, 476nm, 488nm, 514nmGreNe : 543nm; HeNe: 633nmAr激光器(UV): 351nm, 361nm固体激光器:561nm,405nm☐激光器的特点:1) 方向性好: 激光基本延直线传播2) 单色性好:∆λ=10-8nm3) 高亮度: 激光方向性好, 其在空间上的能量分布是高度集中的。
4) 偏振性: 激光为平面偏振光, 光纤耦合。
5)光谱的不连续性。
激光扫描共焦显微镜技术5. 五个荧光通道, 一个透射光通道即除了可同时采集多标记荧光图像外还可以同时采集透射光图像,但透射光图像为非共焦图像。
注:对未标记的标本,可采集反射光图像。
激光扫描共焦显微镜技术☐扫描速度:CONVENTIONAL 2800 lines/s 512⨯512 5/S Resonant 16000 lines/s 512⨯512 25/S ☐扫描密度:64⨯64128⨯128512⨯512,512⨯64,512⨯321024⨯10242048⨯2048 SP5 8192 ⨯8192 4096 ⨯4096☐扫描方式:xyz, xyt, xzt, xt,xyzt, xyλ, xλ,xzλ, xzy, xyzλ,激光扫描共焦显微镜技术☐共焦显微镜的类型:1.点(慢)扫描共焦显微镜:分辨率高, 图像清晰; 噪音低; 采集图像速度慢;目镜中观察不到共焦图像2.线(狭缝)扫描共焦显微镜(video rate)分辨率低; 噪音高; 扫描速度快240幅/秒; 目镜中可观察到共焦图像3.Nipkov转盘式扫描共焦显微镜性能介于上述两者之间Spinning disk confocalSpinning disk confocalSpinning disk confocal☐•每个视场约1000个激光点,总计约20000个针孔☐•针孔尺寸固定在50μm,适合100x/1.4 油镜☐•针孔间的空隙可避免信号相互干扰☐•约有70%的激发光到达样品☐• 盘转速1500到10000转/秒,成像速度300到2000帧/ 秒☐• 激发光谱400-650nm 检测光谱420-750nmSpinning disk confocal☐采用双转盘,微透镜☐EM CCD 作为探测器☐采样速度快,300-2000/s☐适合于记录活细胞样品的快速变化☐没有电子放大,不适合观察细胞内的微细结构。
☐发射波长使用滤片选择。
激光扫描共焦显微镜技术的应用☐The application of Confocal Laser Scanning Microscopy激光扫描共焦显微镜技术的应用☐Confocal基本应用☐FRET、FRAP 和FLIP应用☐与Confocal相关技术的进展激光扫描共焦显微镜技术的应用功能.1.多重荧光标记样品的高清晰度、高分辨率图像采集2.无损伤、连续光学切片,显微“CT”3.真正的三维重组4.假三维图的显示5.可沿Z轴(xy平面)和Y轴(xz平面)方向进行光切6.定量分析7.时间序列扫描: xyt 、xyzt 和xt 扫描8.图像处理9. 旋转扫描10.感兴趣区域扫描11.光谱扫描-光谱拆分☐荧光强度的测量荧光强度=荧光效率×激发光强度☐测量原理(Boehm 1861)☐I=I0Q(1-10-kcd )=I0Q(1-1/10kcd )☐I0: 激发光强度;I: 发射光强度☐Q: 荧光量子产率,对于特定荧光物质,该值为常数。