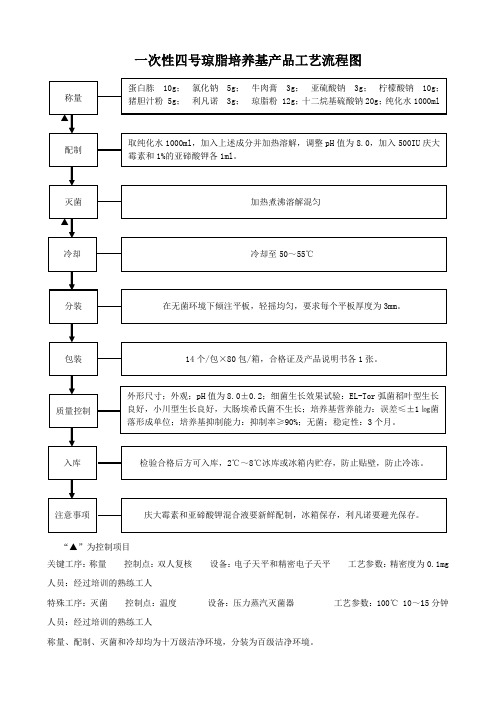
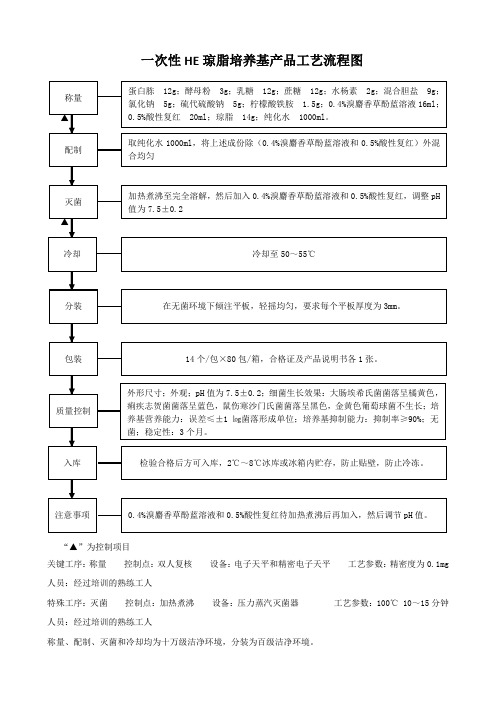
一次性厌氧血琼脂培养基产品工艺流程图
- 格式:docx
- 大小:52.84 KB
- 文档页数:1


血琼脂基础培养基使用说明书【产品名称】通用名称:血琼脂基础培养基英文名称:Blood Agar Base Medium【包装规格】Φ90㎜和Φ70㎜,5块/包。
【预期用途】本产品用于营养需求较高的细菌培养和保存菌种用。
【检验原理】培养基(Medium)是指由人工方法配制而成的,专供微生物培养、分离、鉴别、研究和保存用的混合营养制品。
培养基按用途分为基础培养基、增菌培养基、选择性培养基、鉴别培养基和厌氧培养基等,按原料来源分为天然培养基、半合成培养基和合成培养基。
按形态分为液体培养基、流体培养基、半固体培养基和固体培养基等。
本产品是以人工的方法配制而成的,除基础培养基外另外还添加了脱纤维羊血,以增加营养性能,适应有些细菌的特殊营养要求。
【主要组成成份】血琼脂基础培养基由脱纤维羊血、蛋白胨、氯化钠、牛肉浸粉、琼脂粉和玫瑰红酸原料经配制、高压灭菌,至45℃加入动物血定量灌入一次性塑料培养基内而成。
【贮存条件及有效期】2-8℃,避光保存,有效期3个月,用前复温。
【样本要求】标本可以是液体也可以是固体,液体标本可以直接使用,固体标本需用适量无菌生理盐水溶解后,取溶液使用。
根据浓度需要决定是否采用10倍稀释法进行稀释。
【检验方法】用接种环或棉签以无菌方法取标本直接画线接种于培养基中,或无菌吸取0.1ml适当浓度的标本溶液用玻璃涂布棒均匀涂布于培养基中,置35~37℃温箱中培养。
【检验结果的解释】大肠埃希氏菌菌落白色,有时带黄白色,不同菌株的溶血作用变化很大,其中有致病力的菌株产生β-溶血环;葡萄球菌圆形,橙色至白色,其中金黄色葡萄球菌产生β-溶血环,而表皮葡萄球菌和腐生葡萄球菌无溶血作用;链球菌菌落圆形突起,透明或半透明,其中草绿色链球菌产生α-溶血环,化脓性链球菌产生β-溶血环,不溶血性链球菌没有溶血作用;脑膜炎奈瑟氏菌菌落圆形,凸起,透明,带兰灰色,不溶血;肺炎球菌菌落圆形,扁平,透明或半透明,在菌落周围有草绿色狭窄溶血环;产气荚膜梭菌菌落灰白色,圆形,多数菌株有双层溶血环。


厌氧培养罐操作方法厌氧培养罐是一种用于培养厌氧菌的实验设备。
下面将详细介绍厌氧培养罐的操作方法。
1. 准备工作首先,准备所需的实验材料和试剂。
这包括培养基、无菌培养棒、培养液、培养物等。
同时,准备好操作台和一套无菌技术。
2. 操作过程(1)将培养罐取出,并在培养罐底部放置一个培养基平板。
培养基平板上新鲜制作的培养基需要事先无菌化。
(2)在培养罐内注入适量的培养液,将培养液与培养基平板接触。
培养液中可以添加适量的营养物,以供厌氧菌生长。
(3)用无菌培养棒,将待培养的菌落划入培养液中。
划入的菌落要尽量小,并且要尽可能避免空气进入培养液中。
(4)将培养罐口和培养液接触的部分涂抹上凡士林或者石蜡,以防止空气进入。
(5)将培养罐盖紧,确保完全密闭。
可以用炭盖密封培养罐,以进一步保证厌氧环境。
(6)将培养罐放入恒温培养箱中,并设置适当的温度和培养时间。
根据不同的菌种,温度设置在30-37之间。
3. 注意事项(1)在进行厌氧培养罐操作前,需要严格执行无菌操作。
使用无菌技术,穿戴好实验服和手套,并做好无菌环境的保持。
(2)在操作过程中尽量避免将空气带入培养液或培养罐内。
因为厌氧菌无法生长在氧气环境下,空气的污染可能会影响培养结果。
(3)注意培养罐的密闭性。
在连接培养罐和培养液的部分应该密封良好,以防止空气进入。
(4)培养罐中的培养液要保持清洁。
如有沉淀或是生长不良的情况,应及时更换新的培养液。
(5)在取样时,要做好无菌操作。
严格遵守取样时的操作规范,以避免细菌的传播和污染。
4. 厌氧培养罐的应用厌氧培养罐广泛应用于微生物学、生物工程以及医学研究领域。
通过在厌氧环境中培养微生物,可以研究厌氧菌的生理特性、代谢途径等。
同时,还可以用于分离和鉴定厌氧菌的方法。
总结:厌氧培养罐的操作方法相比于常规培养方法有一定的特殊性,需要在严格无菌条件下进行,并注意保持培养罐的密闭性。
只有这样才能得到可靠的培养结果,为相关研究提供有效的支持。
㊀基金项目:国家自然科学基金项目(C050103)ꎻ湖南农业大学人才科学基金项目(07WD05ꎬ09WD06)㊀作者简介:郑昕㊀男ꎬ硕士研究生ꎮ主要从事动物肠道益生菌研究ꎮE ̄mail:1198827456@qq.com㊀∗通讯作者ꎮ男ꎬ教授ꎬ硕士生导师ꎮ主要从事动物肠道微生物的研究ꎮE ̄mail:chongy@hunau.edu.cn㊀收稿日期:2019 ̄06 ̄14厌氧菌预还原琼脂平板培养方法郑㊀昕ꎬ宫利宏ꎬ杨㊀毅ꎬ王贵平ꎬ尹㊀崇∗(湖南农业大学动物医学院ꎬ湖南长沙㊀410128)摘㊀要㊀为简化厌氧菌分离培养方法ꎬ使其在普通实验条件下于固体培养基上形成单菌落ꎬ本研究增加庖肉培养基无氧溶液体积ꎬ用作无氧倍比稀释液ꎬ在琼脂柱下进行倍比稀释ꎬ将皿盖带有胶塞孔的厌氧琼脂平板进行预还原ꎬ注射接种倍比稀释菌液ꎬ通过厌氧指示剂监测无氧效果ꎬ初步试用于肠道厌氧菌分离培养ꎮ结果显示ꎬ该方法整个操作过程厌氧效果良好ꎬ无需专门厌氧设备即可以分离纯化培养肠道乳酸杆菌ꎬ甚至无芽胞专性厌氧菌ꎬ如双歧杆菌和韦荣球菌ꎮ关键词㊀厌氧菌ꎻ预还原ꎻ厌氧装置ꎻ培养方法中图分类号㊀Q93-335㊀㊀㊀文献标识码㊀A㊀㊀㊀文章编号㊀1005-7021(2020)01-0094-06doi:10.3969/j.issn.1005-7021.2020.01.013AMethodofPre ̄ReducedAgarPlateforAnaerobicBacteriaCultivationZHENGXinꎬGONGLi ̄hongꎬYANGYiꎬWANGGui ̄pingꎬYINChong∗(AnimalMed.Coll.ꎬHunanAgric.Uni.ꎬChangsha410128)Abstract㊀Inordertosimplifythemethodforisolationandcultivationofanaerobicbacteriaandculturethemtoformsinglecoloniesonsolidculturemediumunderordinaryexperimentallaboratoryꎬthevolumeofcookedmeatbrothwasincreasedꎬandusedasanaerobicmultipleproportionaldilutesolution.Themultipleproportionaldilutionsofanaerobicbacteriasampleswereperformedunderagarcolumn.Theanaerobicagarplatewithatinyholeatthecoversealedbyarubberplugwaspre ̄reducedꎬinjectedandinoculatedwithmultipleproportionallydilutedbacterialsolutions.Thean ̄aerobiceffectofthewholeoperationprocesseswasmonitoredbyanaerobicindicator.Thepreliminaryapplicationofcurrentmethodwasconductedduringtheisolationandcultivationofintestinalanaerobicbacteria.Theresultsshowedthatwithoutspecialanaerobicequipmentꎬtheanaerobiceffectofcurrentmethodwasreliabletobeusedfortheisola ̄tionofintestinalLactobacillusꎬevenfornon ̄spore ̄forminganaerobesꎬsuchasBifidobacteriumandVeillonella.Keywords㊀anaerobeꎻpre ̄reductionꎻanaerobicdeviceꎻculturemethod㊀㊀厌氧菌是在无氧环境中才能生长的细菌[1]ꎬ肠道菌群中90%以上为厌氧菌[2]ꎮ受培养条件限制ꎬ厌氧菌研究的开展程度远不及非厌氧菌[3]ꎮ亨氏滚管法和厌氧培养箱是目前分离培养厌氧菌最可靠的方法ꎬ但是设备的购置和运行都需要很高的费用[4]ꎮ厌氧罐和厌氧袋是分离培养厌氧菌更为常用的方法ꎬ但是在操作与耗氧过程中ꎬ仍然使细菌暴露氧气一段时间ꎬ非芽胞专性厌氧菌的初始分离培养较难用此方法获得[5 ̄6]ꎮ深层试管法和庖肉培养基是在普通条件下培养厌氧菌的常用方法ꎬ但是这些液体培养方法无法对厌氧菌进行分离纯化培养[7]ꎮ如上因经费和方法的限制ꎬ使得广大基层细菌实验室难以开展厌氧菌研究ꎮ本研究改进庖肉培养基ꎬ用以代替硫化钠等制备无氧试剂ꎬ在琼脂柱下进行菌液倍比稀释ꎬ并将厌氧琼脂平板进行预还原ꎮ通过厌氧指示剂全程监49微生物学杂志㊀2020年2月第40卷第1期㊀JOURNALOFMICROBIOLOGYFeb.2020Vol.40No.1测ꎬ专性厌氧菌青春双歧杆菌分离培养ꎬ鸡源肠道乳酸杆菌及Veillonellamagna的分离鉴定ꎬ证明该方法无需特殊厌氧设备ꎬ即可在普通实验条件下有效分离厌氧菌ꎮ1㊀材料与方法1.1㊀材料1.1.1㊀菌种来源㊀枯草芽胞杆菌(湖南农业大学动物医院微生物实验室分离保存)ꎻ青春双歧杆菌(市售双歧杆菌活菌胶囊)ꎮ1.1.2㊀培养基㊀TPY液体培养基㊁TPY琼脂培养基(青岛高科园海博生物技术有限公司)ꎻ营养琼脂培养基(国药集团化学试剂有限公司)ꎮ1.1.3㊀试剂与仪器㊀厌氧指示剂(0.5%美蓝水溶液ꎻ0.1mol/LKOHꎻ葡萄糖ꎬ按照1︰2︰2的比例用蒸馏水等量稀释后混合)[8]ꎻ注射器ꎻ15㎝长针头ꎻ细菌基因组DNA提取试剂盒(北京天根生化科技有限公司产品)ꎻ手提式压力蒸汽灭菌器(上海申安医疗器械厂)ꎻ超净工作台(苏州安泰空气技术有限公司)ꎻ生化培养箱(广东省医疗器械厂)ꎮ1.2㊀方法1.2.1㊀预还原琼脂平板制备方法(图1)㊀预还原琼脂平板培养法需制备如下三部分:①无氧稀释液:在试管内分装庖肉液体培养基[8]ꎬ用倒立小试管或自制铁丝网将肝粒承托ꎬ使之悬于液面下ꎬ高压灭菌备用(图1A)ꎻ②厌氧倍比稀释管:取蒸馏水和琼脂粉配置成1%琼脂ꎬ加热溶解后分装至试管中ꎬ每个试管约5mLꎬ高压灭菌备用(图1B的0号试管)ꎻ③预还原琼脂平板:由大培养皿(直径150㎜)和小培养皿(直径80㎜)组成ꎬ皿盖上都打小孔并粘贴胶塞密封ꎬ以小孔为中心在皿盖上画出垂直十字线ꎮ小培养皿用于培养厌氧菌ꎬ大培养皿用于培养耗氧菌(图1C)ꎮ在超净工作台中将灭菌的TPY琼脂培养基倒入小培养皿ꎬ等待凝固后倒置ꎬ加入玻璃珠ꎬ将小培养皿盖上的十字线和大培养皿盖上的十字线重叠ꎬ使两培养皿胶塞孔对准ꎮ营养琼脂铺满大培养皿上下两个面ꎬ在上下两个面上均匀接种枯草芽胞杆菌[9]ꎬ合住大培养皿上下两面ꎬ用融化的1%琼脂注入大培养皿盖与底的缝隙ꎬ待凝固后套上橡皮筋固定(图1D)ꎮ放入湿盒中于培养箱中培养48h进行预还原备用ꎮ图1㊀厌氧菌培养装置示意图Fig.1㊀Schematicdiagramofanaerobicbacteriaculturedevicea:肝粒ꎻb:稀释液ꎻc:1%琼脂ꎻd:大培养皿ꎻe:小培养皿ꎻf:营养琼脂培养基ꎻg:TPY琼脂培养基ꎻh:胶塞ꎻi:玻璃珠a:livergranulesꎻb:diluentꎻc:1%agarꎻd:largepetridishꎻe:smallpetridishꎻf:nutrientagarmediumꎻg:TPYagarmediumꎻh:rubberplugꎻi:glassbeads591期㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀郑㊀昕等:厌氧菌预还原琼脂平板培养方法㊀㊀㊀㊀㊀1.2.2㊀预还原琼脂平板操作方法㊀①用安装长针头的注射器将样本菌液注射接种到庖肉培养基中ꎬ放入培养箱中增菌培养24~48hꎻ②注射器吸取少许无氧稀释液ꎬ置换注射器和长针头内空气后ꎬ取1.8mL无氧稀释液和0.2mL增殖菌液ꎬ酒精灯灼烧稀释管底部3~5sꎬ使底部琼脂融解形成缝隙ꎬ长针头穿过琼脂柱将稀释菌液打入1号稀释管底部ꎬ混匀3次ꎬ照此方法依次倍比稀释至10-7(图1B)ꎻ③分别从6号稀释管和7号稀释管中吸取50μL稀释菌液ꎬ穿过预还原琼脂平皿胶塞孔接种到TPY琼脂培养基表面ꎬ通过前后左右倾斜使玻璃珠在小培养皿内反复滑滚ꎬ将接种菌液涂匀后放入培养箱中培养48h观察菌落形成ꎮ1.2.3㊀预还原琼脂平板培养法无氧效果检测①厌氧指示剂检测:厌氧指示剂替代蒸馏水ꎬ配制庖肉培养基㊁倍比稀释液ꎬ检测倍比稀释过程的无氧效果ꎮ在厌氧指示剂中加入2%的琼脂粉ꎬ加热溶解后注入到小试管内ꎬ置沸水浴加热至无色ꎬ等待凝固后将小试管放入小培养皿中ꎬ预还原48h后模拟细菌接种操作ꎬ通过观察厌氧指示剂的颜色变化检测预还原琼脂平板的无氧效果ꎮ②双歧杆菌分离培养检测:取市售双歧杆菌活菌胶囊内菌粉颗粒ꎬ用TPY液体培养基增菌24hꎬ取10-6和10-7稀释菌液注射接种至预还原琼脂平板和普通TPY琼脂平板ꎬ置培养箱中培养48hꎮ用接种环挑取单个菌落ꎬ革兰染色镜检观察菌体形态ꎮ细菌基因组提取试剂盒提取菌株DNAꎬ16SrRNA通用引物27F(5ᶄ ̄AGAGTTTGATCMTGGCTCAG ̄3ᶄ)㊁1492R(5ᶄ ̄GGTTACCTTGTTACGACTT ̄3ᶄ)扩增目的片段ꎮ将扩增产物送生工生物工程(上海)股份有限公司测序ꎬ测序结果在NCBI网站BLAST进行同源性比较ꎮ1.2.3㊀预还原琼脂平板培养法的试用①细菌分离培养:取鸡盲肠内容物ꎬ用TPY液体培养基增菌24hꎬ取10-6和10-7稀释菌液注射接种至预还原琼脂平板和普通TPY琼脂平板ꎬ置培养箱中培养48hꎮ②细菌形态学观察及种属分析:挑取单个菌落纯化3代后ꎬ革兰染色镜检观察菌体形态ꎮ细菌基因组提取试剂盒提取菌株DNAꎬ16SrRNA通用引物27F㊁1492RꎻdnaK基因测序引物B1(5ᶄ ̄ATTGAYTTAGGWACAACAAA ̄3ᶄ)㊁B2(5ᶄ ̄GCTTTTTCAGCHGCDTCYTT ̄3ᶄ)[10]扩增目的片段ꎬ将扩增产物送生工生物工程(上海)股份有限公司测序ꎬ测序结果在NCBI网站BLAST进行同源性比较ꎬ用MEGA7软件构建系统进化树ꎮ2㊀结果与分析2.1㊀预还原琼脂平板培养法无氧效果2.1.1㊀稀释液的无氧效果(图2)㊀1号试管用厌氧指示剂空白对照ꎻ2号试管底部加入数颗肝粒ꎻ3号试管在2号试管基础上添加1mL液体石蜡ꎻ4号试管用倒立小试管将肝粒托起ꎮ结果显示ꎬ2号和3号试管在肝粒周围形成无氧区域ꎬ且加了液体石蜡的3号比2号无氧区域稍有增加ꎬ而将肝粒托起的4号试管无氧效果最好ꎬ只有液体表面变蓝ꎬ试管内均为无氧ꎮ图2㊀稀释液的无氧效果Fig.2㊀Anaerobiceffectofdiluenta:肝粒ꎻb:液体石蜡a:livergranulesꎻb:liquidparaffin2.1.2㊀厌氧稀释管无氧效果(图3)㊀将图2中4号试管所制备的无氧稀释液直接注入1号空试管ꎬ因与氧气接触ꎬ溶液立即呈现绿色ꎻ将无氧稀释液穿过琼脂打入2号试管底部ꎬ虽也变色但相比1号颜色稍浅ꎻ用少许无氧稀释液置换注射器和针头的空气后吸取稀释液并穿过琼脂打入3号试管底部ꎬ仅轻微变色ꎮ说明排尽注射器内空气后吸取无氧稀释液再打入厌氧稀释管中ꎬ能够有效减少菌样与氧气接触ꎮ69㊀㊀㊀㊀㊀微㊀生㊀物㊀学㊀杂㊀志㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀40卷图3㊀厌氧稀释管无氧效果Fig.3㊀Anaerobiceffectofanaerobicdilutiontube2.1.3㊀预还原琼脂平板无氧效果(图4)㊀2%琼脂厌氧指示管放入小培养皿内ꎬ大培养皿接种枯草芽胞杆菌(图4A)ꎮ培养6h后(图4B)厌氧指示瓶管口呈蓝色ꎻ24h后(图4C)厌氧指示瓶管口蓝色部分颜色变浅ꎻ48h后(图4D)厌氧指示瓶管口蓝色消失说明厌氧盒内为无氧ꎬ模拟接种后ꎬ未见指示剂有颜色变化ꎬ说明需氧菌生长耗尽平皿内氧气且该方法密封良好ꎬ接种操作没有破坏厌氧平皿内的预还原效果ꎮ图4㊀预还原琼脂平板无氧效果Fig.4㊀Anaerobiceffectofprereducedagarplate2.1.4㊀双歧杆菌分离培养效果㊀市售双歧杆菌活菌胶囊内菌粉颗粒经过增殖㊁倍比稀释注射接种到预还原琼脂平板表面后ꎬ在预还原琼脂培养基上生长良好ꎬ而普通培养条件下不生长ꎮ镜检呈革兰阳性ꎬ短杆状(图5A)ꎮ将16SrDNA序列在NCBI网站BLAST进行同源性比较ꎬ与BifidobacteriumadolescentisstrainKLDS2.0609相似度为98.86%ꎬ确认为青春双歧杆菌ꎮ图5㊀革兰染色结果Fig.5㊀Gramstaining2.2㊀试用结果从鸡盲肠内容物中分离到15株厌氧菌ꎬ其中14株乳酸杆菌ꎬ在普通培养条件下生长贫瘠甚至不生长ꎬ而在预还原琼脂平板上生长良好ꎻ1株韦荣球菌(命名为HM ̄1)ꎬ严格厌氧的革兰阴性无芽胞球菌(图5B)ꎬ在普通培养条件下不生长ꎬ而在预还原琼脂平板上生长良好ꎮ韦荣球菌的16SrDNA基因扩增片段1426bp(图6A)ꎬ序列上传到NCBI网站ꎬ序列登录号为MK088246ꎬ与图6㊀PCR扩增结果Fig.6㊀PCRamplificationresultsM:2000bpDNAMarkerM:2000bpDNAMarker791期㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀郑㊀昕等:厌氧菌预还原琼脂平板培养方法㊀㊀㊀㊀㊀Veillonellamagnalac18T[11]菌株相似度为99 8%ꎮdnaK基因扩增片段587bp(图6B)ꎬ与Veillonellamagnalac18T菌株相似度为99.49%ꎮ选取与其同源性最高的韦荣球菌核酸序列进行同源性分析ꎬ构建neighbor ̄joining(NJ)进化树(图7)ꎮ由图7可见ꎬHM ̄1号菌株与Veillonellamagnalac18T模式菌株处于同一个进化分支ꎬ同源性最高ꎮ图7㊀基于16SrRNA基因序列构建的系统发育树Fig.7㊀Neighbor ̄Joiningphylogenetictreebasedon16SrRNAgenesequences参与比对序列的GenBank登录号列于括号中ꎻ分支处标注有自展值ꎻ标尺所示长度为0.005核苷酸置换率TheGenBankaccessionnumbersofalignedsequencesareshowninthebracketsꎻThebootstrapvaluesareshownatthenodeꎻBar0.005meansthenucleotidesubstitutionrateof0.0053㊀讨㊀论亨氏滚管技术和厌氧手套箱技术因为设备昂贵㊁操作复杂ꎬ大多数基层实验室不能满足这样的条件ꎬ所以依然有人在试图寻找简易的厌氧菌培养方法[12 ̄15]ꎮ厌氧罐和厌氧袋由于在操作过程中易与氧气接触而较难分离到非芽胞专性厌氧菌[16]ꎮ为了减少菌液与氧气接触机会ꎬ通常应用无氧试剂进行菌液稀释ꎮ但由于无氧试剂所采用的硫化钠等试剂性质不稳定ꎬ存放期间如果暴露空气容易吸潮和氧化ꎮ动物组织块经过高温处理ꎬ也能在液体培养基中制造稳定厌氧环境ꎬ在配置液体培养基时加入0.01%的琼脂(通常0 05%)能够有效防止液体对流ꎬ减慢氧气扩散ꎬ因而深层试管庖肉培养基是在普通培养条件下培养厌氧菌的常用方法ꎮ通过对深层试管庖肉培养基制备方法进行改进ꎬ将肝粒用倒立的小试管托起至培养基液面下ꎬ从而获得足量用于倍比稀释的无氧稀释液ꎮ在稀释的过程中也充分考虑氧气的排除问题ꎬ每次使用注射器和长针头均用预还原的厌氧肝汤置换注射器和长针头内的空气ꎬ并注射到1%琼脂柱下面ꎬ最大可能减少样本与氧气接触ꎮ最终将无氧倍比稀释菌液注射接种到预还原琼脂平板表面ꎬ使厌氧菌能在固体培养基上形成单个菌落ꎮ本研究双歧杆菌的成功培养以及成功分离到HM ̄1非芽胞专性厌氧菌都证明了该方法的可靠性ꎮ如若在临床上应用ꎬ可省去增菌和稀释两个步骤将样本直接注射接种到预还原琼脂平板表面ꎬ相比早年Chan等[17]对亨氏滚管方法的改进ꎬ此方法更加简便ꎮ预还原琼脂平板装置中的大培养皿也可用厌氧袋代替ꎬ在厌氧袋外需进针处粘贴胶塞密封ꎬ在袋内放另一平皿培养需氧菌或用市售厌氧产气袋耗氧ꎮ本研究设计方法操作简单ꎬ有望被基层实验室采用ꎮ参考文献:89㊀㊀㊀㊀㊀微㊀生㊀物㊀学㊀杂㊀志㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀40卷[1]㊀LoescheWJ.Oxygensensitivityofvariousanaerobicbacteria[J].ApplMicrobiolꎬ1969ꎬ18(5):723.[2]㊀劳一ꎬ李萍ꎬ宁兴旺ꎬ等.肠道菌群与消化系统疾病的关系[J].中华检验医学杂志ꎬ2018ꎬ41(1):13 ̄16. [3]㊀张秀珍.要加强我国临床细菌室厌氧菌的培养技术[J].中华检验医学杂志ꎬ2002ꎬ25(3):133 ̄134. [4]㊀AbabouchLꎬBustaFF.AmodifiedLeetubetechniqueforthecultivationandenumerationofanaerobes[J].InternationalJournalofFoodMicrobiologyꎬ1986ꎬ3(4):211 ̄216. [5]㊀SutterVLꎬ胡尚勤.厌氧培养技术[J].微生物学杂志ꎬ1990ꎬ10(4):76 ̄79.[6]㊀杨兵ꎬ陈小青ꎬ严杰.腹膜炎患者临床标本中无芽胞厌氧菌的分离和鉴定[J].微生物学杂志ꎬ2001ꎬ21(4):54 ̄55.[7]㊀SonnenwirthAC.Evolutionofanaerobicmethodology[J].A ̄mericanJournalofClinicalNutritionꎬ1972ꎬ25(12):1295. [8]㊀周德庆ꎬ徐德强等.微生物学试验教程(第3版)[M].北京:高等教育出版社ꎬ2013.[9]巴翠玉ꎬ张林波ꎬ张培军ꎬ等.2株枯草芽胞杆菌的分离鉴定及特性研究[J].华南农业大学学报ꎬ2017ꎬ(3):46 ̄51. [10]MarchandinH.Intra ̄chromosomalheterogeneitybetweenthefour16SrRNAgenecopiesinthegenusVeillonella:implica ̄tionsforphylogenyandtaxonomy[J].Microbiologyꎬ2003ꎬ149(6):1493 ̄1501.[11]KraatzMꎬTarasD.Veillonellamagnasp.nov.isolatedfromthejejunalmucosaofahealthypigꎬandemendeddescriptionofVeillonellaratti[J].InternationalJournalofSystematicandEv ̄olutionaryMicrobiologyꎬ2008ꎬ58(12):2755 ̄2761. [12]崔明岐.一种简易而有效的培养厌氧菌的方法[J].黑龙江畜牧兽医ꎬ2015ꎬ(24):95 ̄97.[13]李建秋ꎬ祁锋ꎬ刁风英.一次性厌氧菌培养平板的制备与实验使用[J].微生物学通报ꎬ1993ꎬ20(2):121 ̄122. [14]MaitiPKꎬHaldarJꎬMukherjeePꎬetal.Anaerobiccultureongrowthefficientbi ̄layeredcultureplateinamodifiedcandlejarusingarapidandslowcombustionsystem[J].Indianjour ̄nalofMedicalMicrobiologyꎬ2013.[15]谭周进ꎬ肖克宇ꎬ肖启明ꎬ等.乳酸菌计数培养基和培养方法的筛选[J].湖南农业大学学报(自然科学版)ꎬ2001ꎬ27(5):398 ̄400.[16]RosenblattJEꎬStewartPR.Anaerobicbagculturemethod[J].JournalofClinicalMicrobiologyꎬ1975ꎬ1(6):527 ̄530. [17]ChanECꎬDevriesJꎬHarveyRF.Preparationofprereducedanaerobicallysterilizedmediaandtheiruseincultivationofan ̄aerobicbacteria[J].JournalofClinicalMicrobiologyꎬ1978ꎬ8(2):123.991期㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀郑㊀昕等:厌氧菌预还原琼脂平板培养方法㊀㊀㊀㊀㊀。
琼脂平板培养基实验报告一、实验目的本次实验的目的是掌握琼脂平板培养基的制备方法,并通过使用琼脂平板培养基来观察和分离不同菌落。
二、实验原理琼脂平板培养基是一种常用的微生物学实验室培养基,其主要成分为琼脂和营养物质。
琼脂是一种从海藻中提取出来的胶状物质,可以在高温下溶解,在冷却后形成固体。
在制备琼脂平板培养基时,需要将琼脂与适量的营养物质混合后加热至完全溶解,然后冷却至适宜温度并倒入培养皿中凝固。
三、实验步骤1. 准备所需材料:琼脂、适量的营养物质(如肉汤、酵母提取物等)、试管、移液器、烧杯、玻璃棒等。
2. 在试管中加入适量的营养物质,并用移液器将其吸入。
3. 将试管加入水浴中加热至完全溶解。
4. 将琼脂加入烧杯中,并加入适量的水。
5. 将烧杯加入水浴中加热至琼脂完全溶解。
6. 将步骤4和步骤5中的溶液混合均匀,并用玻璃棒搅拌至无颗粒物质。
7. 将混合后的溶液冷却至适宜温度(通常为50℃左右)。
8. 将培养皿倾斜45度,用移液器将混合好的琼脂平板培养基倒入培养皿中,约倒满1/3即可。
9. 等待琼脂平板培养基凝固后,将培养皿竖立并保存在冰箱内备用。
四、实验结果在使用琼脂平板培养基进行微生物分离时,可以观察到不同形态、大小、颜色等特征的菌落。
通过对这些菌落进行进一步分析和检测,可以确定其种类和数量。
五、实验注意事项1. 在制备琼脂平板培养基时需要注意材料的净化和消毒,以避免细菌污染。
2. 在加热溶液时需要注意温度,避免过高或过低导致琼脂不完全溶解或过度凝固。
3. 在混合琼脂和营养物质时需要充分搅拌,以确保混合均匀。
4. 在倒入培养皿中时需要注意倾斜角度,以避免气泡和不均匀厚度的出现。
六、实验总结通过本次实验,我们掌握了琼脂平板培养基的制备方法,并了解了其在微生物学研究中的重要作用。
在今后的实验中,我们将继续运用琼脂平板培养基来观察和分离不同菌落,并进一步深入研究微生物的生命活动和特性。
VIGS操作流接种时间幼苗1~2 weeks,2片真叶展平。
试剂配制20× AB salts●NH4Cl20 g●MgSO4∙7H2O 6 g●KCl 3 g●CaCl20.2 g●FeSO4∙7H2O0.05 g●定容至1L,高压灭菌(若出现沉淀,需要涡旋)IM(induction media)●MES 5.137 g●Glucose 2.632 g●NaH2PO40.164 g●定容至500mL,调节pH5.6~5.7,高压灭菌,冷却后加入20× AB salts 26.316mL●注:IM当天或前一天配制。
200mM Acetosyringone(AS,乙酰丁香酮)Acetosyringone19.6 mgDMSO500 μLMES original cμLture(10 mM MgCl2,10 mM MES)MgCl2∙6H2O 1.0165 gMES 1.066 g定容至500mL,调节pH5.5,高压灭菌LB solid/liquid mediaAgar power 1.5/- g (Solid/liquid)Tryptone 1 gYeast extract0.5 gNaCl 1 g定容至100mL,高压灭菌操作流程_Day 1_ 划板,3抗(R+G+K)LB琼脂板。
↓↓ 28℃、48h。
↓_Day 3_ 挑取单菌落,加入到1mL LB液体培养基(R+G+K)↓↓ 25mL三角瓶摇10mL左右,pTRV1需12mL。
↓ 28℃摇24~48h(OD=1.0左右)↓_Day 4_ 取菌液以1:25的比例加入IM(50 mL IM + 50 μL 200 μM AS + 2.6316 mL 20× AB salts + R + G + K)↓↓ pTRV1需要4瓶,各50mL。
↓ 28℃摇菌16~24h(OD=0.5~0.8)↓_Day 5_ 收集菌体。
4℃、3000g离心10min,用相同体积的MES重悬;4℃、3000g再次离心10min,收集菌体,用1/2体积的MES重悬。
一种血琼脂平板及其制备方法
一种血琼脂平板,涉及培养基技术领域,其含有胰酪胨、大豆蛋白胨等多种物质。
胰酪胨、大豆蛋白胨、酵母浸粉、牛心浸粉为细菌提供合适的碳源和氮源;脱纤维绵羊血含有丰富的营养因子,促进普通细菌的生长,同时可以观察细菌的溶血情况;氯化钠维持细菌渗透压的平衡;琼脂是培养基凝固剂。
该血琼脂平板的营养更为全面,能有效促进细菌的生长,提高细菌的分离率。
一种血琼脂平板的制备方法,其在培养液高温灭菌之后,先降温至80~90℃,给培养液充分的排气时间,避免快速降温过程中形成气泡。
同时,其在加入脱纤维绵羊血前,先对其进行了充分预热,避免了脱纤维绵羊血与培养液温差太大造成的琼脂结块问题。
其操作简单,对设备要求不高,适合工业化生产。