燃烧的条件实验报告
- 格式:doc
- 大小:47.50 KB
- 文档页数:1

初中化学燃烧的条件实验
初中化学燃烧的条件实验可以通过以下步骤进行:
1. 准备实验材料:取适量MnO2于广口瓶,用注射器取5ml双氧水,连接好制氧装置。
2. 设定实验组:取带气球的具支试管倒入适量热水,再取一小块绿豆粒般大小的白磷放入具支试管中,放入大烧杯左边。
3. 设定对照组:另取一支干燥试管放入一小块绿豆粒般大小的红磷,塞上带气球橡皮塞,放入大烧杯右边,观察记录实验现象。
4. 实验操作:将制氧装置和具支试管连接,缓缓推动注射器活塞通入氧气,观察记录实验现象。
5. 实验现象分析:干燥试管中白磷燃烧红磷不燃烧,说明燃烧需达到可燃物着火点。
具支试管里热水中白磷不燃烧,通氧气后燃烧,说明燃烧需要氧气(或空气)。
通过以上步骤,可以清晰地观察到燃烧的条件,增强对燃烧条件的理解。

第1篇一、实验目的1. 观察并记录不同金属在氧气中燃烧的现象。
2. 探究金属燃烧时产生的产物及其性质。
3. 学习金属燃烧实验的基本操作和注意事项。
二、实验原理金属在氧气中燃烧,是指金属与氧气发生氧化反应,生成金属氧化物的过程。
实验中常用的金属有铁、镁、铝等。
这些金属在氧气中燃烧时,会产生明亮的火焰、光和热,并生成金属氧化物。
三、实验仪器与材料1. 仪器:酒精灯、火柴、坩埚钳、镊子、集气瓶、玻璃片、试管、试管架、烧杯、水槽、试管夹、石棉网、量筒、天平等。
2. 材料:铁丝、镁带、铝丝、高锰酸钾、氯酸钾、二氧化锰、过氧化氢、二氧化锰、细砂、细铁丝、火柴梗等。
四、实验步骤1. 铁丝燃烧实验(1)将铁丝表面打磨干净,去除铁锈。
(2)将铁丝绕成螺旋状,一端系上火柴梗,另一端用坩埚钳夹住。
(3)点燃火柴梗,待其快要燃尽时,将铁丝缓慢伸入盛有氧气的集气瓶中。
(4)观察铁丝在氧气中燃烧的现象,记录实验结果。
2. 镁带燃烧实验(1)将镁带表面打磨干净。
(2)用镊子夹住镁带,点燃一端。
(3)将点燃的镁带伸入盛有氧气的集气瓶中。
(4)观察镁带在氧气中燃烧的现象,记录实验结果。
3. 铝丝燃烧实验(1)将铝丝表面打磨干净。
(2)用镊子夹住铝丝,点燃一端。
(3)将点燃的铝丝伸入盛有氧气的集气瓶中。
(4)观察铝丝在氧气中燃烧的现象,记录实验结果。
五、实验现象与结果1. 铁丝燃烧实验现象:铁丝在氧气中剧烈燃烧,火星四射,生成黑色固体,放热。
结果:生成物为四氧化三铁(Fe3O4)。
2. 镁带燃烧实验现象:镁带在氧气中燃烧,发出耀眼的白光,生成白色粉末状固体,放热。
结果:生成物为氧化镁(MgO)。
3. 铝丝燃烧实验现象:铝丝在氧气中燃烧,发出微弱的黄色火焰,生成白色粉末状固体,放热。
结果:生成物为氧化铝(Al2O3)。
六、实验讨论与分析1. 金属燃烧实验中,不同金属在氧气中燃烧的现象和产物不同,这与金属的化学性质有关。
2. 金属燃烧实验过程中,要注意安全操作,防止火灾和烫伤。

实验活动3燃烧的条件实验报告【实验目的】1.加深对燃烧条件的认识,进一步了解灭火的原理。
2.体验实验探究的过程。
【实验用品】烧杯、镊子、坩埚钳、酒精灯、三脚架、薄铜片、酒精、棉花、乒乓球、滤纸、蜡烛。
【实验内容】1.用棉花分别蘸取酒精和水,放到酒精灯火焰上加热片刻,观察到蘸有酒精的棉花燃着了,蘸有水的棉花没有燃烧,通过此实验可以说明燃烧的条件之一是有可燃物。
2.(1)取一小块乒乓球碎片和滤纸碎片,分别用坩埚钳夹住,放在酒精灯的火焰上加热。
①实验现象:乒乓球碎片和滤纸碎片都能燃烧。
②实验结论:乒乓球碎片和滤纸碎片都是可燃物。
(2)从乒乓球和滤纸上各剪下一小片(同样大小),分开放在一块薄铜片的两侧,加热铜片的中部,如图所示。
①实验现象:一段时间后,乒乓球碎片先燃烧起来,然后滤纸碎片也燃烧起来。
②实验结论:燃烧的条件之一是温度需达到可燃物的着火点。
3.利用蜡烛和烧杯(或选择其他用品),设计一个简单的实验,说明燃烧的条件之一:需要有氧气(或空气)。
写出你的实验设计方案:取两支蜡烛放在桌面上并点燃,用一只烧杯罩住其中一支蜡烛,观察现象(合理即可)。
【问题与交流】1.上述实验步骤1中,如果在酒精灯上加热时间较长,会发生什么现象?为什么?蘸有水的棉花也燃烧起来;因为棉花上的水被蒸干后,温度达到棉花的着火点,并与氧气接触,引起燃烧。
2.如果将实验步骤2(2)中的乒乓球碎片和滤纸碎片换成木屑和煤粉,会发生什么现象?说明了什么?木屑先燃烧而煤粉后燃烧,说明煤粉的着火点比木屑高。
3.可燃物燃烧的剧烈程度与哪些因素有关?温度、氧气的浓度、可燃物与氧气的接触面积等。
实验突破1.如图所示的探究燃烧条件的实验中,能得出燃烧需要的条件是(D)A.可燃物B.温度达到可燃物的着火点C.可燃物和氧气D.氧气(或空气)2.如图是探究燃烧条件的实验,有关该实验的说法错误的是(C)A.对比实验中a、c处的现象可说明燃烧需要氧气参与B.对比实验中a、b处的现象可说明燃烧需要温度达到可燃物的着火点C.a处白磷燃着后很快熄灭,原因是管内产生了二氧化碳气体D.管口小气球的使用体现了实验的“绿色化”3.我国有在元宵节燃放孔明灯(如图)祈福的风俗,孔明灯燃气的火焰温度可达300 ℃,但纸质(着火点约170 ℃)灯罩却未被点燃的原因是(D)A.灯罩的材料不是可燃物B.灯罩没有与氧气充分接触C.风将热量吹散后纸质灯罩的着火点降低了D.风将热量吹散使纸质灯罩处温度低于纸的着火点4.如图是有关探究燃烧条件实验的改进装置(部分夹持仪器省略)。

一、实验目的1. 探究燃烧发生的必要条件。
2. 分析燃烧过程中氧气、温度和可燃物之间的关系。
3. 通过实验验证燃烧三要素:氧气、可燃物和温度的相互影响。
二、实验原理燃烧是指可燃物在氧气的作用下,发生氧化反应并释放出热能和光能的过程。
燃烧的发生需要满足三个条件:可燃物、氧气和达到着火点的温度。
本实验通过控制变量法,分别研究氧气、温度和可燃物对燃烧的影响。
三、实验材料与仪器1. 实验材料:木条、火柴、蜡烛、酒精、砂纸、试管、酒精灯、集气瓶、烧杯、水、玻璃棒等。
2. 实验仪器:酒精灯、集气瓶、烧杯、玻璃棒、天平、温度计等。
四、实验步骤1. 实验一:探究氧气对燃烧的影响(1)将一根木条点燃,放入集气瓶中,观察木条燃烧情况。
(2)将集气瓶中的氧气抽空,再次将点燃的木条放入集气瓶中,观察木条燃烧情况。
2. 实验二:探究温度对燃烧的影响(1)点燃蜡烛,将蜡烛放在试管中,观察蜡烛燃烧情况。
(2)用玻璃棒蘸取少量酒精,滴在蜡烛火焰上,观察蜡烛燃烧情况。
3. 实验三:探究可燃物对燃烧的影响(1)将火柴点燃,放入烧杯中,观察火柴燃烧情况。
(2)用砂纸将木条表面摩擦,使其表面粗糙,点燃木条,放入烧杯中,观察木条燃烧情况。
五、实验结果与分析1. 实验一:当集气瓶中的氧气被抽空后,木条无法燃烧。
这说明氧气是燃烧的必要条件之一。
2. 实验二:蜡烛在试管中燃烧,当酒精滴在蜡烛火焰上时,火焰变得更旺。
这说明温度对燃烧有显著影响。
3. 实验三:火柴在烧杯中燃烧,而摩擦后的木条燃烧得更旺。
这说明可燃物的性质对燃烧有影响。
六、实验结论1. 燃烧的发生需要满足三个条件:可燃物、氧气和达到着火点的温度。
2. 氧气是燃烧的必要条件之一,氧气充足时,燃烧更旺。
3. 温度对燃烧有显著影响,温度越高,燃烧越旺。
4. 可燃物的性质对燃烧有影响,可燃物越易燃,燃烧越旺。
七、实验注意事项1. 实验过程中,注意安全,避免火灾事故发生。
2. 实验操作要规范,确保实验结果的准确性。

一、实验目的1. 了解固体燃烧的基本原理和条件。
2. 观察不同固体物质燃烧时的现象。
3. 分析燃烧过程中产生的化学反应和产物。
4. 培养实验操作技能和科学探究能力。
二、实验原理固体燃烧是指固体物质与氧气发生化学反应,放出热和光的过程。
燃烧需要满足以下条件:1. 可燃物:具有可燃性的固体物质。
2. 氧气:作为氧化剂,与可燃物发生反应。
3. 着火点:固体物质达到一定温度时,开始燃烧。
三、实验用品1. 实验器材:酒精灯、燃烧匙、试管、镊子、火柴、酒精、集气瓶、水槽、澄清石灰水。
2. 实验药品:硫磺、磷、铁、木炭、铜、镁。
四、实验步骤1. 硫磺燃烧实验- 将一小块硫磺放在燃烧匙上。
- 用酒精灯加热硫磺,观察其燃烧现象。
- 收集燃烧产物,用澄清石灰水检验。
2. 磷燃烧实验- 将一小块磷放在燃烧匙上。
- 用酒精灯加热磷,观察其燃烧现象。
- 收集燃烧产物,用澄清石灰水检验。
3. 铁燃烧实验- 将一小块铁放在燃烧匙上。
- 用酒精灯加热铁,观察其燃烧现象。
- 收集燃烧产物,用澄清石灰水检验。
4. 木炭燃烧实验- 将一小块木炭放在燃烧匙上。
- 用酒精灯加热木炭,观察其燃烧现象。
- 收集燃烧产物,用澄清石灰水检验。
5. 铜燃烧实验- 将一小块铜放在燃烧匙上。
- 用酒精灯加热铜,观察其燃烧现象。
- 收集燃烧产物,用澄清石灰水检验。
6. 镁燃烧实验- 将一小块镁放在燃烧匙上。
- 用酒精灯加热镁,观察其燃烧现象。
- 收集燃烧产物,用澄清石灰水检验。
五、实验现象及分析1. 硫磺燃烧:硫磺燃烧时,产生淡蓝色火焰,有刺激性气味,放出热量。
燃烧产物为二氧化硫,能使澄清石灰水变浑浊。
2. 磷燃烧:磷燃烧时,产生白色烟雾,放出热量。
燃烧产物为五氧化二磷,能使澄清石灰水变浑浊。
3. 铁燃烧:铁燃烧时,火星四射,放出大量热量。
燃烧产物为四氧化三铁,不能使澄清石灰水变浑浊。
4. 木炭燃烧:木炭燃烧时,产生无色火焰,放出热量。
燃烧产物为二氧化碳,能使澄清石灰水变浑浊。
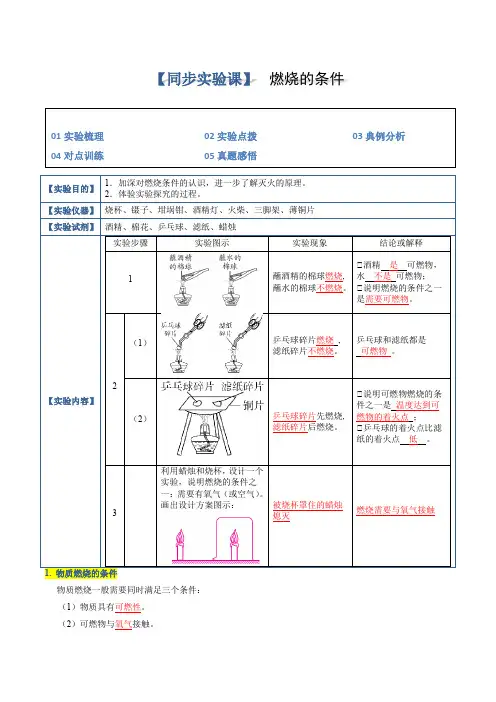
【同步实验课】 燃烧的条件【实验目的】 1.加深对燃烧条件的认识,进一步了解灭火的原理。
2.体验实验探究的过程。
【实验仪器】 烧杯、镊子、坩埚钳、酒精灯、火柴、三脚架、薄铜片【实验试剂】 酒精、棉花、乒乓球、滤纸、蜡烛【实验内容】实验步骤 实验图示 实验现象 结论或解释1蘸酒精的棉球燃烧, 蘸水的棉球不燃烧。
①酒精 是 可燃物,水 不是 可燃物; ①说明燃烧的条件之一是需要可燃物。
2(1)乒乓球碎片燃烧 , 滤纸碎片不燃烧。
乒乓球和滤纸都是 可燃物 。
(2)乒乓球碎片先燃烧, 滤纸碎片后燃烧。
①说明可燃物燃烧的条件之一是 温度达到可燃物的着火点 ;①乒乓球的着火点比滤纸的着火点 低 。
3 利用蜡烛和烧杯,设计一个实验,说明燃烧的条件之一:需要有氧气(或空气)。
画出设计方案图示:被烧杯罩住的蜡烛熄灭燃烧需要与氧气接触1. 物质燃烧的条件物质燃烧一般需要同时满足三个条件:(1)物质具有可燃性。
(2)可燃物与氧气接触。
01实验梳理 02实验点拨 03典例分析 04对点训练 05真题感悟(3)可燃物达到燃烧所需要的最低温度。
2. 着火点某种可燃物燃烧所需要的最低温度,称为该物质的着火点。
【注意】(1)物质燃烧一般需要三个条件同时满足,缺少其中任何一个,燃烧就不能发生。
(2)不同物质着火点一般不同,着火点是物质本身的固有属性,一般不随外界条件的变化而变化。
3. 灭火的原理和方法(1)满足清除可燃物、隔绝空气(或氧气)、降低温度到可燃物的着火点以下三种方法中的任何一种,就能达到灭火的目的。
(2)使用冷却剂是为了降低可燃物的温度,而不是降低可燃物的着火点。
(3)电器设备或电线着火,应先切断电源,再用干粉或液态二氧化碳灭火器灭火,不可用水直接灭火。
(4)油、酒精着火时不能用水灭火,否则易引起火势蔓延。
【典例01】用如图所示装置探究燃烧的条件。
下列说法正确的是()A.铜片上的白磷不燃烧,红磷燃烧B.向热水中的白磷通氧气,白磷会燃烧C.热水的作用只是提供热量D.该实验只能得出燃烧需要氧气这一结论【答案】B【详解】A、铜片上的白磷:与氧气接触,且温度达到着火点,具备燃烧的三个条件燃烧;铜片上的红磷:与氧气接触,但温度没有达到着火点,不同时具备燃烧的三个条件不燃烧,说法不正确;B、热水中的白磷:温度达到着火点,但不能与氧气接触,不能燃烧,向水中通氧气,燃烧的三个条件同时具备,白磷会燃烧,说法正确;C、热水的作用除了提供热量,还起到隔绝氧气的作用,说法不正确;D、该实验中:铜片上的白磷燃烧,红磷不燃烧,可以得出燃烧需要温度达到着火点;铜片上白磷燃烧,热水中的白磷不燃烧,可以得出燃烧需要氧气,说法不正确。

燃烧热测定,实验报告(精选5篇)第一篇:燃烧热测定,实验报告20XX 报告汇编 Compilation of reports报告文档·借鉴学习word 可编辑·实用文档燃烧热的测定一、实验目的λ使用氧弹式量热计测定固体有机物质(萘)的恒容燃烧热,并由此求算其摩尔燃烧热。
λ了解氧弹式量热计的结构及各部分作用,掌握氧弹式量热计的使用方法,熟悉贝克曼温度计的调节和使用方法λ掌握恒容燃烧热和恒压燃烧热的差异和相互换算二、实验原理焓摩尔燃烧焓∆∆cHm 恒容燃烧热 QV ∆∆rHm = Qp∆∆rUm = QV 对于单位燃烧反应,气相视为理想气体∆∆cHm = QV +∑∑νν BRT =QV +△ n(g)RT 氧弹中放热(样品、点火丝)=吸热(水水、氧弹、量热计、温度计)待测物质QV -摩尔恒容燃烧热Mx -摩尔质量εε-点火丝热值bx -所耗点火丝质量 q -助燃棉线热值cx -所耗棉线质量 K -氧弹量热计常数∆∆Tx -体系温度改变值xV x x xxWQ(x)+ εb +qc = KΔTM报告文档·借鉴学习word 可编辑·实用文档三、仪器及设备标准物质:苯甲酸待测物质:萘氧弹式量热计-恒热夹套2弹-氧弹 3 -量器热容器 4片-绝热垫片 5 -隔热盖盖板-马达 7,10 -搅拌器 8 -伯克曼温度计 9 -读数放大镜 11 -振动器12 -温度计报告文档·借鉴学习word 可编辑·实用文档四、实验步骤 1.量热计常数 K 的测定(1)苯甲酸约 1.0g,压片,中部系一已知质量棉线,称取洁净坩埚放量置样片前后质量 W1 和和 W2(2)把盛有苯甲酸片的坩埚放于氧弹内的坩埚架上,连接好点火丝和助燃棉线(3)盖好氧弹,与减压阀相连,充气到弹内压力为1.2MPa 为止(4)把氧弹放入量热容器中,加入 3000ml 水(5)调节贝克曼温度计,水银球应在氧弹高度约 1/2 处(6)接好电路,计时开关指向“1 分”,点火开关到向“ 振动”,开启电约源。

燃烧的条件实验报告燃烧的条件实验报告引言:燃烧是我们日常生活中常见的现象之一,它是指物质在与氧气接触时产生火焰、释放能量的化学反应。
然而,燃烧并非所有物质都能进行的,它需要一定的条件才能发生。
为了深入了解燃烧的条件,我们进行了一系列的实验。
实验一:氧气的必要性为了验证氧气在燃烧过程中的重要性,我们选取了两个物质进行实验:木炭和蜡烛。
首先,我们点燃一块木炭,观察到它迅速燃烧,并产生出明亮的火焰和热量。
然后,我们将另一块木炭放入一个密闭容器中,再次点燃。
这一次,由于缺乏氧气,木炭只是慢慢地燃烧,没有明亮的火焰产生。
类似地,我们点燃了一支蜡烛,它也迅速燃烧并产生火焰。
接着,我们将蜡烛放入一个密闭容器中,结果同样是缺乏氧气导致蜡烛燃烧缓慢,没有明亮的火焰。
通过这些实验,我们可以得出结论:氧气是燃烧发生的必要条件之一。
实验二:可燃物质的存在为了验证可燃物质的存在对燃烧的影响,我们选取了两个物质进行实验:纸张和水。
首先,我们点燃一张纸,观察到它迅速燃烧并产生明亮的火焰。
然后,我们将纸张放入一个密闭容器中,再次点燃。
这一次,由于缺乏可燃物质,纸张只是燃烧一小段时间后熄灭。
接着,我们将水倒入一个容器中,再点燃一张纸。
结果是纸张无法燃烧,因为水的存在阻碍了燃烧反应的进行。
通过这些实验,我们可以得出结论:可燃物质的存在是燃烧发生的必要条件之一。
实验三:点燃温度的影响为了验证点燃温度对燃烧的影响,我们选取了两个物质进行实验:纸张和木片。
首先,我们将一张纸张放在火焰附近,观察到纸张开始燃烧。
然后,我们将另一张纸张放在冰箱中冷却一段时间后再接近火焰,结果是纸张无法点燃。
类似地,我们将一块木片放在火焰附近,观察到木片开始燃烧。
然后,我们将另一块木片放在冰箱中冷却一段时间后再接近火焰,结果是木片无法点燃。
通过这些实验,我们可以得出结论:点燃温度是燃烧发生的必要条件之一。
结论:通过以上实验,我们可以总结出燃烧的三个基本条件:氧气的存在、可燃物质的存在和适当的点燃温度。

第1篇一、实验目的1. 了解燃烧的基本原理,包括燃烧的必要条件、燃烧过程中的能量变化等。
2. 掌握燃烧实验的基本操作方法,提高实验技能。
3. 通过实验观察燃烧现象,加深对燃烧原理的理解。
二、实验原理燃烧是指可燃物质与氧气(或其他氧化剂)在一定的条件下发生放热反应的过程。
燃烧的必要条件包括:1. 可燃物质:具有可燃性的物质,如木材、纸张、汽油等。
2. 氧气:助燃剂,通常指空气中的氧气。
3. 热量:点燃可燃物质,使其达到着火点。
燃烧过程中,可燃物质与氧气发生化学反应,生成新的物质,并释放出大量的热量。
燃烧反应的化学方程式如下:可燃物 + 氧气→ 燃烧产物 + 热量三、实验用品1. 可燃物质:木材、纸张、汽油等。
2. 氧气:空气。
3. 热源:酒精灯、打火机等。
4. 实验仪器:烧杯、试管、温度计、天平等。
四、实验步骤1. 取一定量的可燃物质,放入烧杯中。
2. 用酒精灯或打火机点燃可燃物质,观察燃烧现象。
3. 记录燃烧过程中的温度变化,并观察燃烧产物的颜色、状态等。
4. 对燃烧过程进行定量分析,如测定燃烧产物的质量、热量等。
5. 分析实验数据,验证燃烧原理。
五、实验现象1. 燃烧时,可燃物质发出火焰,并伴有热量释放。
2. 燃烧产物有气体、液体和固体,其颜色、状态等因可燃物质不同而异。
3. 燃烧过程中,温度逐渐升高,直至可燃物质完全燃烧。
六、实验结果与分析1. 燃烧过程中,可燃物质与氧气发生化学反应,生成新的物质,并释放出大量的热量。
2. 燃烧产物的颜色、状态等因可燃物质不同而异。
例如,木材燃烧产生烟雾和灰烬,汽油燃烧产生蓝色火焰和少量水。
3. 通过实验数据,验证了燃烧过程中温度逐渐升高,直至可燃物质完全燃烧。
七、实验结论1. 燃烧是可燃物质与氧气(或其他氧化剂)在一定的条件下发生放热反应的过程。
2. 燃烧的必要条件包括可燃物质、氧气和热量。
3. 燃烧过程中,可燃物质与氧气发生化学反应,生成新的物质,并释放出大量的热量。

第1篇一、实验目的1. 了解燃料燃烧的基本原理和过程。
2. 掌握燃料燃烧实验的基本操作技能。
3. 研究不同燃料燃烧特性及其影响因素。
4. 评估燃料燃烧过程中的热效应和环境影响。
二、实验原理燃料燃烧是指燃料与氧气发生化学反应,产生热量、光和物质的过程。
燃烧反应的基本形式为:燃料 + 氧气→ 热量 + 光 + 二氧化碳 + 水。
本实验通过对比不同燃料的燃烧特性,分析影响燃料燃烧的因素,如燃料种类、氧气浓度、燃烧温度等。
三、实验器材1. 燃烧装置:包括酒精灯、蜡烛、煤油、木炭等燃料。
2. 氧气发生器:用于提供氧气。
3. 温度计:用于测量燃烧温度。
4. 热电偶:用于测量燃烧过程中的热效应。
5. 数据采集器:用于记录实验数据。
四、实验步骤1. 实验前准备:检查实验器材,确保其完好无损。
将燃料分别装入酒精灯、蜡烛、煤油、木炭等燃烧装置中。
2. 燃烧实验:将燃烧装置分别点燃,观察不同燃料的燃烧现象。
记录燃烧过程中的火焰颜色、燃烧温度、燃烧时间等数据。
3. 氧气浓度实验:将氧气发生器放入燃烧装置中,观察氧气浓度对燃烧的影响。
记录燃烧过程中的火焰颜色、燃烧温度、燃烧时间等数据。
4. 燃烧温度实验:使用温度计和热电偶测量燃烧过程中的温度变化。
记录温度随时间的变化曲线。
5. 热效应实验:将热电偶插入燃烧装置中,测量燃烧过程中的热效应。
记录热效应随时间的变化曲线。
6. 环境影响实验:观察燃烧过程中产生的气体和颗粒物,分析其对环境的影响。
五、实验结果与分析1. 燃烧现象观察:不同燃料燃烧时,火焰颜色、燃烧温度、燃烧时间等存在差异。
例如,酒精灯燃烧时火焰呈蓝色,燃烧温度较高;蜡烛燃烧时火焰呈黄色,燃烧温度较低。
2. 氧气浓度对燃烧的影响:氧气浓度越高,燃烧越充分,火焰颜色越亮,燃烧温度越高。
3. 燃烧温度实验:燃烧过程中,温度随时间先升高后降低,燃烧峰值温度与燃料种类、氧气浓度等因素有关。
4. 热效应实验:燃烧过程中,热效应随时间先增大后减小,燃烧峰值热效应与燃料种类、氧气浓度等因素有关。

一、实验目的1. 探究木条燃烧的条件;2. 观察木条燃烧过程中的现象;3. 分析燃烧产生的物质。
二、实验原理燃烧是一种化学反应,需要满足三个条件:可燃物、氧气和着火点。
本实验通过观察木条在火焰中燃烧的现象,分析燃烧产生的物质,以验证燃烧的条件。
三、实验材料1. 实验器材:酒精灯、镊子、火柴、木条、玻璃杯、澄清石灰水、干冷玻璃片;2. 实验药品:酒精、水。
四、实验步骤1. 将木条平放在火焰上,用镊子夹住,点燃酒精灯,将火焰调至微弱;2. 观察木条燃烧过程中的现象,记录木条燃烧的部位、火焰颜色、燃烧速度等;3. 将燃烧后的木条放入玻璃杯中,观察木条燃烧后的残留物;4. 将干冷玻璃片放在火焰上方,观察玻璃片上是否有水雾生成;5. 将内壁蘸有澄清石灰水的烧杯罩在火焰上方,观察石灰水是否变浑浊。
五、实验现象1. 木条在火焰中燃烧,火焰颜色呈黄色;2. 燃烧过程中,木条中间部位燃烧痕迹较轻,两侧燃烧痕迹较重;3. 燃烧后的木条残留物为黑色碳化物;4. 干冷玻璃片上出现水雾;5. 澄清石灰水变浑浊。
六、实验结论1. 木条燃烧需要满足三个条件:可燃物、氧气和着火点;2. 木条燃烧过程中,火焰颜色为黄色,燃烧速度较快;3. 燃烧产生的物质为黑色碳化物,同时生成水和二氧化碳;4. 水雾和石灰水变浑浊的现象表明,燃烧过程中产生了水和二氧化碳。
七、实验分析1. 木条燃烧时,火焰颜色为黄色,说明木条燃烧产生的气体中含有碳;2. 燃烧后的木条残留物为黑色碳化物,说明木条燃烧过程中碳元素被氧化;3. 干冷玻璃片上出现水雾,表明燃烧过程中产生了水;4. 澄清石灰水变浑浊,说明燃烧过程中产生了二氧化碳。
八、实验总结本次实验通过观察木条燃烧的现象,验证了燃烧的条件和燃烧产生的物质。
实验结果表明,木条燃烧需要满足三个条件:可燃物、氧气和着火点。
燃烧过程中,木条燃烧产生的物质为黑色碳化物、水和二氧化碳。
通过本次实验,加深了对燃烧条件的认识,提高了实验操作技能。
第1篇一、实验目的1. 了解木柴燃烧的基本原理。
2. 探究木柴燃烧过程中产生的物质。
3. 分析木柴燃烧对环境的影响。
二、实验原理木柴燃烧是一种氧化反应,主要成分是碳、氢、氧等元素。
在燃烧过程中,木柴与氧气发生化学反应,生成二氧化碳、水蒸气、灰烬等物质。
实验过程中,通过观察燃烧现象、分析生成物,了解木柴燃烧的原理及其对环境的影响。
三、实验材料1. 木柴(干燥、质量约50g)2. 烧杯(100ml)3. 铁夹(2个)4. 酒精灯5. 火柴6. 干净的玻璃片7. 澄清石灰水8. 滤纸9. 秒表10. 记录本四、实验步骤1. 将木柴切成约1cm厚的片状,用滤纸擦拭干净。
2. 用铁夹夹住木柴,将其放在酒精灯的上方。
3. 点燃酒精灯,使木柴开始燃烧。
4. 观察木柴燃烧的现象,记录燃烧过程中的颜色、气味、火焰形状等。
5. 用烧杯收集燃烧过程中产生的气体,用秒表记录收集时间。
6. 将燃烧后的木灰倒入烧杯中,加入适量澄清石灰水,观察石灰水的变化。
7. 用玻璃片收集燃烧产生的烟雾,观察其颜色、气味等。
五、实验结果与分析1. 木柴燃烧现象:木柴燃烧时,火焰呈黄色,伴有蓝色火焰。
燃烧过程中,木柴表面逐渐变黑,有少量灰烬产生。
燃烧过程中,产生明显的气味,可能是焦油和酚类物质。
2. 澄清石灰水实验:将燃烧后的木灰加入澄清石灰水中,石灰水变浑浊,说明木柴燃烧产生了二氧化碳。
3. 烟雾观察:燃烧产生的烟雾呈白色,有轻微的气味。
六、实验结论1. 木柴燃烧是一种氧化反应,主要生成二氧化碳、水蒸气、灰烬等物质。
2. 木柴燃烧过程中产生的烟雾对环境有一定影响,可能含有对人体有害的物质。
3. 澄清石灰水实验表明,木柴燃烧确实产生了二氧化碳。
七、实验讨论1. 木柴燃烧过程中,产生的烟雾对环境的影响较大,建议在燃烧时采取适当的措施,如通风、使用烟囱等,以减少对环境的影响。
2. 木柴燃烧产生的灰烬中可能含有重金属等有害物质,应妥善处理,避免对土壤和水源造成污染。
一、实验目的1. 了解物质燃烧的基本原理和条件。
2. 掌握实验操作技能,观察和分析燃烧现象。
3. 了解燃烧产物的性质及其对环境的影响。
二、实验原理燃烧是物质与氧气发生的一种氧化反应,放出大量的热和光。
燃烧反应的化学方程式为:\[ \text{燃料} + \text{氧气} \rightarrow \text{燃烧产物} + \text{热量} \]本实验通过观察不同物质在燃烧过程中的现象,分析燃烧产物的性质,从而了解物质燃烧的特点。
三、实验用品1. 燃料:蜡烛、酒精、木炭、硫磺等。
2. 氧气:空气、纯氧等。
3. 实验器材:火柴、酒精灯、木炭夹、硫磺夹、烧杯、集气瓶、试管、酒精、蒸馏水、澄清石灰水等。
四、实验步骤1. 蜡烛燃烧实验(1)点燃蜡烛,观察火焰颜色、形状、温度等特征。
(2)将烧杯罩在火焰上方,观察烧杯内壁是否有水珠凝结。
(3)将烧杯取下,加入少量澄清石灰水,振荡,观察石灰水是否变浑浊。
2. 酒精燃烧实验(1)点燃酒精灯,观察火焰颜色、形状、温度等特征。
(2)将烧杯罩在火焰上方,观察烧杯内壁是否有水珠凝结。
(3)将烧杯取下,加入少量澄清石灰水,振荡,观察石灰水是否变浑浊。
3. 木炭燃烧实验(1)点燃木炭,观察火焰颜色、形状、温度等特征。
(2)将烧杯罩在火焰上方,观察烧杯内壁是否有水珠凝结。
(3)将烧杯取下,加入少量澄清石灰水,振荡,观察石灰水是否变浑浊。
4. 硫磺燃烧实验(1)点燃硫磺,观察火焰颜色、形状、温度等特征。
(2)将烧杯罩在火焰上方,观察烧杯内壁是否有水珠凝结。
(3)将烧杯取下,加入少量澄清石灰水,振荡,观察石灰水是否变浑浊。
五、实验现象与分析1. 蜡烛燃烧实验现象:蜡烛火焰呈黄色,烧杯内壁有水珠凝结,澄清石灰水变浑浊。
分析:蜡烛燃烧生成二氧化碳和水,二氧化碳与石灰水反应生成碳酸钙沉淀,使石灰水变浑浊。
2. 酒精燃烧实验现象:酒精火焰呈蓝色,烧杯内壁有水珠凝结,澄清石灰水变浑浊。
一、实验目的1. 了解物质燃烧的基本原理和条件。
2. 掌握物质燃烧实验的操作方法。
3. 分析物质燃烧过程中的现象,总结燃烧的基本规律。
二、实验原理燃烧是物质与氧气发生的一种放热、发光的氧化反应。
燃烧需要满足以下条件:1. 存在可燃物;2. 可燃物与氧气接触;3. 温度达到可燃物的着火点。
三、实验器材1. 酒精灯;2. 火柴;3. 蜡烛;4. 玻璃棒;5. 水槽;6. 澄清石灰水;7. 干净烧杯;8. 小刀;9. 秒表;10. 量筒;11. 温度计。
四、实验步骤1. 观察蜡烛、玻璃棒、酒精灯等实验器材的物理性质,记录颜色、形状、状态、硬度等。
2. 用小刀切下一块石蜡,放入水槽中,观察其在水中的现象,记录石蜡的密度和溶解性。
3. 点燃蜡烛,观察其燃烧现象,记录火焰分层情况、燃烧产物等。
4. 用干净烧杯罩在烛焰上方,观察烧杯壁上的现象,记录水珠的出现情况。
5. 取下烧杯,迅速倒入少量澄清石灰水,振荡,观察石灰水的变化,记录是否变浑浊。
6. 将蘸有酒精和水的棉球分别放入酒精灯火焰上加热,观察现象,记录酒精和水的燃烧情况。
7. 同时将一根小木条和一小块煤放在酒精灯火焰上灼烧,观察现象,记录小木条和煤的燃烧情况。
8. 用干粉灭火器对燃着的蜡烛进行灭火实验,观察灭火效果,记录灭火方法。
五、实验现象1. 蜡烛燃烧时,火焰分为外焰、内焰、焰心三层,外焰温度最高,焰心温度最低。
2. 蜡烛燃烧时,烧杯壁上出现水珠,说明蜡烛燃烧生成了水。
3. 蜡烛燃烧时,澄清石灰水变浑浊,说明蜡烛燃烧生成了二氧化碳。
4. 蘸有酒精的棉球能被点燃,说明酒精具有可燃性。
5. 蘸有水的棉球不能被点燃,说明水不具有可燃性。
6. 小木条容易被点燃,说明木条具有可燃性。
7. 煤块难以点燃,说明煤的着火点较高。
8. 用干粉灭火器对燃着的蜡烛进行灭火实验,灭火效果良好。
六、实验结论1. 蜡烛燃烧时,火焰分为外焰、内焰、焰心三层,外焰温度最高,焰心温度最低。
一、实验目的通过本实验,探究物体燃烧的条件,验证燃烧的三个基本要素:可燃物、助燃物(氧气)和点火源(温度),并进一步了解燃烧过程中的一些相关现象。
二、实验原理燃烧是指可燃物与氧气在点火源的作用下,发生剧烈的氧化反应,释放出热能和光能的过程。
燃烧的三个基本条件如下:1. 可燃物:具有可燃性的物质,如木材、纸张、汽油、酒精等。
2. 助燃物:支持燃烧的物质,一般为氧气。
3. 点火源:引起燃烧的能量来源,如明火、摩擦、冲击、电火花等。
本实验通过设计不同实验方案,验证这三个条件的必要性。
三、实验材料1. 可燃物:木条、纸张、酒精、汽油等。
2. 助燃物:空气(含氧气)。
3. 点火源:酒精灯、火柴、打火机等。
4. 实验器材:烧杯、试管、铁架台、玻璃棒、胶头滴管、温度计等。
四、实验步骤1. 实验一:验证可燃物(1)将一小块木条放在酒精灯火焰上加热,观察木条是否燃烧。
(2)将一小块纸张放在酒精灯火焰上加热,观察纸张是否燃烧。
(3)将一小滴汽油滴在酒精灯火焰上,观察汽油是否燃烧。
2. 实验二:验证助燃物(1)点燃一支蜡烛,用玻璃杯罩住蜡烛,观察蜡烛是否熄灭。
(2)将一小块木条放在空气中燃烧,观察燃烧现象。
(3)将一小块木条放入水中,观察木条是否燃烧。
3. 实验三:验证点火源(1)用火柴点燃蜡烛,观察蜡烛是否燃烧。
(2)用打火机点燃酒精灯,观察酒精灯是否燃烧。
(3)用摩擦方法点燃纸张,观察纸张是否燃烧。
五、实验现象1. 实验一:木条、纸张、汽油均能燃烧。
2. 实验二:用玻璃杯罩住的蜡烛熄灭;木条在空气中燃烧;木条在水中不燃烧。
3. 实验三:火柴、打火机、摩擦均能点燃蜡烛、酒精灯、纸张。
六、实验结论1. 物质燃烧需要具备三个基本条件:可燃物、助燃物(氧气)和点火源(温度)。
2. 可燃物具有可燃性,与氧气接触并达到着火点时,即可燃烧。
3. 燃烧过程中,释放出大量的热能和光能。
4. 燃烧过程中,可燃物发生氧化反应,生成新的物质。
一、实验目的通过本次实验,了解燃烧的条件,探究不同条件下物质燃烧的特性,为今后的安全用火提供理论依据。
二、实验原理燃烧是一种氧化反应,需要满足以下条件:1. 物质具有可燃性;2. 可燃物与氧气接触;3. 可燃物温度达到着火点。
三、实验器材1. 酒精灯;2. 酒精;3. 小木块;4. 小铁块;5. 烧杯;6. 氧气瓶;7. 温度计;8. 秒表;9. 火柴;10. 实验记录表。
四、实验步骤1. 将酒精倒入酒精灯中,点燃酒精灯,观察火焰颜色和形状;2. 将小木块放在酒精灯火焰上加热,记录木块燃烧的时间;3. 将小铁块放在酒精灯火焰上加热,观察铁块表面现象;4. 将烧杯罩在酒精灯火焰上,观察火焰熄灭时间;5. 将氧气瓶打开,用酒精灯加热氧气瓶,观察氧气燃烧现象;6. 记录实验数据,分析燃烧条件。
五、实验现象1. 酒精灯火焰呈蓝色,温度较高;2. 小木块在酒精灯火焰上燃烧,燃烧时间为10秒;3. 小铁块在酒精灯火焰上加热,表面出现红色;4. 烧杯罩在酒精灯火焰上,火焰熄灭时间为30秒;5. 氧气瓶打开后,加热氧气瓶,火焰迅速熄灭。
六、实验结论1. 物质具有可燃性,酒精、木块、铁块均具有可燃性;2. 可燃物与氧气接触,酒精、木块、铁块在氧气中均能燃烧;3. 可燃物温度达到着火点,酒精、木块、铁块在酒精灯火焰上加热后能燃烧;4. 燃烧条件满足时,燃烧现象明显,如火焰颜色、形状、温度等;5. 燃烧条件不满足时,燃烧现象不明显或无法燃烧。
七、实验注意事项1. 实验过程中注意安全,避免酒精灯火焰烧伤;2. 实验过程中注意观察实验现象,准确记录实验数据;3. 实验结束后,将实验器材整理归位。
八、实验拓展1. 探究不同可燃物的燃烧特性;2. 研究燃烧过程中产生的热量;3. 探究燃烧过程中产生的有害气体;4. 研究燃烧条件对燃烧速度的影响。
九、实验总结通过本次实验,我们了解了燃烧的条件,掌握了不同条件下物质燃烧的特性。
在今后的学习和生活中,我们要注意安全用火,避免火灾事故的发生。
一、实验目的1. 观察和了解燃烧现象。
2. 探究燃烧的条件。
3. 学习实验操作技能,培养严谨的科学态度。
二、实验原理燃烧是指物质在氧气存在下,与氧气发生化学反应,放出光和热的过程。
燃烧需要满足以下条件:可燃物、助燃物(氧气)、温度达到着火点。
三、实验用品1. 可燃物:蜡烛、酒精、木材、纸张、棉线等。
2. 助燃物:氧气。
3. 实验器材:酒精灯、火柴、铁夹、烧杯、玻璃棒、温度计、秒表等。
4. 实验材料:沙子、水、肥皂水等。
四、实验步骤1. 观察蜡烛燃烧现象(1)点燃蜡烛,观察蜡烛火焰的颜色、形状、大小、温度等。
(2)将干燥的烧杯罩在火焰上方,观察烧杯壁上的现象。
(3)将湿润的烧杯罩在火焰上方,观察烧杯壁上的现象。
2. 探究燃烧的条件(1)可燃物①点燃蜡烛,观察蜡烛燃烧的现象。
②将蜡烛放入水中,观察蜡烛是否燃烧。
③将蜡烛放入沙子中,观察蜡烛是否燃烧。
(2)助燃物①点燃蜡烛,观察蜡烛燃烧的现象。
②将蜡烛放入氧气瓶中,观察蜡烛是否燃烧。
③将蜡烛放入氮气瓶中,观察蜡烛是否燃烧。
(3)温度①点燃蜡烛,观察蜡烛燃烧的现象。
②将蜡烛放入冰水中,观察蜡烛是否燃烧。
③将蜡烛放入热水中,观察蜡烛是否燃烧。
3. 观察燃烧实验现象(1)观察蜡烛燃烧时火焰的颜色、形状、大小、温度等。
(2)观察蜡烛燃烧时产生的热量、光、烟雾等。
(3)观察不同条件下蜡烛燃烧的现象。
五、实验结果与分析1. 蜡烛燃烧现象(1)火焰颜色:蜡烛火焰颜色为黄色。
(2)火焰形状:蜡烛火焰呈圆柱状。
(3)火焰大小:蜡烛火焰大小与蜡烛大小成正比。
(4)火焰温度:蜡烛火焰温度较高,可达几百摄氏度。
2. 燃烧条件探究(1)可燃物:蜡烛在氧气中燃烧,在水中、沙子中不燃烧。
(2)助燃物:蜡烛在氧气中燃烧,在氮气中不燃烧。
(3)温度:蜡烛在冰水中不燃烧,在热水中燃烧。
3. 燃烧实验现象观察(1)火焰颜色、形状、大小、温度等均与蜡烛燃烧现象一致。
(2)蜡烛燃烧时产生热量、光、烟雾等。