人教版初三化学下册复分解反应的条件-教学设计
- 格式:docx
- 大小:8.55 KB
- 文档页数:2

课题一生活中常见的盐第三课时复分解反应发生的条件一教学目标1.知识与技能:进一步理解酸、碱、盐等基本概念;对重点知识进行初步的归纳和整理;能正确判断酸、碱、盐之间的反应;对物质的分类有进一步的认识。
重点掌握复分解反应发生的条件。
2.过程和方法:尝试利用现代化教育手段获取信息、评价信息,从而提高教学效率;通过创造情景活动,鼓动学习热情,引导学生主动复习、敢于创新;同时使学生学会分类、比较、归纳等方法。
3.情感、态度、价值观:通过小组讨论,培养学生之间的协作精神,也为学生提供发现的机会,使之体会成功的喜悦;同时激发学生参与的兴趣。
二教学重点与难点1理解复分解反应的定义2掌握复分解反应产生的条件三教学过程引入新课:前面我们学了分解反应,化合反应,还有置换反应,现在我写几个反应式,大家思考,它们属于前面我们讲的哪一种反应类型?电解板书:1HO=Hf+Of222燃烧22H+O=2HO2223Fe+CuSO=Cu+FeSO444CaCO+2HCl=CaCl+HO+COf322252KOH+HSO=KSO+2HO242426NaCl+AgNO=AgCl;+NaNO g7NaOH+MgCl=Mg(OH)/+2NaCl通过前面的学习我们知道,由一种物质参加反应生成两种或两种以上物质的反应叫分解反应。
在这个反应中水电解生成氢气和氧气就是分解反应,我们可以把它表示为AB-A+B由两种或两种以上的物质参加反应生成一种物质的反应叫化合反应,氢气和氧气反应生成水,这个反应就属于化合反应,化合反应可以表示为:A+B—AB置换反应是由一种单质和一种化合物反应生成另一种单质和另一种化合物的反应,铁和硫酸铜反应生成铜和硫酸亚铁,所以像这类的反应就是置换反应,可表示为:A+BC—A+CB大家在思考四至七反应属于什么反应类型,通过观察可以看出,它不属于我们所学的三种反应类型中的任意一种,那么它们到底属于哪一种反应类型呢?请大家翻开课本73页,今天我们就来学习有关这方面的知识。

《复分解反应》教案【学习目标】1、进一步理解酸、碱、盐等基本概念;对重点知识进行初步的归纳和整理;2、能正确判断酸、碱、盐之间的反应;对物质的分类有进一步的认识。
【学习重点、难点】1、理解复分解反应的定义;2、掌握复分解反应产生的条件,能根据复分解反应发生条件判断酸碱盐之间的反应能否发生。
【巩固提升】完成下列反应方程式,并判断反应类型。
CaO + H2OKMnO4Zn + H2SO4Na2CO3 + Ca(OH)2HCl + NaOH【自主学习】阅读课本74.75页复分解反应定义:。
【活动探究一】下列反应中哪些属于复分解反应?CuO + CO Cu + CO2BaCl2 + H2SO4 BaSO4 + 2HClNa2CO3 + H2SO4 Na2SO4 + H2O + CO2CuO + 2HCl CuCl2 + H2OCO2 + 2NaOH Na2CO3 + H2O【归纳总结一】复分解反应1、通式:2、特点:【活动探究二】实验一:向两支分别盛有少量氢氧化钠溶液和氯化钡溶液的试管中滴加硫酸铜溶液,观察现象并填写下表。
它们有什么共同之处?。
实验二:向两支分别盛有少量碳酸钾溶液和碳酸钠溶液的试管中滴加稀硫酸,观察现象并填写下表。
它们有什么共同之处?。
实验三:向两支盛有少量氢氧化钠溶液和酚酞溶液的试管中分别滴加稀盐酸和硝酸钾溶液,观察现象并填写下表。
酸和碱中和反应的生成物中,相同的生成物是什么?。
【归纳总结二】复分解反应条件:。
【活动探究三】根据复分解反应发生的条件,并利用酸碱盐溶解性规律,判断稀硫酸与下表中的四种化合物的溶液之间是否能发生反应。
复分解反应的思维导图【拓展练习】1、下列各组物质的溶液,不能发生复分解反应的是( )A、HCl,Ca(OH)2B、Na2CO3,H2SO4C、AgNO3,BaCl2D、KCl,CuSO42、根据复分解反应条件,判断下列物质间能否发生复分解反应。
如能发生反应,写出反应的化学方程式。



复分解反应的条件及其应用【学习目标】1、掌握复分解反应的定义和条件;2、会运用复分解反应的条件解决物质共存、转化、鉴别、除杂等问题。
【学习重点】加深对复分解反应概念的理解【学习难点】应用复分解反应的条件解决问题课前预习:根据酸碱盐的化学性质,回忆常见的复分解反应:(5种)【教学过程】活动一、复习复分解反应的定义和反应条件1、复分解反应的定义?2、复分解反应的条件?3、常见的沉淀:能生成气体的离子对:能生成水的离子对:活动二、复分解反应条件的应用1:物质共存例1.下列离子能在pH=12的无色溶液中大量共存的是()A、SO42-、Fe3+、Na+、Cl-B、K+、SO42-、NH4+、NO3-C、Cl-、K+、SO42-、Na+D、Ca2+、Cl-、CO32-、Na+【小结】思考:某化工厂有甲、乙两个车间排出的废水中各含有K+、Cu2+、H+、NO3-、OH-中的三种离子(两车间的废水中只含有一种相同的离子)。
将甲、乙两车间的废水按适当的比例混合,沉淀后废水变为无色、澄清的中性溶液。
下列分析不正确的是()A、两车间的废水中都含有NO3-B、K+和OH-来自同一车间C、Cu2+ 和H+来自不同车间D、沉淀废水得到的中性溶液中含有一种复合肥料2、物质转变例2:如何通过一步反应实现下列物质的转化?CuCl2 NaCl【小结】小游戏:利用复分解反应进行接龙,比一比哪组的“龙”最长。
方法:由一种物质甲制取另一种物质乙,再以乙物质为反应物制取丙物质,以此类推。
要求:反应物的化学式不能重复,化学方程式的书写不能出错。
3:物质鉴别例3:下列试剂中,能把KOH溶液、稀硫酸、CaCl2溶液一次鉴别出来的是()A.KCl溶液B.K2CO3溶液C.NaNO3溶液D.稀盐酸例4:现有①NaCl、②Mg(NO3)2、③NaOH、④CuSO4 四种溶液,不用其他试剂就可将它们逐一鉴别出来,其鉴别顺序是()A.④②③① B.④③②① C.④②①③ D.③④①②【小结】思考:现有K2SO4、Na2CO3、BaCl2、稀HCl四种溶液,不加其他试剂可以鉴别吗?4:除杂例6:除去下列物质中所含少量杂质的方法正确的是()【小结】这节课我收获了什么:。



复分解反应发生的条件姓名:黄沛霖任教学科:初中化学所在学校:夏湾中学【讲解】对于实验探究①,硫酸铜溶液和氢氧化钠反应后得到的沉淀是什么物质呢?我们知道,硫酸铜溶液中有铜离子,氢氧化钠溶液中有氢氧根离子,当铜离子遇到氢氧根离子,会生成不溶于水的氢氧化铜蓝色沉淀。
对于实验探究②,我们可以回忆一下实验室制取C02,正是因为碳酸钠和稀盐酸反应速度过快,所以不选择碳酸钠和稀盐酸作为制备C02的药品,两者反应的实质是溶液中的碳酸根离子和氢离子结合生成不稳定的碳酸,碳酸又进而分解生成二氧化碳气体和水。
对于实验探究③,请同学们先回忆一下第12单元,常见的酸和碱,其中碱溶液可是酚酞试液变红,同时酸和碱能够发生中和反应,恰好反应时,溶液红色褪去,反应的实质是氢氧根离子和氢离子结合生成了水。
【过渡】请同学们翻到课本第75页,齐读一下复分解反应发生的条件。
【微课展示】为了让同学们更深入了解复分解反应发生的条件,并回顾一下我们所做的这三个实验探究,请同学们认真观看老师制作的微课《复分解反应发生的条件》。
【过渡】同学们看完这个微课,回到我们这节课的主要内容,复分解反应发生需要什么条件呢?(并讲边板书:二、复分解反应发生的条件:生成物中有沉淀J或气体f或水)(2 )拓展探究【引入】老师看到同学们还意犹未尽的样子,是不是还想进行实验探究呢?....那么请同学们进行以下三组实验拓展探究吧。
但在进行探究之前,我想请冋学们先看这三组反应,请同学们先写出三组物质可能发生的反应方程式。
【讲解】第一组是氯化铁与氢氧化钠,两者交换成分后得到的是氢氧化铁和氯化钠;第二组是氯化钡和硫酸,两者交换成分后是硫酸钡和盐酸;第三组是硝酸银和氯化钠,两者交换成分后是氯化银和硝酸钠。
对于这三组可能发生的反应,我们讨论后发现没有常见的气体,也没有水产生,那么生物中是否可能有沉淀呢?请同学们进行实验,并推测可能产生的沉淀是哪个物质,一会儿小组汇报实验结果吧。
反应方程式:Na2C0 3+2HCI=2NaCI+H 2O+CO 2 fZ小组代表:实验探究稀HCI和NaOH溶液(滴有酚酞试液)反应:实验现象:向盛有氢氧化钠溶液的试管中滴加酚酞试液,溶液变红;滴加稀盐酸,溶液红色变浅并逐渐褪至无色。
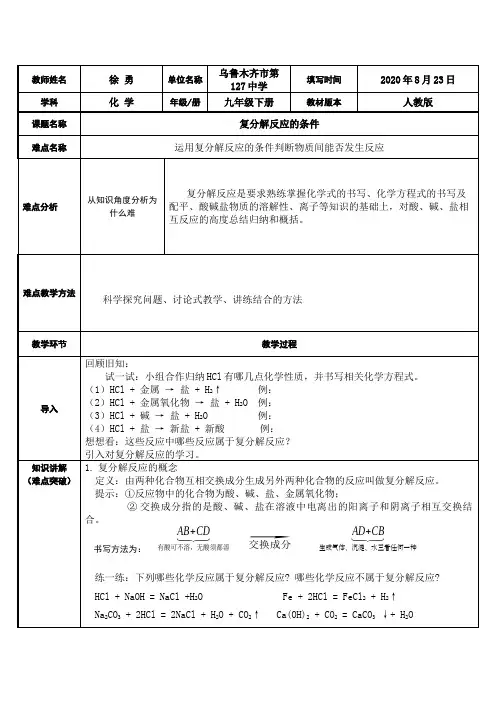
教师姓名徐 勇单位名称乌鲁木齐市第127中学填写时间2020年8月23日学科化 学年级/册九年级下册教材版本人教版课题名称复分解反应的条件难点名称运用复分解反应的条件判断物质间能否发生反应难点分析从知识角度分析为什么难复分解反应是要求熟练掌握化学式的书写、化学方程式的书写及配平、酸碱盐物质的溶解性、离子等知识的基础上,对酸、碱、盐相互反应的高度总结归纳和概括。
难点教学方法科学探究问题、讨论式教学、讲练结合的方法教学环节教学过程导入回顾旧知:试一试:小组合作归纳HCl有哪几点化学性质,并书写相关化学方程式。
(1)HCl + 金属 → 盐 + H2↑ 例:(2)HCl + 金属氧化物 → 盐 + H2O 例:(3)HCl + 碱 → 盐 + H2O 例:(4)HCl + 盐 → 新盐 + 新酸 例:想想看:这些反应中哪些反应属于复分解反应?引入对复分解反应的学习。
知识讲解(难点突破)1.复分解反应的概念定义:由两种化合物互相交换成分生成另外两种化合物的反应叫做复分解反应。
提示:①反应物中的化合物为酸、碱、盐、金属氧化物;②交换成分指的是酸、碱、盐在溶液中电离出的阳离子和阴离子相互交换结合。
书写方法为:AB+CD⏟有酸可不溶,无酸须都溶⃗交换成分AD+CB⏟生成气体、沉淀、水三者任何一种练一练:下列哪些化学反应属于复分解反应? 哪些化学反应不属于复分解反应?HCl + NaOH = NaCl +H2O Fe + 2HCl = FeCl2 + H2↑Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑ Ca(OH)2 + CO2 = CaCO3 ↓+ H2O。
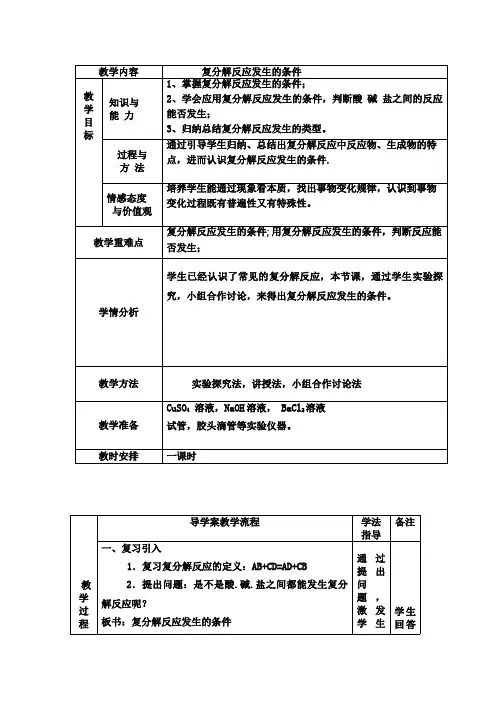

教师姓名田建辉单位名称玉林市福绵高级中学填写时间2020.7.11学科化学年级/册九年级教材版本人教版课题名称复分解反应发生的条件难点名称复分解反应发生的条件难点分析从知识角度分析为什么难填写示例知识点本身内容复杂:被减数连续两位不够减,要连续从前一位退1,在第二次退位后除了加上本位的数还要减去上次退的1,又加又减,计算上思维过程交为复杂,学生容易出错。
难点教学方法填写示例1.通过XX直观演示算理XX2.XX教学环节教学过程导入知识讲解(难点突破)基本条件:发生复分解反应的两种物质能在水溶液中交换离子,结合成难电离的物质(沉淀、气体或弱电解质)。
1、碱性氧化物+酸:酸的酸性较强(如HCl、H2SO4、HNO3等),可发生反应。
2、酸+碱(中和反应):当酸、碱都很弱时,不发生反应。
3、酸+盐:强酸制弱酸;交换离子后有沉淀;强酸与碳酸盐反应;满足一个条件即可发生反应。
4、碱+盐:强碱与铵盐反应;两种反应物都可溶、交换离子后有沉淀、水、气体三者之一;满足一个条件即可发生反应。
5、盐+盐:两种反应物都可溶,交换离子后有沉淀、水、气体三者之一,满足一个条件即可发生反应。
复分解反应能够发生的三个条件(即生成物中有沉淀或有气体或有水),长期以来有效地指导了科学实验和生产实践。
通过实践表明:反应中因温差或浓度的原因能析出一种物质或复盐,复分解反应也能发生。
根据实际教学设计需要增行课堂练习(难点巩固)小结以下为语文学科《长相思》教学设计案样例。
教师姓名××单位名称××填写时间×年×月×日学科语文年级/册五年级(上)教材版本人教版课题名称第七单元 21《长相思》难点名称在移情想象中建构“故园”的丰富意象,体味“故园”的文化意蕴。
难点分析从知识角度分析为什么难体味“故园”的文化意蕴,要通过理解诗句,展开想象,将凝固的语言转化为可感的画面,具有一定的难度。
复分解反应发生的条件
濂溪区一中 梅元锦
【教材分析】:
《复分解反应发生的条件》 是九年级化学下册第十一单元课 题一
第三课时的内容, 本课是在学习了生活中常见的盐、 复分解 反应的概
念和反应形式的基础上引入的一节新课, 通过本课的学 习,使学生掌握
复分解反应发生的条件和本质, 理解离子共存的 含义,为后续除杂、
离子检验、 化肥的使用等构建知识理论基础, 对培养学生的化学综合的
能力有着至关重要的作用。 【学情分析】:
通过上节课的学习, 学生已经全面认识到了初中阶段的四大 基本
反应类型, 即化合反应、 分解反应、 置换反应和复分解反应, 知道了
复分解反应的形式即: AB+CD f BC+AD,只是学生不知 道什么情况下能
互相交换, 即复分解反应发生的条件是什么, 以 及复分解反应的本质
是什么, 为什么能发生反应尚且不清楚, 因 此,通过本课对复分解反
应的条件及本质的学习, 从而为后续离 子共存问题的学习以及除杂、离
子检验的学习构建知识理论基 础。
【教学目标】:
1、 复分解反应的反应发生的条件,熟练书写复分解反应方程式
2、 理解复分解反应的本质
3、 利用复分解反应解决离子共存问题
【重、难点】 :
重点:复分解反应的条件
难点:复分解反应的本质,离子反应
【教学用具】:
试管、试管架、胶头滴管、无色酚酞溶液、硫酸铜溶液、氢氧化钠溶液、石灰水、 稀盐
酸、碳酸钠溶液、氯化镁溶液等。
【教学环节】:
一、 复习引入
1. 酸碱盐的溶解性口诀
2. 酸、碱、盐的概念?
3. 什么是复分解反应?尽可能多的写出几个复分解反应的化学方程式
(此过程学生可能会写出一些不符合复分解反应发生条件的化学方程
式,如氯化钡溶液和氢氧化钠溶液反应等)
二、 提出问题,进入新课
1. 所有的酸碱盐之间都能发生复分解反应吗?
【实验探究】:
(1) 硫酸铜溶液与氢氧化钠溶液
现象:产生蓝色沉淀
(2) 石灰水与碳酸钠溶液
现象:产生白色沉淀
(3) 碳酸钠溶液与盐酸 现象:产生气泡
(4) 氢氧化钠溶液与盐酸 现象:产生水
【总结】:复分解反应的条件:生成沉淀、或气体、或水,且在溶液中进行
2. 不溶于水的物质能不能发生复分解反应呢?
【实验探究】:(1)大理石与盐酸
(2)氢氧化铜与盐酸
【总结与练习】:不溶于水的物质只能与酸发生复分解反应
(硫酸钡、氯化银不溶于三酸!)
3. 复分解反应的本质是什么?
[动画模拟]—复分解反应的实质:离子之间发生反应! 离子之间:生成了 _沉淀,
则不能共存(八大沉淀) 彳 气体,则不能共存(氨气、二氧化碳)
1
-水,则不能共存
[常见的不能共存的离子对]:略
4. 应用与练习:离子共存 三、总结(三个知识点)
1. 复分解反应发生的条件
2. 复分解反应发生的本质
3.离子共存的简单判断