优化方案2017版高考化学大一轮复习 第五章 物质结构 元素周期律 第三讲 化学键讲义
- 格式:doc
- 大小:413.76 KB
- 文档页数:12






第二讲元素周期表元素周期律[2017高考导航]考纲要求真题统计命题趋势1.掌握元素周期律的实质。
了解元素周期表(长式)的结构(周期、族)及其应用。
2.以第三周期为例,掌握同一周期内元素性质的递变规律与原子结构的关系。
3.以ⅠA和ⅦA族为例,掌握同一主族内元素性质递变规律与原子结构的关系。
4.了解金属、非金属在元素周期表中的位置及其性质递变的规律。
2015,卷Ⅰ 12T;2015,卷Ⅱ 9T;2014,卷Ⅰ 10T;2014,卷Ⅱ 27T(1);2013,卷Ⅰ 9T预计2017年高考主要考查元素性质的周期性变化,以元素周期表为依托考查各微粒间关系,用物质结构理论来解释现象、定位推断、归纳总结、定量计算。
题型会稳中有变。
复习备考时,重点掌握同周期、同主族元素性质的递变规律,注意某些物质的特征;理清元素的“位—构—性”的关系,用好元素周期表这一工具。
考点一元素周期表[学生用书P120]1.原子序数原子序数=核电荷数=核外电子数=质子数。
2.编排原则周期(横行):元素原子的电子层数相同,左―→右:原子序数递增;族(纵行):元素原子的最外层电子数相同,上―→下:电子层数递增。
3.结构(1)周期(7个横行,7个周期)短周期长周期周期序数一二三四五六七元素种数 2 8 8 18 18 32 320族元素原子序数 2 10 18 36 54 86 118主族列序 1 2 13 14 15 16 17 族序ⅠAⅡAⅢAⅣAⅤAⅥAⅦA副族列序 3 4 5 6 7 11 12族序ⅢBⅣBⅤBⅥBⅦBⅠBⅡBⅧ族第8、9、10共3个纵行0族第18纵行①分界线:沿着元素周期表中铝、锗、锑、钋与硼、硅、砷、碲、砹的交界处画一条虚线,即为金属元素区和非金属元素区的分界线。
②各区位置:分界线左下方为金属元素区,分界线右上方为非金属元素区。
③分界线附近元素的性质:既表现金属元素的性质,又表现非金属元素的性质。
1.请在下表中画出元素周期表的轮廓,并在表中按要求完成下列问题:(1)标出族序数。




一、选择题1.(2016·广东中山模拟)有关化学用语表达正确的是( )A .聚丙烯的结构简式:CH 2—CH 2—CH 2B .Cl -的结构示意图:C.102 46Pd 和103 46Pd 互为同位素D .过氧化氢电子式: H +[··O ······O ······]2-H + 解析:选C 。
A.聚丙烯的结构简式为,故A 错误;B .Cl -的结构示意图为 ,故B 错误;C.102 46Pd 和103 46Pd 为Pd 元素的两种不同原子,互为同位素,故C 正确; D .过氧化氢为共价化合物,电子式为H··O ······O ······H ,故D 错误。
2.(2016·黑龙江质检)某元素的一个原子形成的离子可表示为b a X n -,下列说法正确的是( ) A.b a X n -含有的中子数为(a +b )B .b a X n -含有的电子数为(a -n )C .X 原子的质量数为(a +b +n )D .X 原子的质量约为b 6.02×1023g 解析:选D 。
中子数等于质量数减去质子数,为(b -a ),A 选项错误;该离子含有的电子数为(a +n ),B 选项错误;原子变成离子时,质量数与核外电子数无关,所以X 原子的质量数为b ,C 选项错误;D 选项正确。
3.(2014·高考上海卷)下列各组中两种微粒所含电子数不相等的是( )A .H 3O + 和OH -B .CO 和N 2C .HNO 2和NO -2D .CH +3 和NH +4解析:选D 。
本题考查微粒中电子数目的计算。

第3节化学键时间:45分钟满分:100分一、选择题(每题6分,共72分)1.下列关于化学键的说法正确的是()A.C、N、O、H四种元素形成的化合物一定既有离子键,又有共价键B.不同元素的原子构成的分子不一定只含极性共价键C.含极性键的共价化合物一定是电解质D.HF的分子间作用力大于HCl,故HF比HCl更稳定答案B解析(NH2)2CO(尿素)中只含共价键,A错误;H2O2中含有O—O 非极性键,B正确;CO中的化学键为极性键,但CO是非电解质,C错误;分子间作用力与分子稳定性无关,HF的键能大于HCl,所以HF比HCl更稳定,D错误。
2.(2019·北京海淀高三期中)下列说法正确的是() A.HCl的电子式为H∶ClB.Na2O2只含有离子键C.质量数为12的C原子符号为12CD.用电子式表示KBr的形成过程:答案D解析氯原子核外最外层有7个电子,与氢原子形成HCl分子的电子式为,故A错误;Na2O2的电子式为:,其中既有离子键,也有共价键,故B错误;质量数应标在原子符号的左上角,质量数为12的C原子符号应为12C,故C错误。
3.将Na、Na2O、NaOH、Na2S、Na2SO4分别加热熔化,需要克服相同类型作用力的物质有()A.2种B.3种C.4种D.5种答案C解析Na熔化时破坏金属键,Na2O、Na2S、NaOH、Na2SO4是离子化合物,熔化时只破坏离子键,所以分别加热熔化题述五种物质,需克服相同类型作用力的物质有4种。
4.(2019·北京师大附中高三期中)下列各分子中,所有原子都满足最外层8电子结构的是()A.BF3B.NCl3C.H2O D.PCl5答案B解析根据定义,共价键中的电子被成键的两个原子共有,围绕两个原子核运动.所以,形成共价键的原子的最外层电子数等于它本身最外层电子的个数加上它与其他原子形成共价键的数目。
据此,题中各原子的最外层电子个数为:A中B有3+3=6个、F有7+1=8个,不符合题意;B中N有5+3=8个、Cl有7+1=8个,符合题意;C中H有1+1=2个、O有6+2=8个,不符合题意;D中P有5+5=10个、Cl有7+1=8个,不符合题意.5.下列说法正确的是()A.原子的最外层电子数等于族序数B.主族元素X、Y能形成XY3型化合物,原子序数差可能为2、6或8C.分子结构相似的分子,相对分子质量越大,熔沸点越高D.元素的原子得电子越多,非金属性越强;失电子越多,金属性越强答案B解析原子的最外层电子数不一定等于族序数,如最外层电子数是2,有可能是0族的氦元素,A错误;主族元素X、Y能形成XY3型化合物,可能是PCl3、NH3、SO3等,原子序数差可能为2、6或8,B正确;分子结构相似的分子的熔沸点与相对分子质量和氢键有关,如水分子间存在氢键,水的沸点比同主族的H2S、H2Se等都高,C错误;元素的非金属性、金属性与得失电子的难易程度有关,与得失电子的多少无关,D错误。

一、选择题1.下面是四位同学学习原子结构后,对这节内容的认识,你认为不正确的是( )解析:选C 。
1H 不含中子。
2.有5种单核粒子,它们分别是4019□、4018□、4019□+、4020□2+、4119□(“□”内元素符号未写出),则它们所属元素的种类有( )A .2种B .3种C .4种D .5种解析:选B 。
质子数决定元素的种类,质子数有19、18、20,共3种。
3.一定量的锎(252 98Cf)在医学上常用作治疗恶性肿瘤的中子源。
下列有关锎的说法错误的是( )A.252 98Cf 原子中,中子数为154B.252 98Cf 原子中,质子数为98C.252 98Cf 原子中,核外电子数为98D .锎元素的相对原子质量为252解析:选D 。
252 98Cf 是锎元素的一种同位素,其质量数为252,核外电子数=核内质子数=98,中子数=252-98=154。
锎元素的相对原子质量等于锎元素的各种同位素的相对原子质量与它们的原子个数百分比之积的和,而不等于某一核素的质量数,故D 项错误。
4.已知R 元素的某种同位素能形成化合物A m R n ,其中A 的化合价为+n 。
该化合物中一个R 微粒的核外电子数为a ,核内中子数为b ,则该同位素的原子符号是( )A.b +m +n a +m RB. b +a -m a +m RC.b +a a RD.a -m +b a -m R解析:选D 。
由题意可知,在化合物A m R n 中,R 的化合价为-m ,其离子符号为R m -,已知一个R m -的核外电子数为a ,则该同位素的核内质子数为a -m ,质量数=质子数+中子数=a -m +b ,D 正确。
5.某短周期非金属元素的原子核外最外层电子数是次外层电子数的一半,该元素( )A .在自然界中只以化合态的形式存在B .单质常用作半导体材料和光导纤维C .最高价氧化物不与酸反应D .气态氢化物比甲烷稳定解析:选A 。

原子结构与元素周期律[学生用书单独成册](时间:45分钟;满分:100分) 一、选择题(本题包括9小题,每小题5分,共45分)1.据ETH 天文研究所的报告,组成太阳的气体中存在20Ne 和22Ne ,下列关于20Ne 和22Ne的说法正确的是( )A .20Ne 和22Ne 互为同位素B .20Ne 和22Ne 互为同分异构体C .20Ne 和22Ne 的化学性质不同D .20Ne 和22Ne 的中子数相同解析:选A 。
同位素是指质子数相同,中子数不同的同一元素的不同原子,互为同位素的原子质量数和中子数不同,质子数和核外电子数相同,化学性质几乎相同,则A 项正确。
2.下列各项中表达正确的是( )A .F -的结构示意图:B .CO 2的电子式··O ······C ··O ······ C .NaCl 的电子式:Na ··Cl ······D .N 2的结构式:解析:选A 。
B 项CO 2的电子式为O ········C ····O ····,C 项中NaCl 的电子式为Na +[··Cl ······]-,D 项中N 2的结构式为NN ,A 项正确。
3.(2016·陕西铜川高三测试)下列物质中,既含有离子键又含有极性共价键的是( )A .Na 2O 2B .MgCl 2C .HClD .NH 4Cl解析:选D 。

第五章 物质结构 元素周期律[学生用书单独成册](时间:45分钟;满分:100分)一、选择题(本题包括9个小题,每小题5分,共45分)1.(2015·高考上海卷)中国科学技术名词审定委员会已确定第116号元素Lv 的名称为。
关于293116Lv 的叙述错误的是( )A .原子序数116B .中子数177C .核外电子数116D .相对原子质量293解析:选D 。
因为原子序数=核电荷数=质子数=电子数,所以原子序数为116,A 正确;核外电子数为116,C 正确;由于质量数=质子数+中子数,所以中子数为177,B 正确;293为其质量数,D 错误。
2.固体X 的化学式为NH 5,它的所有原子的最外层都符合相应稀有气体原子的电子层结构,电子式为[H ··N ··H ··H]+[··H]-,下列说法正确的是( ) A .NH 5属于离子化合物 B .NH 5属于共价化合物C .NH 5只含有离子键D .NH 5只含有共价键解析:选A 。
因为X 中存在阴、阳离子,所以为离子化合物,A 对、B 错;X 中H -与NH +4之间存在离子键,NH +4内部存在共价键,C 、D 错。
3.据ETH 天文研究所的报告,组成太阳的气体中存在20Ne 和22Ne ,下列关于20Ne 和22Ne 的说法正确的是( )A .20Ne 和22Ne 互为同位素B .20Ne 和22Ne 互为同分异构体C .20Ne 和22Ne 的化学性质不同D .20Ne 和22Ne 的中子数相同解析:选A 。
同位素是指质子数相同、中子数不同的同一元素的不同原子,互为同位素的原子质量数和中子数不同,质子数和核外电子数相同,化学性质几乎相同,则A 项正确。
4.下列各项中表达正确的是( )A .F -的结构示意图:B .CO 2的电子式:··O ······C ··O ······ C .NaCl 的电子式:Na ··C l ······D .N 2的结构式:··NN ··解析:选A 。
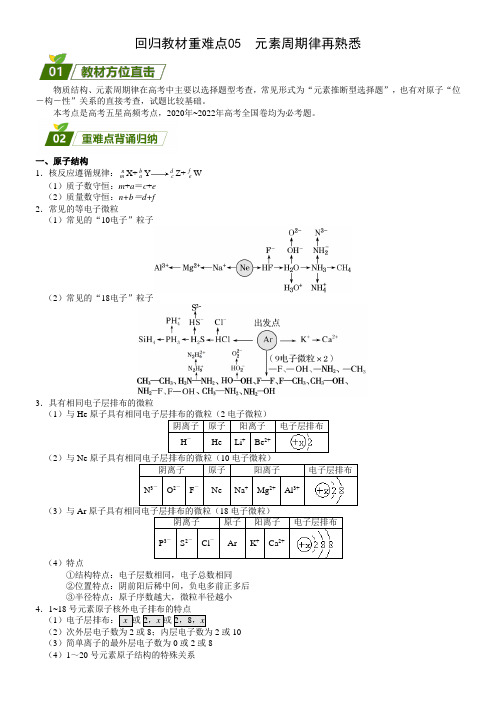
回归教材重难点05 元素周期律再熟悉物质结构、元素周期律在高考中主要以选择题型考查,常见形式为“元素推断型选择题”,也有对原子“位-构-性”关系的直接考查,试题比较基础。
本考点是高考五星高频考点,2020年~2022年高考全国卷均为必考题。
一、原子结构1.核反应遵循规律:nm X+baY dcZ+feW(1)质子数守恒:m+a=c+e(2)质量数守恒:n+b=d+f2.常见的等电子微粒(1)常见的“10电子”粒子(2)常见的“18电子”粒子3.具有相同电子层排布的微粒(1)与He原子具有相同电子层排布的微粒(2电子微粒)阴离子原子阳离子电子层排布H-He Li+Be2+(2)与Ne原子具有相同电子层排布的微粒(10电子微粒)阴离子原子阳离子电子层排布N3-O2-F-Ne Na+Mg2+Al3+(3)与Ar原子具有相同电子层排布的微粒(18电子微粒)阴离子原子阳离子电子层排布P3-S2-Cl-Ar K+Ca2+(4)特点①结构特点:电子层数相同,电子总数相同②位置特点:阴前阳后稀中间,负电多前正多后③半径特点:原子序数越大,微粒半径越小4.1~18号元素原子核外电子排布的特点(1)电子层排布:x 或2,x或2,8,x(22或10(3)简单离子的最外层电子数为0或2或8(4)1~20号元素原子结构的特殊关系特殊关系元素最外层电子数等于次外层电子数的一半Li、Si最外层电子数等于次外层电子数Be、Ar最外层电子数等于次外层电子数的2倍 C最外层电子数等于次外层电子数的3倍O最外层电子数等于次外层电子数的4倍Ne最外层电子数等于电子层数H、Be、Al最外层有1个电子H、Li、Na、K最外层有2个电子He、Be、Mg、Ca内层电子数之和是最外层电子数2倍的元素Li、P电子总数为最外层电子数2倍的元素Be二、元素周期表1.元素周期表的结构2.族序数与列数的关系(1)2、3周期IIA和IIIA相邻,原子序数相差1(2)4、5周期IIA和IIIA之间有副族和VIII族,原子序数相差11(3)6、7周期IIA和IIIA之间有副族和VIII族,还额外多出镧系和锕系,原子序数相差25 3.元素周期表的实际应用4.周期表中的元素(1)元素种类最多的族:ⅢB族,共32种元素(2)元素种类最多的主族:ⅠA族,共7种元素(3)元素种类最多的周期:7周期,共32种元素(4)在短周期中非金属元素多,在周期表中金属元素多。

一、选择题1.(2014·高考全国卷Ⅰ,10,6分)X、Y、Z均为短周期元素,X、Y处于同一周期,X、Z的最低价离子分别为X2-和Z-,Y+和Z-具有相同的电子层结构。
下列说法正确的是() A.原子最外层电子数:X>Y>ZB.单质沸点:X>Y>ZC.离子半径:X2->Y+>Z-D.原子序数:X>Y>Z解析:选D。
短周期元素X、Z形成的常见最低价离子为X2-、Z-,Y+和Z-具有相同的电子层结构,则X、Y、Z三种元素分别处于第ⅥA、ⅠA、ⅦA族。
又知X和Y处于同一周期,Y+和Z-具有相同的电子层结构,从而推知X、Y、Z分别为S、Na和F。
A.原子最外层电子数:F>S>Na。
B.Na单质为金属晶体,S、F2为分子晶体,S为固体,F2为气体,显然沸点Na>S>F2。
C.具有相同电子层结构的离子,元素的原子序数越大,原子半径越小,Na+、F-具有相同的电子层结构,则离子半径:F->Na+,S2-多一个电子层,所以S2-半径最大。
D.三种元素的原子序数关系为S>Na>F。
2.(2016·山西太原模拟)下列根据元素周期表和元素周期律得出的推断中正确的是()A.金属元素原子最外层电子数越少,该金属失电子能力越强B.若存在简单阴离子R2-,则R一定位于ⅥA族C.a A2+、b B+、c C3-三种离子具有相同的电子层结构,则原子序数c>a>bD.铅位于周期表中金属和非金属的交界处,可做半导体材料解析:选B。
A选项,由Na与Ca的活泼性强弱可知错误;C选项,原子序数a>b>c,错误;D选项,铅不位于金属和非金属交界处,是金属,属于导体,错误。
3.(2016·河南洛阳质检)应用元素周期律分析下列推断,其中正确的组合是()①铊(Tl)与铝同主族,其单质既能与盐酸反应,又能与氢氧化钠溶液反应②气态氢化物的稳定性HF大于HCl③硒(Se)位于元素周期表第ⅥA族,其最高价氧化物对应水化物的酸性比硫酸弱④第2周期非金属元素的气态氢化物溶于水后,水溶液均为酸性A.①③B.②④C.①④D.②③解析:选D。

第三讲 化学键考点一 离子键和共价键[学生用书P126]1.化学键(1)概念:使离子或原子相结合的作用力。
(2)分类(3)化学反应的本质2.离子键与共价键的比较(1)Na 2S :(2)CO 2:·C ···+2·O ···· ·―→··O ······C····O ····1.判断正误(正确的打“√”,错误的打“×”)(1)形成离子键的阴、阳离子间只存在静电吸引力。
( ) (2)某些金属与非金属原子间能形成共价键。
( )(3)某元素的原子最外层只有一个电子,它跟卤素结合时,所形成的化学键一定是离子键。
( )答案:(1)× (2)√ (3)×2.(1)用电子式表示下列离子化合物: Na 2O 2、Na 2O 、MgCl 2、NaOH 、NH 4Cl 。
(2)用电子式表示下列物质: Cl 2、N 2、H 2O 、CO 2。
答案:(1)Na +[··O······O ······]2-Na +、Na +[··O ······]2-Na +、[··C l ······]-Mg 2+[··C l ······]-、Na +[··O ······H]-、[H ··N··H ··H]+[··C l ······]-。
(2)··C l ······C l ······、··N ⋮⋮N ··、H ··O ······H 、··O ······C····O ····。
名师点拨错误!(2016·最新调研题)二氯化二硫(S 2Cl 2)是广泛应用于橡胶工业的硫化剂,其分子结构如图所示。
常温下,S 2Cl 2遇水易水解,并产生能使品红溶液褪色的气体。
下列说法错误的是( ) A .S 2Cl 2的结构中各原子均达到8电子稳定结构 B .S 2Cl 2为含有极性键和非极性键的共价化合物C .若S 2Br 2与S 2Cl 2结构相似,则熔沸点:S 2Cl 2>S 2Br 2D .S 2Cl 2与H 2O 反应的化学方程式可能为2S 2Cl 2+2H 2O===SO 2↑+3S↓+4HCl[解析] 从S 2Cl 2的分子结构可知,硫原子之间形成1对共用电子对,每个硫原子与氯原子形成1对共用电子对,各原子均达到8电子稳定结构,A 正确;S 2Cl 2中S —S 键为非极性键,S —Cl 键为极性键,B 正确;对于由结构相似的分子组成的物质,其相对分子质量越大,熔沸点越高,C 错误;S 2Cl 2遇水易水解,并产生能使品红溶液褪色的气体,该气体为SO 2,在反应过程中硫元素一部分升高到+4价,一部分降低到0价,反应的化学方程式可能为2S 2Cl 2+2H 2O===SO 2↑+3S↓+4HCl ,D 正确。
[答案] C白磷、BF 3、PCl 3、PCl 5、H 2O 2等分子是否满足所有原子最外层为8电子稳定结构? 答案:白磷和PCl 3满足,BF 3、PCl 5、H 2O 2不满足。
判断分子中各原子是否达到8电子的稳定结构,主要有两种方法: (1)经验规律法凡符合最外层电子数+|化合价|=8的皆为8电子稳定结构。
(2)试写结构法判断某化合物中的某元素最外层是否达到8电子稳定结构,应从其结构式或电子式结合原子最外层电子数进行判断,如①H 2O :O 原子最外层有6个电子,H 2O 中每个O 原子又与两个H 原子形成两个共价键,所以H 2O 中的O 原子最外层有6+2=8个电子,但H 2O 中的H 原子最外层只有2个电子;②N 2:N 原子最外层有5个电子,N 与N 之间形成三个共价键,所以N 2中的N 原子最外层达到8电子稳定结构。
题组一 离子键、共价键概念辨析1.(2016·长春一中月考)下列说法正确的是( ) A .离子键就是使阴、阳离子结合成化合物的静电引力 B .含有离子键的化合物一定是离子化合物 C .所有金属与所有非金属之间都能形成离子键 D .在化合物Na 2O 2中,阴、阳离子的个数比为1∶1解析:选B 。
离子键就是使阴、阳离子结合成化合物的静电作用,包括静电吸引和静电排斥,A 错误;含有离子键的化合物一定是离子化合物,B 正确;有些金属与非金属之间不能形成离子键,如AlCl 3,C 错误;在化合物Na 2O 2中,阴、阳离子分别是O 2-2、Na +,个数比是1∶2,D 错误。
2.含有极性键且分子中各原子都满足8电子稳定结构的化合物是( ) A .CH 4 B .CH 2===CH 2 C .CO 2 D .N 2解析:选C 。
CH 4、CH 2===CH 2中氢不满足8电子稳定结构,A 、B 项错;N 2中只含有非极性键且为单质,D 项错。
题组二 电子式的书写3.(教材改编)写出下列物质的电子式。
(1)原子:Na :__________,Cl :__________。
(2)简单离子:Na +:________,F -:__________。
(3)复杂离子:NH +4:____________,OH -:____________。
(4)离子化合物MgF 2:____________,K 2O :____________, MgO :____________。
(5)非金属单质及共价化合物O 2:__________,H 2O 2:____________,CH 2===CH 2:____________。
(6)羟基:____________,甲基:____________。
答案:(1)Na· ··C l ···· · (2)Na +[··F ······]-(3)[H ··N··H··H]+[··O ······H]-(4)[··F ······]-Mg 2+[··F ······]-K +[··O ······]2-K + Mg 2+[··O ······]2-(5)··O······O ···· H ··O······O ······H H ··C,····C,··H(6)H ··O ···· · H ··C ··H·4.(2016·长沙高三模拟)下列表达方式正确的是( )A .CS 2的电子式:S ····C ····S B .MgCl 2的电子式:Mg 2+[··Cl ······]-2C .S 2-的结构示意图:D .中子数为20的氯原子:20Cl解析:选C 。
A 项S 原子未标出未成键电子;B 项两个Cl -要分开;D 项应为3717Cl 。
电子式书写时常见的错误(1)漏写未参与成键的电子,如N 2:N ⋮⋮N ,应写为··N ⋮⋮N ··。
(2)化合物类型不清楚,漏写或多写[ ]及错写电荷数,如NaCl :Na+··Cl ······;HF :H +[··F ······]-,应写为NaCl :Na +[··Cl ······]-;HF :H ··F ······。
(3)书写不规范,错写共用电子对,如N 2的电子式为 ··N ⋮⋮N ··;不能写成··N ······N ··,更不能写成··N····N ····或·N ···· N ···· ·。