
像质评价方法
一、几何像差曲线
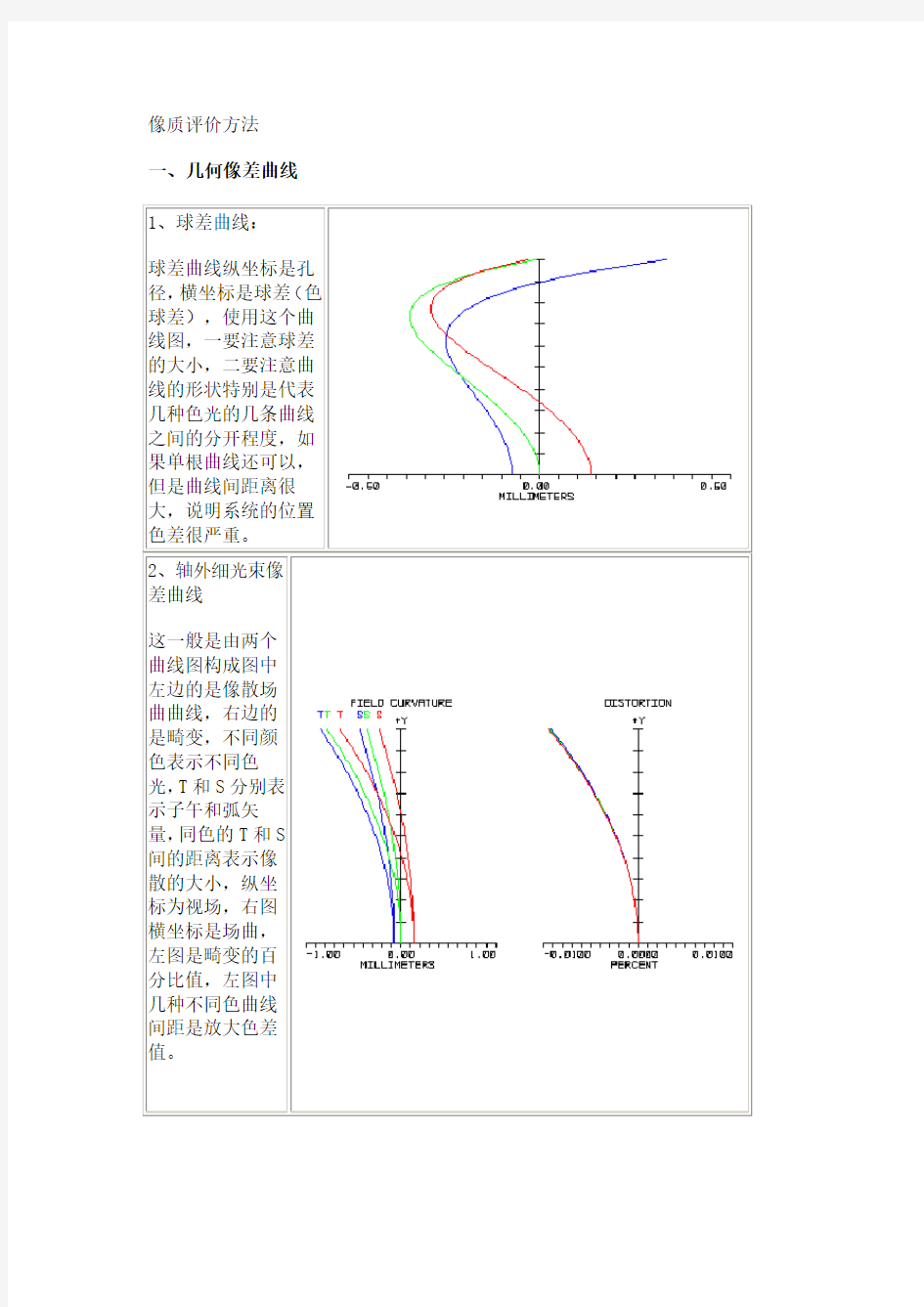
1、球差曲线:
球差曲线纵坐标是孔径,横坐标是球差(色球差),使用这个曲线图,一要注意球差的大小,二要注意曲线的形状特别是代表几种色光的几条曲线之间的分开程度,如果单根曲线还可以,但是曲线间距离很大,说明系统的位置色差很严重。
2、轴外细光束像
差曲线
这一般是由两个
曲线图构成图中
左边的是像散场
曲曲线,右边的
是畸变,不同颜
色表示不同色
光,T和S分别表
示子午和弧矢
量,同色的T和S
间的距离表示像
散的大小,纵坐
标为视场,右图
横坐标是场曲,
左图是畸变的百
分比值,左图中
几种不同色曲线
间距是放大色差
值。
二、点列图——光束的光亮度
由一点发出的许多光线经光学系统后,因像差使其与像面的交点不再集中于同一点,而形成了一个散布在一定范围的弥散图形,称为点列图。,点列图是在现代光学设计中最常用的评价方法之一。
图中的几个图分
别表示给定的几
个视场上不同光
线与像面交点的
分布情况。使用点
列图,一要注意下
方表格中的数值,
值越小成像质量
越好。二根据分布
图形的形状也可
了解系统的几何
像差的影响,如,
是否有明显像散
特征,或彗差特
征,几种色斑的分
开程度如何,有经
验的设计者可以根据不同的情况采取相应的措施。RMS RADIUS:均方根半径值;
GEO RADIUS:几何半径(最大半径)
三、传递函数
调制传递函数MTF:一定空间频率下像的对比度与物的对比度之比。能反映不同空间频率、不同对比度的传递能力。一般而言,高频传递函数反映了物体细节传递能力,低频传递函数反映物体轮廓传递能力,中频传递函数反映对物体层次的传递能力。
1、MTF曲线图
图中不同色的曲
线表示不同视场
的复色光(白光)
MTF曲线,T和S
分别表示子午和
弧矢方向,最上方
黑色的曲线是衍
射极限。横坐标是
空间频率lp/mm
(每毫米线对),
纵坐标是对比度,
最大是1。曲线越
高,表明成像质量
越好。
[返回本章要点]
2、传函与离焦关
系曲线图
此图表明对设定
空间频率不同视
场的子午、弧矢
MTF与离焦量的关
系,图中横坐标是
离焦量,纵坐标是
对比度,通过此图
可以看出各视场
的最佳焦面是否
比较一致,MTF是
否对离焦比较敏
感。此图在光学设
计后期,精细校正
时很有用。
四、波像差
1、光程差曲线
图中几个曲线图分别是不同视场子午和弧矢方向上的光程差,不同颜色表示不同色光。下方表格的数据为纵坐标(光程差)的最大值,单位一般用波长。
2、波面三维图
此图是设定视场和色光的波像差三维分布图,下方表格中的数字给出了波差的大小
PEAK TO VALLEY 波差的峰谷值(最大最小)
RMS 波差均方根值
3、干涉图
这是模拟系统波差在干涉仪上测出的干涉图图形。图中给出的是设定视场和色光的干涉图。
质性研究方法 一、质性研究方法的定义及特点 “质性研究”这个词在台湾、港、澳地区用得比较多,在大陆有的称其为“质的研究”、“质化研究”;还有的为将其与定性研究、定量研究相比较,称为“定质研究”。 1.质性研究的定义 所谓质性研究,就是“以研究者本人为研究工具、在自然情境下采用多种资料收集方法对社会现象进行整体性探究、使用归纳法分析资料和形成理论、通过与研究对象互动对其行为和意义建构获得解释性理解的一种活动”。 2.质性研究的特点: 1)自然主义的探究传统 质性研究是在自然情境下,研究者与被研究者直接接触,通过面对面的交往,实地考察被研究者的日常生活状态和过程,了解被研究者所处的环境以及环境对他们产生的影响。自然探究的传统要求研究者注重社会现象的整体性和关系性。在对一个事件进行考察时,不仅要了解事件本身,而且要了解事件发生和变化时的社会文化背景以及对该实践与其他事件之间的联系。 2)对意义的“解释性理解”
质性研究的主要目的是对被研究者的个人经验和意义建构作“解释性理解”,从他们的角度理解他们的行为及其意义解释。由于理解是双方互动的结果,研究者需要对自己的“前设”和“偏见”进行反省,了解自己与对方达到理解的机制和过程。 3)研究是一个演化的过程 随着实际情况的变化,研究者要不断调整自己的研究设计,收集和分析资料的方法,建构理论的方式。因此对研究的过程必须加以细致的反省和报道。 4)使用归纳法,自下而上分析资料 质性研究中的资料分析主要采纳归纳的方法,自下而上在资料的基础上建立分析类别和理论假设,然后通过相关检验得到充实和系统化。因此,“质性研究”的结果只适用于特定的情境和条件,不能推广到样本之外。 5)重视研究关系 由于注重解释性理解,质性研究对研究者与被研究者之间的关系非常重视,特别是伦理道德问题。研究者必须事先征求被研究者的同意,对他们所提供的信息严格保密,与他们保持良好的关系,并合理回报他们所给予的帮助。 “质性研究”就是一种“情境中”的研究。质性研究的特点决定了这是一种非常适合教育领域的研究。 3.质性研究与量的研究的区别:(只说黑体字)
蛋白质的测定方法 测定食物中的蛋白质含量有二种方法,一是凯氏微量法,二是自动定氮分析法。 一.凯氏微量法 有手工滴定定氮和自动定氮仪定氮,实验者可根据经济条件设备而定。 1.原理 蛋白质是含氮的有机化合物。食品与硫酸和催化剂一同加热消化,使蛋白质分解,分解的氨与硫酸结合生成硫酸铵。然后碱化蒸馏使氨游离,用过量硼酸吸收后再以硫酸或盐酸标准溶液滴定,根据酸的消耗量乘以换算系数,即为蛋白质含量。 2NH2(CH2)2COOH+13H2SO4 (NH4)2SO4+6CO2+12SO2+16H2O (NH4)2SO4+2NaOH 2NH3+2H2O+Na2SO4 2.方法 本法参照GB 5009.5 -85 适用于各类食品及饲料中蛋白质的测定 3.试剂 所有试剂均用不含氨的蒸馏水配制。试剂均为分析纯。 3.1硫酸铜 3.2硫酸钾 3.3浓硫酸 3.4 2%硼酸溶液(或1%的硼酸) 3.5 混合指示剂:1份0.1%甲基红乙醇溶液与5份0.1%溴甲酚绿乙醇溶液临用时混合。也可用2份0.1%甲基红乙醇溶与1份0.1%次甲基蓝乙醇溶液临用时混合。 3.6饱和氢氧化钠:500g氢氧化钠加入500ml水中,搅拌溶解,冷却后放置数日,澄清后使用。 3.7 0.01mol/L或0.05mol/L盐酸标准溶液:需标定后使用(配制及标定方法见附录) 4.仪器 消化炉凯氏定氮蒸馏装置万分之一电子天平 凯氏定氮蒸馏装置:如图所示 5. 操作步骤 5.1样品处理:精密称取0.1~2.0g固体样品或2~5g半固体样品或吸取液体样品5~20ml,放入100ml或500ml凯氏烧瓶中,加入0.2g硫酸铜,0.3g硫酸钾及3~20ml浓硫酸,放置过夜后小心加热,待内容物全部炭化,泡沫完全停止后,加强火力,并保持瓶内液体微沸,至液体呈蓝绿色澄清透明后,取下放冷后用约2~10ml蒸馏水冲洗瓶壁,混匀后继续加热至液体呈蓝绿透明,取下放冷,小心加10~20ml水混匀,放冷后,移入100ml容量瓶中,并用少量水洗定氮瓶,洗液并入容量瓶中,再加水至刻度,混匀备用。取与处理样品相同量的硫酸铜、硫酸钾、硫酸按同一方法做试剂空白实验。 5.2按图装好定氮装置,于水蒸气发生瓶内装水至约2/3处,加甲基红指示液数滴及数毫升硫酸,以保持水呈酸性,加入数粒玻璃珠以防暴沸,加热煮沸水蒸气发生瓶内的水。 5.3向接收瓶内加入10ml ,1~2%硼酸溶液及混合指示液1滴,并使冷凝管的下端插入液面下,吸取10ml样品消化稀释液由小玻璃杯流入反应室,并以10ml水洗涤小烧杯使之流入反应室内,塞紧小玻璃杯的棒状玻璃塞。将3~10ml饱和氢氧化钠溶液倒入小玻璃杯中,提起玻璃塞使其缓缓流入反应室,立即将玻璃塞盖紧,并加水于小玻璃杯中以防漏气。加紧螺旋夹,开始蒸馏。蒸气通入反应室使氨通过冷凝管而进入接收瓶内,蒸馏2min,移动接收瓶,使冷凝管下端离开液面,然后用少量中性水冲洗冷凝管下端外部,再蒸馏1min取下接收瓶,以0.01或0.05mol/L盐酸标准溶液滴定至灰色或蓝紫色为终点。 同时吸取10ml试剂空白消化液按5.3操作。 6. 计算
蛋白质含量测定方法的比较及肽含量的测定 (一)蛋白质测定方法的比较(原理、优缺点)蛋白质含量测定法,目前包括定氮法、双缩脲法、福林酚法(Lowry 法)和紫 外吸收法、考马斯亮蓝法。其中考马斯亮蓝和福林酚法灵敏度最高,比紫外吸收法灵敏10~20 倍,比双缩脲法灵敏100倍以上。定氮法较复杂,但准确,往往以定氮法测定的蛋白质作为其他方法的标准蛋白质。在选择方法时应该考虑:(1)实验测定要求的灵敏度和精确度;(2)蛋白质的性质;(3)溶液中存在的干扰物质;(4)测定花费时间。蛋白质含量测定法,目前包括定氮法、双缩脲法、福林酚法(Lowry 法)和紫外吸收法、考马斯亮蓝法。其中考马斯亮蓝和福林酚法灵敏度最高,比紫外吸收法灵敏10~20 倍,比双缩脲法灵敏100倍以上。定氮法较复杂,但准确,往往以定氮法测定的蛋白质作为其他方法的标准蛋白质。在选择方法时应该考虑:(1)实验测定要求的灵敏度和精确度;(2)蛋白质的性质;(3)溶液中存在的干扰物质;(4)测定花费时间。 1 微量凯氏定氮法(GB 5009.5-2010) 1.1原理样品与浓硫酸共热。含氮有机物即分解产生氨(消化),氨又与硫酸作用,变成硫酸氨。经强碱碱化使之分解放出氨,借蒸汽将氨蒸至酸液中,根据此酸液被中和的程度可计算得样品之氮含量。 1.2操作方法样品经前处理、炭化、消化、蒸馏、滴定等主要步骤 1.3特点准确度较高,适用于0.2~ I.Omg氮,误差为土2%;操作复杂费时,整个过程需要耗时8~10h,试剂消耗量大。,测得结果为总氮含量,包括蛋白氮和非蛋白氮含 量;适用范围广,几乎所有样品均可用此方法。 2双缩脲比色法
质性研究方法考试重点总结 第二章质性研究的抽样策略 抽样方法;极端或偏离标准的个案抽样;最大变异抽样;同质性群体抽样 ;典型案例抽样 ;关键个案抽样;标准抽样;分层目的性抽样;滚雪球抽样或链式抽样;机会抽样;方便抽样;志愿者抽样;三角交叉捡视抽样 第四章:焦点团体 焦点团体访谈定义:以描述和理解一组选定人群的观点和信念为预定目的,从小组参与者的观点中获得对特殊事件的理解。焦点团体访谈的参与者(一般为6至10个)都有相似的社会和文化背景,或有相似的经历,或相似的关注。 焦点群体访谈具有的特征:能进行深入交流;交流重点在感兴趣的某一特定领域;互动是焦点团体访谈独特的性质;协调员在应用焦点团体方法中获得良好而准确信息的过程中起着主要作用;参与者通常拥有相似的社会和文化经历。 焦点团体适用的情形:焦点团体是用于研究的;研究是集中的;参与者在团体中作为团体被访谈。 为什么使用焦点团体: 1、当研究者对参与者的了解不深时 2、当研究者希望探求人们的知识和经历时 3、适合于检测“敏感”问题或研究中涉及的“敏感”人群 4、被应用于反应边缘群体的呼声。 焦点团体的使用领域: ●健康问题的探索性研究 ●检测对新项目的接受度和相关想法 ●解决特别项目的问题 ●评估健康方案。 焦点团体不应使用在以下情况: ●不适合小组讨论的议题 ●参与者在讨论这个话题时很困难 ●要求统计数据。 焦点团体作为方法 1、作为一种“自我包涵”的方式使用,主要用于原始资料的收集。 2、焦点团体作为资料源的“补充”方式使用。 3、焦点团体被用于“多种方式”研究中。 怎样招募参与者:随机电话筛选;滚雪球式;现存的清单;现场招募;推荐式 成功的焦点团体的决定因素: ●范围:成功的焦点团体应覆盖最多的相关事件 ●特征:焦点团体访谈尽可能提供参与者的经历和观点。 ●深度:焦点团体访谈应鼓励互动,以便提高对参与者更深层次的探索。 ●个体背景:考虑参与者反应产生的背景。 ●合适的环境:自然环境与社会政治环境。合适的会议场所,双方没有在 胁迫冲突下进行。 ●充足的资源 ●合适的参与者 ●熟练的协调员 ●有效的问题 焦点团体访谈优点与局限性 ●可以让研究人员快速地从参与者中探求更有深度的信息 ●获得对敏感对象的深度了解,如卫生服务,社区健康干预 ●收集边缘群体资料 ●通过小组成员的互动以产生信息。 局限: ●焦点团体获得的信息仅代表了参与者的观点,不具有普遍性。 ●定性的角度,不能从焦点团体中收集统计学资料。 ●受团体的互动与时间限制,不能探索个人复杂的信念与习惯。 ●获得的信息可能不准确。 ●研究者驱动,反映了研究者兴趣,存在偏倚。 第五章非干预性研究方法 定义:是一种无干预和反应的研究方法。它从现存的资料,如文字记录、视听材料、自然痕迹或人们的行为中提取社会和文化意义。,它不需要其他参与者的主动参与,被研究者的社会环境不受到打扰。 包括行为踪迹研究、档案研究、伪装监视和自然实验等。 为什么要运用非干预性研究法 1.由于个人的、社会的、文化的或政治上的种种原因,他们可能言行不一致。 2.可用于其他质性研究收集资料的补充方法。 3.作为一种自控性的方法,可以凭借惊人的洞察力来获取信息 非干预性研究方法的优点与局限性 ●非干预性研究法比人们的报告更能精确地反映人们的行为●非干预性研究法是非反应性和非干预性的。 ●非干预性研究法具有可重复性。 ●非干预性研究法获得资料更简便。 ●非干预性研究法花钱不多。 ●非干预性研究法特别适合需要长期追踪人们行为的纵向调查。局限 ●非干预性研究法减少了研究双方表达个人主见的可能。 ●记录人员的偏见,原始的记录可能被歪曲或不全面。 ●非干预性研究法中的信息有可能因为干涉变量存在而被曲解●非干预性研究法倾向于一种单纯的方法。 第八章民族志 定义:用于发现和描述个人或群体社会文化的研究方法,对团体或文化进行科学和艺术的描述,其核心是以本地人的观点来理解另外一种生活方式。主要特征: ●主要集中于探索特殊社会现象的本质;
蛋白质的测定方法比较 一、分光光度法 1、测定原理: 食品中的蛋白质在催化加热条件下被分解,分解产生的氨与硫酸结合生成硫酸铵,在pH 4.8 的乙酸钠-乙酸缓冲溶液中与乙酰丙酮和甲醛反应生成黄色的3,5-二乙酰-2,6-二甲基-1,4-二氢化吡啶化合物。在波长400 nm 下测定吸光度值,与标准系列比较定量,结果乘以换算系数,即为蛋白质含量。 2、测定步骤: ①试样消解:称取经粉碎混匀过40目筛的固体试样0.1g~0.5g(精确0.001g)、半固体试样0.2g~1g(精确至0.001g)或液体试样1g~5g(精确0.001g),移入干燥的100 mL 或250 mL 定氮瓶中,加入0.1 g硫酸铜、1 g 硫酸钾及5 mL 硫酸,摇匀后于瓶口放一小漏斗,将定氮瓶以45°角斜支于有小孔的石棉网上。缓慢加热,待内容物全部炭化,泡沫完全停止后,加强火力,并保持瓶内液体微沸,至液体呈蓝绿色澄清透明后,再继续加热半小时。取下放冷,慢慢加入20 mL 水,放冷后移入50 mL 或100 mL容量瓶中,并用少量水洗定氮瓶,洗液并入容量瓶中,再加水至刻度,混匀备用。按同一方法做试剂空白试验。 ②试样溶液的制备:吸取2.00 mL~5.00 mL 试样或试剂空白消化液于50 mL 或100 mL 容量瓶内,加1 滴~2 滴对硝基苯酚指示剂溶液,摇匀后滴加氢氧化钠溶液中和至黄色,再滴加乙酸溶液至溶液无色,用水稀释至刻度,混匀。 ③标准曲线的绘制:吸取0.00 mL、0.05 mL、0.10 mL、0.20 mL、0.40 mL、0.60 mL、0.80 mL 和1.00 mL 氨氮标准使用溶液(相当于0.00μg、5.00μg、10.0μg 、20.0μg、40.0μg、60.0μg、80.0μg 和100.0μg 氮),分别置于10 mL 比色管中。加4.0 mL 乙酸钠-乙酸缓冲溶液及4.0 mL 显色剂,加水稀释至刻度,混匀。置于100 ℃水浴中加热15 min。取出用水冷却至室温后,移入1 cm 比色杯内,以零管为参比,于波长400 nm 处测量吸光度值,根据标准各点吸光度值绘制标准曲线或计算线性回归方程。 ④试样测定:吸取0.50 mL~2.00 mL(约相当于氮<100μg)试样溶液和同量的试剂空白溶液,分别于10 mL 比色管中。以下按上述中“加4 mL 乙酸钠-乙酸
实验二ZEMAX 中的像质评价方法 一、实验目的 了解ZEMAX的各种像质评价方法。 二、ZEMAX的像质评价方法 ZEMAX提供丰富的像质评价指标,现结合D=0.5,相对孔径1/4、视场94°的1/6英寸CCD 广角物镜色合计参数,将主要评价结果介绍如下。 表3-1 广角物镜结构参数 序号半径R 间隔d 玻璃外径D 1 ∞0.6 K9 1.6 2 1.109 0.6 0.9 3 3.448 1.0 LAK3 1.1 4 -18.70 5 0.5 1.1 5 光阑0.1 0.35 6 -2.89 1.0 LAK3 0.41 7 -1.7 0.1 1.1 8 2.29 1.0 K9 1.1 9 -1.7378 0.6 ZF7 1.1 10 -14.791 1.1 1、几何像差曲线 (1)球差曲线(Longitudinal Aberration) 纵坐标是孔径,横坐标是球差(色球差)。 (2)焦点色位移(Focal Shift) 表示的是系统工作波长范围内不同波长的色光近焦距位移。横坐标表示焦点位移,纵坐标为不同色光的波长, 整个图形以主波长的近轴焦点为参考基准。 (3)轴外细光束像差曲线(Field Curv/Dist) 左图为像散场曲曲线,右图为畸变曲线,纵坐标为视场,左图横坐标是场曲,右图是畸变的百分比值。 (4)子午光束与弧矢光束垂轴像差曲线(Ray Fan) 横坐标表示光束孔径高度,纵坐标表示垂轴像差,EY表示δy′(子午),EX表示δz′(弧矢)。(5)垂轴色差(倍率色差)(Lateral Color) 横坐标表示不同色光与参考色光像高的像差,纵坐标表示视场。图中两条AIRY表示的曲线为艾里斑范围。 2、点列图(Spot Diagram) 点列图下方给的数可以看出每个视场的RMS RADIUS(均方根半径值)、AIRY光斑半径、GEO RADIUS为几何半径(最大半径),值越小成像质量越好。 另外根据分布图形的形状也可了解系统的各种几何像差的影响,如是否有明显像散或彗差特征,几种色斑的分开程度如何等。 3、波像差 (1)光程差曲线(OPD Fan) 表示每个视场的子午和弧矢方向上的光程差。横坐标表示光束孔径大小,纵坐标表示光程差。(2)波面三维图(Wavefront Map)
质性研究方法有哪些 推荐于2017-09-14 18:28:17 最佳答案 一、质性研究方法的定义及特点 “质性研究”这个词在台湾、港、澳地区用得比较多,在大陆有的称其为“质的研究”、“质化研究”;还有的为将其与定性研究、定量研究相比较,称为“定质研究”。 1.质性研究的定义 所谓质性研究,就是“以研究者本人为研究工具、在自然情境下采用多种资料收集方法对社会现象进行整体性探究、使用归纳法分析资料和形成理论、通过与研究对象互动对其行为和意义建构获得解释性理解的一种活动”。 2.质性研究的特点: 1) 自然主义的探究传统 质性研究是在自然情境下,研究者与被研究者直接接触,通过面对面的交往,实地考察被研究者的日常生活状态和过程,了解被研究者所处的环境以及环境对他们产生的影响。自然探究的传统要求研究者注重社会现象的整体性和关系性。在对一个事件进行考察时,不仅要了解事件本身,而且要了解事件发生和变化时的社会文化背景以及对该实践与其他事件之间的联系。 2) 对意义的“解释性理解” 质性研究的主要目的是对被研究者的个人经验和意义建构作“解释性理解”,从他们的角度理解他们的行为及其意义解释。由于理解是双方互动的结果,研究者需要对自己的“前设”和“偏见”进行反省,了解自己与对方达到理解的机制和过程。 3) 研究是一个演化的过程 随着实际情况的变化,研究者要不断调整自己的研究设计,收集和分析资料的方法,建构理论的方式。因此对研究的过程必须加以细致的反省和报道。 4) 使用归纳法,自下而上分析资料 质性研究中的资料分析主要采纳归纳的方法,自下而上在资料的基础上建立分析类别和理论假设,然后通过相关检验得到充实和系统化。因此,“质性研究”的结果只适用于特定的情境和条件,不能推广到样本之外。 5) 重视研究关系 由于注重解释性理解,质性研究对研究者与被研究者之间的关系非常重视,特别是伦理道德问题。研究者必须事先征求被研究者的同意,对他们所提供的信息严格保密,与他们保持良好的关系,并合理回报他们所给予的帮助。 “质性研究”就是一种“情境中”的研究。质性研究的特点决定了这是一种非常适合教育领域的研究。 如何选择研究的方法 从实际操作的层面看,研究方法主要由如下几个方面组成:进入现场的方式、收集资料的方法、整理和分析资料的方法、建构理论的方式、研究结果的成文方式。 这是相对定量研究而言。质性研究实际上并不是一种方法,而是许多不同研究方法的统称,其中包含但不限于民族志研究、论述分析、访谈研究、实地调查、参与式观察等。
蛋白质测定方法——化学报告
蛋白质的检测 酚试剂法灵敏度较高 20~250mg 费时蛋白质在碱性溶 液中其肽键与 Cu2+螯合,形成 蛋白质一铜复合 物,此复合物使 酚试剂的磷钼酸 还原,产生蓝色 化合物 酚类、柠檬 酸、硫酸铵、 tris缓冲液、 甘氨酸、糖 类、甘油等均 有干扰作用 由上表可大致了解五种检测蛋白质的方法,下面以实验的形式进行详细阐述:
1 材料与方法 1.1 仪器材料 (1)仪器:凯氏定氮仪、紫外分光光度计、可见光分光光度计、工作离心机、布氏漏斗、抽滤泵。 (2)试剂及原材料:牛奶、酸奶、豆浆、0.12mol/LpH=4. 7醋酸- 醋酸钠缓冲液、乙醇-乙醚等体积混合液、浓H2SO4 、40%氢氧化钠、30%过氧化氢、2%硼酸溶液、0. 050molPL标准盐酸溶液、硫酸钾- 硫酸铜接触剂、混合指示剂、标准蛋白溶液、双缩脲试剂、考马斯亮蓝G- 250试剂。 1.2 实验方法 (1)凯氏定氮法测定蛋白质含量 将待测样品与浓硫酸共热,含氮有机物即分解产生氨(消化) ,氨又与硫酸作用,变成硫酸铵。为了加速消化,可以加入CuSO4 作催化剂和加入K2SO4 以提高溶液的沸点,而加入30%过氧化氢有利于消化溶液的澄清。消化好的样品在凯氏定氮仪内经强碱碱化使之分解放出氨,借蒸汽将氨蒸至定量硼酸溶液中,然后用标准盐酸溶液进行滴定,记录,计算出样品含氮量。每个样品做三次重复测定,取平均值。 (2)紫外吸收法测定蛋白质含量 蛋白质分子中,酪氨酸、苯丙氨酸和色氨酸残基的苯环含有共轭双键,使蛋白质具有吸收紫外光的性质,吸收峰在280nm处,其吸光度(即光密度值)与蛋白质含量成正比。此外,蛋白质溶液在238nm的光吸收值与肽键含量成正比。利用一定波长下,蛋白质溶液的光吸收值与蛋白质浓度的正比关系,可以进行蛋白质含量的测定。 紫外吸收法简便、灵敏、快速,不消耗样品,测定后仍能回收使用。低浓度的盐,例如, 生化制备中常用的(NH4)2SO4 等和大多数缓冲液不干扰测定,特别适用于柱层析洗脱液的快速连续检测,因为此时只需测定蛋白质浓度的变化,而不需知道其绝对值。 此法的特点是测定蛋白质含量的准确度较差,干扰物质较多,在用标准曲线法测定蛋白质含量时,对那些与标准蛋白质中酪氨酸和色氨酸含量差异大的蛋白质有一定的误差,故该法适于用测定与标准蛋白质氨基酸组成相似的蛋白质。若样品中含有嘌呤、嘧啶及核酸等吸收紫外光的物质,会出现较大的干扰。核酸的干扰可以通过查校正表,再进行计算的方法加以适当的校正。但是因为不同的蛋白质和核酸的紫外吸收是不相同的,虽然经过校正,测定的结果还是存在一定的误差。 此外,进行紫外吸收法测定时,由于蛋白质吸收高峰常因pH的改变而有变化,因此要注意溶液的pH值,测定样品时的pH要与测定标准曲线的pH相一致。取待测样品制成蛋白浓度大约在0. 1~1. 0mgPmL的蛋白质溶液,用紫外分光光度计进行比色,对照标准曲线得出样品含氮量。每个样品做3次重复测定,取平均值。 (3)双缩脲法测定蛋白质含量
蛋白质含量测定主要有五种方法,分别是凯式定氮法、双缩脲法、紫外吸收法、酚试剂法和考马斯亮蓝法。这五种方法各有特点,优缺点明确。 凯氏定氮法 蛋白质是含氮的化合物。食品与浓硫酸和催化剂共同加热消化,使蛋白质分解,产生的氨与硫酸结合生成硫酸铵,留在消化液中,然后加碱蒸馏使氨游离,用硼酸吸收后,再用盐酸标准溶液滴定,根据酸的消耗量来乘以蛋白质换算系数,即得蛋白质含量。因为食品中除蛋白质外,还含有其它含氮物质,所以此蛋白质称为粗蛋白。 优点:重现性好,是目前分析有机化合物含氮量常用的方法,是一种蛋白质测定的经典方法, ,测试结果准确。 缺点:操作比较繁复,费时,试剂消耗量大。且此法测定的蛋白质含量实际上包括了核酸,生物碱,含氮类脂,卟啉,含氮色素等非蛋白质含氮化合物。双缩脲定氮法 双缩脲(NH3CONHCONH3)是两个分子脲经180℃左右加热,放出一个分子氨后得到的产物。在强碱性溶液中,双缩脲与CuSO4形成紫色络合物,称为双缩脲反应。凡具有两个酰胺基或两个直接连接的肽键,或能过一个中间碳原子相连的肽键,这类化合物都有双缩脲反应。紫色络合物颜色的深浅与蛋白质浓度成正比,而与蛋白质分子量及氨基酸成分无关,故可用来测定蛋白质含量。测定范围为1~10mg蛋白质。干扰这一测定的物质主要有:硫酸铵、Tris缓冲液和某些氨基酸等。 优点:较快速,不同的蛋白质产生颜色的深浅相近,以及干扰物质少。主要的缺点是灵敏度差。因此双缩脲法常用于需要快速,但并不需要十分精确的蛋
白质测定。 缺点:不太灵敏;不同蛋白质显色相似。 紫外吸收定氮法 双缩脲法是传统的分光光度法测定蛋白质的方法,当含有两个或者两个以上肽键的物质和碱性的硫酸铜反应时,形成紫色的络合物,这个颜色产物是肽键中的氮原子和铜离子配价结合的结果。蛋白质分子中,酪氨酸、苯丙氨酸和色氨酸残基的苯环含有共轭双键,使蛋白质具有吸收紫外光的性质。形成颜色产物的量取决于蛋白质的浓度。实际测定时,必须预先用标准蛋白质溶液制作一个标准校正曲线,通常用牛血清白蛋白水溶液做蛋白质标准溶液。不同浓度的标准蛋白质溶液加入双缩脲试剂后,反应生成的颜色产物用紫外-可见分光光度计在540nm 波长下测定吸光度,以双缩脲试剂加缓冲或水作空白对照。然后将测得的值分别对蛋白浓度(mg/ ml) 作图,得标准曲线。未知蛋白样品用双缩脲试剂做同样处理,根据测得吸光度值在标准曲线上直接查得未知蛋白质样品中得蛋白质浓度。 优点:对各种蛋白质呈色基本相同;特异性和准确度好,精密度好;呈色稳定性好,试剂单一,方法简便。快速,不消耗样品,测定后仍能回收使用。 缺点:准确度较差,干扰物质多,在用标准曲线法测定蛋白质含量时,对那些与标准蛋白质中酪氨酸和色氨酸含量差异大的蛋白质,有一定的误差。故该法适于用测定与标准蛋白质氨基酸组成相似的蛋白质。若样品中含有嘌呤、嘧啶及核酸等吸收紫外光的物质,会出现较大的干扰。核酸的干扰可以通过查校正表,再进行计算的方法,加以适当的校正。但是因为不同的蛋白质和核酸的紫外吸收是不相同的,虽然经过校正,测定的结果还是存在一定的误差。此外,进行紫外
实验二食品中蛋白质的测定方法 Method for determination of protein in foods (一)目的 掌握凯氏定氮法测定食品中蛋白质的原理、步骤,了解蛋白质系数在蛋白质含量计算中的应用。 (二)原理 蛋白质是含氮的有机化合物。食品与硫酸和催化剂一同加热消化,使蛋白质分解,分解的氨与硫酸结合生成硫酸铵。然后碱化蒸馏使氨游离,用硼酸吸收后再以硫酸或盐酸标准溶液滴定,根据酸的消耗量乘以换算系数,即为蛋白质含量。其反应式如下: 2NH2((CH2)2COOH+13H2SO4→(NH4)2SO4+6CO2+12SO2+16H2O (NH4)2SO4+2NaOH→2NH3+Na2SO4+2H2O 2NH3+4H3BO3→(NH4)2B4O7+5H2O (NH4)2B4O7+2HCl+5H2O→2NH4Cl+4H3BO3 (三)仪器与试剂 所用试剂均用不含氨的蒸馏水配制。 1.硫酸铜。 2.硫酸钾。 3.硫酸。 4.2%硼酸溶液。 5.混合指示液:1份0.1%甲基红乙醇溶液与5份0.1%溴甲酚绿乙醇溶液临用时混合。也可用2份0.1%甲基红乙醇溶液与1份0.1%次甲基蓝乙醇溶液临用时混合。 6.40%氢氧化钠溶液。 7.硫酸标准滴定溶液[c(1/2H2SO4)=0.0500mol/L]或盐酸标准滴定溶液[c(HCl)=0.0500mol/L]。 8. 仪器 定氮蒸馏装置(如图1-2),微量滴定管。 铰肉机:篦孔径不超过4nm。 组织捣碎机。
粉碎机。 图1常量蒸馏装置 1—电炉;2—蒸汽发生瓶;3—大气夹;4—螺旋夹;5—加碱漏斗;6—凯氏 烧瓶; 7—氮素球;8—冷凝管;9—接收瓶;10—塑料管 图2微量蒸馏装置 1—电炉;2—蒸汽发生器;3—大气夹;4—螺旋夹;5—小玻璃杯;
像质评价方法 一、几何像差曲线 1、球差曲线: 球差曲线纵坐标是孔径,横坐标是球差(色球差),使用这个曲线图,一要注意球差的大小,二要注意曲线的形状特别是代表几种色光的几条曲线之间的分开程度,如果单根曲线还可以,但是曲线间距离很大,说明系统的位置色差很严重。 2、轴外细光束像 差曲线 这一般是由两个 曲线图构成图中 左边的是像散场 曲曲线,右边的 是畸变,不同颜 色表示不同色 光,T和S分别表 示子午和弧矢 量,同色的T和S 间的距离表示像 散的大小,纵坐 标为视场,右图 横坐标是场曲, 左图是畸变的百 分比值,左图中 几种不同色曲线 间距是放大色差 值。
二、点列图——光束的光亮度 由一点发出的许多光线经光学系统后,因像差使其与像面的交点不再集中于同一点,而形成了一个散布在一定范围的弥散图形,称为点列图。,点列图是在现代光学设计中最常用的评价方法之一。 图中的几个图分 别表示给定的几 个视场上不同光 线与像面交点的 分布情况。使用点 列图,一要注意下 方表格中的数值, 值越小成像质量 越好。二根据分布 图形的形状也可 了解系统的几何 像差的影响,如, 是否有明显像散 特征,或彗差特 征,几种色斑的分 开程度如何,有经 验的设计者可以根据不同的情况采取相应的措施。RMS RADIUS:均方根半径值; GEO RADIUS:几何半径(最大半径) 三、传递函数 调制传递函数MTF:一定空间频率下像的对比度与物的对比度之比。能反映不同空间频率、不同对比度的传递能力。一般而言,高频传递函数反映了物体细节传递能力,低频传递函数反映物体轮廓传递能力,中频传递函数反映对物体层次的传递能力。
蛋白质含量测定 院系名称食品与生物工程学院学生姓名孙洪磊 学号200606021064 专业班级生工06 - 2 指导教师马美范 二○○九年四月一日
蛋白质含量测定方法比较 蛋白质含量测定法,是生物化学研究中最常用、最基本的分析方法之一。目前常用的有四种古老的经典方法,即定氮法,双缩尿法(Biuret法)、Folin-酚试剂法(Lowry法)和紫外吸收法。另外还有一种近十年才普遍使用起来的新的测定法,即考马斯亮蓝法(Bradford法)。其中Bradford法和Lowry法灵敏度最高,比紫外吸收法灵敏10~20倍,比Biuret法灵敏100倍以上。定氮法虽然比较复杂,但较准确,往往以定氮法测定的蛋白质作为其他方法的标准蛋白质。值得注意的是,这后四种方法并不能在任何条件下适用于任何形式的蛋白质,因为一种蛋白质溶液用这四种方法测定,有可能得出四种不同的结果。每种测定法都不是完美无缺的,都有其优缺点。在选择方法时应考虑:①实验对测定所要求的灵敏度和精确度;②蛋白质的性质;③溶液中存在的干扰物质;④测定所要花费的时间。考马斯亮蓝法(Bradford法),由于其突出的优点,正得到越来越广泛的应用。 一、双缩脲法(Biuret法) (一)实验原理 双缩脲(NH3CONHCONH3)是两个分子脲经180℃左右加热,放出一个分子氨后得到的产物。在强碱性溶液中,双缩脲与CuSO4形成紫色络合物,称为双缩脲反应。凡具有两个酰胺基或两个直接连接的肽键,或能过一个中间碳原子相连的肽键,这类化合物都有双缩脲反应。 紫色络合物颜色的深浅与蛋白质浓度成正比,而与蛋白质分子量及氨基酸成分无关,故可用来测定蛋白质含量。测定范围为1~10mg蛋白质。干扰这一测定的物质主要硫酸铵、Tris缓冲液和某些氨基酸等。 (二)试剂与器材 1. 试剂:(1)标准蛋白质溶液:用标准的结晶牛血清清蛋白(BSA)或标准酪蛋白,配制成10mg/ml的标准蛋白溶液,可用BSA浓度1mg/ml的A280为0.66来校正其纯度。如有需要,标准蛋白质还可预先用微量凯氏定氮法测定蛋白氮含量,计算出其纯度,再根据其纯度,称量配制成标准蛋白质溶液。牛血清清蛋白用H2O 或0.9%NaCl配制,酪蛋白用0.05N NaOH配制。(2)双缩脲试剂:称以1.50克硫酸铜(CuSO4?5H2O)和6.0克酒石酸钾钠(KNaC4H4O6?4H2O),用500毫升水溶解,在搅拌下加入300毫升10% NaOH溶液,用水稀释到1升,贮存于塑料瓶中(或内壁涂以石蜡的瓶中)。 此试剂可长期保存。若贮存瓶中有黑色沉淀出现,则需重新配制。 2. 器材:可见光分光光度计、大试管15支、旋涡混合器等。 (三)操作方法 1. 标准曲线的测定:取12支试管分两组,分别加入0,0.2,0.4,0.6,0.8,1.0毫升的标准蛋白质溶液,用水补足到1毫升,然后加入4毫升双缩脲试剂。充分摇匀后,在室温(20~25℃)下放置30分钟,于540nm处进行比色测定。用未加蛋白质溶液的第一支试管作为空白对照液。取两组测定的平均值,以蛋白质的含量为横 座标,光吸收值为纵座标绘制标准曲线。 2、样品的测定:取2~3个试管,用上述同样的方法,测定未知样品的蛋白质浓度。注意样品浓度不要超过10mg/ml。 二、Folin—酚试剂法(Lowry法) (一)实验原理
几种蛋白质含量测定方法的比较 【摘要】:蛋白质含量测定方法,是生物化学研究中最常用、最基本的分析之一。目前常 用的方法有凯氏定氮法、双缩脲法(Biuret)、紫外吸收法、考马斯亮蓝法(Bradford),Folin —酚试剂法(Lowry)杜马斯燃烧法。其中Bradford 法灵敏度颇高,比紫外吸收法灵敏10~20 倍,比Biuret法灵敏100 倍以上。凯氏定氮法虽然比较复杂,但较准确,往往以定氮法测定的蛋白质作为其他方法的标准蛋白质。过去Folin—酚试剂法法是应用最广泛的一种方法,由于其试剂乙的配制较为困难(现在已可以在本公司订购),近年来逐渐被考马斯亮兰法所取代。测定农产品中全氮的凯氏定氮法在许多国家已被杜马斯然烧定氮法所代替,杜马斯燃烧法是基于在高温下(大约 900 ℃),通过控制进氧量、氧化消解样品的原理而进行氮测定的。这6种方法并不能在任何条件下适用于任何形式的蛋白质,每种方法都有其优缺点,在选择方法时应考虑:⑴实验对测定所要求的灵敏度和精确度;⑵蛋白质的性质;⑶溶液中存在的干扰物质;⑷测定所要花费的时间 【关键词】:凯氏定氮法双缩脲法紫外吸收法考马斯亮蓝法 Folin—酚试剂法杜马斯燃烧法 一、凯氏定氮法 1.1原理 凯氏定氮法测定蛋白质分为样品消化、蒸馏、吸收和滴定4 个过程。其原理是样品中含氮有机化合物与浓硫酸在催化剂作用下共热消化,含氮有机物分解产生氨,氨又与硫酸作用,变成硫酸铵。然后加碱蒸馏放出氨, 氨用过量的硼酸溶液吸收,再用盐酸标准溶液滴定求出总氮量换算为蛋白质含量。 1.2特点 凯氏定氮法是目前分析有机化合物含氮量常用的方法,是测定试样中总有机氮最准确和最简单的方法之一,被国际国内作为法定的标准检验方法。凯氏定氮法样品的最佳消化条件为硫酸铜2.50 g, 硫酸钾0.10 g,浓硫酸4.00 mL;硫酸铜的用量为影响消化时间的主要因素,硫酸钾和浓硫酸用量为第二和第三主要因素;用此最佳条件做实验, 消化时间仅为12 min;与其他硫酸铜、硫酸钾、浓硫酸用量方法对比,该法所需消化时间最短,试剂用量减少,可降低实验成本,也降低了对环境的污染。 凯氏定氮法适用范围广泛,测定结果准确,重现性好,但操作复杂费时,试剂消耗量大。若采用模块式消化炉代替传统的消化装置, 可同时测定几份样品,节省时间,提高了工作效率,适用于批量蛋白质的测定,具有准确、快速、简便、低耗、稳定的优点。 二、双缩脲法(Biuret ) 2.1原理 双缩脲(NH3CONHCONH3)是两个分子脲经180 ℃左右加热,放出1 个分子氨后得到的产物。在强碱性溶液中,双缩脲与CuSO4 形成紫色络合物,称为双缩脲反应。凡具有两个酰胺基或两个直接连接的肽键,或能够以1 个中间碳原子相连的肽键,这类化合物都有双缩脲反应。紫色络合物颜色的深浅与蛋白质浓度成正比,而与蛋白质分子量及氨基酸成分无关,故可用来测定蛋白质含量。
基本要求 对一个研究问题不要求写成一个系统的开题报告。要求写清楚的只有如下几项内容:1)你是怎么想到这个问题的?具体可以是你从什么现象(或是自己在生活中观察到的,或是通过看书、学习了解到的历史上或现实中的某种现象),或看了别人的某种理论观点或某项研究想到这个问题的。有关现象、观点或他人的研究如果不是大家熟知的,要有简要的描述。 2)这里的研究问题是什么?其意义何在? 对于需要给出研究思路的3个问题,还需要做如下工作: 1)选择适当的研究方法,对研究方法的适切性要有一定的说明; 2)给出一个简单的研究方案。 大家作业中较普遍的问题 不清楚什么是“研究问题” 这次作业不少同学都想出了不错的选题,但对于如果提出好的研究问题还没把握好。 研究问题可以是一个理论问题,也可以是结合实际问题而提出的,但都必须是你通过研究试图要回答的一个问题,形式上是用问句表示的一个问题。 文章的标题(多数情况下是一个名词性词组)一般不能用来当作研究问题,也不是简单地给出一个研究领域或研究对象就以为是有了研究问题了。 作为这本课程的练习,不要求一定是足以用来写成一篇论文的研究问题。重要的是问题要提得有一定深度。 不清楚什么是好的“研究问题” 好的研究问题,应该是让自己感到某种困惑,又非用常识或一些简单的社会学知识就能回答的问题。结合一些社会学理论对某些现象进行思考也可以提出一些有意义、有一定深度的研究问题。 好的研究问题还需要足够清晰和具体化,而非笼统、模糊。 不清楚如何设计“研究方法” 研究方法也不是简单举出来是课上讲到的什么方法就行了。那太笼统。设计研究方案时,需要结合自己的研究问题来把一种方法具体化,使之具有可操作性。 质性方法的课本上对各种方法的介绍,往往是比较笼统的、一般化的原则和普遍适用于某些类型的研究的操作程序。针对具体的研究问题来设计研究方案时,一定要多考虑自己的研究问题的特殊性以及涉及到的研究条件,并结合这些特殊性和条件来思考用什么具体操作来进行研究。 我没能对每个同学的每一道题都作很详细的批注,所以从大家的作业中节选了一些存在比较典型的问题的地方,连同我作的批注做成一个文档,供大家参考,希望大家除了从老师对自己作业的批改外,也能从老师对别的同学的作业的批改中多学到一些东西,然后再好好地改自己的作业。
Bradford法蛋白定量(Bradford Protein Assay ) Bradford Assay is a rapid and accurate method commonly used to determine the total protein concentration of a sample. The assay is based on the observation that the absorbance maximum for an acidic solution of Coomassie Brilliant Blue G-250 shifts from 465 nm to 595 nm when binding to protein occurs. Both hydrophobic and ionic interactions stabilize the anionic form of the dye, causing a visible color change. Within the linear range of the assay (~5-25 mcg/mL), the more protein present, the more Coomassie binds. Reference Bradford, M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Anal. Biochem. (1976) 72, 248-254. 考马斯亮蓝染色法(Bradford法)测定蛋白质含量 原理 1976年Bradford建立了用考马斯亮蓝G250与蛋白质结合的原理,迅速、敏感的定量测定蛋白质的方法。染料与蛋白质结合后引起染料最大吸收的改变,从465nm变为595nm,光吸收增加。蛋白质-染料复合物具有高的消光系数,因此大大提高了蛋白质测定的灵敏度,最低检出量为1μg蛋白。染料与蛋白质的结合是很迅速的过程,大约需2min,结合物的颜色在1h内是稳定的。一些阳离子,如K+,Na+,Mg2+,(NH4)2SO4,乙醇等物质不干扰测定,而大量的去污剂如TritonX100,SDS等严重干扰测定,少量的去污剂可通过用适当的对照而消除。由于染色法简单迅速,干扰物质少,灵敏度高,现已广泛应用于蛋白质含量的测定。 操作 一、标准方法 取含10~100μg蛋白质溶液于小试管中,用双蒸水或缓冲液调体积到0.1mL,然后加入5mL蛋白试剂,充分振荡混合,2min后于595nm测定光吸收值。以0.1mL 双蒸水或缓冲液及5mL蛋白试剂作为空白对照。 二、微量蛋白分析法 取含1~10μg蛋白质溶液,用双蒸水调体积到0.8mL,加0.2mL蛋白试剂,充分振荡混合,2min后于595nm测定光吸收值,以0.8mL双蒸水及0.2mL蛋白试剂作为空白对照。用不同浓度的蛋白质溶液作标准曲线,以蛋白质浓度为横坐
分析化学 结课作业 常见蛋白质测定方法的总结与比较 材料科学与技术学院 林化13-1班 刘旺衢 130534106
常见蛋白质测定方法的总结与比较 刘旺衢 (北京林业大学材料科学与技术学院林化13-1班 130534106,10083) 蛋白质是构成生物体细胞组织的重要成分。食物中的蛋白质是人体中氮的唯一来源。具有糖类和脂肪不可替代的作用。蛋白质与营养代谢、细胞结构、酶、激素、病毒、免疫、物质运转、遗传等密切相关,是对人类最重要的物质之一。准确精密的测定蛋白质,关乎人类的生产、生活、生存。目前测定蛋白质含量的方法有多种,如凯氏定氮法、紫外吸收法、双缩脲法、考马斯亮蓝染色法、酚试剂法等几种方法,下面本文将总结比较这五种蛋白质的测定方法。 一、凯氏定氮法 凯氏定氮法是测定化合物或混合物中总氮量的一种方法。即在有催化剂的条件下,用浓硫酸消化样品将有机氮都转变成无机铵盐,然后在碱性条件下将铵盐转化为氨,随水蒸气馏出并为过量的酸液吸收,再以标准酸滴定,就可计算出样品中的氮量。由于蛋白质含氮量比较恒定,可由其氮量计算蛋白质含量,故此法是经典的蛋白质定量方法。蛋白质是含氮的有机化合物。蛋白质与硫酸和催化剂一同加热消化,使蛋白质分解,分解的氨与硫酸结合生成硫酸铵。然后碱化蒸馏使氨游离,用硼酸吸收后再以硫酸或盐酸标准溶液滴定,根据酸的消耗量乘以换算系数计算蛋白质含量,即含氮量*6.25=蛋白含量。 凯氏定氮法具有灵敏度高, 样品用量少,最低可检出0.05mg氮;精密度、准确度高,平行误差一般小于0.5%;应用范围广,适用于一切形态的食品与生物样品;仪器装置简单,试剂廉价的优点。 但也存在操作比较繁琐费时,特别是蒸馏定氮过程的效率低,不利于大批样品的测定;定氮的结果既包括有机氮,也包括无机氮,有机氮中除蛋白氮外,还包括非蛋白氮,测定的结果只能是粗蛋白质的含量;在蛋白质氨基酸构成有差异的
1.蛋白质的常规检测方法 凯氏(Kjeldahl )定氮法 一种最经典的蛋白质检测方法。 原理:样品中含氮有机化合物与浓硫酸在催化剂作用下共热消化, 含氮有机物分解产生氨, 氨又与硫酸作用变成硫酸铵。然后加碱蒸馏放出氨, 氨用过量的硼酸溶液吸收, 再用盐酸标准溶液滴定求出总氮量换算为蛋白质含量。 优点:范围广泛、测定结果准确、重现性好 缺点:操作复杂费时、试剂消耗量大 双缩脲法 常用于需要快速但并不需要十分精确的蛋白质检测。 原理:双缩脲(NHCONHCONH是3分子的脲经180C左右加热,放出1分子氨后得到的产物。在强碱性溶液中,双缩脲与硫酸铜形成紫色络合物(肽键中的氮原子和铜离子配价结合),称为双缩脲反应。紫色络合物颜色的深浅与蛋白质浓度成正比,因此可用来测定蛋白质含量。 测定范围:1~10mg(有的文献记载为1~20mg) 优点:较快速,干扰物质少,不同蛋白质产生的颜色深浅相近 缺点:①灵敏度差; ② 三羟甲基氨基甲烷、一些氨基酸和EDTA等会干扰该反应。 Folin- 酚试剂法 原理:Folin- 酚法的原理与双缩脲法大体相同,利用蛋白质中的肽键与铜结合产生双缩脲反应。同时也由于Folin- 酚试剂中的磷钼酸- 磷钨酸试剂被蛋白质中的酪氨酸和苯丙氨酸残基还原,产生深蓝色的钼蓝和钨蓝的混合物。在一定的条件下, 蓝色深度与蛋白的量成正比,由此可测定蛋白质的含量。
测定范围:20~250ug 优点:灵敏度高,对水溶性蛋白质含量的测定很有效 缺点:①费时,要精确控制操作时间; ②Folin -酚法试剂的配制比较繁琐,且酚类和柠檬酸、硫酸铵、Tris缓冲液、甘氨 酸、糖类、甘油、还原剂(二硫代苏糖醇、巯基乙醇)、EDTA和脲素均会干扰反应。 紫外吸收法 原理:蛋白质分子中的酪氨酸、苯丙氨酸和色氨酸残基使其在280nm 处具有紫外吸收,其吸光度与蛋白质含量成正比)。此外,蛋白质溶液在280nm的吸光度值与肽键含量成正比,利用一定波长下蛋白质溶液的吸光度值与蛋白质浓度的正比关系可以测定蛋白质含量。 优点:简便、灵敏、快速,不消耗样品,测定后能回收。 缺点:①测定蛋白质含量的准确度较差,专一性差; ②干扰物质多,若样品中含有嘌呤、嘧啶及核酸等能吸收紫外光的物质,会出现较 大的干扰。 定氮法、双缩脲法、Filon- 酚试剂法和紫外吸收法为常用的 4 种古老的经典方法。 1.5 考马斯亮蓝法 原理:染料考马斯亮蓝G-250 在酸性溶液中与蛋白质中的碱性氨基酸(特别是精氨酸)及芳香族氨基酸残基相结合,使染料最大吸收峰的位置由465nm变为595nm,溶液的颜色也由棕黑色变为蓝色,在595nm下测定的吸光度值与蛋白质浓度呈正比。 优点:灵敏度高,测定快速、简便,干扰物质少,不受酚类、游离氨基酸和缓冲剂、络合剂的影响,适合大量样品的测定。 缺点:由于各种蛋白质中的精氨酸和芳香族氨基酸的含量不同有较大的偏 ,因此用于不同蛋白质测定时 差。