烟台御宝酒业有限公司
白砂糖检验报告单报告书编号:
审核: 主检:
药品检验报告书写细则实施规范(征求意见稿)中药(中药材、饮片、提取物、中成药) 药品检验报告书是对药品质量作出的技术鉴定,是具有法律效力的技术文件,要求做到:依据准确,数据无误,结论明确,文字简洁,书写清晰,格式规范。 国家药品监督管理局2000年9月12日组织制定的《药品检验所实验室质量管理规范(试行)》附件3“检验记录与检验报告书的书写细则”对药品检验报告书检验项目的编排与格式的要求如下: 1.表头之下的首行,横向列出“检验项目”、“标准规定”和“检验结果”三个栏目。 2.“检验项目”下,按质量标准列出[性状]、[鉴别]、[检查]、[浸出物]、[特征图谱或指纹图谱]与[含量测定]等大项目;大项目名称需添加方括号。每一个大项下所包含的具体检验项目名称和排列顺序,应按质量标准上的顺序书写。体现在检验报告书中格式如下: 检验项目标准规定 检验结果 符合规定不符合规定 根据《药品检验所实验室质量管理规范(试行)》附件3“检验记录与检验报告书的书写细则”以及《国家药品工作手册(第三版)》的内容,对于药品检验报告书的书写总体原则如下: 1.检验项目项:按照药典或法定质量标准项目填写。
2.标准规定项:按照质量标准内容书写,如不易用数字或简单的语言确切表达的,此项可写“应符合规定”。 3.检验结果项:具体数值型的,填写具体数值,如不符合规定,应在具体数值后注明不符合规定;描述型的按照质量标准上的描述形式填写。如不易用数字或简单的语言确切表达的,此项可写“符合规定/不符合规定”。 [性状]、[鉴别]、[检查]、[浸出物]、[特征图谱或指纹图谱]、[含量测定]具体填写原则如下: 一、[性状] 按照《中国药典》2010年版一部凡例项目与要求,性状项下记载药品的外观、质地、断面、臭、味、溶解度以及物理常数等。 (一)外观 外观是对药品的色泽和外表观感的规定,制剂应描述供试品的颜色和外形。具体规定如下: 1.标准规定项:按照质量标准内容书写。 2. 检验结果项:按照实际情况描述,不合格的,应先写出与标准规定不符合之处,再加写“不符合规定”。 3.标准中的嗅、味和引湿性(或风化性)等,一般可不予记录,但遇异常时,应详细描述。
安全隐患整改报告书-整改情况书面 报告 事故隐患整改情况报告书 事故隐患整改情况报告书表6—4 年编号: 市安监站:我美景鸿城工地于月日接到贵站三科字24号事故隐患整改通知书,现将提出要求整改的事项,我们进行整改落实的情况报告如下,请复查。 1、外架拉结杆缺少的要求架子班组进行加设,架未设置的安全平网立即进行加设。 2、临时用电依据规要求进行设置,所有设备一律设置开关箱。 3、临边洞口防护缺少的已加设。 4、施工现场群塔作业已制定施工方
案,确保安全。 5、施工现场材料进行分类堆放,散材成堆,型材成跺。 6、生活区食堂、厕所卫生制定专人负责清扫、管理。 7、施工现场消防设施进行检查,缺少的增加。雨季施工制定专项施工方案。 8、特殊工种上岗严格持证上岗制度。并定期组织学习教育。 9、安全资料按规定要求,结合施工实际进行收集、整理。 10、 项目及负责人签章企业主管部门复查意见项目监理监督意见 年月日年月日年月日 市建设安全监督站监制组织相关人员对建文号文件精神,并认真落实。事故隐患整改情况报告书 事故隐患整改情况报告书表6-4
年编号:安检字58号 : 我尚庄一、二组城中村改造B17地块—城3号院1#、2#、3#、7#、8#楼工地于10月19日接到贵站2016字58号事故隐患整改通知书,现将提出要求整改的事项,我们进行整改落实的情况报告如下,请检查。 1、外架搭设已按照规规定整改完毕; 2、基坑周边的材料正在整改; 3、施工用电存在的问题已给电工进行安全用电技术交底并整改完毕; 4、消防制度不完整的已完善,消防器缺失的已及时补充完善,消防通道搭设完成; 5、加工区已按照相关规定搭设防护棚; 6、现场文明施工的材料已堆放整齐,垃圾及时清理出场; 7、生活区存在的相关问题已整改完毕,
药品检验记录与检验报告书的书写细则检验记录是出具检验报告书的依据,是进行科学研究和技术总结的原始资料;为保证药品检验工作的科学性和规范化,检验记录必须做到:记录原始、真实,内容完整、齐全,书写清晰、整洁。 药品检验报告书是对药品质量作出的技术鉴定,是具有法律效力的技术文件;药检人员应本着严肃负责的态度,根据检验记录,认真填写“检验卡”,经逐级审核后,由所领导签发“药品检验报告书”。要求做到:依据准确,数据无误,结论明确,文字简洁,书写清晰,格式规范;每一张药品检验报告书只针对一个批号。 1 检验记录的基本要求: 1.1 原始检验记录应采用统一印制的活页记录纸和各类专用检验记录表格(见附件),并用蓝黑墨水或碳素笔书写(显微绘图可用铅笔)。凡用微机打印的数据与图谱,应剪贴于记录上的适宜处,并有操作者签名;如系用热敏纸打印的数据,为防止日久褪色难以识别,应以蓝黑墨水或碳素笔将主要数据记录于记录纸上。 1.2 检验人员在检验前,应注意检品标签与所填检验卡的内容是否相符,逐一查对检品的编号、品名、规格、批号和效期,生产单位或产地,检验目的和收检日期,以及样品的数量和封装情况等。并将样品的编号与品名记录于检验记录纸上。 1.3 检验记录中,应先写明检验的依据。凡按中国药典、部颁标准、地方药品标准或国外药典检验者,应列出标准名称、版本和页数;凡按送验者所附检验资料或有关文献检验者,应先检查其是否符合要求,并将前述有关资料的影印件附于检验记录之后,或标明归档编码。 1.4 检验过程中,可按检验顺序依次记录各检验项目,内容包括:项目名称,检验日期,操作方法(如系完全按照1.3检验依据中所载方法,可简略扼要叙述;但如稍有修改,则应将改变部分全部记录),实验条件(如实验温度,仪器名称型号和校正情况等),观察到的现象(不要照抄标准,而应是简要记录检验过程中观察到的真实情况;遇有反常的现象,则应详细记录,并鲜明标出,以便进一步研究),实验数据,计算(注意有效数字和数值的修约及其运算,详见《中国药品检验标准操作规范》第414页)和结果判断等;均应及时、完整地记录,严禁事后补记或转抄。如发现记录有误,可用单线划去并保持原有的字迹可辩,不
安全隐患整改完成情况报告书 (监督机构): 根据你单位年月日签发的《安全隐患限期整改通知书》 号的要求,我单位立即组织了整改,目前已将工程相关安全隐患整改完毕,并通过建设、监理单位验收合格。现将《安全隐患整改完成情况报告书》及整改佐证材料报上。 整改情况简述: 施工单位(公章):项目负责人(签字): 监理单位(公章): 总监理工程师(签字): 建设单位(公章):项目负责人(签字): 年月日 注:1、“整改情况简述”:应针对《整改通知书》提出的问题,逐条写出整改完成情况,此页不够可续页。2、建设单位、监理单位对施工单位的整改情况进行监督并验收,验收合格后在本表盖章确
认。 恢复施工申请书 (监督机构): 根据你单位年月日签发的号《安全隐患停工整改通知书》的要求,我单位立即组织了整改,目前已将工程项目存在的较大安全隐患整改完毕(详见整改完成情况报告书),并通过建设、监理单位验收合格,现申请恢复施工。 附:整改完成情况报告书及整改佐证材料。 施工单位(公章):项目负责人(签字): 监理单位(公章): 总监理工程师(签字): 建设单位(公章):项目负责人(签字): 年月日 注:1、“整改情况简述”:应针对《整改通知书》提出的问题,逐条写出整改完成情况。
2、建设单位、监理单位对施工单位的整改情况进行监督并验收,验收合格后在本表盖章确认。 中止施工安全监督申请书 (监督机构): 我单位组织建设的项目,现已施工到(工程形象),该项目因 原因,拟于年月日至年月日中止施工。我单位已经做好现场相关防护,现提出中止施工安全监督申请,并附《中止施工期间安全保障措施方案》相关资料。中止施工期间,我单位保证会同施工、监理单位严格落实各项安全保障措施,确保工程现场不发生生产安全事故。 建设单位项目负责人(签字): 联系电话: (建设单位公章) 年月日 施工单位项目负责人(签字):总监理工程师(签字): (施工单位公章)(监理单位公章)年月日年月日
Record the situation and lessons learned, find out the existing problems and form future countermeasures. 姓名:___________________ 单位:___________________ 时间:___________________ 安全隐患排查整改报告
编号:FS-DY-20778 安全隐患排查整改报告 根据xx市教育局的《关于开展学校安全隐患排查整改活动的通知》,我校为切实加强学校各方面的安全工作,杜绝重大安全事故的发生,对学校各方面安全状况进行了全面的排查,取得了很好的效果,现将有关情况汇报如下: 一、严格落实通知精神。 接到教育局的通知后,学校马上召开班子会议,校长对通知精神做了具体传达,由校长亲自部署,组织、指挥,主管领导具体负责,对校舍安全、食品卫生、消防安全、校园保卫、交通安全、安全教育等各方面进行周密部署。紧接着又召开了炊管人员和保卫人员紧急会议。 二、严格完善落实各项规章制度。 完善了《xx小学重大食品卫生安全预案》、《门卫职责》,特别是对食堂工作提出了具体要求,如《食堂人员操作职责》《食堂人员卫生要求》等各项规章制度一定落实到位。
三、成立了“安全监督小组” 。 以xx校长为组长的学校安全工作组织机构,进一步明确了责任分工。对学校食堂、楼道、门口进行监督,定点值班,并严格地责任到人,一名领导带两名数学教师,每天负责学生上下学、上下操等集体活动的监管,以确保校园的安全。 组长:xx 副组长:北楼,xxx 南搂,xxx 组员:六年级,北楼四层,xxx;五年级,北楼三层,xxx 四年级,南楼四层,xxx;三年级,南楼三层,xxx 二年级,南楼一层,xxx;一年级,南楼二层,xxx 学前教育,xxx 四、采取的措施、办法。 我校从xx年十一月份才开始正式使用,各种设施和设备虽然都是新的,但是为了切实消除校园内、外安全隐患,保护好学校财产安全和维护广大教师、学生的身体健康和生命安全,维护正常的教育教学秩序,我校认真对校内校外进行了彻底的安全工作自查、自纠。 (一)、校内自查:
检验报告书写规范 目的:建立检验报告书写规范,确保检验报告数据完整、用语规范、结论明确。 适用范围:适用于原辅料、包装材料、中间产品、待包装产品、成品、工艺用水、环境监测及各类验证项目中所涉及到的检验报告的书写。 任人:质量控制部 容: 检验报告书是对药品质量作出的技术鉴定,是技术性文件。药品检验人员 1. 应本着严肃认真的态度,根据检验记录,认真填写检验报告书,要求做到依据准确,数据无误,结论明确,文字简洁,书写清晰,格式规范。每一张检验报告书只针对一个批号。 药品检验报告书应在“检验报告书”字样之前冠以药品生产企业的全称。 2.检验报告分三部分:表头栏目、检验项目及检验结论。 3.表头栏目的填写说明 检验报告书表头一般设置有以下项目:企业名称、标题、报告编号、检品名称、剂型、规格、包装、批号、检品编号、生产厂家、检验项目、检验依据、请验部门、请验日期、报告日期。 3.1企业名称:应填写本企业全称。 3.2标题:“检验报告书”应使用加粗字体表示。 3.3报告编号:同检品编号。 3.4检品名称:原辅料、包装材料应按其包装上的名称填写;其他应按送样部门请验单上的名称填写。检品名称应按法定名称规范填写。 3.5剂型:按检品的实际剂型填写,没有的填“ /”。 3.6规格:按检品的实际规格填写,没有的填“ /”。 3.7批号:原辅料、包装材料应按其包装上的批号填写;其他应按送样部门请验单上的批号填写。
3.8检品编号:由专人负责编制,并标注在请验单的备注栏。 3.9生产厂家:适用于原辅料及包装材料,并按其包装上的名称填写。 3.10检验依据:成品应依据现行版《中华人民共和国药典》,原辅料、包装材料、中间品、待包装品依据企业标准。 3.11请验部门:与请验单上的请验部门一致。 3.12请验日期:与请验单上的请验日期一致。 3.12报告日期:为质控部负责人审定签发报告的日期。 4.检验项目的编排与格式 4.1在表头之下的首行,横向列出“检验项目”、“标准规定”、“检验结果”三个栏目。 4.2“检验项目”下,按质量标准列出【性状】、【鉴别】、【检查】与【含量测定】等大项目号,大项目号名称需添加方括号。 4.3每一个大项目下所包含的具体检验项目名称和排列顺序,应按质量标准书写。 4.4各检验项目的书写规范: 4.4.1 [性状] 4.4.1.1外观性状:在“标准规定”下,按质量标准内容书写。“检验结 果”下,合格的写“符合规定”,必要时可按实况描述;不合格的,应先写出不符合标准规定之处,再加写“不符合规定”。 4.4.1.2熔点、比旋度或吸收系数等物理常数:在“标准规定”下,按质量标准内容书写。在“检验结果”下,写实测数值;不合格的应在数据之后加写“不符合规定”。 4.4.2[鉴别] 常由一组试验组成,应将质量标准中鉴别项下的试验序号(1) (2)…等列 在“检验项目”栏下。每一序号之后应加注检验方法简称,如化学反应、薄层色谱、高效液相色谱、紫外光谱、红外光谱、显微特征等。 4.4.2.1凡属显色或沉淀反应的,在“标准规定”下写“应呈正反应” “检
安全隐患整改报告三篇 篇一:安全隐患整改报告 20XX年3月29日办事处安全生产巡查办公室领导组对我公司进行了全面的检查,对我公司安全方面上的不足提出了很多宝贵问题和意见。针对问题我公司高度重视,我公司主要安全管理人员于4月2日晚上,召开了安全隐患整改紧急会议,对领导提出的安全隐患进行了整理分类,并落实到位。现将安全隐患整改报告汇报如下: 1、车间部分电线裸露,未采用不燃套作保护。 整改情况:裸露电线已用不燃套材料进行了保护。 2、安全出口指示牌应急灯配置不足。 整改情况:已重新采购指示牌和应急灯进行安装完毕。 3、未健全各项安全管理规章制度 整改情况:已建立健全本公司安全管理规章制度。 4、未对作业人员进行安全生产的培训,教育。 整改情况:目前已完成各岗位员工的安全生产的培训。 20XX年7月20日
篇二:安全隐患整改报告 宝安区西乡街道安全生产巡查办公室: 根据贵方20XX年7月5日的现场巡查记录要求,我公司目前安全整改事项如下: 1、提供当日未能提交经营证照。 2、初步建立公司安全生产档案。 3、已按要求制定公司安全生产责任制度。 4、组织编写多项事故应急预案,并将于近期实施应急事故演练。 5、已按要求编写公司日常安全生产检查细则并予以实施。 6、已按要求派公司骨干参训安全主任的安全生产培训课程。 7、已按要求派公司负责人参训企业负责人的安全生产培训课程。 8、生产车间安全出口已经按照规定由专人负责在上班时间开启。 9、已按照要求配备消防器材和安全出口标志。 10、定期由公司负责人和安全主任主导并监督对从业人员的安全生产培训教育(二、三级教育)。 11、对相应操作工提供符合国家行业标准的劳动防护用品。 深圳市新奥联电子有限公司 20XX年7月12日
药品质量保证书 药品质量保证书 在我们平凡的日常里,保证书的用途越来越大,保证书实际上是合同的一种,也具有法律效力。那么保证书应该怎么写才合适呢?以下是小编精心整理的药品质量保证书,仅供参考,欢迎大家阅读。 药品质量保证书1 1、我公司将严格根据国家有关规定提供合法、有效的证件、资料等复印件,并加盖公司红色印章,因我公司所提供的证照、资料不全或无效而造成的经济损失及相关法律责任由我公司承担。 2、我公司所提供的药品质量保证符合国家药典标准和相关质量标准要求。 3、对我公司所提供的进口药品保证提供符合规定的《进口药品注册证》、《医药产品注册证》和口岸药品检验所出具的《进口药品检验报告书》复印件并加盖公司质量管理部红色印章。 4、对我公司所提供的药品包装和使用说明书,保证符合国家相关的规定要求。 5、对我公司所提供的药品若出现质量问题,我公司郑重承诺将承担直接经济损失和相关的法律责任。 6、我公司将积极主动配合院方相关人员按照药品说明书要求,保管养护好药品,因保管不善造成的药品损失由我公司承担。 7、我公司保证杜绝有下列情况的药品在院内和各卫生所发生:①不符合上述质量条款要求的药品;②质量异常或经确定不合格的`药品;③包装受污染、破损及包装标识模糊不清或脱落的药品;④无生产厂牌、生产批号、生产日期或无有效期的药品。 8、我公司将按院方的要求,积极主动地提供质优价廉的药品,保证患者用药安全、有效,确保患者利益不受侵犯。 药品质量保证书2 尊敬的xx: 社会郑重作出四项承诺:不生产、销售伪劣医药产品,不以虚假广告诱骗群众,以优质产品奉献社会,以优良服务奉献人民;制定北京医药行业行规行约,建设百姓放心企业;强化企业自律意识,加强质量管理,大力提高产品质量和服务水平;团结、依靠社会力量,促进医药行业质量信用建设,杜绝假冒伪劣药品。 保证单位: xx年xx月xx日 药品质量保证书3 甲方(供货方): 乙方(购货方): 为了规范药品经营,保证经营药品质量,确保人体用药安全、有效、维护人民身体健康和用药的合法权益,依据《中华人民共和国药品管理法》及其实施条例、《药品管理法》、《药品经营质量管理规范》、《产品质量法》以及《经济合同法》等有关法律、法规,根据平等互利、真诚合作、互守信誉原则,经甲乙双方协商签订以下质量保证协议: 一、甲方必须向乙方提供本企业的药品生产许可证和营业执照、GMP证书等复印件并加盖企业公章。 二、甲方向乙方提供所销售药品注册证、生产批文、物价批文、质量标准、药品检验
药品检验记录与检验报告书的书写细则 检验记录是出具检验报告书的依据,是进行科学研究和技术总结的原始资料;为保证药品检验工作的科学性和规范化,检验记录必须做到:记录原始、真实,内容完整、齐全,书写清晰、整洁。 药品检验报告书是对药品质量作出的技术鉴定,是具有法律效力的技术文件;药检人员应本着严肃负责的态度,根据检验记录,认真填写“检验卡”,经逐级审核后,由所领导签发“药品检验报告书”。要求做到:依据准确,数据无误,结论明确,文字简洁,书写清晰,格式规范;每一张药品检验报告书只针对一个批号。 1 检验记录的基本要求: 1.1 原始检验记录应采用统一印制的活页记录纸和各类专用检验记录表格(见附件),并用蓝黑墨水或碳素笔书写(显微绘图可用铅笔)。凡用微机打印的数据与图谱,应剪贴于记录上的适宜处,并有操作者签名;如系用热敏纸打印的数据,为防止日久褪色难以识别,应以蓝黑墨水或碳素笔将主要数据记录于记录纸上。 1.2 检验人员在检验前,应注意检品标签与所填检验卡的内容是否相符,逐一查对检品的编号、品名、规格、批号和效期,生产单位或产地,检验目的和收检日期,以及样品的数量和封装情况等。并将样品的编号与品名记录于检验记录纸上。 1.3 检验记录中,应先写明检验的依据。凡按中国药典、部颁标准、地方药品标准或国外药典检验者,应列出标准名称、版本和页数;凡按送验者所附检验资料或有关文献检验者,应先检查其是否符合要求,并将前述有关资料的影印件附于检验记录之后,或标明归档编码。 1.4 检验过程中,可按检验顺序依次记录各检验项目,内容包括:项目名称,检验日期,操作方法(如系完全按照1.3检验依据中所载方法,可简略扼要叙述;但如稍有修改,则应将改变部分全部记录),实验条件(如实验温度,仪器名称型号和校正情况等),观察到的现象(不要照抄标准,而应是简要记录检验过程中观察到的真实情况;遇有反常的现象,则应详细记录,并鲜明标出,以便进一步研究),实验数据,计算(注意有效数字和数值的修约及其运算,详见《中国药品检验标准操作规范》第414页)和结果判断等;均应及时、完整地记录,严禁事后补记或转抄。如发现记录有误,可用单线划去并保持原有的字迹可辩,不
安全隐患整改报告书 GDAQ4310 、工程名称:*******项目致:*******建设监理有限公司我方接到编号为全文结束》》-08-30 的安全隐患整改通知后,已按要求完成了在通知单中提出的存在安全问题的整改工作,现报上,请予以复查。 1、现场已经增设了安全警示标志牌; 2、现场拖地的电线已经架空拉接,电箱已经做好标识; 3、基坑边个别地方维护不严的已安排人员加强维护,部分脱落的安全网已绑扎好; 4、已对工人进行了交底,进入工地现场必须佩戴安全帽,否则不得进入; 5、钢筋机械已做好防雨措施,钢筋机械防护棚已安排人员做好。 总承包单位(项目章): 项目负责人(签名): 年月日专业监理工程师审查意见: 专业监理工程师(签名): 年月日总监理工程师审核意见: 项目监理机构(章): 总监理工程师(签名): 年月日安全隐患整改通知回复(施工单位项目部报监理) GDAQ4310 、工程名称:******项目致:*******建设监理有限公司我方接到编号为的安全隐患整改通知后,已按要求完成了在通知单中提出的存在安全问题的整改工作,现报上,请予以复查。 回复编号《施工安全监督抽查记录》 1、钢筋加工场的钢筋机械电源线已架空拉接,钢筋加工机械已做好防护棚。
2、地下室顶板模板作业层已安装临时防护栏杆,堆放过高的钢筋已经搬离。 3、已对年后进场的工人重新进行了安全教育和技术交底,并办理了签字手续。 4、基坑变形观测、日常巡查等安全管理资料已完善。 总承包单位(项目章): 项目负责人(签名): 年月日专业监理工程师审查意见: 专业监理工程师(签名): 年月日总监理工程师审核意见: 项目监理机构(章): 总监理工程师(签名): 年月日安全隐患整改通知回复(施工单位项目部报监理) GDAQ4310 、工程名称:******项目致:*******建设监理有限公司我方接到编号为全文结束》》-01-14 的安全隐患整改通知后,已按要求完成了在通知单中提出的存在安全问题的整改工作,现报上,请予以复查。 1、基坑西面堆放在基坑边的塔吊连接节和其它设备、材料等已搬离。 2、基坑东面靠北面位置基坑边的砂浆机已搬离至基坑边允许范围内,水泥和砂等材料也已搬离基坑边。 总承包单位(项目章): 项目负责人(签名): ***全文结束》》年01月17日专业监理工程师审查意见: 专业监理工程师(签名): 年月日总监理工程师审核意见: 项目监理机构(章):
一、基本面分析 (一)现货市场供求状况 一般来说,对于供给而言,商品供给的增加会引起价格的下降,供给的减少会引起价格的上扬;对于需求而言,商品需求的增加将导致价格的上涨,需求的减少导致价格的下跌。白糖的供求也遵循同样的规律。 1、白糖的供给 世界食糖产量1.21-1.40亿吨,产量超过1000万吨的国家和地区包括巴西、印度、欧盟、中国等,其中巴西产量超过2000万吨。巴西、欧盟、泰国是世界食糖主要出口国家,其产量和供应量对国家市场的影响较大。特别是巴西,作为世界食糖市场最具影响力和竞争力的产糖国,其每年的糖产量、货币汇率及其政府的糖业政策直接影响到国际食糖市场价格的变化走向。 2、白糖的需求 世界食糖消费量约1.24亿吨,消费量较大的的国家和地区包括印度、欧盟、中国、巴西等。从近几年消费情况来看,印度食糖年消费量维持在1900万吨左右,欧盟消费量维持于1500万吨左右,中国消费量增长至1100万吨左右,巴西年消费量950万吨左右。 3、白糖进出口 食糖进出口对市场的影响很大。食糖进口会增加国内供给数量,食糖出口会导致需求总量增加。对食糖市场而言,要重点关注世界主要出口国和主要进口国有关情况。世界食糖贸易量每年约为3700万吨,以原糖为主。主要出口国为巴西、欧盟、泰国、澳大利亚、古巴等。主要进口国为俄罗斯、美国、印尼、欧盟、日本等。主要进口国的消费量和进口量相对比较稳定,而主要出口国的生产量和出口量变化较大,出口国出口量的变化对世界食糖市场的影响比进口国进口量的变化对世界食糖市场的影响大。 我国食糖处于供求基本平衡的状态,略有缺口,进口食糖以原糖为主。食糖进口仍然实行配额管理,2004-2006年的每年配额均为194.5万吨。2001-2004年进口量分别为119.87万吨、118.31万吨、77.51万吨、105.78万吨,2005年进口量为139万吨。 我国市场出口量较少,2004年仅为4.84万吨。
化学药品检验报告书写格式 检验项目标准规定检验结果 [性状] 应为白色或微黄色结晶性粉末为白色结晶性粉末符合规定 (为黄色结晶性粉末不符合规 定) 比旋度应为17°~21°20°( 25°不符合规定) [鉴别] (1)化学反应(颜色,火焰等) 应呈正反应呈正反应(不呈正反应不符合规 定) (2)高效液相色谱供试品溶液主峰的保留时间应 与对照品溶液主峰的保留时间 一致与对照一致(与对照不一致不符合规定) (3)紫外光谱应在296nm的波长处有最大吸收在296nm的波长处有最大吸收(在 296nm的波长处无最大吸收不符合 规定) (4)红外光谱应与对照品的图谱一致与对照一致(与对照不一致不符合 规定) (5)薄层色谱供试品所显主斑点的颜色与位 置应与对照品相同与对照一致(与对照不一致不符合规定) [检查] 酸度pH值应为4.0~6.0 4.5(3.5 不符合规定) 溶液的澄清度与颜 色 应符合规定符合规定(不符合规定) 有关物质应符合规定符合规定(不符合规定) 重量差异应符合规定符合规定 (不符合规定) 装量应符合规定符合规定 (不符合规定) 水分应为11.4%~13.4%12.0%(15.0%不符合规定) 结晶性应符合规定符合规定 (不符合规定) 炽灼残渣应不得过0.2%0.1%(0.3%不符合规定) 头孢**聚合物应不得过1.0% 0.5% (1.9% 不符合规定) 重金属应不得过百万分之十符合规定(百万分之20 不符合规 定)
(细菌数:应不得过1000 cfu/克(ml);霉菌数:应不得过100 cfu/克(ml); 酵母菌数:应不得过100 cfu/克(ml); 大肠埃希菌:应不得检出/克(ml)) (10000 cfu/克(ml) 500 cfu/克(ml) 300 cfu/克(ml) 检出/克(ml) 符合规定(不符合规定)) 异常毒性应符合规定符合规定(不符合规定) 细菌内毒素应符合规定符合规定(不符合规定) 可见异物(粉针) 应符合规定符合规定(不符合规定) 金属性异物应符合规定符合规定(不符合规定) 粒度(软膏剂) 应符合规定符合规定(不符合规定) 粒度(颗粒剂) 应不得过10.0% 5.5%(12.4%不符合规定) 氯霉素二醇物应不得过5.0% 2.0% (5.8% 不符合规定) 干燥失重应不得过4.0% 2.0% (5.0%不符合规定) 溶化性应符合规定符合规定(不符合规定) 可见异物(水针) 应符合规定符合规定(不符合规定) 崩解时限应在30分钟内全部崩解25分钟(32分钟不符合规定)装量差异应符合规定符合规定(不符合规定) 溶出度限度应为标示量的80%符合规定(60%,67%,60%,60%, 60%,60%不符合规定) 热原应符合规定符合规定(不符合规定) 无菌应符合规定符合规定(不符合规定) 组分测定应符合规定符合规定(不符合规定) 不溶性微粒应符合规定符合规定(不符合规定) 颜色吸光度应不得大于0.03 0.02(0.05不符合规定) 氯化物消耗硝酸银滴定液(0.1mol/L) 应为14.6ml~16.2ml 15.1ml(17.1ml不符合规定) 含量均匀度A+1.80S应不得过15.0 8.0(16.0不符合规定)
检品编号:共3 页第 1 页 [性状] 本品为 (规定:应为无色结晶或白色结晶性的松散粉末;无臭,味甜) 单项结论: 比旋度取本品,精密称定,加水溶解并定量稀释制成每1ml中约含0.1g的溶液,测其比旋度为___________。 (规定:比旋度为+66.3°至+67.0°) 单项结论: [鉴别] 取本品,加0.05mol/L硫酸溶液,煮沸后,用0.1mol/L氢氧化钠溶液中和,再加碱性酒石酸铜试液,加热,___________。 (规定:应生成氧化亚铜的红色沉淀) 单项结论 [检查] 溶液的颜色取本品5g,加水5ml溶解,置于25ml的纳氏比色管中,加水稀释至10ml,另取黄色四号标准比色液10ml(精密称取在120℃干燥 至恒重的基准重铬酸钾0.4000g,置500ml量瓶中,加适量水溶解 并稀释至刻度,摇匀,每1ml溶液中含0.800mg重铬酸钾,精密量 检验者:核对者:年月日年月日
检品编号:共3 页第 2 页 取该重铬酸钾液23.3ml,加水72.7ml,制成黄色标准重铬酸钾储备 液,量取该储备液2ml,加水至10ml,即得),置于另一25ml的纳 氏比色管中,两管同置白色背景上,自上向下透视,供试品管呈现 的颜色与对照管比较,___________。 (规定:供试品与标准液比较,不得更深) 单项结论: 硫酸盐取本品1.0g,加水溶解使成约40ml,置50ml纳氏比色管中,加稀盐酸2ml,摇匀,既为供试品溶液。另取标准硫酸钾溶液5.0ml,置 50ml纳氏比色管中,加水使成约40ml,加稀盐酸2ml,摇匀,既得 对照溶液。于供试品品溶液和对照溶液中,分别加入25%氯化钡溶 液5ml,用水稀释至50ml,充分摇匀,放置10分钟,同置黑色背 景上,从比色管上方向下观察、比较,___________。 (规定:供试品与标准液比较,不得更浓) 单项结论: 还原糖取本品5.0g,置250ml锥形瓶中,加水25ml溶解后,精密加碱性枸橼酸试液25ml与玻璃珠数粒,加热回流使在3分钟内沸腾,从全沸 时起,连续沸腾5分钟,迅速冷却至室温,立即加25%碘化钾溶液15ml, 摇匀,随振摇随缓缓加入硫酸溶液25ml,待二氧化碳停止放出后,立 即用硫代硫酸钠滴定液(0.1mol/L)滴定,至近终点时,加淀粉指示 液2ml,继续滴定至蓝色消失,同时做一个空白试验;二者消耗硫代 硫酸钠滴定液(0.1mol/L)的差数为_______________。 (规定:供试品与对照品消耗硫代硫酸钠滴定液(0.1mol/L)的差数不得过2.0ml) 单项结论: 炽灼残渣取本品2.0g,置已炽灼至恒重的坩埚中,精密称定,缓缓炽灼至完 检验者:核对者: 年月日年月日
中药检验报告书书写格式规范药品检验报告书写细则实施规范(征求意见稿) 中药(中药材、饮片、提取物、中成药) 药品检验报告书是对药品质量作出的技术鉴定,是具有法律效力的技术文件,要求做到:依据准确,数据无误,结论明确,文字简洁,书写清晰,格式规范。 国家药品监督管理局2000年9月12日组织制定的《药品检验所实验室质量管理规范(试行)》附件3“检验记录与检验报告书的书写细则”对药品检验报告书检验项目的编排与格式的要求如下: 1.表头之下的首行,横向列出“检验项目”、“标准规定”和“检验结果”三个栏目。 2.“检验项目”下,按质量标准列出[性状]、[鉴别]、[检查]、[浸出物]、[特征图谱或指纹图谱]与[含量测定]等大项目;大项目名称需添加方括号。每一个大项下所包含的具体检验项目名称和排列顺序,应按质量标准上的顺序书写。体现在检验报告书中格式如下: 检验项目 标准规定 检验结果 符合规定 不符合规定
根据《药品检验所实验室质量管理规范(试行)》附件3“检验记录与检验报告书的书写细则”以及《国家药品工作手册(第三版)》的内容,对于药品检验报告书的书写总体原则如下: 1.检验项目项:按照药典或法定质量标准项目填写。 2.标准规定项:按照质量标准内容书写,如不易用数字或简单的语言确切表达的,此项可写“应符合规定”。 3.检验结果项:具体数值型的,填写具体数值,如不符合规定,应在具体数值后注明不符合规定;描述型的按照质量标准上的描述形式填写。如不易用数字或简单的语言确切表达的,此项可写“符合规定/不符合规定”。 [性状]、[鉴别]、[检查]、[浸出物]、[特征图谱或指纹图谱]、[含量测定]具体填写原则如下: 一、[性状] 按照《中国药典》2010年版一部凡例项目与要求,性状项下记载药品的外观、质地、断面、臭、味、溶解度以及物理常数等。 (一)外观 外观是对药品的色泽和外表观感的规定,制剂应描述供试品的颜色和外形。具体规定如下: 1.标准规定项:按照质量标准内容书写。 2.检验结果项:按照实际情况描述,不合格的,应先写
报告具有汇报性,是向上级讲述做了什么工作,或工作是怎样做的,有什么情况、经验、体会,存在什么问题,今后有什么打算,对领导有什么意见、建议,行文上一般都使用叙述方法,即陈述其事,而不是像请示那样采用祈使、请求等法。本站今天为大家精心准备了安全隐患整改报告范文,希望对大家有所帮助! 安全隐患整改报告范文 医疗安全隐患整改自查报告我院根据市卫生局下发关于‘医疗安全隐患整改’活动的要求,认真组织广大职工学习活动精神,根据要求对医院各个方面的工作进行了专项整改活动。通过整改活动开展以来,现将我院整改时存在的问题及整改措施汇报如下: 1、存在的问题: (一).医疗质量方面存在的问题 1.门诊科室存在的问题 根据门急、诊科室的管理要求,我院门急诊科没有单独设立,没有固定的业务技能强的门、急诊工作人员。门急诊医生持证上岗率不高,存在无证行医、非
法行医情况。部分医务人员业务技能不高,不能够对一些常见急救设备进行熟练地掌握和应用,对一些基本急救技术掌握不够熟练。各科室之间配合不够紧密,科室人员之间协作不够。 医疗文书书写不规范。门诊处方书写不规范,要素不全,剂量用法不详,抗生素应用不规范,存在不合理用药情况。门诊留观病历内容过于简单,不能够严格规范书写留观病例。住院病例质量管理不到位,部分医务人员病例书写不规范、不及时。各种记录不规范,急危重病人谈话记录、抢救记录、疑难病例讨论记录、死亡病人讨论记录等书写不规范,书写要求远未达到医疗文书书写质量规范要求。各种门诊日志记录登记不全、不连续、不全面。部分医疗制度及核心制度建立不全、不完善。有待与进一步建立、健全、落实各科室相关制度,尤其是乡镇医院持续改进的核心制度各项制度落实不到位,部分制度已不符合现阶段医院管理的需要。 护理部存在的问题各项护理制度建立不全、不完善。以前的各项护理制度是以门诊制度管理为起点建立起来的,自从住院部大楼投入使用以来,原来的制度已经不等够适应现在管理的要求,现需结合住院部管理的实际情况建立相关标准制度。 护理管理组织体系不建全。未能够按照《护士条例》制度规定,实施相关护理管理工作,未实行目标管理责任制。自医院住院部投入使用以来护理管理部门不能够按照乡镇卫生院的功能和任务建立起完善的护理管理体系,各岗位职责不
安全隐患整改报告书 整改报告书 工程名称丰华.星河苑7 #住宅楼工程地点 1. 该工程未按规定办理安全措施备案手续. 2. 施工现场主要道路物料堆放处未硬化,未设置六牌两图、安全警 示牌、物料堆放混乱,现场脏、乱差达不到文明施工要求。 3. 施工现场临时用电不规范,缺少开关箱,使用三芯电缆达不到 三级配电两级保护要求。 4. 塔机基础未清理,限位位置不齐全,未检测验收禁止使用。 5. 砼机、配电箱、钢筋加工区、木材加工去未搭设防护棚。 6. 未建立安全资料,缺少消防器材。 整整改如下: 改 1.该工程已按排专人办理安全措施备案手续. 情 2.施工现场主要道路物料堆放处已硬化,已设置六牌两图、安全况警示牌、物料分类堆放整齐,现场按文明施工要求施工。 3.施工现场临时用电已按规范用电. 4.塔机基础已清理,限位装置已齐全,已申报检测验收。 5.砼机、配电箱、钢筋加工区、木材加工区已搭设防护棚。 6.已建立安全资料,并配备消防器材。 项目负责人: 年月日 企建企业负责人: 建设单位: 业设复单查位 (公章) (公章) 意意年月日年月日见见
检 监查 理监理工程师: 单检查单位: 单位 位 (公章) 复 (公章) 意年月日查年月日见意 见 注:检查单位、被检查单位各1份存档 隐患整改报告书 工程名称华安.东方明珠36商住#住宅楼工程地点玉清街以南,潍县路以东 1、院墙未美化处理。 2、施工现场管理混乱。 3、外脚手架防护不到位,平网未按规定设置。 4、个别外脚手架严重变形。 5、配电系统未执行TN-S接零保护系统,少数配电箱存在一箱多用。 6、现场使用塔机“四限位,二保险”不齐全。 7、临时设施搭建使用泥砌砖墙净高低于2.7米,部分临建卫生不符合要求无纱门纱 网。整 8、少数塔机(拆卸)无防碰撞措施,改整改如下: 情 1、院墙已按规定整改完毕。况 2、施工现场按材料的分类,整改完毕已达规范要求。 3、外脚手架、网已按照施工规范要求整改完毕。 4、外脚手架变形部位拆除按施工规范重新安装,整改完毕。 5、配电系统已按规范整改完毕。 6、现场使用的塔机已按规范要求整改完毕。 7、临时设施搭建实用的砖房净高低于2.7米内的部分临建卫生不符合要求的
正确解读药品检验报告 依据 根据《药品管理法》第七十八条,除但书(指立法表述中以“但是”、“但”作为转折连词,用以表例外的条件或行为的前提的句法模式)规定的几种情形外,对假劣药的处罚通知,必须载明药品检验机构的检验结果。药品质量检验结果即通常所说的药品检验报告书,是药品检验机构对抽验药品质量出具的技术鉴定,具法律效力,同时也是药品监管部门认定某种药品是否应定性为假劣药实施行政处罚的重要依据。 目的 然而,药品检验报告只载明检验结果是否合乎标准,却未对不合格药品进行定性,执法人员对检验结果理解不同就有可能得出不同的结论,这直接影响监管部门对药品生产、经营企业和使用单位药品质量的定性和行政处罚决定,关系到药品生产、经营企业和使用单位的利益和声誉,甚至影响其生存。 意义 因此,正确解读药品检验报告,对判定假劣药品,依法实施行政处罚具有相当重要的意义。 一、正确理解药品检验报告所反映的质量信息 (一)、理解药品标准是解读检验报告的前提 药品标准是国家对药品的质量、规格和检验方法所作的技术规定,是保证药品质量,进行药品生产、经营、使用、管理及监督检验的法定依据,是药品生产、流通、使用和监督检验中各环节、各单位所必须共同遵守的强制性标准。 药品标准包括二大部分: 1.必须经过药品检验机构检验的事项,如成份、规格、含量、允许的杂质及其限量、质量要求等; 2.无需经过药品检验机构进行专门技术检验的事项,如药品的通用名称、功能主治、适应症、有效期、生产批号等。 通常所说药品检验合格与否实际上是指所检验的项目是否符合规定,但检验项目合格不等同于药品符合国家药品标准。如药品的功能主治、适应症超出规定范围,擅自延长有效期、更改生产批号等,同样也是不符合药品标准。 对检验项目和非检验项目都合格的药品也不能放松警惕,如在药品中人为添加官能团结构相类似的物品或者在药品中非法加入对检测项目有干扰的成份等,依现有质量标准中检测项目却无法鉴别,都有可能使检验结果失真,导致假劣药品检验合格,这些假劣药品披上“合法”外衣,对民众用药安全的危害性更大,这就要求检验机构不断的提高检验水平,让假劣药品“无处藏身”,执法人员对检验合格的品种也要“掘地三尺”,利用其他渠道辨别药品的真伪。 (二)、分析检验项目,正确定性假劣药品 药品检验的项目通常包括性状、鉴别、检查和含量测定四大项,因各个药品剂型的质量标准要求不同,故其检验项目中所含的内容会有所不同,但不论检验项目多少,只要其中有一项不合格,该批药品总的结论便是不合格。检验报告书上对检验结果的描述仅为是否符合规定,却未载明对检验不合格药品的定性。因此,执法人员不仅要看检验报告的总结论,更需分析药品检验报告中各个检验项目不合格的原因,依据《药品管理法》相关条款来判断不合格药品是假药还是劣药。 1、性状药品性状是指药品制剂的物理特征或形态,包括了药品应具有的外观(例如色泽、臭味、溶解度、粘稠度等)以及各项物理常数(例如熔点、沸点、比重、折光率、比旋度、吸收系数等)。药品的色泽(包括药品的表面、截面和内容物等)、外形(如大小不均匀、破损、粘连结块、沉淀等)、气味与标准描述不符,溶解度、物理常数检测数据与标准不同,一般来说按劣药处理,但有时也应结合其他检验项目才能最终定性。
安全隐患整改告知书(存根)安全隐患整改告知书 ________业主:________业主: 您_________的行为已违反《物业管理服务协议》您_________的行为已违反《物业管理服务协议》 ___________的规定,该行为极易造成_______,___________的规定,该行为极易造成________,具有较大______隐患。现通知您自本告知书下发之日起__日内具有较大______隐患。现通知您自本告知书下发之日起__日内予以整改。逾期未整改或拒不整改,造成不良后果由业主主负全部责任。予以整改。逾期未整改或拒不整改,造成的不良后果由业主负全部责任。物业公司保留依法采取强制措施处理该违规行为的权利。物业公司依法保留采取强制措施处理该违规行为的权利。 甘肃稀土物业管理有限公司甘肃稀土物业管理有限公司 __年__月__日__年__月__日 安全隐患整改告知书(存根)安全隐患整改告知书 ________业主:________业主: 您_________的行为已违反《物业管理服务协议》您_________的行为已违反《物业管理服务协议》 ___________的规定,该行为极易造成_______,___________的规定,该行为极易造成________,具有较大______隐患。现通知您自本告知书下发之日起__日内具有较大______隐患。现通知您自本告知书下发之日起__日内予以整改。逾期未整改或拒不整改,造成不良后果由业主主负全部责任。予以整改。逾期未整改或拒不整改,造成的不良后果由业主负全部责任。物业公司保留依法采取强制措施处理该违规行为的权利。物业公司依法保留采取强制措施处理该违规行为的权利。 甘肃稀土物业管理有限公司甘肃稀土物业管理有限公司 __年__月__日__年__月__日
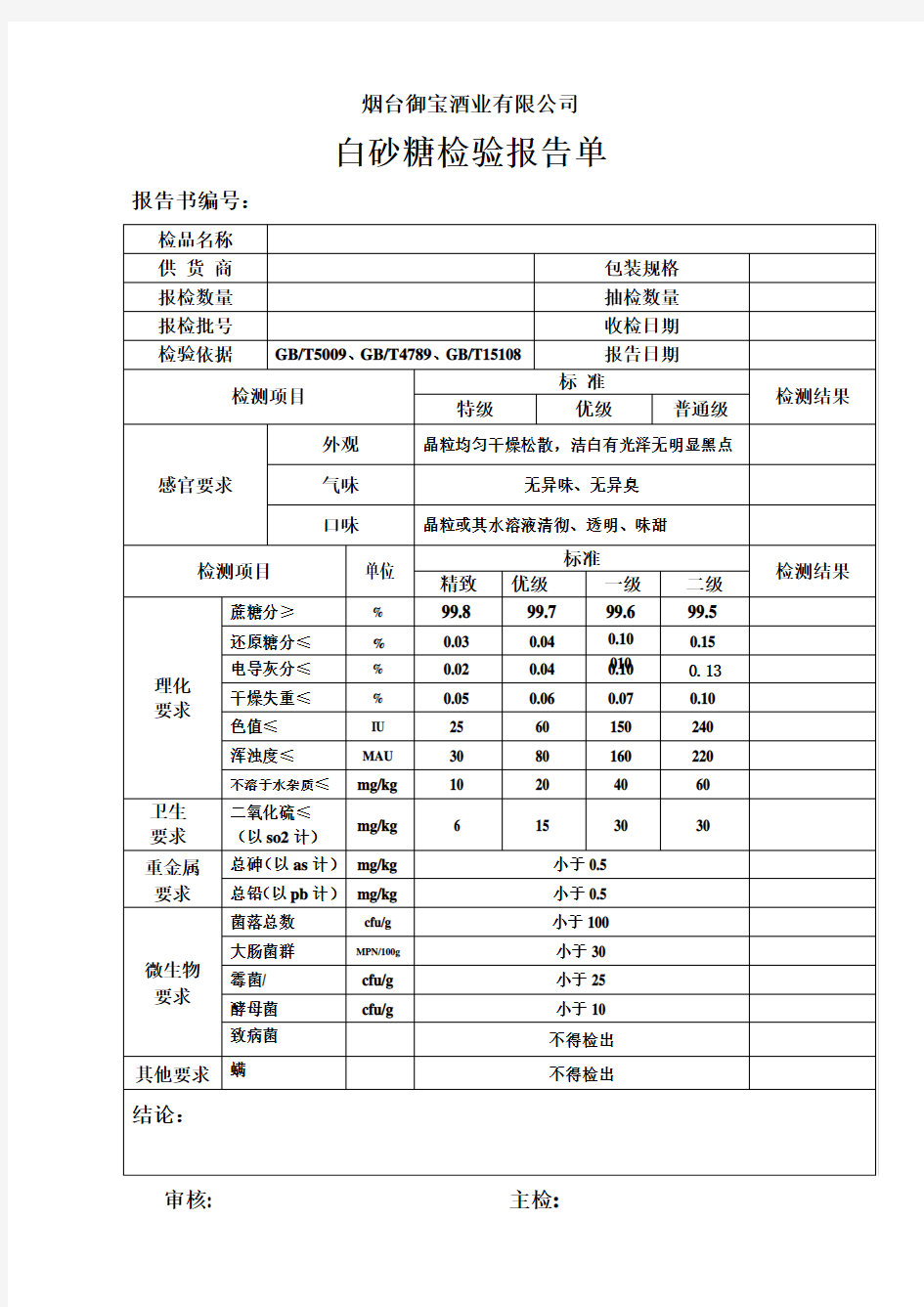
白砂糖检验作业指导书 1 目的 为了使本公司使用的白砂糖检验有章可循,从而确保白砂糖的质量得到有效控制。 2 适用范围 本厂使用的所有饮料添加所用的白砂糖。 3 职责 3.1 采购部负责根据标准进行白砂糖的采购; 3.2 原料仓库负责清点数量,储存及请检; 3.3 品管部品控员负责取样、检验,并根据标准对批次作出判定。 4 验收标准 4. 1 级别 白砂糖分为精制、优级、一级和二级共四个级别 4.2感官要求 4.2.1 晶粒均匀,晶粒或其水溶液味甜、无异味。 4.2.2 干燥松散、洁白、有光泽,无明显黑点。 4.3 理化要求 4. 3.1净含量 单件定量包装商品的实际含量应当准确反映其标注净含量,标注净含量与实际净含量之差不得大于规定的允许短缺量。 4. 4 微生物要求 微生物指标应符合表1的规定。 表1 微生物指标 项目指标 菌落总数cfu/g ≤20 大肠菌群MPN/g≤0.03 5 检验方法(抽样方法,检验方法) 5.1感官
白砂糖应颗粒均匀、干燥松散、颜色洁白、有光泽、无明显黑点、无异物、无异味、无异嗅,水溶液清澈、透明,味甜。 5.2 净含量 将整袋白砂糖至于电子称(精确度为0.1kg)上称重,平行称重3袋。记录数据并求出平均值。平均净含量与标注净含量净含量之差不得大于规定的允许短缺量。(见表2) 表2 允许短缺量 允许短缺量(T)g 质量定量包装商品的标注 5.3.1 菌落总数 5.3.1.1 样品的稀释 5.3.1.1.1 移取25ml样品置盛有225磷酸盐缓冲液或生理盐水的无菌锥形瓶中,充分振摇,制成1:10 的样品匀液。 53.1.1.2 用1ml的无菌吸管或微量移液器吸取1:10的样品匀液1ml,沿管壁缓慢注入于盛有9ml稀释 液的无菌试管中(注意吸管或吸头尖端不要触及稀释液面),振摇试管或换用一支 无菌吸管反复吹打使其均匀混合,制成1:100的样品匀液。 5.3.1.1.3 根据4.2.2.1.2操作程序,制备10倍系列稀释样品匀液。每递增稀释一次,换用一次1ml 无菌吸管或吸头。