
第三章 水溶液中的离子平衡 一、弱电解质的电离 1、定义:电解质:在水溶液中或熔化状态下能导电的化合物, 非电解质 :在水溶液中或熔化状态下都不能导电的化合物 强电解质 : 在水溶液里全部电离成离子的电解质 弱电解质: 在水溶液里只有一部分分子电离成离子的电解质 。 ! 2、电解质与非电解质本质区别: 电解质——离子化合物或共价化合物 非电解质——共价化合物 注意:①电解质、非电解质都是化合物 ②SO 2、NH 3、CO 2等属于非电解质 ③强电解质不等于易溶于水的化合物(如BaSO 4不溶于水,但溶于水的BaSO 4全部电离,故BaSO 4为强电解质)——电解质的强弱与导电性、溶解性无关。 3、影响电离平衡的因素: A 、温度:电离一般吸热,升温有利于电离。 B 、浓度:浓度越大,电离程度 越小 ;溶液稀释时,电离平衡向着电离的方向移动。 C 、同离子效应:在弱电解质溶液里加入与弱电解质具有相同离子的电解质,会 减弱 电离。 D 、其他外加试剂:加入能与弱电解质的电离产生的某种离子反应的物质时,有利于电离。 4、电离方程式的书写:用可逆符号 弱酸的电离要分布写(第一步为主) 5、电离常数:在一定条件下,弱电解质在达到电离平衡时,溶液中电离所生成的各种离子浓度的乘积,跟溶液中未电离的分子浓度的比是一个常数。叫做电离平衡常数,(一般用Ka 表示酸,Kb 表示碱。 ) — 表示方法:AB A ++B - Ki=[ A +][ B -]/[AB] 6、影响因素: a 、电离常数的大小主要由物质的本性决定。 b 、电离常数受温度变化影响,不受浓度变化影响,在室温下一般变化不大。 C 、同一温度下,不同弱酸,电离常数越大,其电离程度越大,酸性越强。如:H 2SO 3>H 3PO 4>HF>CH 3COOH>H 2CO 3>H 2S>HClO 二、水的电离和溶液的酸碱性 1、水电离平衡:: 水的离子积:K W = c[H +]·c[OH -] 25℃时, [H +]=[OH -] =10-7 mol/L ; K W = [H +]·[OH -] = 1*10-14 注意:K W 只与温度有关,温度一定,则K W 值一定 ; 物质 单质 @ 化合物 电解质 非电解质: 非金属氧化物,大部分有机物 。如SO 3、CO 2、C 6H 12O 6、CCl 4、CH 2=CH 2…… 强电解质: 强酸,强碱,大多数盐 。如HCl 、NaOH 、NaCl 、BaSO 4 弱电解质: 弱酸,弱碱,极少数盐,水 。如HClO 、NH 3·H 2O 、Cu(OH)2、H 2 O …… 混和物 纯净物
习题解答 2-1 2-2 2-3 2-4 2-5 2-6 2-7 2-8 2-9 2-10 2-11 2-12 2-13 2-14 2-15 2-16 2-17 2-18
2-1 如题图2-1所示为RLC 电路网络,其中()i U t 为输入电压,安培表的指示电流)(t i o 为输出 量。试列写状态空间模型。 题图2-1 解: (1) 根据回路电压和节点电流关系,列出各电压和电流所满足的关系式. ()()() 1 ()()()()() i L C L C R C C d U t L i t U t dt d i t i t i t C U t U t dt R =+=+=+ (2) 在这个电路中,只要给定了储能R 元件电感L 和电容C 上的i L 和U C 的初始值,以及t ≥t 0 时刻后的输入量U i (t ),则电路中各部分的电压、电流在t ≥t 0时刻以后的值就完全确定了。也就是说,i L 和U C 可构成完整的描述系统行为的一组最少个数的变量组,因此可选i L 和为U C 状态变量,即 x 1(t )=i L , x 2(t )=u C (3) 将状态变量代入电压电流的关系式,有 1221211 11 i dx x U dt L L dx x x dt C RC =-+=- 经整理可得如下描述系统动态特性的一阶矩阵微分方程组--状态方程 11i 22110110x x L U L x x C RC ??-??????????=+???? ???? -???????????? (4) 列写描述输出变量与状态变量之间关系的输出方程, 1221110C x y U x x R R R ????===?? ?????? (5) 将上述状态方程和输出方程列写在一起,即为描述系统的状态空间模型的状态空间表达 式 11i 221211011010 x x L U L x x C RC x y x R ??-?????????? =+????????-? ??????????? ??? ?=????? ???
水溶液中的离子平衡第三章 一、弱电解质的电离, 、定义:电解质:在水溶液中或熔化状态下能导电的化合物1 :在水溶液中或熔化状态下都不能导电的化合物非电 解质 强电解质:在水溶液里全部电离成离子的电解质 。弱电解质:在水溶液里只有一部分分子电离成离子的电解质 混和物、电解质与非电解质本质区别: 2物质单质强电解质:强酸,强碱,大多数盐。如HCl、NaOH、NaCl、BaSO 4电解质——离子化合物或共价化合物非电解质——共价化合物纯净物电解质 弱电解质:弱酸,弱碱,极少数盐,水。如HClO、NH·HO、Cu(OH)、注意:①电解质、非电解 质都是化合物②SO、NH、CO等属于非电解质232化合物 ③强电解质不等于易溶于水的化合物(如 232HO (2) BaSO不溶于水,但溶于水的BaSO全部电离,……HO、CCl、CH=CH 非金属氧化物,大部 分有机物。如SO、CO、C 非电解质:44123622462故BaSO为强电解质)——电解质的强弱与导电性、溶解性无关。43、影响电离平衡的因素: A、温度:电离一般吸热,升温有利于电离。 B、浓度:浓度越大,电离程度越小;溶液稀释时,电离平衡向着电离的方向移动。 C、同离子效应:在弱电解质溶液里加入与弱电解质具 有相同离子的电解质,会减弱电离。D、其他外加试剂:加入能与弱电解质的电离产生的某种离子反应的物质时,有利于电离。 4、电离方程式的书写:用可逆符号弱酸的电离要分布写(第一步为主) 5、电离常数:在一定条件下,弱电解质在达到电离平衡时,溶液中电离所生成的各种离子浓度的乘积,跟溶液中未电离的分子浓度的比是一个常数。叫做电离平衡常数,(一般用Ka表示酸,Kb表示碱。) +- +-]/[AB] +B][ B Ki=[ A表示方法:ABA6、影响因素: a、电离常数的大小主要由物质的本性决定。 b、电离常数受温度变化影响,不受浓度变化影响,在室温下一般变化不大。 C、同一温度下,不同弱酸,电离常数越大,其电离程度越大,酸性越强。如: H SO>H PO>HF>CHCOOH>HCO>H S>HClO 23233432二、水的电离和溶液的酸碱性 1、水电离平衡:: +-]c[OH]·水的离子积:K = c[H W+--7+--14 ] = 1*10· mol/L ; K = [H[OH25℃时, [H]]=[OH] =10W注意:K只与温度有关,温度一定,则K值一定 WW K不仅适用于纯水,适用于任何溶液(酸、碱、盐)W2、水电离特点:(1)可 逆(2)吸热(3)极弱 3、影响水电离平衡的外界因素: -14 =1*10 K:抑制水的电离①酸、碱W②温度:促进水的电离(水的电 离是吸热的)
6-1 对线性系统 A B C D =+?? =+? x x u y x u 作状态反馈v x u +-=K ,试推导出闭环系统的状态空间模型和传递函数。 解 将反馈律代入状态空间模型,则有 ()()()()A B K A BK B C D K C DK D =+-+=-+=+-+=-+x x x v x v y x x v x v 因此,闭环系统的状态空间模型和传递函数分别为 1()()()()()K A BK B C DK D G s C DK sI A BK B D -=-+?? =-+?=--++x x v y x v 6-2 对线性系统 A B C D =+?? =+? x x u y x u 作输出反馈u =-H y +v ,试推导出闭环系统的状态空间模型和传递函数。 解 将反馈律代入状态空间模型的输出方程,则有 () C D H C DH D =+-+=-+y x y v x y v 即 ()I DH C D +=+y x v 因此,当()I DH +可逆时,闭环系统输出方程为 11()()I DH C I DH D --=+++y x v 将反馈律和上述输出方程代入状态方程,则有 11() [()][()]A B A B H A BH I DH C BH I DH D B --=+=+-+=-++++x x u x y v x v 当闭环系统的状态空间模型和传递函数分别为 1111 11111[()][()]()()()()[()][()]()H A BH I DH C BH I DH D B I DH C I DH D G s I DH C sI A BH I DH C BH I DH D B I DH D ---------?=-++++?=+++?=+-++++++x x v y x v
第三章 水溶液中的离子平衡 一、弱电解质的电离 1、定义:电解质: 在水溶液中或熔化状态下能导电的化合物,叫电解质 。 非电解质 : 在水溶液中或熔化状态下都不能导电的化合物 。 强电解质 : 在水溶液里全部电离成离子的电解质 。 弱电解质: 在水溶液里只有一部分分子电离成离子的电解质 。 2、电解质与非电解质本质区别: 电解质——离子化合物或共价化合物 非电解质——共价化合物 注意:①电解质、非电解质都是化合物 ②SO 2、NH 3、CO 2等属于非电解质 ③强电解质不等于易溶于水的化合物(如BaSO 4不溶于水,但溶于水的BaSO 4全部电离,故BaSO 4为强电解质)——电解质的强弱与导电性、溶解性无关。 3、弱电解质的电离平衡:在一定的条件下,当弱电解质分子电离成 离子的速率 和离子结合成 分子的速率相等 时,电离过程就达到了平衡状态,这叫弱电解质的电离平衡。 4、影响电离平衡的因素: A 、温度:电离一般吸热,升温有利于电离。 B 、浓度:浓度越大,电离程度 越小 ;溶液稀释时,电离平衡向着电离的方向移动。 C 、同离子效应:在弱电解质溶液里加入与弱电解质具有相同离子的电解质,会 减弱 电离。 D 、其他外加试剂:加入能与弱电解质的电离产生的某种离子反应的物质时,有利于电离。 5、电离方程式的书写: 用可逆符号 弱酸的电离要分布写(第一步为主) 6、电离常数:在一定条件下,弱电解质在达到电离平衡时,溶液中电离所生成的各种离子浓度的乘积,跟溶液中未电离的分子浓度的比是一个常数。叫做电离平衡常数,(一般用Ka 表示酸,Kb 表示碱。 ) 物质 单质 电解质 非电解质: 非金属氧化物,大部分有机物 。如SO 3、CO 2、C 6H 12O 6、CCl 4、CH 2=CH 2 强电解质: 强酸,强碱,大多数盐 。如HCl 、NaOH 、NaCl 、BaSO 4 弱电解质: 弱酸,弱碱,极少数盐,水 。如HClO 、NH 3·H 2O 、Cu(OH)2、 混和物 纯净物
1 v(x) a 1x 12 b 1x 22 c 1 x 32 2x 1x 2 4x 3 x 2 2X 1X 3 a 1 x T 1 1 b 1 2 (1) v(x) x 12 4x 22 x 32 2x 1x 2 6x 3x 2 2x 1x 3 (2) v(x) x 12 10x 22 4x 32 6x 1 x 2 2x 3x 2 2 2 2 (3) v(x) 10x 1 4x 2 x 3 2x 1x 2 2x 3x 2 4x 1 x 3 【解】: (1) 二次型函数不定。 ⑵ 二次型函数为负定。 ⑶ 二次型函数正定。 3-4-2 试确定下列二次型为正定时,待定常数的取值范围。 【解】: 3-4-1 第四章 控制系统的稳定性 试确定下列二次型是否正定。 1 1 1 1 1 1 1 1 1 4 3 , 1 0, 3 0, 1 4 3 1 1 1 1 4 1 3 1 1 1 3 1 P 4 10 0, 3 10 0, 10 10 P 1 2 1 , 10 1 1 10 1 2 10 1 39 0 1 4 1 1 4 2 1 1 0, 17
a 1 0 a 1 b 1 1 a 1b 1 c 1 4 b 1 4a 1 c 1 【解】: (1) 设 2 2 v(x) 0.5x 1 0.5X 2 V (X ) X 1X 1 X 2X 2 X 1X 2 X 1X 2 X2 x/ ° " °)为半负定。 0 (x 0) 又因为v(x) 0时,有X 2 0, 则X 2 0,代入状态方程得: X 1 0. 所以系统在X 0时,v(x)不恒为零。 则系统渐近稳定,又因为是线性系统,所以该系统是大范围渐近稳定。 (2) 设 2 2 v(x) 0.5X 1 0.5X 2 v(x) X 1X 1 X 2X 2 X 1 ( X 1 X 2) X 2(2X 1 3X 2) X 12 3X 22 3X 1X 2 T 1 1.5 1 1 1 1.5 X x 1 0, 1.5 3 1 1 1 1.5 3 T … X Px P 负定,系统渐近稳定,又因为是线性系统,所以该系统是大范围渐近稳定。 (3) 0 1 1 1 (1) X X (2) x X ; 1 1 2 3 1 1 1 0 (3) x X (4) x X 1 1 0 1 3-4-3 满足正定的条件为: a i | of 1 1 b i a i 0, 1 1 1 1 b 1 2 0 2 C 1 试用李亚普诺夫第二法判断下列线性系统的稳定性。
第三章习题 3-1判断下列系统的状态能控性和能观测性。系统中a,b,c,d 的取值对能控性和能观性是否有关,若有关,其取值条件如何? (1)系统如图3.16所示: 图3.16 系统模拟结构图 解:由图可得: 3 43432112332 211x y dx x x cx x x x x cx x bx x u ax x =-=-+=++-=-=+-=???? 状态空间表达式为: []x y u x x x x d c b a x x x x 01 000001100 011000000 43214321=? ???????????+????????????????????????----=??????? ? ??????????? ? 由于? 2x 、?3x 、? 4x 与u 无关,因而状态不能完全能控,为不能控系统。由于y 只与3x 有关,因而系统为不完全能观的,为不能观系统。 (3)系统如下式:
x d c y u b a x x x x x x ?? ????=??????????+????????????????? ???---=?????? ?????????? ?00000012200010011321321 解:如状态方程与输出方程所示,A 为约旦标准形。要使系统能控,控制矩阵b 中相对于约旦块的最后一行元素不能为0,故有0,0≠≠b a 。 要使系统能观,则C 中对应于约旦块的第一列元素不全为0,故有0,0≠≠d c 。 3-2时不变系统 X y u X X ?? ????-=?? ? ???+??????--=? 111111113113 试用两种方法判别其能控性和能观性。 解:方法一: []?? ?? ??==?? ????-=????? ?=??????--=2-2-1 12-2-1 1AB B M 1111,1111,3113C B A 系统不能控。 ,21<=rankM ??? ? ? ???????----= ??????=44221111CA C N 系统能观。,2=rankN 方法二:将系统化为约旦标准形。 ()4 20133113 A I 212 -=-==-+=+--+= -λλλλλλ,
1、下列说法中正确的是() A、能溶于水的盐是强电解质,不溶于水的盐是非电解质; B、强电解质溶液中不存在溶质分子;弱电解质溶液中必存在溶质分子; C、在熔融状态下能导电的化合物一定是离子化合物,也一定是强电解质; D、Na2O2 和SO2 溶液于水后所得溶液均能导电,故两者均是电解质。 2、下列说法中错误的是() A、非电解质一定是共价化合物;离子化合物一定是强电解质; B、强电解质的水溶液一定能导电;非电解质的水溶液一定不导电; C、浓度相同时,强电解质的水溶液的导电性一定比弱电解质强; D、相同条件下,pH 相同的盐酸和醋酸的导电性相同。 3、物质的量浓度相同的盐酸、硫酸和醋酸溶液,pH 最小的是,pH 最大 的是;体积相同时分别与同种NaOH 溶液反应,消耗NaOH 溶液的体积大小关系为。 4、pH 相同的盐酸、硫酸和醋酸溶液,物质的量浓度最小的是,最大的 是;体积相同时分别与同种NaOH 溶液反应,消耗NaOH 溶液的体积大小关系为。 +)为乙5、甲酸和乙酸都是弱酸,当它们的浓度均为0.10mol/L 时,甲酸中的 c(H 酸中c(H +)的3 倍,欲使两溶液中c(H+)相等,则需将甲酸稀释至原来的 3 倍(填“<”、“>”或“=”);试推测丙酸的酸性比乙酸强还是弱。 6、试比较pH=3 的HAc 、pH=4 的NH4Cl、pH=11 的NaOH、pH=10Na2CO3 四种 溶液中水的电离程度从大到小的顺序是。 -12 7、已知100℃时,水的K W=1×10 ,则该温度下 (1)NaCl 的水溶液中[H +]= ,pH = ,溶液呈性。(2)0.005mol/L 的稀硫酸的pH= ;0.01mol/L 的NaOH 溶液的pH=
现代控制理论第4章教学要求 按章节,打*号的部分为本科不要求的内容,另外在一些未打*的部分有些内容也不要求,请按下面要求的内容组织本科教学。 第4 章动态系统的结构分析 4.1 引言 4.1.1 能控性与能观性物理现象——从例子谈起 从物理角度理解能控性与能观性的重要性。 4.1.2 能控性与能观性的数学描述 从数学角度理解能控性与能观性的状态方程特点。 4.2 连续线性系统能控性与能观性定义 4.2.1 能控性定义 理解能控性的定义包含的丰富内涵。 能利用定义解决与系统能控性相关的问题。 4.2.2 能观性定义 理解能观性的定义包含的丰富内涵。 能利用定义解决与系统能观性相关的问题。 4.3 连续线性系统能控性与能观性判据 4.3.1 定常系统的能控性判据与能控性指数 掌握定常系统的Gram矩阵能控性判据。 掌握Jordan标准型的能控性判据,并能依此进行相应计算。 掌握能控性矩阵秩判据,并能依此进行相应计算。 了解能控性PBH判据,包括PBH秩判据和PBH特征向量判据。 了解定常系统的能控性指数,并基此减小能控性矩阵的规模。 4.3.2 定常系统的能观性判据与能观性指数 掌握定常系统的Gram矩阵能观性判据。 掌握Jordan标准型的能观性判据,并能依此进行相应计算。。 掌握能观性矩阵秩判据,并能依此进行相应计算。 了解能观性PBH判据,包括PBH秩判据和PBH特征向量判据。。 了解定常系统的能观性指数,并基此减小能观性矩阵的规模。 4.3.3 时变系统的能控性判据 了解时变系统的 Gram矩阵能控性判据。 了解时变系统的能控性秩判据。 4.3.4 时变系统的能观性判据 了解时变系统的 Gram矩阵能观性判据。 了解时变系统的能观性秩判据。 4.3.5 时变系统的能控、能观性判据与其定常情况的关系 理解时变系统的能控、能观性判据与其定常情况的关系。 4.4 连续线性系统输出能控性和输出函数能控性及判据 4.4.1 输出能控性定义及其判定* 本科不要求此节内容。 4.4.2 输出函数能控性定义及其判定* 本科不要求此节内容。 4.5 连续线性系统的对偶关系 4.5.1 定常情况下的对偶关系 理解定常情况下的对偶关系,燕能利用对偶关系解决相关问题。 4.5.2 时变情况下的对偶关系 了解定常情况下的对偶关系,燕能利用对偶关系解决相关问题。 4.6 定常连续线性系统的能控型与能观型 4.6.1 SISO 系统的能控标准型与能观标准型 掌握SISO系统的能控标准型与能观标型以及变换方法,能计算标准型。 4.6.2 MIMO 类SISO 的能控标准型与能观标准型 了解MIMO 类SISO 的能控标准型与能观标准型。 4.6.3 MIMO 系统的Wonham 规范型与Luenberger 规范型* 本科不要求此节内容。 4.7 连续线性系统的结构分解
2.6 可控性与可观性 26 2.6.1 概述 经典控 制论中: 系统用传递函数描述。 只注重输入-输出间的直接关系! 低阶系统,输出可控制亦可测量。 可控性与可观性不是问题。
现代控制论中: 系统描述:状态方程+输出方程 由于状态?输入,输出?状态 所以要控制输出,首先要控制状态 并且使输出随状态发生变化输 (1)输入?状态间的问题: 输入是否使状态发生希望的变化? ? 可控性问题 要使状态发生某种变化,输入? 要使状态发生某种变化,输入=? ? 最优控制问题
(2)输出?状态间的问题: 状态可否从输出得到? ? 可观测性问题 如何从输出得到? ? 最优估计问题 &可控性、可观性为现代控制理论的基础,例如最优控制与最优估计的基础! &如何处理可控性?可观测性?
可控性:系统输入对系统状态的有效控制能力 可观性:系统输出对系统状态的确切反映能力 问题: 状态可控?系统可控? 状态不可控?系统不可控? 状态可观测系统可测观 状态可观测?系统可测观? 状态不可观测?系统不可观测?
个系统的可控性和可观测性 ?分析如下4个系统的可控性和可观测性:x x 111001/????+??????=u dt d []x 11=???y x x 101/????+???????=u dt d x x 001/??+???=u dt d []x 01110=? ??y x 11110=?????????x x 0111/? ???+???=u dt d []y []x 0110=???????y
?x x 111001/????+??????=u dt d []x 11=? ??y x ∫ ?1 u y 1 2 x ∫ 1?
第三章 水溶液中的离子平衡 一、 电解质,强、弱电解质 【知识点】 ● 物质分类: ● 电解质:在水溶液或.熔化状态下能导电的化合物... 叫电解质。注意: 强电解质: 。注意: 弱电解质: 。注意: 非电解质: 。注意: ● 电解质与导电性 影响电解质溶液导电性的因素: 【典型例题】 1、判断下列说法中正确的是,错误的说明原因。 ① 氯气的水溶液导电,所以氯气是电解质。 ② 二氧化碳的水溶液能导电,二氧化碳是电解质。 ③ 硫酸钡的水溶液不导电,但是硫酸钡是电解质。 ④ 氯化钠溶液的水溶液能导电,氯化钠溶液是电解质。 ⑤ 强电解质一定是离子化合物 2、下列物质按纯净物、混合物、电解质和非电解质顺序排列的是 A .盐酸、空气、醋酸、干冰 B .冰醋酸、福尔马林、硫酸钠、乙醇 C .蛋白质、油脂、苛性钾、石灰石 D .胆矾、漂白粉、氯化钾、硫酸钡 3、 强电解质溶液一定比弱电解质的导电性强醋酸溶液中滴入稀氨水,溶液的导电能力 发生变化,其电流强度I 随加入氨水的体积V 的变化曲线是( ) 【常见错误及注意事项】 二、 电离方程式 【知识点】 ● 注意事项: 【典型例题】 1、书写下列物质的电离方程式: HF NH 3?H 2O H 2S H 2SO 4 NaHSO 4 ①溶液中 ②熔化时 NaHCO 3 2、 下列离子方程式错误的是 ( ) A. NaHS Na + + H + + S 2- B. Al(OH)3H 2O + AlO 2- + H + C.(NH 4)2SO 4==2NH 4++SO 42- D. HF+H 2O H 3O ++F - E.H 3PO 43H + + PO 43- F.CaCO 3Ca 2+ + CO 32- 【常见错误及注意事项】 三、弱电解质电离平衡的移动 【知识点】 ● 在一定条件(如温度、浓度)下,当电解质分子电离成离子的速率和离子重新 结合生成分子的速率相等时,电离过程就达到了平衡状态,这叫电离平衡。 ● 影响电离平衡的因素: 内因: 外因:①浓度:浓度增大,电离平衡 移动,电离程度 ; ②温度:因电离正反应 热,故温度升高,电离平衡 移动,电离程度 例.在0.1mol/L CH 3COOH 溶液中改变下列条件,下列各项将如何变化? 平衡移动方向 电离程度 n(H +) C(H +) pH 溶液导电能力 加水 正移 增大 增大 减小 增大 减弱 升温 正移 增大 增大 增大 减小 增强 加入固体NaOH 正移 增大 减小 减小 增大 增强 加入无水CH 3COONa 逆移 减小 减小 减小 增大 增强 通入气体HCl 逆移 减小 增大 增大 减小 增强 加等浓度CH 3COOH 不移 不变 增大 不变 不变 不变 V I O A V I O B V I O C V I O D
《现代控制理论参考答案》 第一章答案 1-1 试求图1-27系统的模拟结构图,并建立其状态空间表达式。 解:系统的模拟结构图如下: 系统的状态方程如下: 令y s =)(θ,则1x y = 所以,系统的状态空间表达式及输出方程表达式为 1-2有电路如图1-28所示。以电压)(t u 为输入量,求以电感中的电流与电容上的电压作为状态变量的状态方程,与以电阻2R 上的电压作为输出量的输出方程。 解:由图,令32211,,x u x i x i c ===,输出量22x R y = 有电路原理可知:? ? ? +==+=++3 213 222231111x C x x x x R x L u x x L x R 既得 2 221332 2222131111111111x R y x C x C x x L x L R x u L x L x L R x =+- =+-=+-- =? ? ? 写成矢量矩阵形式为: 1-4 两输入1u ,2u ,两输出1y ,2y 的系统,其模拟结构图如图1-30所示,试求其状态空间表达式与传递函数阵。 解:系统的状态空间表达式如下所示: 1-5系统的动态特性由下列微分方程描述 列写其相应的状态空间表达式,并画出相应的模拟结构图。 解:令.. 3. 21y x y x y x ===,,,则有 相应的模拟结构图如下: 1-6 (2)已知系统传递函数2 )3)(2() 1(6)(+++= s s s s s W ,试求出系统的约旦标准型的实现,并画出相应的模拟结构图 解:s s s s s s s s s W 31 233310)3(4)3)(2()1(6)(22++++- ++-=+++= 1-7 给定下列状态空间表达式 []??? ? ? ?????=???? ??????+????????????????????----=??????????321321321100210311032010x x x y u x x x x x x ‘ (1) 画出其模拟结构图 (2) 求系统的传递函数
王金城化工出版社第1章习题参考答案: 1-1(a )选123123,,,,,y y y v v v 为状态变量,根据牛顿定律, 对1M ,有()1 1112121 dv M g K y K y y M dt ---= 对2M ,有()()2 22123232dv M g K y y K y y M dt +---= 对3M ,有()3 3323433dv M g K y y K y M dt +--= 令312112233415263,,,,,dy dy dy x y x y x y x v x v x v dt dt dt ===== ====,整理得 ()()()122214253641 11 23342332 51262322233 ,,,, ,K K K x x x x x x x x x g M M K K K K K x K K x x x g x x x g M M M M M +====-++++= -++=-+ () ()() 122 11 23222 22 3433 3 000100000010000000100000 01100010000K K K M M x x g K K K K M M M K K K M M ? ????? ??????? ? ??+??-????=+??????+?? ??- ? ? ???? ??? ? +- ?? ??? ? 100000010000001000y x ?? ??=?? ???? (b )选12,12,,y y v v 为状态变量,根据牛顿定律, 对1M ,有()1 1121111 dv M g B v v K y M dt +--= 对2M ,有()2 2221212dv f M g B v B v v M dt +---= 令1211223142,,,dy dy x y x y x v x v dt dt === ===,整理得 11113243134111 ,,K B B x x x x x x x x g M M M ===--++, 112434222 B B B f x x x g M M M +=-++
第三章水溶液中的离子平衡 一、弱电解质的电离 课标要求 1、了解电解质和非电解质、强电解质和弱电解质的概念 2、掌握弱电解质的电离平衡 3、熟练掌握外界条件对电离平衡的影响 要点精讲 1、强弱电解质 (1)电解质和非电解质 电解质是指溶于水或熔融状态下能够导电的化合物;非电解质是指溶于水和熔融状态下都不导电的化合物。 注:①单质、混合物既不是电解质,也不是非电解质。 ②化合物中属于电解质的有:活泼金属的氧化物、水、酸、碱和盐;于非电解质的有:非金属的氧化物。 (2)强电解质和弱电解质 ①强电解质:在水溶液中能完全电离的电解质称为强电解质(如强酸、强碱和大部分的盐) ②弱电解质:在水溶液里只有部分电离为离子(如:弱酸、弱碱和少量盐)。 注:弱电解质特征:存在电离平衡,平衡时离子和电解质分子共存,而且大部分以分子形式存在。 (3)强电解质、弱电解质及非电解的判断
2、弱电解质的电离 (1)弱电解质电离平衡的建立(弱电解质的电离是一种可逆过程) (2)电离平衡的特点 弱电解质的电离平衡和化学平衡一样,同样具有“逆、等、动、定、变”的特征。 ①逆:弱电解质的电离过程是可逆的。 ②等:达电离平衡时,分子电离成离子的速率和离子结合成分子的速率相等③动:动态平衡,即达电离平衡时分子电离成离子和离子结合成分子的反应并没有停止。 ④定:一定条件下达到电离平衡状态时,溶液中的离子浓度和分子浓度保持不变,溶液里既有离子存在,也有电解质分子存在。且分子多,离子少。 ⑤变:指电离平衡是一定条件下的平衡,外界条件改变,电离平衡会发生移动。 (3)电离常数 ①概念:在一定条件下,弱电解质在达到电离平衡时,溶液中电离所生成的各种离子浓
第一和第二讲小结 一、状态空间表达式的标准形式 能控标准形 能观测标准形 对角线标准形 Jordan标准形 二、矩阵的特征值及对角线化 矩阵是能控标准形时的变换矩阵求法(1)特征值互异 (2)重根 (3)一般情形 三、利用MATLAB进行系统模型之间的相互转换 [A, B, C, D] = tf2ss (num, den) [num,den] = ss2tf [A,B,C,D,iu] 四、时域分析的基本概念 状态转移矩阵及其性质,凯莱-哈密尔顿定理 最小多项式 五、矩阵指数计算 级数法,对角线标准形与Jordan标准形法 拉氏变换法凯莱-哈密尔顿定理
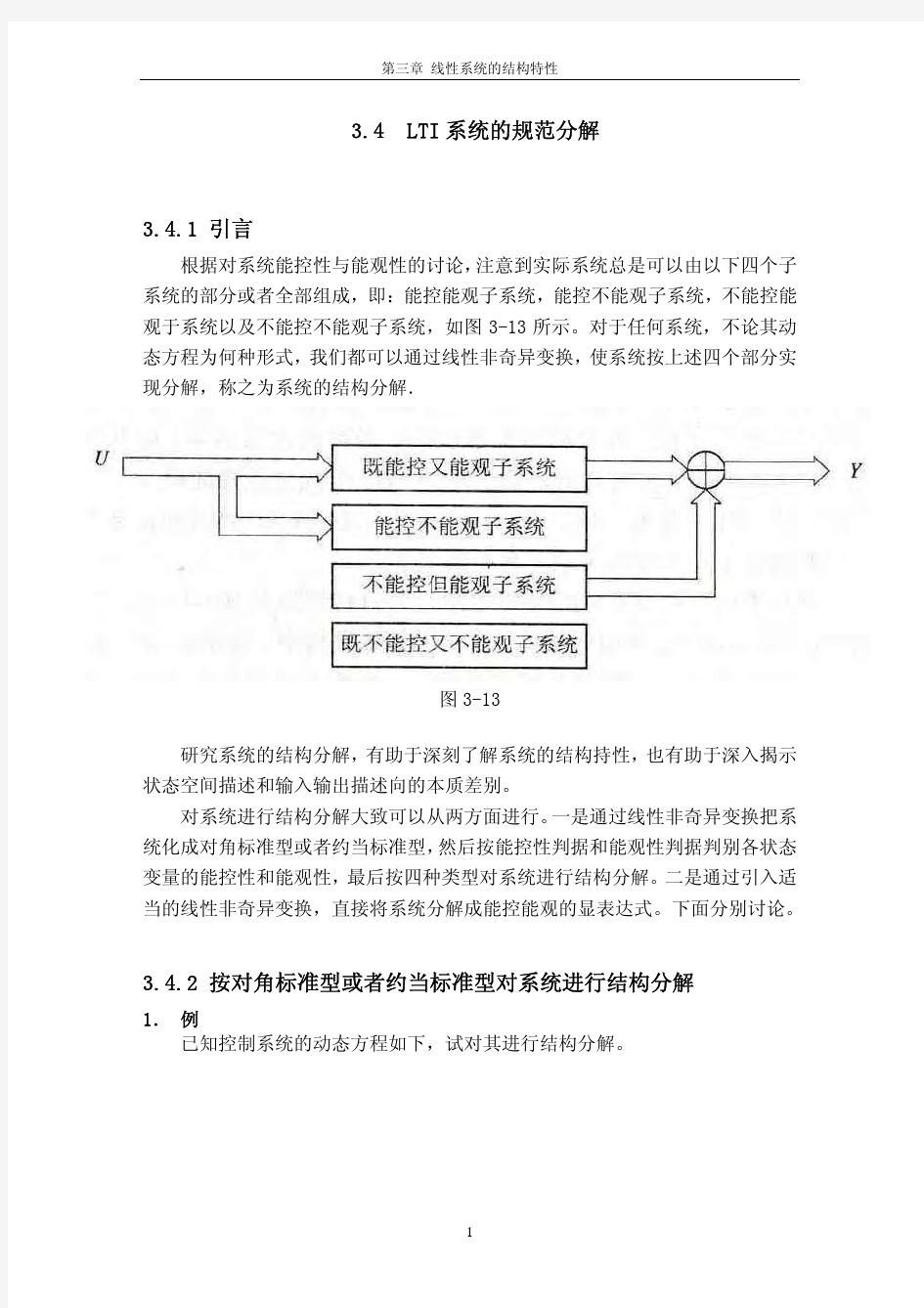
II、分析部分 第三章线性多变量系统的能控性与能观测性分析 能控性(controllability)和能观测性(observability)深刻地揭示了系统的内部结构关系,由R.E.Kalman于60年代初首先提出并研究的这两个重要概念,在现代控制理论的研究与实践中,具有极其重要的意义,事实上,能控性与能观测性通常决定了最优控制问题解的存在性。例如,在极点配置问题中,状态反馈的的存在性将由系统的能控性决定;在观测器设计和最优估计中,将涉及到系统的能观测性条件。 在本章中,我们的讨论将限于线性系统。将首先给出能控性与能观测性的定义,然后推导出判别系统能控和能观测性的若干判据。 3.1 线性连续系统的能控性 3.1.1 概述 能控性和能观测性就是研究系统这个“黑箱”的内部的状态是否可由输入影响和是否可由输出反映。 例1.给定系统的描述为
u x x x x ??????+????????????-=??????2150042121 []?? ? ???-=2160 x x y 将其表为标量方程组的形式,有: u x x +=114 u x x 2522+-= 26x y -= 例3-2:判断下列电路的能控和能观测性 ) (t u + y C R ) (t u L y 2
数学选修 4-4 坐标系与参数方程知识点总结第一讲 一平面直角坐标系 1.平面直角坐标系 (1)数轴:规定了原点,正方向和单位长度的直线叫数轴.数轴上的点与实数之间可以 建立一一对应关系. (2)平面直角坐标系: ①定义:在同一个平面上互相垂直且有公共原点的两条数轴构成平面直角坐标系,简称为直角坐标系; ②数轴的正方向:两条数轴分别置于水平位置与竖直位置,取向右与向上的方向分别为 两条数轴的正方向; ③坐标轴水平的数轴叫做x 轴或横坐标轴,竖直的数轴叫做y 轴或纵坐标轴,x 轴或 y 轴统称为坐标轴; ④坐标原点:它们的公共原点称为直角坐标系的原点; ⑤对应关系:平面直角坐标系上的点与有序实数对(x, y)之间可以建立一一对应关系. (3)距离公式与中点坐标公式:设平面直角坐标系中,点 P1(x1, y1), P2(x2, y2),线段 P1P2的中点为 P,填表: 两点间的距离公式中点 P 的坐标公式 x1+ x2 x=2 |P1P2|=(x1-x2)2+(y1-y2)2 y1+ y2 y= 2 2.平面直角坐标系中的伸缩变换 x′=λx(λ>0) 设点 P(x, y)是平面直角坐标系中的任意一点,在变换φ:的作用下,y′=μy (μ>0) 点 P(x,y)对应到点P′(x,y′),称φ为平面直角坐标系中的坐标伸缩变换,简称伸缩变换.
二极坐标系 (1)定义:在平面内取一个定点 O,叫做极点;自极点 O 引一条射线 Ox 叫做极轴;再选定一个长度单位、一个角度单位( 通常取弧度)及其正方向(通常取逆时针方向) ,这样就建立了一个极坐标系. (2)极坐标系的四个要素:①极点;②极轴;③长度单位;④角度单位及它的方向. (3)图示 2.极坐标 (1)极坐标的定义:设M 是平面内一点,极点O 与点 M 的距离 |OM |叫做点 M 的极径, 记为ρ;以极轴 Ox 为始边,射线 OM 为终边的角 xOM 叫做点 M 的极角,记为θ.有序数对 ( ρ,θ) 叫做点 M 的极坐标,记作 M(ρ,θ ). (2)极坐标系中的点与它的极坐标的对应关系:在极坐标系中,极点O 的极坐标是 (0,θ) ,(θ∈R ),若点 M 的极坐标是M(ρ,θ ),则点 M 的极坐标也可写成M(ρ,θ+ 2kπ ),(k∈Z ). (ρ,θ )之间才是一一若规定ρ>0, 0≤ θ<2π,则除极点外极坐标系内的点与有序数对 对应关系. 3.极坐标与直角坐标的互化公式 如图所示,把直角坐标系的原点作为极点,x 轴的正半轴作为极轴,且长度单位相同, 设任意一点M 的直角坐标与极坐标分别为(x, y), (ρ,θ ). (1)极坐标化直角坐标 x=ρcos θ, y=ρsin θW . (2)直角坐标化极坐标 ρ2= x2+ y2, y tan θ=x( x≠0) . 三简单曲线的极坐标方程 1.曲线的极坐标方程 一般地,在极坐标系中,如果平面曲线 C 上任意一点的极坐标中至少有一个满足方程 f(ρ,θ )= 0,并且坐标适合方程f(ρ,θ )= 0的点都在曲线 C 上,那么方程f(ρ,θ)=0 叫做曲线 C 的极坐标方程. 2.圆的极坐标方程 (1)特殊情形如下表: 圆心位置极坐标方程图形 ρ= r 圆心在极点 (0, 0) (0≤ θ<2π )
现代控制理论第四章习题答案 4-1判断下列二次型函数的符号性质: (1)222 123122313()31122Q x x x x x x x x x x =---+-- (2)222123122313()4262v x x x x x x x x x x =++--- 解:(1)由已知得 []1123 123 1232311 2 3231 1()3112 2111113211112x Q x x x x x x x x x x x x x x x x x x ?? ? ???=-+------???? ? ????? ? ? ??--??? ?????=--???????????? ---?? 110?=-<,211 2013 -?= =>-,31111711 3 024 1 1112 --?=--=-<-- - 因此()Q x 是负定的 (2)由已知得 [][]112312312323112323()433111143131x Q x x x x x x x x x x x x x x x x x x ????=---+---+?????? --???? ????=--???? ????--???? 110?=>,211 3014 -?= =>-,3111 143160131 --?=--=-<-- 因此()Q x 不是正定的 4-2已知二阶系统的状态方程:
11122122a a x x a a ??= ??? 试确定系统在平衡状态处大范围渐进稳定的条件。 解:方法(1):要使系统在平衡状态处大范围渐进稳定,则要求满足A 的特征值均具有负实部。 即: 11 12 2122 2112211221221()0 a a I A a a a a a a a a λλλλλ---= --=-++-= 有解,且解具有负实部。 即:1122112212210a a a a a a +<>且 方法(2):系统的原点平衡状态0e x =为大范围渐近稳定,等价于T A P PA Q +=-。 取Q I =,令11 121222P P P P P ??=???? ,则带入T A P PA Q +=-,得到 11 2111121122 211212 2222220100 221a a P a a a a P a a P -???? ????????+=????????????-?????? 若 112112 1122 2111221122122112 22 220 4()()0022a a a a a a a a a a a a a a +=+-≠,则此方程组有唯一解。即 22 21221222211122 1222211111121122()1 ()2()A a a a a a a P a a a a A a a a a A ??++-+=-??-++++?? 其中11221221det A A a a a a ==- 要求P 正定,则要求 22 2122 111112202()A a a P a a A ++?== >-+ 22 1122122121122()()0 4() a a a a P a a ++-?==>-+
第三章 水溶液中的离 子平衡 一、弱电解质的电离 1、定义:电解质:在水溶液中或熔化状态下能导电的化合物, 非电解质 :在水溶液中或熔化状态下都不能导电的化合物 强电解质 : 在水溶液里全部电离成离子的电解质 弱电解质: 在水溶液里只有一部分分子电离成离子的电解质 。 2、电解质与非电解质本质区别: 电解质——离子化合物或共价化合物 非电解质——共价化合物 注意:①电解质、非电解质都是化合物 ②SO 2、NH 3、CO 2等属于非电解质 ③强电解质不等于易溶于水的化合物(如BaSO 4不溶于水,但溶于水的BaSO 4全部电离,故BaSO 4为强电解质)——电解质的强弱与导电性、溶解性无关。 3、影响电离平衡的因素: A 、温度:电离一般吸热,升温有利于电离。 B 、浓度:浓度越大,电离程度 越小 ;溶液稀释时,电离平衡向着电离的方向移动。 C 、同离子效应:在弱电解质溶液里加入与弱电解质具有相同离子的电解质,会 减弱 电离。 D 、其他外加试剂:加入能与弱电解质的电离产生的某种离子反应的物质时,有利于电离。 4、电离方程式的书写:用可逆符号 弱酸的电离要分布写(第一步为主) 物质 单质 化合物 电解质 非电解质: 非金属氧化物,大部分有机物 。如SO 3、CO 2、C 6H 12O 6、CCl 4、CH 2=CH 2…… 强电解质: 强酸,强碱,大多数盐 。如HCl 、NaOH 、NaCl 、BaSO 4 弱电解质: 弱酸,弱碱,极少数盐,水 。如HClO 、NH 3·H 2O 、Cu(OH)2、H 2O …… 混和物 纯净物
5、电离常数:在一定条件下,弱电解质在达到电离平衡时,溶液中电离所生成的各种离子浓度的乘积,跟溶液中未电离的分子浓度的比是一个常数。叫做电离平衡常数,(一般用Ka表示酸,Kb表示碱。) 表示方法:AB A++B- Ki=[ A+][ B-]/[AB] 6、影响因素: a、电离常数的大小主要由物质的本性决定。 b、电离常数受温度变化影响,不受浓度变化影响,在室温下一般变化不大。 C、同一温度下,不同弱酸,电离常数越大,其电离程度越大,酸性越强。如:H2SO3>H3PO4>HF>CH3COOH>H2CO3>H2S>HClO 二、水的电离和溶液的酸碱性
第三章 水溶液中的离子平衡 第一节 弱电解质的电离 复习回顾 一、电解质与非电解质 1、电解质:在水溶液中或熔融状态时能够导电的化合物。(包括酸、碱、盐、水、大多数金属氧化物)如:NaCl 、HCl 、CH 3COOH 、MgO 2、非电解质:在水溶液中和熔融状态时都不能导电的化合物。(包括多数有机物、某些非金属氧化物)如: CH 3CH 2OH 、CO 2 、SO 2 注意: 二、强电解质与弱电解质 强电解质: 在水溶液里或熔融状态下全部电离成离子的电解质(其离子无 分子化倾向)。包括大多数盐类、强酸、强碱。 弱电解质: 在水溶液里部分电离成离子的电解质(其离子有分子化倾向)包括弱酸(如HAc 、H 2S)、弱碱(如NH 3·H 2O)、水 三、电解质的电离方程式 1、电离定义:电解质在溶于水或受热熔化时,离解成自由移动离子的过程。 2、电离方程式: (1)、强电解质:完全电离,符号选用“=” (2)、弱电解质: 部分电离,符号选用“ ” NaHCO 3=Na + +HCO 3- HCO 3- ?H ++CO 32- 四、弱电解质的电离平衡 吸:弱电解质的电离过程是吸热的 五、影响电离平衡的因素 (1)内因:电解质本性。通常电解质越弱,电离程度越小。 (2)外因:溶液的浓度、温度等。 ① 温度:由于弱电解质的电离是吸热的,因此升高温度,电离平衡将向电离方向移动,弱电解质的电离程度将增大。 ②浓度:增大电解质分子的浓度或减少相应离子的浓度,都会使弱电解质分子向电离为离子的方向移动。加水稀释弱电解质溶液,电离平衡向右移动,电离程度增大。 ③同离子效应:在弱电解质溶液中加入能与弱电解质电离产生的某种离子反应的物质时,可使平衡 向电离的方向移动。 ④化学反应:在弱电解质溶液中加入能与弱电解质电离产生的某种离子反应的物质时,可使平衡向电离的方向移动。 六、电离常数 1、电离常数 (1)、定义:在一定条件下,弱电解质的电离达到平衡时,溶液中电离出来的各种离子浓度的乘积跟溶液中未电离的分子浓度之比值是个常数,这个常数称为电离平衡常数,简称电离常数。 (2)、表达式: 注意:Ⅰ、弱电解质的电离常数表达式中的c(A 十 )、 c(B - ) 和c(AB ) 均为达到电离平衡后各